Paul C.M.S. Verhagen a,*, Fritz H. SchroЁder a, Laurence Collette b, Chris H. Bangma a
a Отделение урологии, Эрасмус MC, Роттердам, Голландия
b Европейская организация исследования и лечения рака, Главное управление, отдел статистики, Брюссель, Бельгия
Тезис
Контекст: Андрогенная депривация играет базовую роль при лечении местно-распространенного и метастатического рака простаты. Противоречивыми вопросами остаются, когда и как долго ее применять.
Цель: Провести обзор рандомизированных исследований по андрогенной депривации (орхэктомия или аналоги релизинг-фактора лютеинизирующего гормона) при раке простаты – и по немедленной, и по отсроченной/адъювантной терапии – для определения возможной связи между местным лечением и андрогенной депривацией.
Получение данных: в этот обзор были включены опубликованные рандомизированные исследования по андрогенной депривации при различных стадиях рака простаты.
Синтез данных: Исследования по сравнению немедленной и отсроченной андрогенной депривации без местного лечения последовательно показывают незначительное преимущество в общей выживаемости (отношение риска (HR):0,90; доверительный интервал (ДИ) 95%, 0,83-0,97), канцерспецифической выживаемости (HR: 0,79; 95% ДИ, 0,71–0,89). В противоположность этому, андрогенная депривация в качестве адъювантного лечения после лучевой терапии у пациентов с локализованным раком простаты высокого риска или местно-распространенным раком дает значительное преимущество в общей и канцерспецифической выживаемости. Такое же влияние наблюдалось у пациентов с подтвержденным системным поражением (позитивные лимфоузлы после радикальной простатэктомии). В целом, данные позволяют предположить, что проведение местного лечения первичной опухоли дает клинически важное преимущество в выживаемости (HR для общей выживаемости: 0,69; 95% ДИ, 0,61–0,79). Обсуждаются возможные механизмы этого терапевтического эффекта.
Выводы: мы сделали вывод, что, полагаясь на данные нашего систематического обзора, можно предположить наличие взаимосвязи между местным лечением и андрогенной депривацией. Немедленная и длительная андрогенная депривация значительно повышает общую и канцерспецифическую выживаемость пациентам с местно-распространенным и агрессивным раком, которые имеют высокий риск смерти от него и получают радикальное лечение по поводу первичной опухоли. Местное лечение при раке на стадии Т3 и/или при поражении лимфоузлов – важная часть оптимального ведения больных. Тем не менее, это интенсивное лечение у значительного числа пациентов с раком на стадии Т3 и/или N1 при медленном естественном течении или высоком риске смерти от конкурирующих причин не является необходимым.
1. Введение
Оптимальное время начала и продолжительность гормональной терапии при раке простаты были предметом обсуждений с момента ее первого описания. Hodges и Huggins часто упоминаются как первые авторы, в 1941 году применившие этот вид лечения [1]. В первой публикации в 1940 году Dr. Paul Niehans из Швейцарии описал рак и гиперплазию простаты как результат гормонального заболевания, которое он лечил путем операции на мошонке [2]. Два обзора из базы данных Cochrane были посвящены проблеме сравнения немедленной и отсроченной [3] или адъювантной андрогенной депривации [4] при различных стадиях рака простаты. Оба обзора оценивали эффективность более длинных или более коротких курсов андрогенной депривации на течение рака простаты, преимущественно с использованием в качестве вмешательства агонистов релизинг-фактора лютеинизирующего гормона или кастрации. Тем не менее, в этих обзорах авторы пришли к различным выводам, предполагая, что немедленная андрогенная депривация не дает большого преимущества, однако кажется, что в адъювантном режиме она значительно повышает выживаемость. Различающиеся результаты различных исследований являются частой причиной споров. Несмотря на различия между исследованиями по немедленной и отсроченной андрогенной депривации с одной стороны и исследованиями по адъювантному режиму с другой, мы считаем, что важно обсуждать их вместе, потому, что единственной переменной, которая модифицировалась в этих рандомизированных исследованиях, является воздействие андрогенной депривации.
Важным объяснением повышения результатов в исследованиях по лучевой терапии, в которых применялась симультанная андрогенная депривация, является, в основном, радиосенсибилизирующий эффект андрогенной депривации. В исследованиях по лучевой терапии доза облучения простаты варьировала от 65 до 70 Гр, а поле радиации, включающее региональные лимфоузлы, было различным. Важно, что по сегодняшним стандартам данный диапазон дозы облучения рассматривается как субоптимальный. Действительно, исследования по эскалации дозы показали более высокие результаты при локализованном раке при дозе облучения конформальной лучевой терапии до 79 Гр над стандартной дозой (70,2 Гр) [5]. Сообщается о том, что андрогенная блокада снижает гипоксию опухоли, что может играть роль в повышении эффективности лучевой терапии, хотя на настоящий момент точный механизм не изучен [6].
Кроме формы возможного радиосенсибилизирующего эффекта, к некоторым из наблюдаемых результатов может приводить системное влияние адъювантной андрогенной депривации. В исследовании, проведенном Messing et al (пациенты с поражением лимфоузлов после радикальной простатэктомии) сообщалось об увеличении выживаемости при немедленной гормональной терапии [7]. Более того, недавно было опубликовано исследование по оптимальной продолжительности адъювантного лечения [8]. В нем пациенты с местно-распространенным раком были рандомизированы в группу симультанной и адъювантной андрогенной депривации к трехмерной конформной лучевой терапии (70 Гр) в течение 6 месяцев в одной группе и такой же комбинации лечения с дополнением 2,5 лет гормональной терапии в другой группе. После 3 лет андрогенной депривации сообщалось о повышении общей выживаемости (показатели смертности составили 15,2% и 19%, соответственно). Наблюдаемое отношение риска (HR) для общей выживаемости составило 1,42, что поддерживает положительную роль более длительной андрогенной депривации [8]. Хотя в этом исследовании местное лечение было идентичным, 2,5 года дополнительной гормональной терапии привели к повышению общей и канцерспецифической выживаемости больше, чем мы знали об этом из исследований, посвященных сравнению немедленной и отсроченной гормональной терапии. Эти результаты послужили началом систематического обзора, целью которого было рассмотреть рандомизированные исследования по андрогенной депривации (орхэктомия или аналоги релизинг-фактора лютеинизирующего гормона) при раке простаты для выявления связи между местным лечением и андрогенной депривацией.
2. Получение данных
Для этого систематического обзора отбирались все опубликованные результаты, полученные из рандомизированных исследований по сравнению немедленной и отсроченной гормональной терапии при раке простаты (Medline, Embase) с 1970 года, в которых приводились данные по общей и канцерспецифической выживаемости. Исследования, посвященные сравнению немедленной и отсроченной терапии и адъювантного режима, соответственно, кажутся достаточно схожими для проведения анализа литературы. Очевидно, что в этом обзоре нельзя избежать разногласий в публикациях и проблем, связанных с различием характеристик пациентов, схем лечения и т.д..
2.1. Статистический анализ
Результаты представлены в графике с применением анализа Мантеля-Хэнзеля [9]. Измерения влияния было представлено как отношения рисков в соответствии с фиксированными моделями влияния. С этой целью, мы брали информацию из опубликованных результатов отдельных исследований об отношениях рисков и доверительном интервале. Для исследования, проведенного группой Veterans Administration Cooperative.
Urological Research Group (VACURG) 1, было доступно только общее количество явлений и пациентов, поэтому, для суммирования его результатов использовали отношение шансов. Статистика I2 представлена скорее для процента отклонений между исследованиями, которые вызывают гетерогенность, чем для вероятности [10,11]: I2 = 0 означает отсутствие гетерогенности, I2 = 100% - максимальную гетерогенность. Для построения графика использовали SAS v.9.1 (SAS Institute, Cary, NC,USA).
2.2. Критерии отбора исследований
Три исследования, в которых оценивали только применение антиандрогенов или эстрогенов, не были включены в анализ [12–14]. Эстрогены и некоторые антиандрогены (бикалутамид) в некоторых ситуациях связаны с повышением смертности, не связанной с раком простаты [15,16]. В дополнение, в двух из этих исследований риск смерти от рака простаты был очень низким [12,13]. В таблице 1 представлены рандомизированные исследования, которые были выбраны для данного обзора.
3. Синтез данных
Было включено пять исследований по сравнению немедленной и отсроченной андрогенной депривации (раздел A в таблице 1) [17–23].
Из исследования VACURG 1 были взяты только лечебные группы, в которых проводилась орхэктомия и/или назначалось плацебо; группы, получавшие диэтилстилбестрол, не были включены.
В 4 исследованиях сообщалось о средней отсрочке в лечении в контрольной группе – она варьировала от 1,8 до 7 лет. В разделе В таблицы 1 приведены 5 исследований по адъювантному режиму [7,24–27], в них в качестве гормональной терапии применялась либо орхэктомия, либо назначались аналоги релизинг-фактора лютеинизирующего гормона. Продолжительность андрогенной депривации варьировала от 6 месяцев до пожизненного лечения.
В двух исследованиях – Онкологической группы по лучевой терапии (Radiation Therapy Oncology Group (RTOG)) 92-02 [28] и Европейской организации по исследования и лечению рака (EORTC) 22961 [8]— сравнивали короткие курсы (4 месяца неоадъювантной и симультанной терапии и 6 месяцев симультанной адъювантной терапии) и длинные (2 года адъювантной и 3 года адъювантной терапии, соответственно), они приведены в разделе С таблицы 1. В 3 исследованиях (приведенных под пунктом D в таблице 1) проводили рандомизацию между одной лучевой терапией и лучевой терапией с неоадъювантной и симультанной андрогенной депривацией [29,30]; в одном из них пациентов рандомизировали между 2 месяцами неоадъювантной и симультанной и 4 месяцами адъювантной гормональной терапии (без симультанной) [31]. Три исследования дают возможность установить преимущество андрогенной депривации как радиосенсибилизатора, при назначении ее симультанно с лучевой терапией.
Далее, одно исследование, в котором оценивали применение наружной лучевой терапии при стадии рака сT3 (исследование Скандинавской группы по раку простаты), приведено в разделе Е в таблице 1[32].
Таблица 1. Рандомизированные исследования, отобранные для этого обзора
ID исследования |
Первый автор |
Год |
TNM* |
Число пациентов |
Андрогенная депривация |
Местное лечение |
Отсроченная гормональная терапия, контроль |
Результаты, общая выживаемость |
||
А: Сравнение немедленной и отсроченной гормональной терапии, без местного лечения |
||||||||||
VACURGI |
Jordan |
1973 |
T3NxM0 |
528 |
Орхэктомия |
Нет |
Не установлено |
Нет значительного различия |
||
VACURGI |
Jordan |
1973 |
TxNxM1 |
426 |
Орхэктомия |
Нет |
Не установлено |
Нет значительного различия |
||
MRC |
Kirk |
2004 |
T3NxM0–1 |
938 |
Орхэктомия или аналоги релизинг-фактора лютеинизирующего гормона |
Нет |
2,5 года (М0) |
Нет значительного различия |
||
SAKK08/88 |
Studer |
2004 |
T0–4N0–1M0–1 |
188 |
Орхэктомия |
Нет |
3,2 года |
Нет значительного различия |
||
EORTC30891 |
Studer |
2006 |
T0–4N0–1M0 |
985 |
Орхэктомия или аналоги релизинг-фактора лютеинизирующего гормона |
Нет |
7 лет |
Небольшое преимущество при немедленной терапии, нет различий в канцер-специфической выживаемости |
||
EORTC30846 |
SchroЁder |
2008 |
TxN1M0 |
234 |
Орхэктомия или аналоги релизинг-фактора лютеинизирующего гормона |
Нет |
1,8 лет |
Нет значительного различия |
||
В: Сравнение адъювантной гормональной терапии к местному лечению с только местным лечением |
||||||||||
BI: андрогенная депривация в адъювантном режиме к радикальной простатэктомии |
||||||||||
ECOG3886 |
Messing |
2006 |
T1b–2N1M0 |
98 |
Орхэктомия или аналоги релизинг-фактора лютеинизирующего гормона |
Радикальная простатэктомия |
2,5 года1 |
Важное преимущество при комбинированном лечении |
||
BII: андрогенная депривация в адъювантном режиме к лучевой терапии |
||||||||||
EORTC22863 |
Bolla |
2002 |
T1–4N0–1M0 |
415 |
Аналоги релизинг-фактора лютеинизирующего гормона в течение 3 лет |
70 Гр |
4,5 года1 |
Важное преимущество при комбинированном лечении |
||
RTOG85-31 |
Pilepich |
2005 |
T3илиN1M0 |
977 |
Орхэктомия или аналоги релизинг-фактора лютеинизирующего гормона |
65-70 Гр |
Не установлено |
Умеренное преимущество при комбинированном лечении |
||
Granfors |
2006 |
T3N0–1M0 |
91 |
Орхэктомия |
65 Гр |
Не установлено |
Важное преимущество при комбинированном лечении |
|||
D’Amico |
2008 |
T2N0M0 |
206 |
Аналоги релизинг-фактора лютеинизирующего гормона плюс флутамид 6 месяцев |
3-мерная конформная лучевая терапия |
Не установлено |
Важное преимущество при комбинированном лечении |
|||
C: Сравнение кратко- и долгосрочной андрогенной депривации в адъювантном режиме к лучевой терапии |
||||||||||
RTOG92-02 |
Horwitz |
2008 |
T2c–4N0–1M0 |
1554 |
Аналоги релизинг-фактора лютеинизирующего гормона плюс флутамид 4 месяца в неоадъювантном режиме и одновременное лечение; сравнение 0 и 2 лет применения аналогов релизинг-фактора лютеинизирующего гормона |
65-70 Гр |
2,5 года1 |
Нет значительного различия |
||
EORTC22961 |
Bolla |
2009 |
T1c–T2abN1M0 |
970 |
Аналоги релизинг-фактора лютеинизирующего гормона в одновременном и адъювантном режиме; сравнение 6 месяцев и 3 лет |
3-мерная конформная лучевая терапия |
Не установлено |
Преимущество в группе 3-летнего лечения (3.8% через 5 лет) |
||
T2c–4N0–1M0 |
70 Гр |
|||||||||
D: Исследования, сравнивающие неоадъювантную плюс симультанную андрогенную депривацию с лучевой терапией и одну лучевую терапию |
||||||||||
TTROG96-01 |
Denham |
2005 |
T2b–T4N0M0 |
802 |
Аналоги релизинг-фактора лютеинизирующего гормона плюс флутамид; |
66 Гр |
– |
Нет значительного различия |
||
RTOG94-13 |
Lawton |
2007 |
T1c–T4N0–1M0 |
1292 |
Аналоги релизинг-фактора лютеинизирующего гормона плюс флутамид: |
Лучевая терапия всего таза в сравнении с лучевой терапией только простаты 70,2 Гр |
– |
Нет значимого различия между неоадъювантной плюс симультанной и адъювантной андрогенной депривацией (возможна взаимосвязь) |
||
RTOG86-10 |
Roach |
2008 |
T2–4N0–1M0 |
456 |
Аналоги релизинг-фактора лютеинизирующего гормона плюс флутамид: |
65–70 Гр |
– |
Через 10 лет нет значимых различий |
||
E: Комбинация местной лучевой терапии с гормональной в сравнении только с гормональной |
||||||||||
SPCG-7 |
Widmark |
2009 |
T3N0M0 |
880 |
Аналоги релизинг-фактора лютеинизирующего гормона 3 месяца плюс флутамид |
70 Гр (рандомизация) |
- |
Важное преимущество комбинированного лечения |
||
VACURG = Veterans Administration Cooperative Urological Research Group; MRC = Медицинский исследовательский совет;EORTC = Европейская организация по исследованию и лечению рака; ECOG = Восточная кооперативная онкологическая группа; RTOG = онкологическая группа по лучевой терапии. |
||||||||||
3.1. Исследования по сравнению немедленной и отсроченной андрогенной депривации
Результаты пяти исследований пациентов с местно-распространенным раком простаты, в которых оценивали роль немедленной и отсроченной андрогенной депривации, представлены на рис. 1A1 (общая выживаемость) и A2 (канцерспецифическая выживаемость) [15,18,20,22,23]. Два из этих исследований были частью обзора Cochrane 2001 года по сравнению немедленной и отсроченной андрогенной супрессии (VACURG) [15] и Медицинского исследовательского совета [MRC; 18,19]), которые пришли к заключению, что немедленная андрогенная депривация дает незначительное преимущество в общей выживаемости [3]. Результаты трех других исследований по этой проблеме были опубликованы после обзора Cochrane 2001 года; два были представлены EORTC (EORTC 30846 [21] и EORTC 30891 [23]), а одно – Швейцарской исследовательской группой SAKK [22]. Эти исследования были акцентированы на сравнении немедленной и отсроченной гормональной терапии у (соответственно) пациентов с опухолевым поражением лимфоузлов [21] и у пациентов с различными стадиями, которые не подходили для местного радикального лечения [22,23]. В первом исследовании (EORTC 30846) проводили рандомизацию 234 пациентов с опухолевым поражением лимфоузлов в группу немедленной и отсроченной андрогенной депривации без лечения первичной опухоли; однако оно не имело достаточной силы для оценки выживаемости. Отношение риска для общей выживаемости при отсроченной гормональной терапии по сравнению с немедленной составило 1,22, с широким доверительным интервалом 95% от 0,92 до 1,62, что показывает незначимую тенденцию в пользу немедленной терапии [21].
А1 |
Общая выживаемость |
||||||
|
Явления/пациенты |
Статистика |
HR/ДИ |
|1-HR| |
|||
Исследование |
Немедленная |
Отсроченная |
(О-Е) |
Откл. |
Немедленная : отсроченная |
%±SD |
|
Vacurg-1 M0 |
217/266 |
228/261 |
-7,6 |
111,3 |
 Немедленная лучше/отсроченная лучше Немедленная лучше/отсроченная лучше Лечебный эффект: p<0,01 |
10%±4 снижение |
|
Vacurg-1 M1 |
196/203 |
210/223 |
2,5 |
101,5 |
|||
MRC PR03 |
434/469 |
438/468 |
-24,9 |
218 |
|||
EORTC 30846 |
96/119 |
97/115 |
-9,6 |
47,9 |
|||
EORTC 30891 |
257/492 |
284/493 |
-29,5 |
134,1 |
|||
SAKK |
87/96 |
85/92 |
-0,4 |
41,9 |
|||
|
1287/1645 |
1342/1652 |
-69,5 |
654,7 |
|||
Анализ на гетерогенность |
|||||||
ДИ везде 95% |
|||||||
(А2) |
Канцер-специфическая выживаемость |
||||||
|
Явления/пациенты |
Статистика |
HR/ДИ |
|1-HR| |
|||
Исследование |
Немедленная |
Отсроченная |
(О-Е) |
Откл. |
Немедленная : отсроченная |
%±SD |
|
Vacurg-1 M0 |
39/266 |
62/261 |
-12 |
25,3 |
|
21%±5 снижение |
|
Vacurg-1 M1 |
100/203 |
111/223 |
-0,5 |
52,8 |
|||
MRC PR03 |
241/469 |
287/468 |
-35,5 |
131 |
|||
EORTC 30846 |
69/119 |
70/115 |
-7,1 |
34,5 |
|||
EORTC 30891 |
94/492 |
99/493 |
-9 |
47,3 |
|||
SAKK |
23/96 |
34/92 |
-6,3 |
13,7 |
|||
|
566/1645 |
663/1652 |
-70,6 |
304,5 |
|||
Анализ на гетерогенность |
|||||||
ДИ везде 95% |
|||||||
Рис. 1 – графики, показывающие эффективность пролонгированной андрогенной депривации над андрогенной депривацией при прогрессии в выбранных исследованиях, в плане влияния на общую и канцерспецифическую выживаемость.
(A1) Общая выживаемость при сравнении немедленной и отсроченной терапии; без местного лечения.
(A2) Канцерспецифическая выживаемость при сравнении немедленной и отсроченной терапии; без местного лечения.
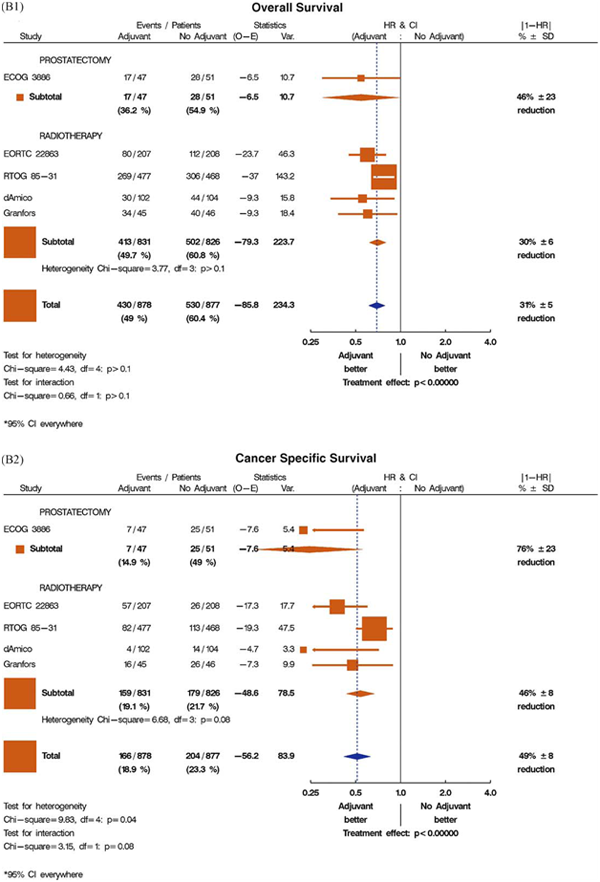
(B1) Общая выживаемость при режиме адъювантой андрогенной депривации (в сочетании с местной лучевой терапией или радикальной простатэктомией).
(B2) Канцерспецифическая выживаемость при режиме адъювантой андрогенной депривации (в сочетании с местной лучевой терапией или радикальной простатэктомией).
VACURG = Veterans Administration Cooperative Urological Research Group;
MRC = Медицинский исследовательский совет;
EORTC = европейская организация по исследованию и лечению рака ;
HR = отношение риска;
CI = доверительный интервал;
SD = стандартное отклонение.
В EORTC 30891 исследовали 985 пациентов со стадией рака простаты T0–4N0–1M0, которые не подходили или не хотели, чтобы им проводили местное радикальное лечение. Почти у половины пациентов, рандомизированных в группу отсроченного лечения, не было необходимости начинать андрогенную депривацию в течение исследования. Немедленная андрогенная депривация привела к умеренному, но статистически значимому повышению общей выживаемости, однако различий в смертности, связанной с раком простаты или бессимптомной выживаемостью, не было [23]. Также, в Швейцарском исследовании не было показано явного преимущества при немедленной терапии у пожилых бессимптомных пациентов, которым не проводилось радикальное лечение [22]; тем не менее, это исследование было небольшим и не достигло статистической мощности. Графики показывают последовательную картину этих исследований: небольшое, но значимое в метаанализе, статистическое преимущество немедленной андрогенной депривации, измеренное в относительном увеличении общей и канцерспецифической выживаемости на 10% (HR: 0,90; 95% ДИ, 0,83–0,97) и 21% (HR:0,79; 95% ДИ, 0,71–0,89), соответственно. При большей продолжительности андрогенной депривации в группе немедленной терапии достигнутое преимущество в общей выживаемости было умеренным. В некоторых исследованиях сообщалось и о других плюсах немедленной терапии. Например, в исследовании MRC повысилась канцерспецифическая выживаемость, и наблюдалось снижение частоты компрессии спинного мозга, патологических переломов и внескелетных метастазов [19]. В противоположность, в исследовании EORTC 30891 было показано, что отсроченное лечение дает преимущество в качестве жизни [23].
В1 |
Общая выживаемость |
|||||
|
Явления/пациенты |
Статистика |
HR/ДИ |
|1-HR| |
||
Исследование |
Адъювантная терапия |
Без адъювантной терапии |
(О-Е) |
Откл. |
Адъювантная : без адъювантной |
%±SD |
Простатэктомия |
|
46%±23 |
||||
ECOG 3886 |
17/47 |
28/51 |
-6,5 |
10,7 |
||
|
17/47 |
28/51 |
-6,5 |
10,7 |
||
Лучевая терапия |
||||||
EORTC 22863 |
80/207 |
112/208 |
-237 |
46,3 |
||
RTOG 85-31 |
269/477 |
306/468 |
-37 |
143,2 |
||
d’Amico |
30/102 |
44/104 |
-9,3 |
15,8 |
||
Granfors |
34/45 |
40/46 |
-9,3 |
18,4 |
||
|
413/831 |
502/826 |
-79,3 |
223,7 |
||
Гетерогенность Хи-квадрат=3,77, df=3, p>0,1 |
||||||
|
430/878 |
530/877 |
-85,8 |
234,3 |
||
Анализ на гетерогенность |
||||||
Анализ на взаимосвязь |
||||||
ДИ везде 95% |
||||||
(В2) |
Канцер-специфическая выживаемость |
|||||
|
Явления/пациенты |
Статистика |
HR/ДИ |
|1-HR| |
||
Исследование |
Адъювантная терапия |
Без адъювантной терапии |
(О-Е) |
Откл. |
Адъювантная : без адъювантной |
%±SD |
Простатэктомия |
||||||
ECOG 3886 |
7/47 |
25/51 |
-7,6 |
5,4 |
|
76%±23 |
|
7/47 |
25/51 |
-7,6 |
5,4 |
||
Лучевая терапия |
||||||
EORTC 22863 |
57/207 |
26/208 |
-17,3 |
17,7 |
||
RTOG 85-31 |
82/477 |
113/468 |
-19,3 |
47,5 |
||
d’Amico |
4/102 |
14/104 |
-4,7 |
3,3 |
||
Granfors |
16/45 |
26/46 |
-7,3 |
9,9 |
||
|
159/831 |
179/826 |
-48,6 |
78,5 |
||
Гетерогенность Хи-квадрат=6,68, df=3, p>0,08 |
||||||
|
166/878 |
204/877 |
-56,2 |
83,9 |
||
Анализ на гетерогенность |
||||||
Анализ на взаимосвязь |
||||||
ДИ везде 95% |
||||||
Рис. 1. (продолжение)
3.2. Исследования по адъювантной терапии
Для данного обзора были выбраны пять исследований адъювантной андрогенной депривации, они представлены в графиках на рис.1 B1 (общая выживаемость) и B2 (канцерспецифическая смертность) [7,24–27]. В четырех из них в качестве местного лечения применяли лучевую терапию, а в одном – радикальную простатэктомию (рис. 1B1 и B2). Три из этих исследований [7,24,25] были частью метаанализа Cochrane 2006 года, в котором авторы пришли к заключению, что использование адъювантной андрогенной депривации в сочетании с простатэктомией или лучевой терапией приводит к важному клиническому преимуществу, включая увеличение общей выживаемости [4]. Длительность андрогенной депривации в группах адъювантной терапии варьировала от 6 месяцев (D’Amico et al. [26]) до 3 лет (Bolla et al. [24]) и до пожизненного лечения (исследование Восточной кооперативной онкологической группы [ECOG] [7]; RTOG 85-31 [25]; Granfors et al. [27]).
В исследованиях по лучевой терапии андрогенную депривацию начинали на ее старте, за исключением исследования RTOG 85-31, в котором гормональное лечение начали на последней неделе лучевой терапии [25]. О времени до начала спасительной андрогенной депривации в контрольной группе не сообщалось. Если это было доступно, то в таблице 1 приводились данные по времени до прогрессии в контрольной группе, потому что, вероятно, что она приводит к началу андрогенной депривации у этих пациентов. Метаанализ показал общее относительное снижение риска смерти на 31% (HR: 0,69; 95% ДИ, 0,61–0,79; p менее 0,000001; анализ на гетерогенность I2 = 10%, p = 0,35) и риска канцерспецифической смертности на 49% (HR: 0,51; 95% ДИ, 0,41–0,63; p менее 0,000001; анализ на гетерогенность I2 = 59%, p = 0,04). При ограничении анализа на исследования, в которых в качестве первичного лечения применяли лучевую терапию, рисунки становятся похожими (HR: 0,70; 95% ДИ, 0,62–0,80 для общей, HR: 0,54; 95% ДИ, 0,43–0,67 для канцерспецифической выживаемости). Тем не менее, необходимо отметить значительную гетерогенность в результатах исследований, особенно по канцерспецифической выживаемости, даже когда рассматриваются только исследования по лучевой терапии (гетерогенность I2 = 20%, p = 0,29 для общей и I2 = 55%, p = 0,08 для канцерспецифической выживаемости в исследованиях по лучевой терапии). Возможными причинами такой гетерогенности между исследованиями являются различия в местном лечении (радикальная простатэктомия или лучевая терапия с различными дозами облучения) и различия в продолжительности андрогенной депривации как в основной, так и в контрольной группе. Дополнительное отклонение канцерспецифической выживаемости при определении причины смерти также может быть причиной гетерогенности. Относительное преимущество для немедленной (адъювантной) терапии в исследовании RTOG 85-31 менее выражено, чем в других исследованиях, приведенных на рис. 1B1 и B2. Следует отметить, что в исследовании RTOG 85-31 при местной лучевой терапии была принята доза облучения 65 Гр, которая является самой низкой среди этих исследований. В дополнение, в этом исследовании адъювантная андрогенная депривация проводилась не симультанно, а начиная с последней недели лучевой терапии.
3.3. Обсуждение
Исследования, которые были направлены на оценку немедленной и отсроченной андрогенной депривации без местного лечения при различных стадиях рака простаты (T3, N1, M1), показывают умеренное преимущество для немедленной терапии в плане общей и канцерспецифической выживаемости. Хотя популяции в 5 включенных исследованиях значительно отличались, умеренное преимущество при пролонгированном применении андрогенной депривации определяется в каждом из них и для общей, и для канцерспецифической выживаемости. Учитывая хорошо известные побочные эффекты пролонгированного воздействия гормональной терапии, многие клиницисты утверждают, что в этой ситуации для большинства пациентов умеренное преимущество не перевешивает ее недостатков. Более разнообразная и сложная картина развивается в исследованиях, в которых комбинировали андрогенную депривацию с местным лечением рака. Во-первых, мы обнаружили, что исследования на рис. 1B1 и B2 показывают более выраженное относительное влияние на общую (HR: 0,69; 95% ДИ, 0,61–0,79) и канцерспецифическую выживаемость (HR: 0,51; 95% ДИ, 0,43–0,67), чем исследования по сравнению немедленной и отсроченной андрогенной депривации. Во вторых, мы наблюдаем значительную гетерогенность среди исследований по адъювантной терапии, даже при анализе исследований только с лучевой терапией. По большей части, кажется, что эта гетерогенность является следствием исследования RTOG 85-31 (при исключении этого исследования I2 = 0 для обеих конечных точек).
Важный вопрос в том, является ли повышение эффективности андрогенной депривации в адъювантном режиме результатом улучшения местного лечения (радиосенсибилизирующий эффект), системным эффектом (который наблюдается только после местного лечения, потому что не присутствует на рис. 1A1 и A2) или комбинацией двух составляющих. По нашему мнению, на основании четырех следующих наблюдений для достижения преимущества в выживаемости особенно важен системный эффект андрогенной депривации. Во-первых, ее радиосенсибилизирующий эффект был предположен ранее, особенно когда доза облучения была субоптимальной, что наблюдалось во всех приведенных исследованиях по лучевой терапии [24–27]. Тем не менее, в трех крупных, рандомизированных исследованиях, в которых комбинировали неоадъювантную и симультанную андрогенную депривацию в одной группе и не проводили симультанной гормональной терапии в другой, не было показано преимущества комбинированного лечения в плане общей выживаемости (смотрите Таблицу 1, раздел D) [29–31].
В первом исследовании [30], проведенном Denham et al, проводили лучевую терапию с дозой облучения 66 Гр при местно-распространенном раке. Не было обнаружено статистически значимого преимущества при среднем периоде наблюдения 5,9 лет.
Во втором исследовании, проведенном Lawton et al, были показаны одинаковые показатели общей и канцерспецифической выживаемости у 1292 пациентов (местно-распространенный рак и/или установленный 15% риск опухолевого поражения лимфоузлов), которые были рандомизированы в группу 2 месяцев неоадъювантной и симультанной терапии и в группу 4 месяцев адъювантной андрогенной депривации, проведенной после лучевой терапии. В этом исследовании, вторая рандомизация была выполнена между лучевой терапией всего таза и только простаты (также не было значимого различия в общей и канцерспецифической выживаемости). Необъяснимая связь между местным и системным лечением была предположена в этом исследовании, хотя оно не имело достаточной силы для подтверждения этого утверждения в анализе подгрупп [31]. В третьем исследовании для воздействия на простату и региональные лимфоузлы при стадии рака T2–4N0–1применяли дозу облучения 65-70 Гр [29]; через 10 лет для комбинированного лечения не было обнаружено преимущества в общей выживаемости.
В общем, эти исследования показали, что радиосенсибилизирующий эффект андрогенной депривации одной имеет ограниченное влияние на общую выживаемость. Следует отметить, что в двух из этих исследований сообщалось о значительном различии в канцер-специфической выживаемости, в то время как на основании данных подгруппового анализа можно предположить преимущество в общей выживаемости при опухолях с суммой баллов по Глисону менее 7 [30,33].
Во-вторых, во всех исследованиях, в которых обнаружили преимущество в общей выживаемости для адъювантной андрогенной депривации (рис. 1B1 и B2), кривые выживаемости начинают разделяться почти сразу же после включения в исследования, что позволяет предположить, что пациенты с очень агрессивным раком внесли наибольший вклад в наблюдаемое различие [7,24–27]. Таблицы риска показывают очень высокий риск развития субклинических метастазов в исследованиях, включавших пациентов с местно-распространенным раком простаты [24], в то время как в другие исследования были включены пациенты с подтвержденным опухолевым поражением лимфоузлов [7,25]. Считается, что именно эта подгруппа с метастазами вносит вклад в большинство ранних смертей в этих исследованиях. Маловероятно, что на ранний риск смерти может влиять только одно повышение местного контроля.
В третьих, в исследовании ECOG, в котором в качестве местного лечения использовали радикальную простатэктомию, было показано, что преимущество в выживаемости для немедленной андрогенной депривации достигает такой же величины, которая была обнаружена в исследованиях по симультанной и адъювантной к лучевой терапии андрогенной депривации [7].
И, в-четвертых, в исследовании EORTC 22961, в котором сравнивали 3 года и 6 месяцев симультанной и адъювантной гормональной терапии (после лучевой), через 3 года исследования была достигнута более высокая выживаемость [8]. Лечение первичной опухоли было одинаковым в обеих группах, что показывает, что преимущество в выживаемости пролонгированной андрогенной депривации (+3,8% в общей выживаемости через 5 лет; HR: 1,42) намного больше, чем отношения рисков, наблюдаемые в этих исследованиях без местного лечения (HR: 1,11; рис. 1A1).
На наш взгляд, эти результаты показывают, что не только один радиосенсибилизирующий эффект вносит вклад в большое различие, обнаруженное в исследованиях, в которых применяли симультанную и адъювантную к лучевой гормональную терапию. Андрогенная депривация имеет потенциал к улучшению общей и канцерспецифической выживаемости, но, что важно – эффект наблюдается только при применении местного лечения первичной опухоли.
Преимущество местного лечения пациентов при назначении пролонгированной андрогенной депривации подчеркивается сравнением исследования EORTC 30846 (без местного лечения, Рис. 1A1 и A2) и исследования ECOG (радикальная простатэктомия, Рис. 1B1 и B2), каждое из которых проводилось среди пациентов с опухолевым поражением лимфоузлов [7,21]. В обоих исследованиях были ограниченное число пациентов и статистическая мощность и, поэтому, их нужно интерпретировать с осторожностью; тем не менее, их результаты включены в другие исследования в их метаанализ. Хотя 10-летняя общая выживаемость в исследовании EORTC 30846 составила 25% в группе отсроченной и 30% в группе немедленной андрогенной депривации, в группе комбинированного лечения в исследовании ECOG была показана 10-летняя общая выживаемость около 80%, по сравнению только с 50% в группе одной радикальной простатэктомии. Возможен сдвиг к более распространенному раку и/или менее здоровым пациентам в исследовании EORTC 30846, которым не требовалась радикальная хирургия (в противоположность исследованию ECOG). Тем не менее, большое различие в общей выживаемости позволяет предположить, что местное лечение влияет на нее, несмотря на наличие метастазов в лимфоузлах и, далее, что пролонгированная андрогенная депривация в этой популяции позволяет получить дополнительное преимущество в выживаемости, что не наблюдается при отсутствии местного лечения.
Не проводилось рандомизированных исследований, которые бы оценивали значимость местного лечения при подтвержденном опухолевом поражении лимфоузлов. В исследовании SPCG-7, при сравнении местной лучевой терапии в сочетании с гормональным лечением и только гормонального лечения при местно-распространенном раке простаты, была подтверждена важность местного лечения при стадии T3N0 (таблица 1, раздел E) [32]. В этом исследовании, у субъектов был уровень простатспецифического антигена (ПСА) 70 нг/мл и менее, и при выполнении остеосцинтиграфии и обзорной R-граммы органов грудной клетки не было выявлено данных за метастазы. Субъектам с уровнем ПСА 11 нг/мл и более, выполняли тазовую лимфодиссекцию (до запирательной ямки); пациенты с поражением лимфоузлов не включались в исследование. В недавнем наблюдательном исследовании сообщалось о более высокой общей выживаемости при поражении лимфоузлов после радикальной простатэктомии; тем не менее, интерпретации результатов этого исследования препятствует дисбаланс между прогностическими факторами между группами [34].
Хорошо документированные побочные эффекты андрогенной депривации включают потерю эректильной функции, усталость, анемию, потерю минеральной плотности костей, депрессию и физиологические изменения. Побочные эффекты пролонгированного лечения (3 года по сравнению с 6 месяцами) хорошо изучены в исследовании EORTC 22961, которое обсуждалось ранее [8]. В опросниках, заполняемых пациентами (EORTC-QLQ C30), баллы по нарушению сна, приливам, половому интересу и сексуальной активности были хуже после 3-летнего периода лечения, по сравнению с пациентами, у которых андрогенная депривация была приостановлена через 6 месяцев. Тем не менее, баллы по общему качеству жизни, были идентичными в обеих группах исследования в течение 3 лет [8].
Данные текущего анализа позволяют предположить, что роль местного лечения при местно-распространенном раке и раке с поражением лимфоузлов важна, и предполагается связь между местным лечением и системной андрогенной депривацией. Молекулярная основа для взаимодействия или супрааддитивного эффекта местного и системного лечения рака простаты в настоящее время не выяснена. Можно рассуждать, что первичная опухоль является преимущественным источником метастазов, и на нее, по-видимому, не адекватно воздействует одна гормональная терапия. Coen et al сообщили о ретроспективном исследовании, в котором описывалось, что пациенты с местным рецидивом после лучевой терапии имеют более высокий риск развития отдаленных метастазов. Из-за продолжительного времени до появления отдаленных метастазов у пациентов с местным рецидивом, авторы отнесли это наблюдение к поздней волне метастазов из местно-персистирующей опухоли [35].
Андрогенная депривация после местного лечения может снижать риск смерти от рака простаты, но это не означает, что такое лечение необходимо назначать каждому пациенту. Рак простаты – это заболевание возрастных мужчин, которые имеют сопутствующие заболевания и риск умереть от причин иных, чем рак. Во всех исследованиях значительное число пациентов имеют большую выживаемость, даже в группе наблюдения. В исследовании ECOG, например, после медианы наблюдения более 11 лет, 26% пациентов с опухолевым поражением лимфоузлов в группе наблюдения не перешли на андрогенную депривацию [7]. Отбор пациентов, которым, как ожидается, принесет преимущество комбинация местного лечения и пролонгированной терапии, остается трудной задачей. При вторичном анализе исследования EORTC 30891 (без местного лечения), было выявлено, что время удвоения ПСА менее 12 месяцев является показателем, который может помочь в выявлении пациентов с высоким риском смерти от рака простаты [36]. Также следует отметить, что в этом исследовании 50% пациентов в группе отсроченной андрогенной депривации не начинали лечение в течение 7 лет, и 25,6% умерли без необходимости в начале гормональной терапии [23].
3.4. Ограничения
Этот анализ имеет несколько ограничений, многие из которых связаны с методологией, применяемой при метаанализе. Во-первых, исследования включали различные популяции (некоторые исследования, сравнивающие немедленную и отсроченную андрогенную депривацию, включали пациентов с костными метастазами, в то время как в исследованиях по адъювантному режиму эта популяция не включалась). Во-вторых, исследования проводились в различное время, некоторые датируются в эру до введения ПСА. В дополнение, имеются различия в самой андрогенной депривации, как в типе, так и в схемах лечения. Также, применение андрогенной депривации в руке наблюдения за последние годы изменилось и отличается в Европе и США. Местное лечение в исследованиях по адъювантному режиму также варьировало (после радикальной простатэктомии, лучевой терапии в различных формах, с или без симультанной андрогенной депривации). В соответствии с сегодняшними стандартами, доза облучения в 65-70 Гр является субоптимальной. В исследованиях по лучевой терапии, варьировало поле облучения (включая различия в облучении тазовых лимфоузлов). В дополнение, некоторые исследования были ограниченными по размеру и мощности. Наконец, так как мы не можем собрать данные отдельных пациентов из различных исследований, мы не можем установить полную кривую выживаемости, а можем выявить только средний относительный эффект лечения; мы не можем исследовать прогностические факторы эффективности лечения, связанные с пациентами. Сила анализа в том, что могут быть включены несколько крупных и зрелых исследований и что результаты менее крупных исследований, при группировании соответственно виду лечения первичной опухоли, следуют в том же направлении. Результаты позволяют предположить, что лечение первичной опухоли – это важная составляющая при обсуждении андрогенной депривации.
4. Выводы
В некоторых исследованиях было показано, что у пациентов с раком простаты высокого риска на различных стадиях, особенно при местно-распространенном раке и при поражении лимфоузлов адъювантная андрогенная депривация (варьируя по срокам от 6 месяцев до пожизненной) может значительно влиять на общую и канцер-специфическую выживаемость. Кажется, что лучевая терапия и хирургическое удаление первичной опухоли является необходимыми условиями для получения полного преимущества продолжительной (например, более 6 месяцев) андрогенной депривации. Хотя многие клиницисты не решаются предлагать местное лечение пациентам, которые не могут быть радикально излечены, текущий анализ позволяет предположить, что это является важным компонентом оптимального лечения, вносящим вклад в повышение выживаемости. Будет ли преимущество в выживаемости при комбинированном лечении достаточно веским контраргументом против побочных эффектов пролонгированной андрогенной депривации и местного лечения, остается вопросом, который должен присутствовать в беседе с информированным пациентом. Не все больные с раком со стадией Т3 и/или опухолевым поражением лимфоузлов нуждаются в таком интенсивном лечении, что связано с медленным естественным развитием рака простаты и/или часто встречающимися сопутствующими заболеваниями. Оптимальный отбор пациентов для такого интенсивного лечения остается проблемным. Если ожидается, что пациент умрет в течение 3-5 лет от рака, то считается, что он получит максимальную пользу от комбинированного лечения.
Список литературы
[1] Huggins C, Hodges CV. Studies on prostatic cancer: I. The effect of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. 1941. J Urol 2002; 168:9–12.
[2] Niehans P. Prostata Krebs wie Paraprostata-Hypertrophie sind Folgen hormonaler StoЁrungen die wir je fruЁ her je besser beeinflussen koЁnnen. Bern: Verlag Hans Huber; 1940.
[3] Nair B, Wilt T, MacDonald R, Rutks I. Early versus deferred androgen suppression in the treatment of advanced prostatic cancer. Cochrane Database Syst Rev 2002, CD003506.
[4] Kumar S, Shelley M, Harrison C, et al. Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. Cochrane Database Syst Rev 2006, CD006019.
[5] Zietman AL, DeSilvio ML, Slater JD, et al. Comparison of conventional- dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial. JAMA 2005;294:1233–9.
[6] Milosevic M, Chung P, Parker C, et al. Androgen withdrawal in patients reduces prostate cancer hypoxia: implications for disease progression and radiation response. Cancer Res 2007;67:6022–5.
[7] Messing EM, Manola J, Yao J, et al. Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol 2006;7:472–9.
[8] Bolla M, de Reijke TM, Van Tienhoven G, et al. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009;360:2516–27.
[9] Mantel N, Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. J Natl Cancer Inst 1959;22:719–48.
[10] Higgins JP, Thompson SG. Quantifying heterogeneity in a metaanalysis. Stat Med 2002;21:1539–58.
[11] Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ 2003;327:557–60.
[12] McLeod DG, Iversen P, See WA, et al. Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cancer. BJU Int 2006;97:247–54.
[13] Wirth MP, Weissbach L, Marx F-J, et al. Prospective randomized trial comparing flutamide as adjuvant treatment versus observation after radical prostatectomy for locally advanced, lymph node-negative prostate cancer. Eur Urol 2004;45:267–70, discussion 270.
[14] Zagars GK, Johnson DE, von Eschenbach AC, Hussey DH. Adjuvant estrogen following radiation therapy for stage C adenocarcinoma of the prostate: long-term results of a prospective randomized study. Int J Radiat Oncol Biol Phys 1988;14:1085–91. 268 E U R O P E A N U R O L O G Y 5 8 ( 2 0 1 0 ) 2 6 1 – 2 6 9
[15] Jordan Jr WP, Blackard CE, Byar DP. Reconsideration of orchiectomy in the treatment of advanced prostatic carcinoma. South Med J 1977;70:1411–3.
[16] Iversen P, Johansson JE, Lodding P, et al. Bicalutamide (150 mg) versus placebo as immediate therapy alone or as adjuvant to therapy with curative intent for early nonmetastatic prostate cancer: 5.3-year median followup from the Scandinavian Prostate Cancer Group Study Number 6. J Urol 2004;172:1871–6.
[17] Byar DP. Proceedings: The Veterans Administration Cooperative Urological Research Group’s studies of cancer of the prostate. Cancer 1973;32:1126–30.
[18] The Medical Research Council Prostate Cancer Working Party Investigators Group. Immediate versus deferred treatment for advanced prostatic cancer: initial results of the Medical Research Council Trial. Br J Urol 1997; 79:235–46.
[19] Kirk D. Timing and choice of androgen ablation. Prostate Cancer Prostatic Dis 2004;7:217–22.
20] SchroЁder FH, Kurth K-H, Fossa SD, et al. Early versus delayed endocrine treatment of pN1-3 M0 prostate cancer without local treatment of the primary tumor: results of European Organisation for the Research and Treatment of Cancer 30846—a phase III study. J Urol 2004;172:923–7.
[21] Schroder FH, Kurth KH, Fossa SD, et al. Early versus delayed endocrine treatment of T2-T3 pN1-3 M0 prostate cancer without local treatment of the primary tumour: final results of European Organisation for the Research and Treatment of Cancer Protocol 30846 after 13 years of follow-up (a randomised controlled trial). Eur Urol 2009;55:14–22, editorial 23-25.
[22] Studer UE, Hauri D, Hanselmann S, et al. Immediate versus deferred hormonal treatment for patients with prostate cancer who are not suitable for curative local treatment: results of the randomized trial SAKK 08/88. J Clin Oncol 2004;22:4109–18.
[23] Studer UE, Whelan P, Albrecht W, et al. Immediate or deferred androgen deprivation for patients with prostate cancer not suitable for local treatment with curative intent: European Organisation for Research and Treatment of Cancer (EORTC) Trial 30891. J Clin Oncol 2006;24:1868–76.
[24] Bolla M, Collette L, Blank L, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002;360:103–6.
[25] Pilepich MV, Winter K, Lawton CA, et al. Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma—longterm results of phase III RTOG 85-31. Int J Radiat Oncol Biol Phys 2005;61:1285–90.
[26] D’Amico AV, Chen MH, Renshaw AA, Loffredo M, Kantoff PW. Androgen suppression and radiation vs radiation alone for prostate cancer: a randomized trial. JAMA 2008;299:289–95.
[27] Granfors T, Modig H, Damber JE, Tomic R. Long-term followup of a randomized study of locally advanced prostate cancer treated with combined orchiectomy and external radiotherapy versus radiotherapy alone. J Urol 2006;176:544–7.
[28] Horwitz EM, Bae K, Hanks GE, et al. Ten-year follow-up of Radiation Therapy Oncology Group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 2008;26:2497–504.
[29] Roach III M, Bae K, Speight J, et al. Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: long-term results of RTOG 8610. J Clin Oncol 2008;26:585–91.
[30] Denham JW, Steigler A, Lamb DS, et al. Short-term androgen deprivation and radiotherapy for locally advanced prostate cancer: results from the Trans-Tasman Radiation Oncology Group 96.01 randomised controlled trial. Lancet Oncol 2005;6:841–50.
[31] Lawton CA, DeSilvio M, Roach III M, et al. An update of the phase III trial comparing whole pelvic to prostate only radiotherapy and neoadjuvant to adjuvant total androgen suppression: updated analysis of RTOG 94-13, with emphasis on unexpected hormone/ radiation interactions. Int J Radiat Oncol Biol Phys 2007;69:646–55.
[32] Widmark A, Klepp O, Solberg A, et al. Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/ SFUO-3):an open randomisedphase III trial. Lancet2009;373:301–8.
[33] Pilepich MV, Winter K, John MJ, et al. Phase III radiation therapy oncology group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001;50:1243–52.
[34] Engel J, Bastian PJ, Baur H, et al. Survival benefit of radical prostatectomy in lymph node–positive patients with prostate cancer. Eur Urol 2010;57:754–61.
[35] Coen JJ, Zietman AL, Thakral H, Shipley WU. Radical radiation for localized prostate cancer: local persistence of disease results in a late wave of metastases. J Clin Oncol 2002;20:3199–205.
[36] Studer UE, Collette L, Whelan P, et al. Using PSA to guide timing of androgen deprivation in patients with T0–4 N0–2 M0 prostate cancer not suitable for local curative treatment (EORTC 30891). Eur Urol 2008;53:941–9.
EUROPEAN UROLOGY 5 8 ( 2 0 1 0 ) 2 6 1 – 2 6 9 269









 Немедленная лучше/отсроченная лучше Лечебный эффект: p<0,00001
Немедленная лучше/отсроченная лучше Лечебный эффект: p<0,00001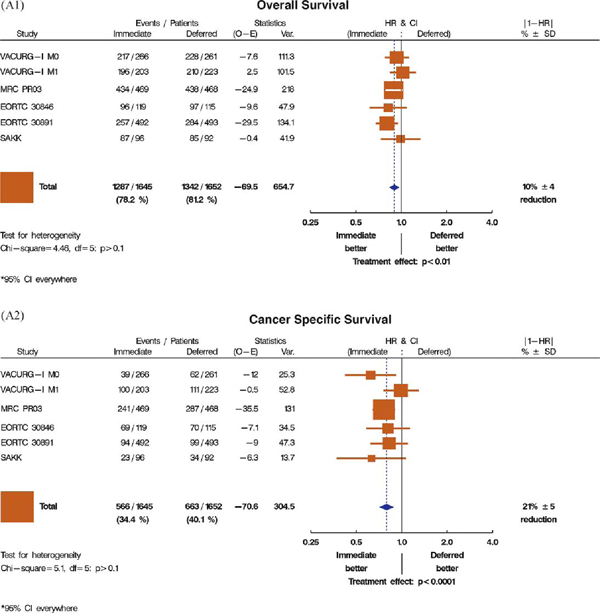
Комментарии