Тюзиков И.А., Калинченко С.Ю.
Инфекции нижних мочевыводящих путей у женщин являются актуальной медико-социальной проблемой современной амбулаторной урологии, что обусловлено, прежде всего, высокой частотой их распространенности в женской популяции [1-4]. По данным статистики, каждый год около 15% сексуально активных женщин переносят хотя бы один эпизод острого бактериального цистита, а в целом в течение всей жизни не менее 60% женщин хотя бы раз страдали этим заболеванием [1]. После перенесенного острого бактериального цистита примерно у 50% женщин в течение года развиваются рецидивы заболевания, которые в 15-25% случаев переходят к хронический рецидивирующий бактериальный цистит (ХРБЦ), приобретающий зачастую весьма упорное клиническое течение и характеризующийся недостаточной эффективностью проводимых фармакотерапевтических мероприятий, что сопровождается нередко тяжелой медико-социальной и психологической дезадаптацией и резким снижением качества жизни женщин [2-4].
ХРБЦ: СОВРЕМЕННЫЕ ПРОБЛЕМЫ АНТИМИКРОБНОЙ ХИМИОТЕРАПИИ И ПУТИ ИХ РЕШЕНИЯ
В настоящее время практически все исследователи и клиницисты отмечают мультифакторную природу феномена снижения эффективности антибактериальной терапии при ХРБЦ:
- Факторы со стороны микроорганизмов (способность бактерий к формированию биофильмов (биопленок) в слизистой мочевого пузыря; мутации, приводящие к повышению экспрессии ключевых ферментов распада антибиотиков, которые бактерии способны передавать следующим поколениям штаммов; структурная модификация синтезируемых бактериями эндои экзотоксинов и т.д.) [5,6].
- Факторы со стороны макроорганизма (снижение механизмов природной и приобретенной иммунологической реактивности как врожденного характера, так и приобретаемых в течение жизни в связи с различными заболеваниями (например, снижение уротелиального синтеза секреторного иммуноглобулина IgA и защитных гликозаминогликанов слизистой); повышенный уровень аллергической триггерности населения, что делает практически невозможным назначение антибиотиков в целом ряде случаев; хронические заболевания, сопровождающиеся потенциальной способностью изменять метаболизм антибиотика в организме (заболевания печени и желудочно-кишечного тракта) и т.д.) [7,8].
- Фармакологические факторы (практически полное отсутствие синтеза новых эффективных классов антибиотиков за последние десятилетия, ограниченный механизм действия ряда антимикробных химиопрепаратов, бесконтрольное и нерациональное назначение антибиотиков в клинической практике, использование некачественных дженериков, широкое назначение ветеринарных антибиотиков животным, ведущее к последующей сенсибилизации иммунной системы человека при употреблении мяса таких животных, и т.д.) [9-11].
Мировая волна антибиотикорезистентности в различных ее проявлениях, захлестнувшая подавляющее большинство стран мира, включая Россию, заставляет сегодня активно искать пути решения проблемы фармакотерапии инфекционных заболеваний, в том числе, и ХРБЦ у женщин. И если в настоящее время возможности синтеза новых эффективных антибиотиков для борьбы с микроорганизмами остаются ограниченными, то, очевидно, следует обратить внимание на состояние второго участника инфекционно-воспалительного процесса – макроорганизм, который противостоит любому патогену, а исход инфекционного воспаления зависит не от каждого из них по отдельности, а является результатом их противостояния и взаимодействия, опосредованных огромным количеством механизмов с обеих сторон. Это положение, на наш взгляд, особо применимо в отношении мочевого пузыря, который с физиологической точки зрения не является простым «пассивным» резервуаром для удержания и эвакуации мочи, а представляет собой гормоно-зависимый орган, все структуры которого находятся под мощным нейро-гормональным контролем [12]. Опосредованное, прежде всего половыми стероидными гормонами, влияние на анатомо-функциональное состояние структурных элементов мочевого пузыря обеспечивает практически все его физиологические функции: от накопительно-резервуарной и эвакуаторной до уротелий-протективной, нейроэндотелиальной (иннервация и кровоснабжение) и особенно бактерицидной функции, которые в содружестве обеспечивают уротелию мочевого пузыря известный и достаточно высокий уровень природной антибактериальной резистентости [13,14].
Зависимость анатомо-функционального состояния уротелия мочевого пузыря у женщин от уровня половых гормонов была установлена еще в 1947 году [15]. В дальнейших же исследованиях была показана ключевая роль половых гормонов (эстрогенов и прогестерона) в обеспечении синтеза уротелием защитных мукополисахаридов-гликозаминогликанов (гиалуроновая кислота и ее соли натрия и цинка, хондроитинсульфат, гликопротеины, муцин), составляющих поверхностный гликокаликс слизистой мочевого пузыря – мощную природную систему антибактериальной защиты (антиадгезивный фактор), утрата которой закономерно повышает восприимчивость уротелия к различным неблагоприятным воздействиям, включая инфекционные агенты. Это рассматривается сегодня как одно из ключевых проявлений дисфункции уротелия, лежащей в основе современного патогенеза ХРБЦ и его рецидивов [16-19].
Работы последних десятилетий свидетельствуют, что ХРБЦ является не столько самостоятельным локальным инфекционно-воспалительным процессом в мочевом пузыре, сколько инфекционной «верхушкой айсберга» системных метаболических и гормональных механизмов (системного хронического цитокинового воспаления, симпатической вегетативной гиперактивности, окислительного стресса, снижения антиоксидантной и иммунологической реактивности организма, нейро-эндотелиальной дисфункции, системной гипоксии и др.), неизбежно отражающихся на ключевых функциях мочевого пузыря, включая бактерицидную [20-22].
С позиций системного подхода к проблеме ХРБЦ также очевидно, что при общем нездоровье женщины частота его рецидивов склонна к увеличению, что может быть связано с высокой частотой в популяции современных женщин гормональнометаболических системных нарушений (ожирение, инсулинорезистентность, дислипидемия, артериальная гипертония (эндотелиальная дисфункция), сахарный диабет 2 типа, саркопения (дефицит количества и качества мышечной массы), дефицит витамина D и т.д.). Эти изменения имеют тенденции к омоложению и с учетом увеличения средней продолжительности жизни женщин на Земле будут сопровождать ее практически всю вторую половину ее жизни после наступления менопаузы, неуклонно при этом прогрессируя одновременно с ухудшением с возрастом анатомо-функционального состояния мочевого пузыря («старение мочевого пузыря», или «сенильный мочевой пузырь») [23, 24].
ЭНДОКРИННО-АУТОКРИННО-ПАРАКРИННАЯ МОДЕЛЬ РЕГУЛЯЦИИ МОЧЕВОГО ПУЗЫРЯ КАК ПАТОГЕНЕТИЧЕСКАЯ ОСНОВА УПРАВЛЕНИЯ ХРБЦ У ЖЕНЩИН
К настоящему времени накоплено огромное количество научных клинико-экспериментальных публикаций, позволяющих говорить о том, что мочевой пузырь является единой функциональной системой, все элементы которой (уротелиальные клетки, нервные окончания, сосуды, миоциты и миофибробласты) находятся в постоянном активном взаимодействии, направленном на поддержание физиологической комплаентности органа с целью обеспечения его максимально оптимальных функций в постоянно меняющихся условиях внешней и внутренней среды. Уротелиальные и другие клетки мочевого пузыря могут быть активированы или заблокированы различными механизмами – как системными (эндокринными), так и местными (аутокринными или паракринными) [20].
Эндокринная регуляция мочевого пузыря, как и всех других органов, осуществляется специализированными веществами различной природы – гормонами, синтезирующимися в специализированных эндокринных железах и попадающими в клетки органов и тканей, в которых имеется экспрессия соответствующих рецепторов, через системный кровоток (регуляция на расстоянии). В настоящее время доказана ключевая роль половых гормонов (эстрогенов, прогестерона, андрогенов), витамина D, инсулина в обеспечении метаболизма и энергетического обмена во всех клетках мочевого пузыря (установлена экспрессия в мочевом пузыре рецепторов к соответствующим гормонам), а также показана важная роль в этом процессе гормона сна (мелатонина), гормона роста (соматотропина), оказывающего свои физиологические эффекты через инсулиноподобный фактор роста-1 (ИФР-1), а также гормонов жировой ткани (лептина, адипонектина, адипсина, резистина, десмина и др.), которая сегодня рассматривается как один из активнейших эндокринных органов [25-33].
Эндокринная регуляция мочевого пузыря обеспечивает практически все его функции, создавая «гормональный» плацдарм для реализации свойственных клеткам механизмов аутокринной и паракринной регуляции, которые имеют место и в тканях мочевого пузыря. При аутокринной регуляции клетка способна к самостоятельному синтезу местного гормона (гормоноподобного вещества) и при этом имеет к нему же соответствующие рецепторы. Иными словами, клетка одновременно является и продуцентом гормона, и клеткой-мишенью. В качестве примера можно привести эндотелины, вырабатываемые клетками эндотелия, в том числе, в сосудах мочевого пузыря, которые воздействуют непосредственно на функцию этих же эндотелиальных клеток [34]. Паракринная регуляция заключается в том, что секретируемые клетками-продуцентами биологически активные вещества (местные гормоны) распространяются в ткани за счет диффузии и действуют на соседние клетки-мишени. Так действуют, например, многие митогенные стимуляторы (полипептидные ростовые факторы) – эпидермальный фактор роста (ЭФР), фактор роста тромбоцитов (ФРТ), интерлейкин-2 (фактор роста Т-клеток), фактор роста нервов (ФРН) и др. [34].
Известно, что стимуляция рецепторов и мембранных каналов на уротелиальных клетках может приводить к освобождению многих медиаторов, которые регулируют функции нервных окончаний и других типов клеток мочевого пузыря. С другой стороны, клетки уротелия сами могут быть мишенью для медиаторов, высвобождаемых клетками нейротелия, эндотелия или других типов клеток. Высвобождение местных медиаторов в тканях мочевого пузыря осуществляется благодаря адаптивному взаимодействию симпатического и парасимпатического отделов вегетативной нервной системы при участии системных и локальных гормональных механизмов (нейро-эндокринная регуляция), что позволяет мочевому пузырю, морфологически состоящему из различных типов клеток, работать как единый функциональный клеточный синцитий [20] (рис. 1).
В этой слаженной функциональной системе важная роль отводится эндокринному компоненту вегетативной регуляции функций мочевого пузыря, поскольку гормоны оказывают как прямое воздействие на анатомо-функциональное состояние всех структурных элементов мочевого пузыря, так и опосредованное – путем регуляции функциональной активности и экспрессии различных рецепторов в уротелии и нейро-мышечных элементах детрузора. Результаты проведенных исследований показывают, что половые гормоны способны модулировать функции местного нейрорецепторного аппарата мочевого пузыря как у мужчин, так и у женщин. Так, известно, что у женщин эффекты эстрогенов реализуются через модуляцию активности и экспрессии преимущественно α-адренорецепторов сосудов мочевого пузыря, а эффекты прогестерона – через β-адренорецепторы детрузора [35].
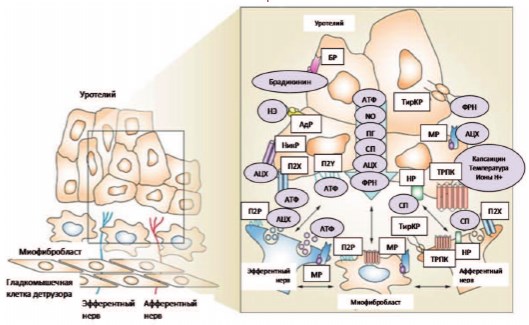
Рис. 1. Гипотетическая модель взаимодействий между уротелиальным клетками (уротелием), афферентными и эфферентными нервными окончаниями (нейротелием), сосудами (эндотелием), гладкомышечными клетками и миофибробластами мочевого пузыря [20].
Условные сокращения: АТФаденозинтрифосфат НРнейрокининовый рецептор ПГ – простагландины АЦХ – ацетилхолин НикРникотиновый рецептор CП – субстанция P АдР – адренергический рецептор NO – оксид азота ТирКРтирозинкиназный рецептор с БРбрадикининовый рецептор П2Р – пуринергический рецептор высокой аффинностью к ФРН МРмускариновый рецептор подтипа 2 ТРПК транзитный рецептор НЭнорэпинефрин П2X и П2Y – пуринергические потенциальных каналов ФРН – фактор роста нервов рецепторы Xи Y-подтипов
Таким образом, половые стероидные гормоны играют одну из самых критических ролей в метаболизме мочевого пузыря, регулируя практически все его функции, поэтому рассматривать различные клинические варианты заболеваний мочевого пузыря, в том числе, инфекционно-воспалительные, в отрыве от его гормональной регуляции представляется нелогичным и неверным.
Половые стероидные гормоны у женщин: синтез и особенности возрастной динамики. К настоящему времени в медицине сложилось неверное традиционное представление о половых гормонах, согласно которому якобы существуют только «мужские» (андрогены) или только «женские» (эстрогены, прогестерон) половые гормоны, применение которых нецелесообразно, недопустимо и даже опасно у представителей противоположного пола. Однако, с биохимической точки зрения это неверно, так как все половые гормоны являются представителями одного гормонального семейства – стероидных гормонов (к которому также относятся глюкокортикоиды, минералокортикоиды и витамин D) и имеют единого биохимического предшественника (7-дигидрохолестерол) [35,36] (рис. 2).
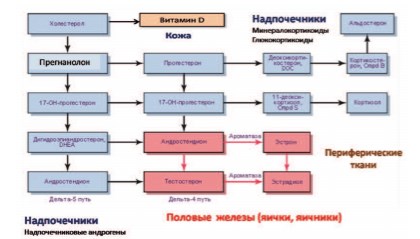
Рис. 2. Схема синтеза и биотрансформации половых стероидных гормонов у мужчин и женщин [35, 36]
В этой связи традиционное деление половых гормонов на «женские» и «мужские» нужно считать ошибочным и некорректным, так как для обеспечения всех физиологических процессов как мужчинам, так и женщинам необходимо присутствие в организме всех трех половых гормонов, а также витамина D в соответствующих физиологическим потребностям организма концентрациях [36,37].
Результаты современных исследований доказывают важную роль всех трех половых гормонов в регуляции различных физиологических процессов у женщин (транскрипция, связывание металлов и ДНК, внутриклеточная передача сигнала, активация генов синтеза белков, углеводного и жирового обменов, функционирование митохондрий клеток и т.д.). В этих процессах участвуют и эстрогены (активация эстрогеновых рецепторов приводит к модулированию экспрессии около 600 генов), и прогестерон (активация прогестероновых рецепторов вызывает модулирование около 1800 генов), и андрогены (активация андрогеновых рецепторов ведет к изменениям экспрессии около 250 генов) [37] (рис. 3).
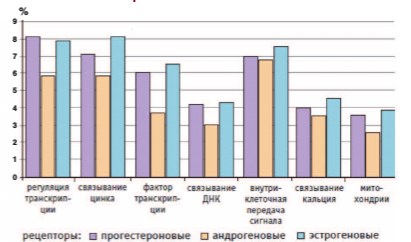
Рис. 3. Процент генов основных функциональных категорий при активации различных стероидных рецепторов у женщин [37]
Активация рецепторов витамина D приводит к модулированию экспрессии не менее 300 генов (по другим данным, до 2000 генов), что является отражением крайней физиологической важности постоянства витамин D-баланса в организме, поскольку этот витамин, являясь по сути активным стероидным гормоном, регулирует не менее 3% генома человека, в том числе, гены инсулинового рецептора, обмена глюкозы и стероидогенеза [38-40]. С возрастом уровень всех трех половых гормонов и витамина D у представителей обоих полов снижается, что совпадает с началом формирования и прогрессирования большинства возраст-ассоциированных заболеваний, в том числе, и урогенитального тракта [41]. Поэтому у ранее урологически здоровых женщин с возрастом могут манифестировать различные симптомы нарушений функции мочеполовой системы, которых не было в более молодом возрасте (стрессовое недержание мочи, гиперактивный мочевой пузырь, ноктурия, рецидивирующие воспалительные заболевания мочевого пузыря и т.д.) [42-44].
Ранее традиционно считалось, что различные урогенитальные нарушения у женщин связаны только с дефицитом эстрогенов, и в этой связи их относят к средне-временным проявлениям климактерического синдрома, которые развиваются вскоре после его ранних проявлений (приливов и вазомоторных расстройств) [45]. Однако в настоящее время эта точка зрения кардинально пересмотрена, и современная концепция эндокринологии у женщин состоит в том, что им (как и мужчинам) необходимы эффекты всех трех половых гормонов, уровни которых при старении постепенно снижаются [41]. При этом наиболее ранним гормональным дефицитом у женщин сегодня рассматривают дефицит прогестерона, который может наблюдаться уже в возрасте 35 лет, а далее у женщин начинает снижаться уровень андрогенов, что приводит практически к их двукратному снижению к 40 годам по сравнению с 20-летним возрастом [41,46]. Начиная с 40-45 лет, когда большинство женщин вступает в свой менопаузальный переход, и вплоть до менопаузы в среднем возрасте 51 года, у женщин начинается снижение синтеза эстрогенов, который манифестирует различными проявлениями эстрогеновой недостаточности (климактерический синдром) [47,48].
При этом в каждом временном промежутке по мере снижения синтеза и эффектов соответствующего полового гормона можно наблюдать различные клинические проявления со стороны нижних мочевых путей, анатомия которых у женщин отличается от мужской анатомии (короткая и широкая уретра, близость влагалища и уретры к потенциальному источнику инфицирования – анусу и т.д.), поэтому ключевыми факторами природной антибактериальной защиты у женщин выступают нормальный биоценоз влагалища (поддержание кислой бактерицидной рН вагинального секрета) и активный синтез слизистыми оболочками половых и нижних мочевых путей различных биологических секретов с местными защитными факторами (муцин, лизоцим, IgA, IgS, мукополисахариды, гликозаминогликаны и т.д.), которые общепринято рассматриваются как гормонозависимые процессы [49-51]. Данное положение подтверждается широко известным в классической урогинекологии фактом, согласно которому имеется достоверная связь между частотой и степенью выраженности нарушений гормоно-синтетической функции яичников, с одной стороны, и нарушениями функций мочевого пузыря у женщин, с другой стороны [52, 53].
ЗАКЛЮЧЕНИЕ
В современных условиях роста антибиотикорезистентности большинства уропатогенов, вызывающих хронические рецидивирующие инфекции нижних мочевыводящих путей у женщин, для эффективного решения проблемы ХРБЦ остается весьма ограниченное количество антимикробных химиопрепаратов. Однако клиническая практика показывает, что даже их рациональное использование по показаниям не позволяет у многих пациенток осуществлять эффективную санацию мочевого пузыря и успешно снижать частоту рецидивирования ХРБЦ. Роль микроорганизма в патогенезе любого инфекционно-воспалительного процесса несомненна, но сегодня следует больше внимания уделять и второй стороне взаимодействия в рамках хронического рецидивирующего инфекционного воспаления, а именно состоянию макроорганизма. Мочевой пузырь у женщин является гормонозависимым органом, и нормальный клеточный уровень гормонов представляется одним из ключевых условий, необходимых для обеспечения всех физиологических функций мочевого пузыря, включая его природную антибактериальную функцию. Современная эндокринно-аутокринно-паракринная теория регуляции функций мочевого пузыря позволяет рассматривать ХРБЦ как своеобразную инфекционно-бактериальную «вершину айсберга» гормонального нездоровья мочевого пузыря у женщин. Своевременное и эффективное управление эндокринологическими механизмами регуляции функций мочевого пузыря у женщин может стать одной из самых эффективных фармакотерапевтических опций в терапии и профилактике любых инфекций нижних мочевыводящих путей у женщин, включая ХРБЦ.
ЛИТЕРАТУРА
1. Naber KG, Cho YH, Matsumoto T, Schaefer AS. Immunoactive prophylaxis of recurrent urinary tract infections: A meta-analysis. Int J Antimicrob 2009;2:111-119.
2. Лоран О.Б., Зайцев A.B., Годунов Б.Н. Особенности диагностики и лечения хронического цистита у женщин. Акушерство и гинекология 2000;(3): 40-43.
3. Франк У. Антибактериальная терапия в амбулаторно-поликлинической практике. М.: ГЭОТАР-Медиа, 2010. 256 с.
4. Перепанова Т.С. Инфекции почек и мочевыводящих путей: современные подходы к терапии. Фарматека. 2004; 82(3-4):16-21.
5. Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Шевелев А.Н., Гринев А.В. и др. Исследовательская группа «ДАРМИС». Современное состояние антибиотикорезистентности возбудителей внебольничных инфекций мочевых путей в России: результаты исследования «ДАРМИС» (2010–2011). Клиническая Микробиология. антимикробная химиотерапия 2012;14(4): 280-302.
6. Minardi D, d’Anzeo G, Cantoro D. Urinary tract infections in women: etiology and treatment options. Intern J General Med 2011; 4:333–334.
7. Apisarnthanarak A, Buppunharun W, Tiengrim S, Sawanpanyalert P, Aswapokee N. An overview of antimicrobial susceptibility patterns for gram-negative bacteria from the National Antimicrobial Resistance Surveillance Thailand (NARST) program from 2000 to 2005. J Med Assoc Thai 2009;92(Suppl.4): 91-94.
8. Стрельцова О.С., Крупин В.Н. Хронический цистит: новое в диагностике и лечении. Лечащий врач 2008;(7): 18–24.
9. Сидоренко С.В., Тишков В.И. Молекулярные основы резистентности к антибиотикам. Успехи биологической химии 2004; 44(3): 263-306.
10. Gyssens IC. All EU hands to the EU pumps: the Science Academies of Europe (EASAC) recommend strong support of research to tackle antibacterial resistance. Clin Microbiol Infect 2008;14(10):889-891.
11. Allocati N, Masulli M, Alexeyev MF, Di Ilio C. Escherichia coli in Europe: an overview. Int J Environ Res Public Health 2013;10(12):6235-6254.
12. Andersson K-E, Arner A. Urinary Bladder Contraction and Relaxation: Physiology and Pathophysiology. Physiological Reviews 2004;84(3):935-986.
13. Robinson D, Toozs-Hobson P, Cardozo L. The effect of hormones on the lower urinary tract. Menopause Int 2013; 19(4):155-162.
14. Apodaka G. The uroepithelium: not just a passive barrier. Traffic 2004;5(3):117-128.
15. Cifuentes L. Epithelium of vaginal type in the female trigone; the clinical problem of trigonitis. J Urol 1947;57(6):1028-1037.
16. Parsons CL. The role of the urinary epithelium in the pathogenesis of interstitial cystitis/ prostatitis/ urethritis. Urol 2007; 69(Suppl. 4): 9 – 16.
17. Lilly JD, Parsons CL. Bladder surface glycosaminoglycans is a human epithelial permeability barrier. Surgery, Gynecology and Obstetrics 1990; 171(6): 2543-2551.
18. Graham E, Chai TC. Dysfunction of bladder urothelium and bladder urothelial cells in inrestitial cystitis. Curr urol rep 2006;7(6):440-446.
19. Sivick KE, Mobley HL. Waging war against uropathogenic Escherichia coli: winning back the urinary tract [minireview]. Infect Immun 2010;78(2)2:568-585.
20. Birder LA, de Groat WC. Mechanisms of disease: involvement of the urothelium in bladder dysfunction. Nat Clin Pract Urol 2007;4(1): 46–54.
21. Grover S., Srivastava A., Lee R, Tewari AK, Te AE. Role of inflammation in bladder function and interstitial cystitis. Ther Adv Urol 2011;3(1):19–33.
22. Hang L, Wullt B, Shen Z. Cytokine repertoire of epithelial cells lining the human urinary tract. J Urol 1998; 159(6):2185–2192.
23. Bunn F, Kirby M, Pinkney E, Cardozo L, Chapple C, Chester K, et al. Is there a link between overactive bladder and the metabolic syndrome in women? A systematic review of observational studies. Int J Clin Pract. 2015;69(2):199-217.
24. Singh S, van Herwijnen I, Phillips C. The management of lower urogenital changes in the menopause. Menopause Int 2013;19(2):77-81.
25. Тюзиков И.А., Калинченко С.Ю., Апетов С.С. Дефицит андрогенов у женщин в урогинекологической практике: патофизиологические механизмы, клинические «маски» и фармакотерапия трансдермальными формами тестостерона. Российский вестник акушера-гинеколога. 2014; (1): 33-43.
26. Hanna-Mitchell AT, Robinson D, Cardozo L, Everaert K, Petkov GV. Do we need to know more about the effects of hormones on lower urinary tract dysfunction? ICI-RS 2014. Neurourol Urodyn 2016; 35(2):299-303.
27. Chen J, Zhou YX, Yu YL, Shen ZJ. Effects of sex hormones on bladder function and structure: experiment with ovariectomized female rats. Zhonghua Yi Xue Za Zhi 2008;88(26):1851-1854.
28. Shapiro B, Redman TL, Zvara P. Effects of vitamin D analog on bladder function and sensory signaling in animal models of cystitis. Urol 2013; 81(2):466-470.
29. Fathollahi A, Daneshgari F, Hanna-Mitchell AT. Melatonin and its role in lower urinary tract function: an article review. Curr Urol 2015; 8(3):113-118.
30. Messing EM, Bubbers JE, Dekernion JB, Fahey JL. Growth stimulating activity produced by human bladder cancer cells. J Urol 1984;132(6):1230-1234.
31. Russo GI, Castelli T, Urzì D, Privitera S, La Vignera S, Condorelli RA, et al. Emerging links between non-neurogenic lower urinary tract symptoms secondary to benign prostatic obstruction, metabolic syndrome and its components: a systematic review. Int J Urol 2015;22(11):982-990.
32. Matthews CA. Risk factors for urinary, fecal, or double incontinence in women. Curr Opin Obstet Gynecol 2014; 26(5):393-397.
33. Greer WJ, Richter HE, Bartolucci AA, Burgio KL. Obesity and pelvic floor disorders: a systematic review. Obstet Gynecol 2008; 112(2, Pt 1):341-349.
34. Солодков А.С., Сологуб Е.Б. Физиология человека. 2-е изд., испр. и доп. М.: Олимпия Пресс, 2005. 528 с.
35. Hacker N, Moore JG, Gambone J. [Eds.]. Essentials of Obstetrics and Gynecology. Saunders, 2004. 544 p.
36. Ворслов Л.О., Тюзиков И.А., Тишова Ю.А., Калинченко С.Ю., Гусакова Д.А. Квартет здоровья – новая концепция современной профилактической и эстетической медицины: половые гормоны у женщин, возможности внутреннего и наружного применения. Косметика и медицина. 2016;(2): 26-34.
37. Торшин И. Ю., Громова О. А., Сухих Г. Т., Галицкая С. А., Юргеев И.С. Молекулярные механизмы дидрогестерона (Дюфастон®). Полногеномное исследование транскрипционных эффектов рецепторов прогестерона, андрогенов и эстрогенов. Consilium Medicum. Гинекология 2009;11(5): 9–16.
38. Castro LC. The vitamin D endocrine system. Arq Bras Endocrinol Metabol. 2011;55(8):566–575.
39. Шварц Г.Я. Витамин D и D-гормон. М.: Анахарсис, 2005. 152 с.
40. Holick MF, Binkley NC, Bischoff-Ferrari HA. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol. Metab 2011;96(7):1911–1930.
41. Baber RJ, Panay N, Fenton A. The Ims Writing Group. IMS Recommendations on women's midlife health and menopause hormone therapy. Climacteric 2016;19(2):109-150.
42. Тюзиков И.А., Греков Е.А. Апетов С.С. Ворслов Л.О. Калинченко С.Ю. Ноктурия: современные гендерные аспекты эпидемиологии, патогенеза и диагностики. Экспериментальная и клиническая урология. 2013;( 3):113-122.
43. Тюзиков И.А., Калинченко С.Ю., Тишова Ю.А., Ворслов Л.О., Греков Е.А. Ноктурия как актуальная междисциплинарная проблема интегративной медицины XXI века: эпидемиология и связь с возраст-ассоциированной коморбидностью. Клиническая нефрология. 2014;(5):48-55.
44. Тюзиков И.А. Эндокринологические аспекты патогенеза и фармакотерапии синдрома хронической урогенитальной неинфекционной боли у женщин. Эффективная фармакотерапия. Эндокринология. 2014;(9): 44-56.
45. Sturdee DW, Pines A, Archer DF, Baber RJ, Barlow D, Birkhäuser MH, et al. Updated IMS recommendations on postmenopausal hormone therapy and preventive strategies for midlife health. Climacteric 2011; 14(3):302–320.
46. Shifren JL, Hanfling S. Sexuality in Midlife and Beyond: Special Health Report. Harvard University: Harvard Health Publications, Boston, MA. 2010.
47. Liang CC, Lee TH, Chang SD. Effects of sex hormones on cell proliferation and apoptosis in the urinary bladder muscle of ovariectomized rat. Taiwan J Obstet Gynecol 2013;52(3):335-340.
48. Серов В.Н., Прилепская В.Н., Овсянникова Т.В. (Ред.). Гинекологическая эндокринология. М.: МЕДпресс-информ, 2015. 512 с.
49. Mirmonsef P, Hotton AL, Gilbert D, Gioia CJ, Maric D, Hope TJ, et al. Glycogen Levels in Undiluted Genital Fluid and Their Relationship to Vaginal pH, Estrogen, and Progesterone. PLoS One 2016;11(4):e0153553.
50. Mirmonsef P, Modur S, Burgad D, Gilbert D, Golub ET, French AL, et al. Exploratory comparison of vaginal glycogen and Lactobacillus levels in premenopausal and postmenopausal women. Menopause 2015;22(7):702-709.
51. Dennerstein GJ, Ellis DH. Oestrogen, glycogen and vaginal candidiasis. Aust N Z J Obstet Gynaecol 2001;41(3):326-328.
52. Montezuma T, Antônio FI, Rosa de Silva AC, Sá MF, Ferriani RA, Ferreira CH. Assessment of symptoms of urinary incontinence in women with polycystic ovary syndrome. Clinics (Sao Paulo) 2011;66(11):1911-1915.
53. Hvidman L, Foldspang A, Mommsen S, Bugge Nielsen J. Menstrual cycle, female hormone use and urinary incontinence in premenopausal women. Int Urogynecol J Pelvic Floor Dysfunct 2003; 14(1):56-61.











Комментарии