М.Ю. Просянников, Н.В. Анохин, С.А. Голованов, В.И. Кирпатовский, А.В. Сивков, О.В. Константинова, К.В. Иванов, О.И. Аполихин
НИИ урологии и интервенционной радиологии им. Н.А.Лопаткина - филиал ФГБУ «НМИЦ радиологии» Минздрава России
Отмечающаяся в последнее десятилетие во всем мире «цифровизация» здравоохранения в целом и медицинской науки в частности, послужила основой проведения многочисленных крупномасштабных исследований, базирующихся на статистических данных. Так, было показано взаимное потенцирование рисков различных заболеваний. При мочекаменной болезни (МКБ) отмечено потенцирование рисков гиперинсулинемии, сахарного диабета второго типа, эректильной дисфункции, ожирения, метаболического синдрома, гипертонической болезни и других заболеваний (рис. 1) [1-6]. Также на основе статистических методов было продемонстрировано увеличение вероятности развития инсультов и инфарктов у пациентов, в анамнезе которых зафиксирован эпизод камнеобразования [7-10].
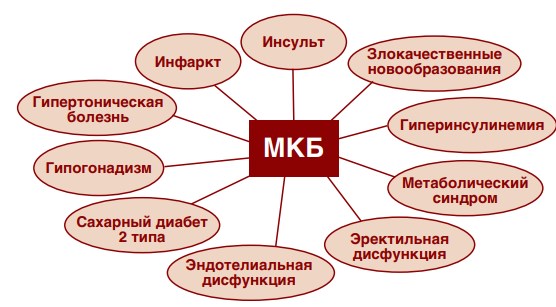
Рис. 1. Коморбидные МКБ заболевания и состояния
Изучение статистической взаимосвязи различных заболеваний с использованием широких популяционных данных сегодня весьма распространено и применяется не только при МКБ. Так, например, было показано, что развитие эректильной дисфункции опережает проявления инфаркта и инсульта примерно на 5-7 лет [11]. Подобные работы требуют дополнительного осмысления не только статистических данных, но и патогенетических механизмов подобных связей.
Цель данной статьи – сбор и систематизация информации о возможных патогенетических механизмах выявленной статистической взаимосвязи МКБ и сердечно-сосудистых заболеваний.
Учитывая общепринятый факт, что атеросклероз лежит в основе большинства сердечно-сосудистых заболеваний, в настоящем обзоре мы сосредоточились на описании возможных патогенетических взаимосвязей МКБ именно с атеросклерозом (АС) [12].
ВЗАИМОСВЯЗЬ АС И МКБ
В настоящее время накоплена информация, подтверждающая коморбидность МКБ и АС. Исследование, проведенное S. Akoudad и соавт. показало, что у пациентов, страдающих МКБ, уровень триглицеридов крови значительно выше, чем у здоровых лиц [13]. Как известно, высокий уровень триглицеридов увеличивает риск развития АС [14].
A. Fabris и соавт. доказали, что в зависимости от возраста и пола у пациентов с идиопатическим кальциевым уролитиазом плотность сосудистой стенки значительно выше, чем у лиц контрольной группы, не страдающих МКБ [15]. В свою очередь, учеными из Японии доказана связь плотности сосудистой стенки с риском развития раннего АС [16].
L. Shavit и соавт. в 2014 г. после исследования 111 больных установили, что у пациентов с кальций-оксалатной формой уролитиаза значительно выше степень кальцификации аорты, чем у пациентов контрольной группы [17].
Результаты исследования R.S. Hsi и соавт, показали наличие связи между количеством кальциевых бляшек на стенках коронарных сосудов (индекс Агатстона) и рецидивным уролитиазом. Было продемонстрировано, что у пациентов с рецидивирующим течением МКБ количество кальциевых бляшек на стенках коронарных сосудов выше, чем у лиц с безрецидивной формой уролитиаза. Проведенное исследование в очередной раз показало наличие общих патогенетических процессов, протекающих как при МКБ, так и при АС [18].
Ученые из Турции изучили активность фермента параоксоназы 1 при наличии полиморфизмов 55, 192 гена PON1 и МКБ. Параоксоназа 1 – один из основных ферментов крови, который обладает антиоксидантными и антиатерогенными свойствами, стимулирует дифференцировку моноцитов в макрофаги, захват макрофагами окисленных липопротеидов низкой плотности (ЛПНП) и превращение макрофагов в пенистые клетки [19]. Некоторые авторы считают, что антиатерогенные свойства липопротеидов высокой плотности (ЛПВП) зависят частично от антиоксидантной активности параоксоназы 1, ассоциированной с апобелками ЛПВП [20].
Результаты исследования A.Atar и соав. показали, что у лиц с аллелем M полиморфизмом 55 гена PON1 заболеваемость МКБ гораздо выше, чем в контрольной группе. При этом уровень параоксоназы 1 у лиц, страдающих уролитиазом, с выявленным аллелем M полиморфизмом 55 гена PON1 был ниже, чем у контрольной группы. Результаты исследования позволили в очередной раз предположить наличие общих патогенетических механизмов развития МКБ и АС [21].
Таким образом, коморбидность уролитиаза и АС для многих исследователей кажется доказанной и вполне понятной. Более того, некоторые авторы относят МКБ к группе системных заболеваний [22-26]. Прослеживается патогенетическая связь уролитиаза не только с АС, но и с сахарным диабетом, гипертонической болезнью, ожирением, метаболическим синдромом, инфарктом миокарда, инсультом. И эта связь вполне объяснима: необходимо обратить внимание на тот факт, что основой практически всех поражений сердечно сосудистой системы является АС [27]. АС приводит к стенокардии, ишемической болезни сердца, инфаркту миокарда, инсульту. По всей видимости, существует единый патогенетический механизм, общий как для АС, сердечно-сосудистых заболеваний, так и для МКБ.
Стоит подчеркнуть, что к данному выводу пришли в результате проведения серьезных популяционных исследований. Так, например, в Канаде было проведено когортное исследование 3195452 человек в возрасте старше 18 лет [7]. Авторы установили, что у пациентов с МКБ риск развития острого инфаркта миокарда и инсульта выше, чем у пациентов, не страдающих уролитиазом.
К похожим выводам пришли исследователи из Франции, указав, что МКБ является ранним маркером развития сердечно-сосудистых заболеваний. Исследователи утверждают, что метафилактика уролитиаза способна не только снизить число рецидивов камнеобразования, но и является профилактикой развития сердечно-сосудистых заболеваний [8].
Более того, китайские ученые доказали, что противорецидивное лечение МКБ, рекомендованное Европейской ассоциацией урологов, снижает риск развития сердечно-сосудистых катастроф (инфаркта миокарда и инсульта) у пациентов, страдающих уролитиазом [9,10]. Так оказалось, что назначение аллопуринола, тиазидных диуретиков, калий сберегающих диуретиков и альфа-адреноблокаторов снижает вероятность возникновения инфаркта миокарда и его осложнений.
Анализируя причины возникновения МКБ и коморбидных уролитиазу заболеваний, необходимо остановиться на общепризнанных Всемирной организацией здравоохранения фактах, а именно на том, что риск развития неинфекционных системных заболеваний зависит от генетики и наследственности на 20%, от условий внешней среды– на 20%, от уровня здравоохранения в регионе – на 10% и от условий и образа жизни человека – на 50% [28]. В рамках образа жизни ключевыми факторами риска развития МКБ и других коморбидных заболеваний являются избыточное потребление соли, животного белка, гипогидратация, курение, наличие избыточного веса [29-32].
При этом необходимо подчеркнуть, что возраст манифестации МКБ и АС различен. Как правило, МКБ проявляется в возрасте 20-45 лет в виде почечной колики или выявляется при плановом УЗИ [29]. АС, в свою очередь, начинается в возрасте 45-70 лет и диагностируется при плановом обследовании или при возникновении сердечно-сосудистых катастроф [32]. Подобное различие сроков манифестации МКБ и АС имеет связь с известной теорией Гиппократа о декадах жизни, основная идея которого заключается в том, что для каждого возраста характерно развитие «своих» специфических заболеваний: в возрасте от 0 до 17 превалируют наследственные заболевания, в возрасте 17-45 лет – болезни обмена веществ (МКБ, подагра, метаболический синдром и т.д.); для возраста 45-70 лет характерны сосудистые заболевания (эректильная дисфункция, ИБС); в возрасте 70 лет и старше достаточно часто наблюдают сердечно-сосудистые катастрофы (инфаркт, инсульт).
ВОЗМОЖНЫЕ ПРИЧИНЫ ЛИТОГЕНЕЗА И АТЕРОГЕНЕЗА
Выявленную тенденцию связи уролитиаза и коморбидных ему состояний можно объяснить наличием общих звеньев патогенеза МКБ и АС, гипертонической болезни, сахарного диабета, инфаркта миокарда и других неинфекционных заболеваний.
Для понимания этой связи необходимо описать современные представления о камнеобразовании, а также попытаться объяснить общность патогенетических механизмов, протекающих при МКБ и АС.
По одной из самых распространенных теорий патогенеза МКБ считают, что в основе процессов камнеобразования лежит повреждение почечных канальцев или собирательных трубочек (протоков Беллини), что приводит к образованию бляшек Рэндалла [33].
Бляшка Рэндалла состоит из солей кальция фосфата, их дальнейший рост происходит за счет отложения солей кальция оксалата на уже имеющуюся бляшку. При этом важным условием является перенасыщенность мочи камнеобразующими веществами, к которым относят кальций, оксалаты, мочевую кислоту (рис. 2) [34,35]. Также процесс камнеобразования ускоряется при низкой концентрации ингибиторов камнеобразования [36].
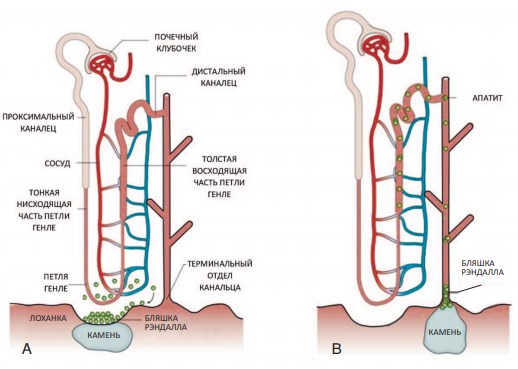
Рис. 2. Современные представления о патогенезе камнеобразования при МКБ, образование бляшки (А) и пробки (В) Рэндалла [38].
Что влияет на уротелий почечных канальцев и запускает процессы образования мочевых камней? По мнению многих авторов в основе повреждения уротелия лежит свободно-радикальное окисление [37-39].
В основе ведущих метаболических процессов человека лежат окислительно-восстановительные реакции. Среди них большое значение имеет свободнорадикальное окисление, при котором образуются перекисные соединения. Триггером образования этих соединений, как правило, являются свободные радикалы. К свободным радикалам относят молекулы или фрагменты молекул, имеющие в одном из атомов кислорода неспаренный электрон (активные формы кислорода). Радикалы вступают во взаимодействие между собой и могут непосредственно окислять органические молекулы (жирные кислоты, участки белковых комплексов) с образованием свободно-радикальных фрагментов, которые в свою очередь тоже включаются в процесс свободнорадикального повреждения биомолекул и клеточных структур.
При отсутствии реакции обрывания цепи процессы свободнорадикального окисления могут приобрести лавинообразный, неконтролируемый характер. Одним из основных субстратов для свободнорадикальных реакций служат липиды, а процесс окисления липидов в результате этих реакций называется перекисным окислением липидов (ПОЛ).
Большая часть свободных радикалов выполняют защитную функцию. При этом свободные радикалы крайне токсичны. Они окисляют фосфолипиды и белки клеточных мембран, нарушая их целостность, инактивируют клеточные и мембранные ферменты. Необходимо подчеркнуть, что в противовес свободнорадикальным процессам в организме существует антиоксидантая система. В нее входят антиоксидантные ферменты (супероксиддимутаза, каталаза, глютатионпероксидаза, α-токоферол, аскорбиновая кислота, флавоноиды и др.). Таким образом, про- и антиоксидантная системы находятcя в состоянии динамического равновесия [40].
ПОЛ – это окислительная деградация липидов, происходящая, в основном, под действием активных форм кислорода. Вероятно, повышенная продукция активных форм кислорода приводит к дедифференцировке эпителиальных (эндотелиальных) клеток. В результате свободнорадикального окисления запускаются процессы повреждения клеток. Под действием активных форм кислорода происходит повреждение липидного бислоя, резко меняются свойства фосфолипидов мембран, из которых состоит клеточная оболочка, нарушается мембранный транспорт, что приводит в конечном счете к гибели клетки (рис. 3).
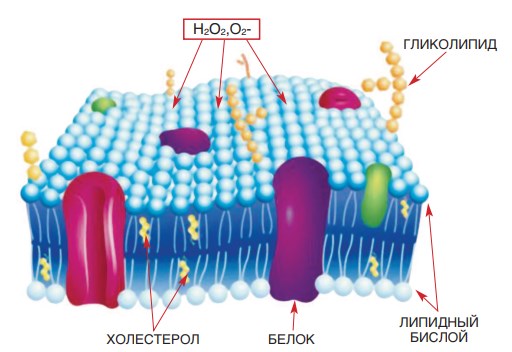
Рис. 3. Разрушение липидного бислоя мембраны эндотелиальной клетки под воздействием активных форм кислорода (перекись кислорода, супероксидный анион-радикал) – перекисное окисление липидов [62]
Активация ПОЛ инициирует повреждение клеток почечного эпителия, приводя, тем самым, к задержке кристаллов кальция фосфата на клеточной поверхности, формированию бляшек Рэндалла и дальнейшему камнеобразованию [41,42].
Так, российские исследователи под руководством Я.Ф. Зверева в условиях экспериментального оксалатного нефролитиаза у крыс выявили прямую связь между развитием оксалатного нефролитиаза и активацией свободно-радикального окисления [43]. C.R. Tracy и соавт. изучили роль оксидативного стресса в патогенезе МКБ [44]. Оказалось, что у пациентов, страдающих рецидивным уролитиазом, уровень молекул-маркеров оксидативного стресса был заметно выше, чем в контрольной группе (пациенты с нерецидивной формой МКБ). Авторы подчеркнули, что уровень 8- гидрокси-дезоксигуанозина в моче, 2-азобис (2-амидинопропан) дигидрохлорида в сыворотке крови, тиобарбитуровой кислоты заметно выше у пациентов, страдающих рецидивным кальций-оксалатным уролитиазом. При этом авторы отметили, что уровень антиоксидантного фермента параоксоназы 1 оставался одинаковым как у пациентов с рецидивным, так и нерецидивным уролитиазом.
Нарушения структурных свойств клеточных мембран наблюдают не только при МКБ, но и при АС и при других заболеваниях и патологических состояниях [45].
Атерогенез является очень сложным процессом и включает целый ряд событий, в том числе повреждение эндотелия, отложение липопротеидов в интиме артерий, активацию и пролиферацию клеток эндотелия и гладких мышц, активацию макрофагов интимы артерий, образование пенистых клеток, перенасыщенных холестерином, и соединительно-тканной капсулы. Все эти процессы завершаются образованием фиброзной атеросклеротической бляшки [46].
Общепризнано, что основным фактором повреждения эндотелия сосуда является активизация процесса воспаления в интиме сосудов. Этот процесс сопровождается образованием свободных радикалов [47,48]. В последнее время, говоря о механизмах атерогенеза, многие авторы придают большое значение перекисной модификации липопротеидов низкой плотности.
Согласно оксидативной теории, АС не связан с дислипидемией. ПОЛ окисляет ЛПНП до измененных ЛПНП. Подобные измененные ЛПНП индуцируют синтез цитокинов, в том числе моноцитарного хемотаксического белка 1 (МХБ1) в клетках сосудов. МХБ 1 стимулирует переход моноцитов в подэндотелиальный слой, где моноциты превращаются в макрофаги. Макрофаг поглощает окисленные ЛПНП до образования пенной клетки, что является первичным звеном атерогенеза. Кроме того, оксидативный стресс увеличивает проницаемость эндотелия, что приводит к увеличению накопления ЛПНП в подэндотелиальном слое. Окисленная форма аполипопротеина В-100 в подэндотелиальном слое взаимодействует с матричными молекулами в частности, протеогликаном.
Удержание липопротеина в стенке сосуда является обязательным фактором атерогенеза. Доказательством главенствующей роли перекисно-модифицированных липопротеидов низкой плотности в развитии АС служит тот факт, что в экспериментальных работах инактивация их окисления с помощью антиоксидантов задерживала формирование атеросклеротической бляшки [40].
При повреждении эндотелия сосуда и дальнейшей гибели клеток происходит отложение липопротеидов в интиме артерий и формирование атеросклеротической бляшки. Также есть мнение, что под влиянием различных метаболитов, образующихся в процессе жизнедеятельности органов и тканей может увеличиваться концентрация свободных радикалов, которые, в свою очередь, вступая с липопротеидами в реакцию, патогенно изменяют их [39].
Таким образом, современные теории литогенеза и атерогенеза во многом похожи и что более важно, одним из значимых звеньев патогенеза как камнеобразования, так и АС, является свободно-радикальное окисление активными формами кислорода. МКБ и АС можно рассматривать в качестве коморбидных состояний – состояний с общими звеньями патогенеза. Не исключено, что свободно-радикальное окисление является вторичным звеном развития патологического процесса, существуют первичные механизмы, инициирующие свободно-радикальное окисление.
Стоит обратить внимание на работы показывающие, что оксалаты способны инициировать ПОЛ, выработку провоспалительных цитокинов, что приводит к повреждению эндотелия сосуда [49-50]. Более того, недавние исследования показали, что мочевая кислота стимулирует образование циклооксигеназы 2, таким образом мочевая кислота, как и оксалаты, способна запускать воспалительные реакции. [51]. Также известно, что мочевая кислота нарушает синтез оксида азота – основного эндотелиального сосудорасширяющего фактора, обеспечивающего защиту миокарда от ишемии и снижающего артериальное давление [52].
При этом доказано, что высокий уровень кальция в крови перестраивает гладкомышечные клетки в остеобласт-подобные клетки при помощи активации факторов транскрипции, что индуцирует выработку костного белка и остеопонтина и приводит к кальцификации сосуда [53].
При уролитиазе свободно-радикальное окисление и ПОЛ, в частности, проявляются как на клеточном (мембранном), тканевом, так и на системном уровнях [54]. Для АС характерны те же уровни поражения ПОЛ [55]. При исследовании пациентов, страдающих АС, в ряде клеток и тканей обнаружены специализированные ферменты — циклооксигеназы и липоксигеназы, отвечающие за синтез простагландинов, участвующих в воспалительном процессе, который сопровождается активацией свободнорадикальных окислительных процессов.
В клинической практике подобные заключения крайне важны и позволяют, в первую очередь, формировать группы риска возникновения МКБ и АС. Всем пациентам с МКБ, особенно с рецидивной формой уролитиаза, показано выполнение биохимического анализа крови с определением липидного профиля [56]. Аналогично, всем пациентам с АС рекомендовано выполнение биохимического анализа суточной мочи для определения концентрации основных камнеобразующих веществ (кальций, фосфор, оксалаты, мочевая кислота).
Более того, мы уже упоминали, что в организме существует естественная защита от ПОЛ – мощная антиоксидантная система. Ее ферментное звено представлено супероксиддисмутазой, элиминирующей О2- из клеток путем реакции дисмутации, а также каталазой и пероксидазой, безрадикальным путем восстанавливающих перекись водорода с образованием воды. Неферментное звено представлено различными веществами-антиоксидантами, среди которых ведущее место занимает естественный мембранный антиоксидант: альфа-токоферол (витамин Е). Он является жирорастворимым и локализуется в гидрофобном липидном слое мембран, непосредственно защищая эти структуры клетки от действия активных радикалов. Показано, что назначение витамина E предотвращает ПОЛ и снижает риск камнеобразования [57].
Среди водорастворимых антиоксидантов наибольшее значение имеет аскорбат и глутатион, которые содержатся в цитозоле, митохондриях и ядре, нейтрализуют широкий спектр свободных радикалов и обеспечивают регенерацию токоферолов в клетке [58]. Известна большая группа соединений, выполняющих роль «ловушек» свободных радикалов: синглетного кислорода (гистидин, каротиноиды, коэнзим Q10 и др.) и гидроксильных радикалов (маннит, бензоат, фенолы и др.) [59,60]. Таким образом, назначение антиоксидантов, в частности витамина Е, патогенетически обосновано и оправдано при метафилактике МКБ и при профилактике АС.
Наряду с антиоксидантами, обосновано и назначение аллопуринола, который ингибирует образование пенных клеток и снижает выработку провоспалительных цитокинов. В эксперименте на мышах аллопуринол и фебуксостат препятствовали образованию пенных клеток, кальцификации сосудов и отложению липидов в стенке аорты. Необходимо подчеркнуть, что данные препараты не только снижают уровень мочевой кислоты крови, но и ингибируют выработку свободных радикалов [61].
ЗАКЛЮЧЕНИЕ
Таким образом, согласно современным представлениям о патогенезе МКБ, уролитиаз – это системное неинфекционное заболевание. Многочисленные популяционные рандомизированные исследования доказывают, что МКБ, АС и другие сердечно-сосудистые заболевания в своей основе имеют общие звенья патогенеза. Тем не менее, подробного и четкого представления о звеньях единого патогенеза в настоящий момент нет. Необходимы дальнейшие исследования для выявления патогенетических взаимосвязей указанных процессов.
Для практикующих врачей необходимо обратить внимание на тот факт, что АС является фактором риска развития МКБ, как и то, что у пациентов с уролитиазом увеличивается риск развития АС и других сердечно-сосудистых заболеваний.
ЛИТЕРАТУРА
- Rule AD, Roger VL, Melton LJ 3rd, Bergstralh EJ, Li X, Peyser PA, Krambeck AE et al. Kidney stones associate with increased risk for myocardial infarction. J Am Soc Nephrol 2010;21(10):1641-4. doi: 10.1681/ASN.2010030253
- Chung SD, Keller JJ, Lin HC. Association between urinary calculi and erectile dysfunction: a case-control study. J Sex Med 2011;8(10):2876-82. doi: 10.1111/j.1743-6109.2011.02407.x
- Seitz C, Fajkovic H. Epidemiological gender-specific aspects in urolithiasis. World J Urol 2013;31(5):1087-92. doi: 10.1007/s00345-013-1140-1
- Shih CJ, Chen YT, Ou SM, Yang WC, Chen TJ, Tarng DC. Urinary calculi and risk of cancer: a nationwide population-based study. Medicine (Baltimore) 2014;93(29):342. doi: 10.1097/MD.0000000000000342
- Weinberg AE, Patel CJ, Chertow GM, Leppert JT. Diabetic severity and risk of kidney stone disease. Eur Urol 2014;65(1):242-7. doi: 10.1016/j.eururo.2013.03.026
- Голованов С.А., Сивков А.В., Анохин Н.В., Дрожжева В.В. Индекс массы тела и химический состав камней. Экспериментальная и клиническая урология 2015:4;94-99.
- Alexander RT, Hemmelgarn BR, Wiebe N, Bello A, Samuel S, Klarenbach SW. Kidney Stones and Cardiovascular Events: A Cohort Study. Clin J Am SocNephrol. 2014;9:506–512. doi: 10.2215/CJN.04960513
- Ernandez T, Bonny O. Kidney stone as a cardiovascular risk marker. Rev Med Suisse 2014;10(441):1656-60.
- Skolarikos A, Straub M, Knoll T, Sarica K, Seitz C, Petřík A. Metabolic evaluation and recurrence prevention for urinary stone patients: EAU guidelines. Eur Urol 2015 Apr;67(4):750-63. doi: 10.1016/j.eururo.2014.10.029
- Lin SK, Liu JM, Chang YH, Ting YT, Pang ST, Hsu RJ, Lin PH. Increased risk of endotracheal intubation and heart failure following acute myocardial infarction in patients with urolithiasis: a nationwide population-based study TherClin Risk Manag 2017;13:245-253. doi: 10.2147/TCRM.S123702.
- Аполихин О.И., Красняк С.С. Современный взгляд на связь эректильной дисфункции и сердечно-сосудистых заболеваний. Экспериментальная и клиническая урология 2013;4:54-57.
- Марцевич С.Ю. Атеросклероз. Лечащий врач 2004;2:4.
- Akoudad S, Szklo M, McAdams MA, Fulop T, Anderson CA, Coresh J et al. Correlates of kidney stone disease differ by race in a multi-ethnic middle aged population: The ARIC Study. Prev Med. 2010;51(5):416–420. doi:10.1016/j.ypmed.2010.08.011
- Аронов Д.М., Арабидзе Г.Г., Ахмеджанов Н.М., Балахонова Т.В., Бойцов С.А., Бубнова М.Г. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. российские рекомендации (v пересмотр). Российский кардиологический журнал 2012;4(96):0-32.
- Fabris A, Ferraro PM, Comellato G, Caletti C, Fantin F, Zaza G, et al. The relationship between calcium kidney stones, arterial stiffness and bone density: unraveling the stone-bone-vessel liaison. J Nephrol 2015;28:549. doi: 10.1007/s40620-014-0146-0
- Nakashima Y, Wight TN, Sueishi K. Early atherosclerosis in humans: role of diffuse intimal thickening and extracellular matrix proteoglycans. Cardiovasc Res 2008;79:14. doi: 10.1093/cvr/cvn099
- Shavit L, Girfoglio D, Vijay V, Goldsmith D, Ferraro PM, et al. Vascular Calcification and Bone Mineral Density in Recurrent Kidney Stone Formers. Clin J Am Soc Nephrol 2015;10(2):278–285. doi: 10.2215/CJN.06030614
- Hsi RS, Spieker AJ, Stoller ML, Jacobs DR Jr, Reiner AP, McClelland RL. Coronary Artery Calcium Score and Association with Recurrent Nephrolithiasis: The Multi-Ethnic Study of Atherosclerosis. J Urol 2016;195(4Pt1):971– 976. doi: 10.1016/j.juro.2015.10.001
- Mackness MI, Durrington PN, Ayub A, Mackness B. Low serum paraoxonase: a risk factor for atherosclerotic disease? Chem Biol Interact 1999;119- 120:389-97. PMID:10421475
- Aviram M. Atherosclerosis: cell biology and lipoproteins - paraoxonases protect against atherosclerosis and diabetes development. Curr Opin Lipidol 2012;23(2):169-7. doi: 10.1097/MOL.0b013e3283513594
- Atar A, Gedikbasi A, Sonmezay E, Kiraz ZK, Abbasoglu S, Tasci AI, et al. Serum paraoxonase-1 gene polymorphism and enzyme activity in patients with urolithiasis. Renal Failure 2016;38(3):378-82. doi: 10.3109/0886022X.2015.1136872
- Madore F, Stampfer MJ, Rimm EB, Curhan GC. Nephrolithiasis and risk of hypertension. Am J Hypertens 1998;11:46.
- Taylor EN, Stampfer MJ, Curhan GC. Obesity, weight gain, and the risk of kidney stones. JAMA 2005;293:455. DOI:10.1001/jama.293.4.455
- Taylor EN, Stampfer MJ, Curhan GC. Diabetes mellitus and the risk of nephrolithiasis. Kidney Int 2005;68:1230. DOI:10.1111/j.1523-1755.2005.00516.x
- Rule AD, Roger VL, Melton LJ. 3rd, et al. Kidney stones associate with increased risk for myocardial infarction. J Am SocNephrol 2010;21:1641. doi: 10.1681/ASN.2010030253
- Ferraro P.M., Taylor E.N., Eisner B.H., Gambaro G, Rimm EB, Mukamal KJ, et al. History of kidney stones and the risk of coronary heart disease. JAMA 2013;310:408. doi: 10.1001/jama.2013.8780.
- Мантров Д.А. Атеросклероз. ЛитРес.:; 2009. 250 С.
- Шестьдесят первая ежегодная сессия ВОЗ. Баку, Азербайджан, 12–15 сентября 2011 г. Режим доступа: http://www.euro.who.int/ru/about-us/governance/regional-committee-for-europe/past-sessions/sixty-first-session
- Menon M, . Resnick M.I. Urinary lithiasis: etiology, diagnosis, and medical management In: Campbell’s Urology, 8th Ed. – WB Saunders Company: Philadelphia, PA, 2002. – С.3242–3305
- Coe FL, Evan A, Worcester E. Kidney stone disease. J Clin Invest. 2000
- Tamadon MR, Nassaji M, Ghorbani R. Cigarette smoking and nephrolitiasis in adult individuals. Nephrourol Mon 2013;5(1):702-5. doi: 10.5812/numonthly.5251.
- А. Луковкина. Атеросклероз. М.: «Научная книга», 2013 г. URL: https://mybook.ru/author/aurika-lukovkina/ateroskleroz/
- Taylor ER, Stoller ML. Vascular theory of the formation of Randall plaques. Urolithiasis 2015;43:41–45. doi: 10.1007/s00240-014-0718-4.
- Pak CY, Sakhaee K, Moe OW, Poindexter J, Adams-Huet B. Defining hypercalciuria in nephrolithiasis. Kidney International 2011;1:777-782. doi: 10.1038/ki.2011.227
- Pearle MS, Lotan Y. Urinary lithiasis: etiology, epidemiology and pathogenesis. In Campbell-Walsh Urology, 9-th edition. [Ed. Alan J. Wein]. Philadelphia, PA, 2007;2:1363-1392.
- Phillips R, Hanchanale VS, Myatt A, Somani B, Nabi G, Biyani CS. Citrate salts for preventing and treating calcium containing kidney stonesin adults. Cochrane Database Syst Rev 2015;10:CD010057. doi: 10.1002/14651858.CD010057
- Hsi RS, Spieker AJ, Stoller ML, Jacobs DR Jr, Reiner AP, McClelland RL et al. Coronary Artery Calcium Score and Association with Recurrent Nephrolithiasis: The Multi-Ethnic Study of Atherosclerosis. J Urol 195:4;1:971–976. doi: 10.1016/j.juro.2015.10.001.
- Bird VY, Khan SR. How do stones form? Is unification of theories on stone formation possible? Arch Esp Urol 2017;70(1):12–27.
- Gustafsson D, Unwin R. The pathophysiology of hyperuricaemia and its possible relationship to cardiovascular disease, morbidity and mortality. BMC Nephrology 2013;14:164. doi: 10.1186/1471-2369-14-164.
- Голиков А.П., Бойцов С.А., Михин В.П., Полумисков В.Ю. Cвободнорадикальное окисление и сердечно-сосудистая патология: коррекция антиоксидантами. Лечащий врач 2003;4:70-74.
- Thamilselvan S, Hackett RL, Khan SR. Lipid peroxidation in ethylene glycol induced hyperoxaluria and calcium oxalate nephrolithiasis. J Urol 1997;157(3):1059-1063.
- Grases F, Garcia Ferragut L , Costa Bausa A. Development of calcium oxalate crystals on urothelium: effects of free radicals. Nephron 1998;78(3):296-301. doi: 10.1159/000044939
- Зверев Я.Ф., Брюханов В.М., Талалаева О.С., Лампатов В.В., Жариков А.Ю., Талалаев С.В. О роли процессов свободно-радикального окисления в развитии экспериментального нефролитиаза. Нефрология 2008;12(1):58-63.
- Tracy CR, Henning JR, Newton MR, Aviram M, Bridget Zimmerman M. Oxidative stress and nephrolithiasis: A comparative pilot study evaluating the effect of pomegranate extract on stone risk factors and elevated oxidative stress levels of recurrent stone formers and controls Urolithiasis 2014;42:401–408. doi: 10.1007/s00240-014-0686-8.
- Добрецов Г.Е. Флуоресцентные зонды в исследовании клеток, мембран и липопротеинов. М.: Наука;1989. 277 c.
- Лиходед В.Г., Бондаренко В.М., Гинцбург А.Л. Экзогенные и эндогенные факторы в патогенезе атеросклероза. рецепторная теория атерогенеза Российский кардиологический журнал 2010;2(82).
- Воробьева Е.Н., Симонова Г.И., Воробьев Р.И., Лещенко И.Ж. Свободно-радикальное окисление и атеросклероз. Атеросклероз 2010:6(2).
- Ахминеева, А.Х. Эндотелиальная дисфункция и оксидативный стресс в развитии респираторно- кардиальной коморбидности: Автореф. дисс. докт. мед. наук Астрахань; 2015, 48 с.
- Selvam, R. Calcium oxalate stone disease: role of lipid peroxidation and antioxidants. Urol Res 2002;30:35–47, https://doi.org/10.1007/s00240-001-0228-z
- Asokan, D., Kalaiselvi, P. and Varalakshmi, P. Modulatory effect of the 23- kD calcium oxalate monohydrate binding protein on calcium oxalate stone formation during oxalate stress. Nephron Physiol. 2004;97:23–30, https://doi.org/10.1159/000077599
- KanellisJ, Watanabe S, Li JH, Kang DH, Li P, Nakagawa T. et al. Uric acid stimulates monocyte chemoattractant protein-1 production in vascularsmooth muscle cells via mitogen-activated protein kinase and cyclooxygenase-2. Hypertension 2003;41:1287–1293, https://doi.org/10.1161/01.HYP.0000072820.07472.3B
- Choi YJ, Yoon Y, Lee KY, Hien TT, Kang KW, Kim K.C. et al. Uric acid induces endothelial dysfunction by vascular insulin resistance associated with the impairment of nitric oxide synthesis. FASEB J 2014;28:3197–3204, https://doi.org/10.1096/fj.13-247148
- Lu KC, Wu CC, Yen JF, Liu WC. Vascular calcification and renal bone disorders. Scientific World Jl 2014;637065, https://doi.org/10.1155/2014/637065
- Голованов, С.А. Клинико-биохимические и физико-химические критерии течения и прогноза мочекаменной болезни: дис. … д-ра мед. наук. М.; 2002, 270 с.
- Ланкин В.3., Вихерт А.М., Тихазе А.К., Согоян С.М., Бондарь Т.И. Роль перекисного окисления липидов в этиологии и патогенезе атеросклероза (обзор). Вопросы медицинской химии. 2010;35(3):18-24.
- Константинова О.В., Дзеранов Н.К. Сопутствующие заболевания у пациентов с мочекаменной болезнью. Тезисы докл. II урологической конференции «Актуальные вопросы урологии» М.; 2010, 94 с.
- Selvam R. Calcium oxalate stone disease: role of lipid peroxidation and antioxidants. Urol. Res. 2002;30:35–47, https://doi.org/10.1007/s00240-001-0228-z
- Gassen M., Youdim M.B. Free radical scavengers: chemical concepts and clinical relevance. J. Neural Transm Suppl 1999;56:193-210.
- Nomura J, Busso N, Ives A, Matsui C, Tsujimoto S, Shirakura T, et al. Xanthine oxidase inhibition by febuxostat attenuates experimental atherosclerosis in mice. Sci Rep 2014;4:4554, https://doi.org/10.1038/srep04554
- Владимиров Ю.А., Шерстнев М.П. Хемилюминесценция клеток животных. Итоги науки и техники, сер. Биофизика 1989;24(176)
- Chaudiere J, Ferrari-Iliou R. Intracellular antioxidants: from chemical to biochemical mechanisms. Food Chem Toxicol 1999;37(9-10):949-962.60. 62. Электронный ресурс. Режим доступа: https://www.slideserve.com
Статья опубликована в журнале"Экспериментальная и клиническая урология" №3 2018, стр.34-41











Комментарии