Асфандияров Ф.Р., Абдулхакимов Э.Р., Абдулхакимова Ф.К., Выборнов С.В., Курбангалиева Н.Р., Новоженова Н.А.
Сведения об авторах:
- Асфандияров Ф.Р. – д.м.н., заведующий кафедрой урологии и нефрологии, Астраханский государственный медицинский университет Минздрава России, г. Астрахань, drfa@rambler.ru, AuthorID: 744044
- Абдулхакимов Э.Р. – к.м.н., врач уролог-андролог, ГБУЗ АО «Центр охраны здоровья семьи и репродукции», elmir_doc@mail.ru, г. Астрахань
- Абдулхакимова Ф.К. – врач-уролог ГУЗ АО ГП №1, fatma-25@mail.ru, г. Астрахань
- Выборнов С.В. – Астраханский государственный медицинский университет Минздрава России, г. Астрахань, andro_vibor@bk.ru, AuthorID: 536079
- Курбангалиева Н.Р. – ГБУЗ АО «Центр охраны здоровья семьи и репродукции», nuriya712@mail.ru; г. Астрахань
- Новоженова Н.А. – ГБУЗ АО «Центр охраны здоровья семьи и репродукции, natnov1973@mail.ru, г. Астрахань
По данным Всемирной Организации Здравоохранения 10-20% супружеских пар репродуктивного возраста страдают от отсутствия беременности, и, в половине случаев причиной бесплодия является та или иная патология у мужчины [1].
Актуальность проблемы мужского бесплодия не вызывает сомнений, а методы его диагностики и лечения остаются не до конца изученными. В течение последних лет фертильность мужчин неуклонно снижается. В 50% случаев бесплодие связано с «мужским фактором», проявляющимся отклонениями в параметрах эякулята. Нередко наблюдается одновременное наличие нескольких изменений количества, подвижности и морфологии сперматозоидов, и данное состояние обозначается как олигоастенотератозооспермия (ОАТсиндром) [2]. Причиной этому могут являться инфекции мочеполовой системы, варикоцеле, эндокринные нарушения, генетические отклонения и др. Но в 30-40% случаев причинный фактор мужского бесплодия не удается выявить (идиопатическое бесплодие) [3]. Так по данным различных авторов распространенность идиопатического бесплодия среди мужчин колеблется от 30 до 75% [2,4,5]. В этом случае применяется эмпирическая терапия, основанная на имеющихся знаниях о сперматогенезе [6-10].
В настоящее время предполагается, что в 80% случаев идиопатическое бесплодие мужчин вызвано влиянием окислительного стресса. Последний развивается в результате дисбаланса между активными формами кислорода (АФК) и антиоксидантной способностью эякулята. Активные формы кислорода представляют собой кислородсодержащие химически активные молекулы, которые могут быть полезными, способствуя реакции капацитации, регуляции созревания сперматозоидов и развитию клеточных сигнальных путей. Тем не менее, при более высоких уровнях АФК индуцируется перекисное окисление липидов, повреждение ДНК сперматозоидов и апоптоз. Чтобы преодолеть эти нежелательные последствия, АФК естественным образом стабилизируются или дезактивируются антиоксидантной системой организма. В случае, когда возникают избыточные количества АФК или, когда антиоксидантная система не справляется, развивается оксидативный стресс (ОС). Сперматозоиды наиболее подвержены ОС, поскольку не обладают необходимыми цитоплазматическими антиоксидантными системами восстановления. Мембрана сперматозоидов богата полиненасыщенными жирными кислотами, что делает их восприимчивыми к ОС-индуцированному перекисному окислению липидов [7,11]. Таким образом, уменьшение оксидативного стресса является основной целью при лечении идиопатического мужского бесплодия.
В последние годы для лечения мужского бесплодия широко используют антиоксиданты, которые представляют собой природные или синтетические биомолекулы, препятствующие повреждению клеток вследствие оксидативного стресса [11-14]. Среди всех доступных антиоксидантов наиболее популярными являются витамины E и C, карнитин, N-ацетилцистеин, селен и цинк. Докозагексаеновая кислота улучшает состав мембран, препятствует фрагментации ДНК, увеличивает подвижность и выживаемость сперматозоидов. Исчерпывающий метаанализ показал, что применение антиоксидантов при бесплодии более, чем в 2 раза повышает вероятность зачатия [13,15,16]. По мнению J.B. Cheng и соавт. [17], наиболее заметным эффектом было то, что использование нескольких антиоксидантов увеличивало подвижность и концентрацию сперматозоидов.
В качестве источника антиоксидантов нами был выбран многокомпонентный препарат БЕСТФертил® (ООО «Фармакор Продакшн», Россия), уникальный состав которого направлен на улучшение показателей спермограммы (табл. 1). Данный комплекс влияет на все звенья сперматогенеза и компенсирует действие патологических факторов, тем самым, повышая мужскую фертильность. Компоненты препарата БЕСТФертил® разделены на два приема: капсулы «УТРО» и «ВЕЧЕР». Это сделано для максимального раскрытия потенциала ряда компонентов: 1). Прием жирорастворимых компонентов (витамин Е, докозагексаеновая кислота), которые могут нарушить всасывание минеральных компонентов (цинк, селен), а также фолиевой кислоты и витамина С, был перенесен на вечерние часы. 2). В то же время гинсенозиды (экстракт женьшеня), обладающие антиастеничеcким действием, следует принимать в первой половине дня. Кроме того, селен потенцирует действие коэнзима Q10, поэтому их следует принимать одновременно.
Цель исследования – показать возможность применения отечественного биологически активного комплекса БЕСТФертил® для лечения мужчин с идиопатической патоспермией.
МАТЕРИАЛЫ И МЕТОДЫ
В данном исследовании приняли участие 44 пациента в возрасте от 26 до 47 лет, которые обратились в ГБУЗ АО «Центр охраны здоровья семьи и репродукции» в период с сентября по ноябрь 2018 г. Средний возраст больных составил 35±1,06 год. Первичное бесплодие было выявлено у 26 человек (81,8%), длительность бесплодия составляла в среднем 51,6±0,72 месяц.
Критерии включения в исследование: отсутствие беременности в браке более 12 месяцев половой жизни без контрацепции; идиопатическая олиго-, астено- или тератозооспермия; отсутствие инфекций репродуктивного тракта (Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Trichomonas vaginalis), диагностированных методом полимеразной цепной реакции; отсутствие клинических и лабораторных признаков воспалительного процесса дополнительных половых желез; пальпируемого варикоцеле; отсутствие психосексуальной и эякуляторной дисфункций; отсутствие гормональных расстройств.
Критерии исключения: установленные генетические причины бесплодия (синдром Клайнфельтера, микроделеции AZF-локуса, мутации гена CFTR – Cystic Fibrosis Transmembrane conductance Regulator); азооспермия; пиоспермия; наличие аутоиммунных реакций, сопровождающихся выработкой антиспермальных антител к сперматозоидам (MAR IgG>50%);
В качестве основного критерия оценки эффективности терапии использовали спермограмму. Исследование спермы проводили в соответствии с требованиями руководства Всемирной организации здравоохранения [18]. Определяли объем, концентрацию, долю нормальных форм по строгим критериям Крюгера, вычисляли количество прогрессивно подвижных сперматозоидов в эякуляте. Повреждение хромосом сперматозоидов характеризовали по фрагментации ДНК, по методике оценки дисперсии хроматина сперматозоидов (метод SCD). Метод включает последовательное выполнение нескольких стадий. На первой стадии выполняется приготовление образца для исследования. Для этого проводится оценка концентрации сперматозоидов в исследуемом образце. После чего концентрация сперматозоидов в образце при необходимости нормируется до 5 млн/мл с использованием фосфатного буфера (PBS). Затем 50 мкл образца спермы помещается в микропробирку, содержащую расплавленный 0,7% гель легкоплавкой агарозы при температуре 36°С и 10 минут инкубируется при температуре 36°С. Микродозатором 12 мкл суспендированного образца спермы помещается на подложку. В качестве подложки используется предметное стекло, предварительно покрытое пленкой из обычной агарозы. После чего образец накрывают покровным стеклом (18×18 мм) и 5 минут инкубируют при температуре 4°С. После полного затвердения агарозы с предметных стекол проводится аккуратное удаление покровных стекол (микрогель не должен быть поврежден!). На второй стадии образец обрабатывается ДНКденатурирующим раствором (0,2 N раствор соляной кислоты) и лизирующим раствором для экстракции ядерных белков (содержащим хлорид натрия, дитиотрейтол (DTT), 2-амино2-(гидроксиметил)-1,3-пропандиол (трис) и Тритон Х-100). Затем образец промывается фосфатным буфером (PBS) для удаления остатков денатурирующего и лизирующего растворов. Для обезвоживания образца используется проведение через возрастающие концентрации этилового спирта в диапазоне от 70% до 100%. На третьей стадии проводят окрашивание полученного образца красителем Райта на фосфатном буферном растворе с рН 6,88. На четвертой стадии проводится микроскопирование окрашенного образа при увеличении 400х и оценка полученных результатов.
Всем больным помимо спермограммы проводили: микробиологическое исследование эякулята, пальцевое ректальное исследование предстательной железы (ПЖ), трансректальное ультразвуковое исследование ПЖ и УЗИ органов мошонки, микроскопическое исследование секрета ПЖ (СПЖ), микроскопическое исследование уретрального мазка и ПЦР-диагностика заболеваний, передающихся половым путем.
Больные были разделены на две группы, основная – 32 (72,7%) пациента, и контрольная – 12 (27,3%) пациентов. Мужчины основной группы принимали БЕСТФертил® по рекомендованной схеме: 2 капсулы«Утро» в 1-й половине дня, во время приема пищи и 2 капсулы «Вечер» во 2-й половине дня, во время приема пищи. Продолжительность курса составила 3 месяца. Анализ эякулята проводили до лечения, через 1 мес. и через 3 мес. от начала приема препарата. В контрольную группу вошли пациенты, которые воздержались от приема каких-либо препаратов и находились под контрольным наблюдением (табл. 1)
Таблица 1. Состав биологически активного комплекса БЕСТФетрил®
| Компонент | Суточная доза | Действие |
|---|---|---|
| L-карнитин | 500 мг | Положительно влияет на количество и подвижность сперматозоидов, на число сперматозоидов с прогрессивным движением |
| L-аргинин | 250 мг | Непосредственный предшественник N0. Улучшает подвижность и морфологию сперматозоидов |
| Витамин Е | 32 мг | Универсальный протектор мембран. Антиоксидант. Улучшает подвижность и капацитацию сперматозоидов |
| Гинсенозиды | 26 мг | Природный адаптоген. Увеличивает количество и подвижность сперматозоидов |
| Фолиевая кислота | 400 мг | Принимает участие в синтезе ДНК, препятствует ДНК-фрагментации |
| Цинк | 20 мг | Улучшает морфологию и подвижность сперматозоидов, препятствует фрагментации ДНК |
| Селен | 30 мг | Антиоксидант. Улучшает подвижность сперматозоидов |
| Глутатион | 40 мг | Улучшает подвижность сперматозоидов, препятствует фрагментации ДНК |
| Коэнзим Q10 | 15 мг | Играет ключевую роль в энергетическом обмене. Улучшает морфологию и подвижность сперматозоидов |
| Докозагексаеновая кислота | 400 мг | Улучшает состав мембран, препятствует фрагментации ДНК, увеличивает подвижность и выживаемость сперматозоидов |
Имеются публикации о применении препарата БЕСТФертил® у мужчин [9], однако особенностью нашего исследования являлась оценка не только показателей стандартной спермограммы, но и динамики фрагментации ДНК на фоне лечения этим препаратом.
Степень достоверности разницы между средними значениями проводили по критерию Стьюдента. Различия считали значимыми при р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе изучения полученных результатов, такие показатели спермограммы, как объем и вязкость в обеих группах практически не изменились и через 3 мес. от начала лечения составили 3,4±0,3 мл, 0,6±0,1 см, соответственно. В то же время, в основной группе, отмечено статистически значимое увеличение концентрации сперматозоидов с 14,2± 0,9 млн/мл до 18,7±1,4 через 1 месяц приема препарата БЕСТФертил® (р=0,00004). Через 3 месяца терапии средняя концентрация сперматозоидов составила 27,9±1,8 млн/мл (р=0,00001), что составляет +1,97 млн/мл к исходной (табл. 2). Общее количество сперматозоидов выросло на 98%. В контрольной группе концентрация сперматозоидов до начала наблюдения была 18,2±2,8 млн/мл, а через 3 месяца составила 17,5±2,9 млн/мл, демонстрируя отсутствие какой-либо динамики, статистически значимо отличается от основной группы (р<0,05) (рис. 1).
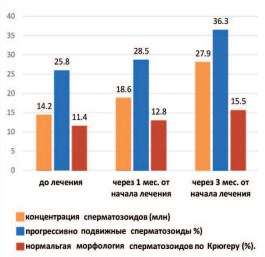
Рис. 1. Показатели спермограммы при приеме препарата БЕСТФертил®
В ходе исследования основной группы доля активно-подвижных сперматозоидов (категория А+В) достоверно не изменилась и составила 25,8±1,8% и 28,6%±1,2% до и через 1 месяц лечения, соответственно (р=0,24). Значимое и достоверное увеличение категории активно-подвижных сперматозоидов в эякуляте наблюдалось после 3-х месяцев приема БЕСТФертил® с 25,8±1,8% до 36,3±1,16% (р=0,00001). Прирост показателя составил 41%. Через 3 месяца наблюдения у пациентов контрольной группы доля активно-подвижных сперматозоидов составила 29,8±3,3%. Увеличение составляет всего 8,8% от исходного (27,4±3,3%), что является не достоверным (р=0,2).
Таблица 2. Показатели спермограммы пациентов исходно и на фоне терапии препаратом «БЕСТФертил®»
| Показатель | Контрольная группа | Основная группа | |||
|---|---|---|---|---|---|
| до начала наблюдения | через 3 мес. наблюдения | до лечения | через 1 мес. от начала лечения | через 3 мес. от начала лечения | |
| Объем, мл | 3,3±0,3 | 3,4±0,23 | 3,4±0,3 | 3,5±0,3 | 3,5±0,3 |
| Вязкость - длина нити, см | 0,6±0,1 | 0,5±0,2 | 0,7±0,33 | 0,7±0,33 | 0,58±0,16 |
| Концентрация сперматозоидов, млн/мл | 18,2±2,8 | 17,5±2,9 | 14,2±0,96 | 18,6± 1,36 | 27,9±1,79 |
| Доля сперматозоидов с поступательным движением (категорий А и В), % | 27,4±3, | 29,8±3,3 | 25,8± 1,76 | 28,5± 1,24 | 36,3±1,16 |
| Нормальная морфология сперматозоидов по строгим критериям Крюгера, % | 5,8±1,9 | 6,5±1,7 | 11,5±2,29 | 12,9± 1,83 | 15,2± 1,93 |
| Степень фрагментации ДНК сперматозоидов, % | 19,8±0,9 | 18,4±0,8 | 28±2,8 | - | 19±0,9 |
Нормальная морфология сперматозоидов по строгим критериям Крюгера у пациентов основной группы через 1 месяц изменилась малодостоверно (p=0,6), однако через 3 месяца лечения процент нормальных форм сперматозоидов статистически и высокодостоверно повысился до 15±2,01%, что составило 30,4% от исходного уровня (p=0,04). В контрольной группе доля нормальных форм сперматозоидов до начала наблюдения была 5,8±1,9%, что ниже основной группы на 98%, но при этом динамика составила всего 12%, в абсолютных значениях повысилась до 6,5±1,7% и это различие не являлось достоверным (p>0,5).
Положительная динамика фрагментации ДНК на фоне лечения имела место у 32% мужчин. Процент сперматозоидов с фрагментацией ДНК до начала лечения составил 28±2,8%, после – 19±0,9%. Таким образом, через 3 мес. терапии процент повреждения ДНК сперматозоидов достоверно не изменился (p=0,02), но показал тенденцию к улучшению. В контрольной группе за период наблюдения степень фрагментации ДНК сперматозоидов не изменилась. Несмотря на малодостоверное изменение этого показателя в основной группе, положительная динамика степени фрагментации ДНК сперматозоидов представляет несомненный практический интерес и является предметом дальнейшего изучения, так как не был включен в критерии основной оценки данного исследования.
В результате исследования у 6 (19%) партнерш пациентов, принимавших препарат БЕСТФертил®, наступила беременность. В ходе лечения ни в одном случае каких-либо нежелательных или побочных эффектов зарегистрировано не было.
ЗАКЛЮЧЕНИЕ
Такимобразом, применение отечественного препарата БЕСТФертил® в дозе 4 капсулы в сутки уже через 1 мес. лечения приводит к значимому увеличению количества сперматозоидов.Через 3месяца достоверно увеличился процент активно-подвижных и морфологически нормальных форм сперматозоидов. Полученные данные позволяют рекомендовать биологически активный комплекс БЕСТФертил® для лечения мужского идиопатического бесплодия с признаками нарушения целостности ДНК сперматозоидов курсом не менее 3-х месяцев.
ЛИТЕРАТУРА
- WHO Manual for the Standardized Investigation, Diagnosis and Management of the Infer-tile Male. Cambridge: Cambridge University Press, 2000; 102 p.
- Jungwirth A, Diemer T, Kopa Z, Krausz C, Tournaye H. Guidelines. Male infertility. URL: https://uroweb.org/guideline/male-infertility/#.
- Руководство ВОЗ по лабораторному исследованию эякулята человека и взаимодей-ствия сперматозоидов с цервикальной слизью.4–е издание М., 2001. 143 с.
- Рутинский А.И. Особенности диагностики идиопатического мужского бесплодия (обзор литературы). Медикосоциальные проблемы семьи 2013;18(1):116–21.
- Sabanegh EJ, Agarwal A. Male infertility. In: Campbell-Walsh urology. 10th ed. Eds.: M.F. Campbell, P.C. Walsh, A.J. Wein. Philadelphia: Saunders Elsevier, 2012. P. 616–647.
- Jung JH, Seo JT. Empirical medical therapy in idiopathic male infertility: Promise or pana-cea? Clin Exp Reprod Med 2014;41(3):108–14. doi: 10.5653/ cerm.2014.41.3.108.
- Imamovic Kumalic S, Pinter B. Review of clinical trials on effects of oral antioxidants on basic semen and other parameters in idiopathic oligoasthenoteratozoospermia. Biomed Res Int 2014;2014:42695. doi: 10.1155/2014/426951.
- Божедомов В.А., Николаева М.А., Теодорович О.В. Нормализация акросомальной реакции сперматозоидов в результате комплексной терапии карнитином,фруктозой и лимонной кислотой. Проблемырепродукции 2005;(4):84-7.
- Кореньков Д.Г., Павлов А.Л., Казимзаде Э.Д. Влияние препарата БЕСТФертил на репродуктивную функцию у мужчин с идиопатическим бесплодием. Андрология и генитальная хирургия 2018;(4):54-9.
- Lenzi A, Lombardo F, Sgrò P, Salacone P, Caponecchia L, Dondero et al. Use of carnitine therapy in selected cases of male factor infertility: a doubleblind crossover trial. Fertil Steril 2003;79(2): 292–300.
- Agarwal A, Sekhon LH. Oxidative stress and antioxidants for idiopathic oligoasthenoter-atospermia: Is it justified? Indian J Urol 2011;27(1):74-85. doi: 10.4103/0970-1591.78437/.
- Sigman M, Glass S, Compagnone J, Pryor JL. Carnitine for the treatment of idiopathic as-thenospermia: a randomized, double-blind, placebo-controlled trial. Fertil Steril 2006;85(5):1409–14. doi: 10.1016/j.fertnstert.2005.10.055.
- Zini A, Fischer MA, Nam RK, Jarvi K. Use of alternative and hormonal therapies in male infertility. Urology 2004;63(1):141-3.
- Tremellen K. Oxidative stress and male infertility – a clinical perspective. Hum Reprod Update 2008;14(3):243-58. doi: 10.1093/humupd/dmn004.
- Sabeti P, Pourmasumi S, Rahiminia T, Akyash F, Talebi AREtiologies of sperm oxidative stress. Int J Reprod Biomed (Yazd). 2016;14(4):231-40.
- Evers JLH. Female subfertility. Lancet 2002;360(9327):151–159. doi:10.1016/S0140-6736(02)09417-5
- Cheng JB, Zhu J, Ni F, Jiang H [L-carnitine combined with coenzyme Q10 for idiopathic oligoasthenozoospermia: A double-blind randomized controlled trial]. Zhonghua Nan Ke Xue 2018;24(1):33-38.
- WHO laboratory manual for the examination of human sperm and semencervical mucus interaction. 4nd ed. Cambridge: The Press Syndicate of the University of Cambridge, 1999.136 p.
Статья опубликована в журнале "Экспериментальная и клиническая урология" №2 2019 г., стр. 116-121











Комментарии