В.Ю. Старцев1 , И.Н. Дыленок2 , Т.Р. Джемилев2
1ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, Санкт-Петербург;
2 ГБУЗ РК «Крымский республиканский онкологический клинический диспансер им. В.М. Ефетова», Симферополь
По данным мировой литературы, у 30 % больных раком мочевого пузыря (РМП) опухоль впервые выявляют в стадии инвазивного роста и еще в 30 % случаев немышечно-инвазивного рака мочевого пузыря опухоль прогрессирует в стенку мочевого пузыря, несмотря на адекватное лечение. При лечении больных мышечно-инвазивным РМП стандартно выполняют радикальную цистэктомию (РЦ) с удалением мочевого пузыря, регионарных лимфатических узлов и окружающих структур (матка или предстательная железа) с деривацией мочи [1].
Ближайшие и отдаленные результаты этого вмешательства связаны с высокой (30–61 %) частотой осложнений, а деривация мочи оказывает выраженное влияние на функцию мочевых путей, органов желудочно-кишечного тракта, половую функцию и снижает качество жизни пациента [2]. Больные после РЦ нуждаются в особом уходе медицинского персонала с высокой профессиональной подготовкой, что возможно в крупных специализированных центрах [3].
Цель данного исследования заключалась в проведении метаанализа данных о возможности сохранения мочевого пузыря, профиле токсичности и контроле состояния опухоли при использовании органосохраняющих технологий у больных неметастатическим мышечно-инвазивным РМП. В 80–90-х гг. XX столетия многие исследователи признавали, что органосохраняющее лечение больных мышечно-инвазивным РМП, включающее трансуретральную резекцию мочевого пузыря (ТУРМП), химиотерапию (ХТ) и/или лучевую терапию (ЛТ), приводит к однозначно худшим результатам с точки зрения локального контроля опухоли и долгосрочной общей и беспрогрессивной выживаемости [4].
Изменилось ли мнение ученых по этому вопросу в наше время? В 2010 г. начато исследование SPARE («Выборочное сохранение мочевого пузыря против радикального удаления»), в котором предполагалось сравнение результатов РЦ с методиками сохранения мочевого пузыря, но оно было приостановлено в связи с неудовлетворительным набором пациентов [5]. За последние два десятилетия проведено несколько проспективных исследований с целью анализа показателей общей выживаемости в ходе так называемой тримодальной терапии — комбинации ТУРМП и химиолучевой терапии (ХЛТ) и РЦ или неоадъювантной химиотерапии с последующей спасительной цистэктомией [6, 7].
Результаты исследований легли в основу документов, опубликованных в 2014 г. Группой онкологической радиационной терапии (RTOG), что стало важным вкладом в развитие методов сохранения мочевого пузыря как альтернативы РЦ [8]. С современных позиций, консервативный подход оправдан для двух групп пациентов: при расположении опухоли в пределах стенки мочевого пузыря (и при желании больного избежать агрессивной операции) и у пациентов с тяжелыми сопутствующими заболеваниями [9].
Сохранение мочевого пузыря для отдельных групп пациентов по сей день рассматривается в качестве альтернативы руководящим принципам ведущих научных сообществ (National Comprehensive Cancer Network (NCCN) и European Association of Urology (EAU)) [10, 11]. Цель органосохраняющего лечения больных мышечно-инвазивным РМП — сохранение высокого качества жизни, снижение угрозы потенциальной прогрессии опухоли или смертности после РЦ без ущерба для онкологического результата [12].
Мультимодальный подход при органосохраняющем лечении
Современные варианты сохранения мочевого пузыря известны под названием «бимодальная» (БМТ) и «тримодальная» терапия (ТМТ) [13]. Цель проведения БМТ (ТУРМП + ЛТ) — достижение локального контроля над опухолью, а при комбинации с курсом ХТ (при ТМТ) достигается потенцирование радиочувствительности рака [13]. В ходе органосохраняющего лечения врач пытается воспроизвести результаты общей выживаемости больных мышечно-инвазивным РМП, сравнимой с последствиями РЦ, избегая осложнений и снижения качества жизни, характерного для радикальной операции.
Однако до сих пор не опубликованы рандомизированные исследования с проспективным сравнением результатов РЦ и ТМТ. Показатели эффективности БМТ значительно уступают результатам после полного цикла ТМТ [9]. Причиной отказа в проведении ХТ служат сопутствующие заболевания, однако потребность в комплексном подходе к пациентам пожилого возраста привлекает все больше внимания во всем мире.
Недостатки ТМТ включают частое выявление мышечно-инвазивного рецидива РМП в сохраненном мочевом пузыре (чаще в зоне первоначального расположения раковой опухоли), отсутствие лечебного вмешательства на регионарных лимфатических узлах, рост числа смертельных исходов у больных мышечно-инвазивным РМП после спасительной РЦ при прогрессировании опухоли или ее рецидиве после высокой дозы облучения органов малого таза [14].
После опроса урологов Канады M. Walker et al. сообщили о сопоставимой пятилетней общей выживаемости больных после РЦ (51 %) и пациентов, которым проводили ТМТ (50 %) [15]. Выбор в пользу органосохраняющего лечения включал такие факторы, как «убеждения о последствиях» у пациентов (OR = 8,1, 95 % CI 1,5–44,9), их «социальное и профессиональное значение» (OR = 11,2, 95 % CI 2,3–53,6) и «поведенческие особенности и ресурсы» (OR = 5,9, 95 % CI 1,5–23,3). Сравнительные исследования результатов РЦ и органосохраняющего лечения продолжаются.
Возможности сохранения мочевого пузыря у больных пожилого возраста
При ретроспективном анализе распространенности РМП у жителей Дании (2016) установлено, что заболеваемость мышечно-инвазивным РМП в 7–10 раз выше у пациентов старше 70 лет в сравнении с более молодыми людьми. Показатели смертности с течением времени снижались у пациентов всех возрастных групп, кроме 90-летних больных [16]. С учетом мировых данных внимание к сопутствующим заболеваниям и ментальному статусу больных мышечно-инвазивным РМП пожилого и старческого возраста имеет большое значение.
S. Poletajew et al. рекомендуют органосохраняющее лечение больным мышечно-инвазивным РМП при наличии следующих факторов: старческий возраст (в среднем — 78 лет), высокий индекс массы тела (свыше 25,7 кг/м2 ), низкий показатель гемоглобина (ниже 11,6 г/л), курение (72,1 %), интервал между первым проявлением болезни и установлением диагноза РМП свыше 60 дней [17]. В результате исследования эффективности органосохраняющего лечения у пациентов пожилого возраста (≥75 лет), проведенного R.H. Clayman et al., было установлено, что пяти- (60 %) и десятилетние (56 %) показатели раковоспецифической выживаемости такие же, как после РЦ [18].
С учетом общемировой тенденции старения населения ожидается возрастание численности пациентов с мышечно-инвазивным РМП, а значит, контингента пациентов с выраженной сопутствующей патологией и онкологическим диагнозом. В 2016 г. A. Erlich и A.R. Zlotta предложили алгоритм выбора лечения возрастных больных мышечно-инвазивным РМП (табл. 1) [19].
Таблица 1 Алгоритм органосохраняющего лечения пациентов пожилого возраста с мышечно-инвазивным раком мочевого пузыря [19]
| Характеристика пациентов | Потенциальные варианты лечения |
| Операбельные, цисплатинчувствительные |
|
| Операбельные, цисплатин-нечувствительные |
|
| Неоперабельные, цисплатин-чувствительные |
|
| Неоперабельные, цисплатиннечувствительные |
|
S.J. Byun et al. ретроспективно изучили результаты органосохраняющего лечения 50 пациентов с мышечно-инвазивным РМП (средний возраст — 71,5 года): пятилетняя общая выживаемость и раковоспецифическая выживаемость составили 37,2 и 30,2 % соответственно [20]. При многофакторном анализе индекс G оказался статистически значимым показателем прогноза, что позволило представить графическую зависимость (рис. 1). Для принятия решения о предстоящем лечении, помимо возраста больного, необходим учет его работоспособности, производительности, качества жизни, социальных показателей и собственных предпочтений [21].
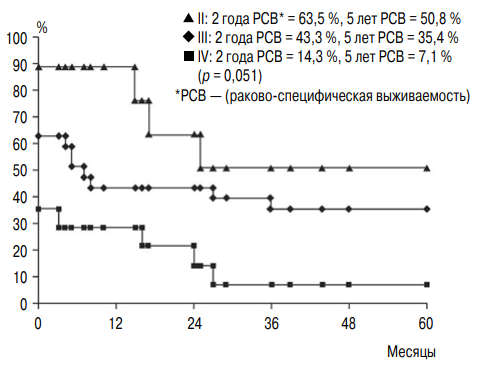
Рис. 1. Общая выживаемость больных мышечно-инвазивным раком мочевого пузыря с учетом степени злокачественности опухоли [20]
Хирургические технологии в программе органосохраняющего лечения
Во время выполнения ТУРМП, составной части ТМТ, стараются добиться максимальной резекции опухоли, поскольку оставление резидуальной ткани обычно сопровождается низким показателем раковоспецифической выживаемости [22]. Монотерапия ТУРМП продемонстрировала невысокую эффективность в нескольких исследованиях из-за высокой частоты развития локальных рецидивов в ближайшие (до полугода) сроки после операции [23, 24].
Следовательно, у пациентов с мышечно-инвазивным РМП следует предпочесть более агрессивное лечение с мультимодальным подходом. Для улучшения качества визуализации и снижения побочных эффектов терапии М.М. Garcia et al. (2014) предложили выполнять трансуретральную разметку границ опухоли с помощью специальных маркеров с микрозубчиками в подслизистом слое органа, в 5–7 мм от края резекции, что улучшает переносимость ЛТ [25].
При выполнении РЦ у больных этой группы ни интраоперационных (кровотечение, сопутствующая травма), ни послеоперационных осложнений (формирование камней, инфицирование мочевыводящих путей, гематурия после ТУРМП) отмечено не было. Японские авторы возвращаются к вопросу о возможности секторальной резекции мочевого пузыря с лимфодиссекцией («частичная цистэктомия») с последующей индукционной ЛТ в более низкой СОД (40 Гр), называя подобный подход у больных местнораспространенным РМП «рациональной стратегией для локорегионарного контроля и снижения дозы облучения» [14, 26].
Хирургическое лечение больных с распространением опухоли на соседние органы (Т 4) характеризуется невысокой (10–12 %) пятилетней общей выживаемостью [27]. Для таких пациентов наиболее предпочтителен мультимодальный подход или внутриартериальная химиотерапия.
Лучевая терапия в программе мультимодального лечения больных мышечно-инвазивным раком мочевого пузыря
Стандартный протокол ЛТ включает создание внешнего пучка излучения на мочевой пузырь, ограниченного тазовыми лимфатическими узлами (СОД = 40 Гр), с повышением лучевой нагрузки на мочевой пузырь до СОД = 54 Гр и доведением СОД до 64–65 Гр [28]. Внедрена новая методика планирования зоны облучения, получившая название «конусной лучевой компьютерной томографии», в основе которой лежит 3D-визуализация, позволяющая уменьшить искажения визуализации, связанные с дыханием [29].
S. Hafeez et al. сообщают, что при помощи предлучевого планирования конусной лучевой компьютерной томографии существует возможность подведения к опухоли СОД = 70 Гр с оптимальным уровнем воздействия и минимальным побочным эффектом (2 из 19 лучевых циститов через 5,3 месяца после ЛТ) [30].
Современная ЛТ получила название «адаптивной» благодаря возможности точного учета анатомических особенностей пациента, в том числе возможности центровать дозу, подводимую к органу, с максимальной точностью до 75 %, что гораздо эффективнее наведения с использованием компьютерной томографии (49 %), и уменьшать дозу облучения здоровых тканей, прежде всего кишечника и стенки мочевого пузыря [31].
В 2008–2014 гг. проведены исследования у больных мышечно-инвазивным РМП, позволившие улучшить ряд показателей после органосохраняющего лечения. Целью исследований было достижение максимальной эффективности лечения путем эскалации общей дозы ЛТ, использования нетрадиционных схем фракционирования, сокращения общего времени терапии, а также сочетания дистанционного излучения с интерстициальной брахитерапией и новыми методами ЛТ, радиосенсибилизаторами и гипертермией [32, 33].
Новое лечебное направление в радиологии — радиотерапия с модулированной интенсивностью, позволяетдостигать высоких результатов у пожилых (старше 75 лет) больных мышечноинвазивным РМП. L.J. Lutkenhaus et al. сообщили о полном опухолевом ответе у 87 % пожилых больных мышечно-инвазивным РМП (трехлетняя общая выживаемость — 44 %, признаков продолженного роста не обнаружено у 73 % больных за 36 месяцев наблюдения) при невысокой токсичности (недержание мочи и стула G ≥ 2 у 14 и 5 % пациентов соответственно) [31].
Современная химиотерапия в комплексном лечении больных мышечно-инвазивным раком мочевого пузыря
Поиск оптимального соотношения варианта введения и дозы химиопрепаратов, дающего возможность снизить проявления побочных эффектов и сохранить высокий опухолевый ответ, составляет одну из актуальных проблем онкоурологии [34, 35]. Местнораспространенный и диссеминированный РМП хорошо поддается воздействию системной ХТ на основе цисплатина [35].
Что касается сроков начала проведения ХТ при органосохраняющем лечении, до сих пор не получено окончательных данных, подтверждающих преимущество использования неоадъювантной или адъювантной химиотерапии. Полный лекарственный патоморфоз после неоадъювантной химиотерапии в 28 % случаев мышечно-инвазивного РМП отметили V.K. Pokuri и et al.: эффект зависел от морфологического типа строения опухоли. Так, у пациентов с переходноклеточной карциномой патоморфоз отмечался после трех курсов неоадъювантной химиотерапии [36].
Опухолевый ответ на ХТ на основе цисплатина наблюдается у 50–60 % пациентов с прогрессирующим мышечно-инвазивным РМП, но в ряде случаев отмечается химиорезистентность. Цитотоксический эффект платины опосредован необратимым повреждением ДНК, но экспрессия репарации ДНК белков (комплементарный фактор перекрестной репарации 1 (ERCC1) и ген восприимчивости 1 (BRCA1)) не связана с ответом на препараты платины [37].
Альтернативные подходы для прогнозирования чувствительности к платине с участием экспрессии нескольких генов в настоящее время изучаются. Так, в 2016 г. Е.А. Guancial et al. измеряли концентрацию платины в опухолевой ткани с использованием беспламенной атомно-абсорбционной спектрофотометрии (FAAS) и сравнивали с показателями в нормальном уротелии мочевого пузыря после применения комбинации неоадъювантной химиотерапии и РЦ [38].
Для установления причин химиорезистентности РМП исследовали цисплатин-резистентные клеточные линии РМП: были определены гены, вызывающие дерегуляцию РНК-последовательностей (секвенирование РНК) и метилирование ДНК [39, 40]. P. Sidaway проанализировал метилирование ДНК in vitro в опухолях 18 пациентов, получавших цисплатин. Было установлено, что промотор метилирования HOXA9 может служить потенциальным прогностическим биомаркером мышечно-инвазивного РМП, а децитабин сенсибилизирует резистентные опухоли у пациентов, получающих ХТ на основе цисплатина [41].
Полученные результаты, вероятно, послужат началом для изучения тканевых факторов, определяющих персонализированный подход у больных мышечно-инвазивным РМП при использовании ХЛТ. При нечувствительности к платине, а также у ослабленных пациентов с мышечно-инвазивным РМП используют и другие химиопрепараты, например из класса таксанов [35].
Еженедельные инъекции паклитаксела (80 мг/м2 ) удовлетворительно переносятся больными, наиболее выраженными проявлениями токсичности (Grade3–4) оказываются анемия, слабость (10 %) и боль (38 %), что чаще связано с костными метастазами РМП и требует проведения локальной ЛТ и пероральных болеутоляющих у взрослых и у пациентов детского возраста [42, 43].
Гемцитабин, антиметаболит пиримидина, демонстрирует выраженный эффект при системном использовании и низкую токсичность по сравнению с другими агентами. Дополнение курса ХТ вторым препаратом позволяет увеличить общую выживаемость больных мышечно-инвазивным РМП (p < 0,05), а выбор ХТ в пользу винфлунина или гемцитабина оказывает влияние на общий лечебный эффект [44].
Особо следует выделить подход, включающий внутриартериальную химиотерапию: с помощью регионарной полихимиотерапии удается добиться ремиссии у больных диссеминированным РМП, у которых агрессивное хирургическое лечение сопряжено с высоким риском осложнений. В исследованиях 80-х гг. прошлого столетия показано, что при сравнении с традиционным внутривенным введением препаратов возможен эффективный пассаж во внутреннюю подвздошную артерию малых доз цисплатина (50–70 мг/м²) [45].
В 2015 г. в Японии продемонстрированы результаты баллонной окклюзии внутренней подвздошной артерии: 329 больным РМП в стадиях pTis,1–4N0–1М0 проведена внутриартериальная химиотерапия по схеме GР в комбинации с гемодиализом и ЛТ. Достигнута чрезвычайно высокая концентрация препаратов в опухолевых тканях без значимых системных побочных эффектов [46].
Полный клинический ответ отмечен у 83,6 % пациентов, в том числе у 93,6 % больных мышечно-инвазивным РМП. Y. Miyata et al. проводили лечение больных мышечно-инвазивным РМП (n = 163) в трех разных вариантах: системная полихимиотерапия (группа А), внутриартериальная химиотерапия (группа В) и внутриартериальная химиотерапия в комбинации с ЛТ (группа С). Наибольший эффект достигнут в группе С (полный ответ — 43 %), пятилетняя общая выживаемость больных составила 50,3 % [47].
В группе B16 пациентам с мышечно-инвазивным РМП в среднем в возрасте 83 лет (75–91 год) проведена внутриартериальная химиотерапия, двух- и пятилетние показатели общей выживаемости составили 80 и 66,7 % соответственно [48]. Результаты свидетельствуют о широких возможностях органосохраняющего лечения у пациентов достаточно широкой возрастной группы. Применение методики катетеризации внутренней подвздошной артерии посредством установки чрескожных артериальных портов позволяет проводить ХТ с любыми промежутками по времени и широко варьировать дозу химиопрепаратов [49].
Иммунотерапия в программе органосохраняющего лечения
В последние годы значительно возрос интерес к иммунотерапии рака мочевого пузыря, в том числе резистентного к ХТ первой линии. Результаты клинических исследований указывают на высокую эффективность и большой потенциал такой группы лекарственных препаратов, как ингибиторы PD-1/PD-L1 [50]. О потенциале органосохраняющего лечения больных мышечно-инвазивным РМП, основанного на точечном геномном воздействии в сочетании с ЛТ, сообщили китайские исследователи в 2004 г. [51].
Созданы два рекомбинантных аденовируса, контролируемых промотором уроплакина II и уротелийспецифического мембранного протеина (UPII): Ad-hUPII-GFP, с зеленым флуоресцентным белком (GFP), и Ad-hUPII-ФНО, с фактором некроза опухоли альфа (TNF-альфа), который определен с помощью ELISA. Продемонстрирован высокий эффект in vitro TNF-альфа, полученного путем инфицирования клеток РМП [52].
Сделан вывод о пользе внутрипузырного введения Ad-hUPII-ФНО в связи с высокой активностью ингибирования роста раковой опухоли в модели РМП человека. Результаты исследования могут быть положены в основу разработки нового терапевтического подхода у больных РМП с учетом информации о молекулярной регуляции роста уротелия, дифференциации его клеток и развитии неопластического процесса.
Целесообразна оценка молекулярного профиля опухоли в сочетании с методами лучевой визуализации, что может играть важную роль в выборе оптимального лечения для сохранения мочевого пузыря. За последние годы в медицинской литературе появился ряд сообщений об успешном использовании ЛТ и тканеспецифического онколитического аденовируса (Ad-PSCAE-UPII-E1A) при РМП: успешно построена и опробована in vitro модель аденовируса Е1А под контролем антигена простаты UPII и промотора стволовых клеток (PSCAE) [52].
Онколитический аденовирус в сочетании с ЛТ характеризуется повышенной противоопухолевой активностью по сравнению с монотерапией ЛТ: отмечен максимальный противоопухолевый эффект инъекции аденовируса в течение 24 ч после облучения, что может стать потенциальной стратегией для терапии больных мышечно-инвазивным РМП в будущем. Глубокое знание основ патогенеза РМП позволит шире использовать возможности экспрессии генов, что даст новые прогностические инструменты для разработки целенаправленных методов лечения, в то время как ХТ будет играть менее важную роль.
Стратегия наблюдения больных после завершения курса лечения
После полного завершения ТМТ проводят эндоскопическую оценку эффекта терапии с систематической повторной биопсией уротелия. При выраженной резистентности и прогрессировании опухоли предлагается выполнение спасительной РЦ. Результаты исследований прошлых лет показали, что у пациентов с мышечно-инвазивным РМП, перенесших БМТ, показатели пятилетней общей выживаемости и раковоспецифической выживаемости составили 20–40 и 31–56,8 % соответственно [53].
В дальнейшем эти показатели удалось существенно улучшить — до 36–74 и 50–82 % соответственно [54]. Наибольший эффект органосохраняющего лечения отмечен у больных с небольшим объемом раковой опухоли в стадии Т 2 без сопутствующего гидронефроза или Cais [55]. В исследовании М.А. Gerardi et al. в ходе проведения ТМТ (n = 25) ни в одном случае не наблюдалась тяжелая токсичность со стороны мочевыводящих путей или органов желудочно-кишечного тракта.
Полный ответ и стабилизация заболевания констатированы у 11 (92 %) и 1 (8 %) пациента соответственно, общая пятилетняя выживаемость составила 77 %. Авторы сформулировали алгоритм органосохраняющего лечения как вариант терапии у больных мышечно-инвазивным РМП, отказывающихся от радикального хирургического лечения [56] (рис. 2).
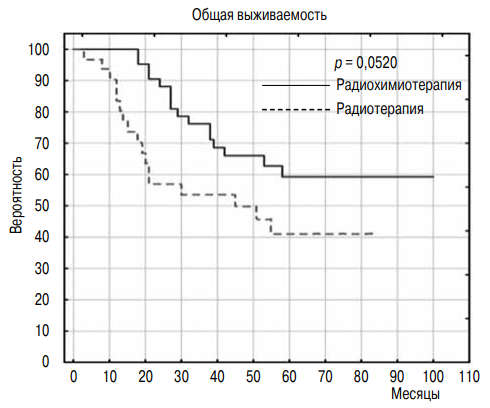
Рис. 2. Общая выживаемость больных мышечно-инвазивным раком мочевого пузыря после органосохраняющего лечения [33]
J. Nowak-Sadzikowska et al. провели полноценное исследование результатов органосохраняющего лечения у больных мышечно-инвазивным РМП, что дало возможность сформулировать выводы на основе наблюдения 73 пациентов в стадии pT2– 4aN0M0 [33]. За 67 месяцев наблюдения скончались 33 (45 %) пациента (в том числе 28 от прогрессирования РМП). Трех- и пятилетняя общая и раковоспецифическая выживаемость составила 65 и 52 %, 70 и 59 % соответственно.
Пятилетние показатели общей выживаемости в группе ТМТ — 59 %, в группе БМТ — 41 % (р = 0,0520) (рис. 2). Авторы сделали вывод о том, что в группе работоспособных пациентов с мышечно-инвазивным РМП (тяжелые сопутствующие заболевания с высоким риском радикального хирургического вмешательства) только у 6–19 % пациентов можно соблюсти все критерии комбинированного подхода [33].
В Канадском междисциплинарном центре по лечению РМП (MDBCC) 4,5 года наблюдали 112 пациентов с мышечно-инвазивным РМП (56 получали РЦ и 56 — ТМТ), в среднем в возрасте 68 лет. Около трети пациентов (29,5 %) имели стадию РМП cT3/cT4 [57]. Число случаев летальных исходов в группах РЦ и ТМТ составило 20 (35,7 %) и 22 (39,3 %) соответственно (по 13 случаев в результате прогрессии РМП), а пятилетняя раковоспецифическая выживаемость — 73,2 и 76,6 % соответственно (p = 0,49). Сделан вывод, что ТМТ позволяет достичь результатов выживаемости, сравнимых с таковыми для отобранных пациентов после РЦ.
Обсуждение и заключение
В отсутствие рандомизированных исследований трудно сравнивать возможность сохранения мочевого пузыря со стандартной РЦ из-за широкой гетерогенности отбора пациентов. В систематическом обзоре клинических ретроспективных и проспективных исследований, включавших 13 396 пациентов (2015), средняя пятилетняя общая выживаемость в группе ТМТ составила 57 %, тогда как в группах, получавших РЦ или РЦ и адъювантную химиотерапию, — 52 % (р = 0,04) и 53 % (р = 0,38) соответственно [7]. В результате вполне закономерен вопрос: можно ли продолжать игнорировать доказательства возможности органосохраняющего лечения пациентов с мышечно-инвазивным РМП [58]?
Итак, идеальный кандидат для сохранения мочевого пузыря — здоровый пациент с небольшой унифокальной опухолью (менее 5 см), без резидуальных изменений после ТУРМП, с отсутствием обструкции мочеточника или гидронефроза, без карциномы in situ (диагностированной с помощью биопсии подозрительных участков), в отсутствие признаков поражения тазовых лимфатических узлов [59]. До 15 % пациентов с мышечно-инвазивным РМП могут стать кандидатами для сохранения мочевого пузыря, а ТУРМП с сопутствующей ХЛТ можно рассматривать как оптимальный лечебный подход с позиции переносимости и эффективности [59].
Основными вариантами токсичности при ХЛТ остаются проблемы кроветворных, желудочно-кишечных органов и мочевыводящих путей. В ряде случаев при ХТ на основе цисплатина отмечается невропатия. Пятилетняя общая выживаемость больных, перенесших спасительную РЦ, не превышает 25–30 % [60].
Тем не менее признано возможным сохранение мочевого пузыря у отдельной, тщательно отобранной группы больных мышечно-инвазивным РМП, в частности, у престарелых пациентов и больных с выраженными сопутствующими заболеваниями, что позволяет сохранить качество жизни и самостоятельное мочеиспускание. Это является крайне важным моментом для данной гериатрической популяции.
Продолжаются исследования, касающиеся качества выполнения хирургического вмешательства, модификации дозы химиопрепаратов и лучевой энергии, а также экспрессии генома раковой клетки. Представляются перспективными рандомизированные исследования с целью сравнения результатов ТМТ и РЦ, что необходимо для выбора оптимального индивидуального метода лечения.
Литература
- Gschwend JE, Fair WR, Vieweg J. Radical cystectomy for invasive bladder cancer: contemporary results and remaining controversies. Eur Urol. 2000;38(2):121-130. https://doi. org/10.1159/000020268.
- Khalil el SA. Long term complications following ileal conduit urinary diversion after radical cystectomy. J Egypt Natl Canc Inst. 2010;22(1):13-18.
- El-Taji OM, Khattak AQ, Hussain SA. Bladder reconstruction: The past, present and future. Oncol Lett. 2015;10(1):3-10. https://doi. org/10.3892/ol.2015.3161.
- Sauer R, Birkenhake S, Kühn R, et al. Efficacy of radiochemotherapy with platin derivatives compared to radiotherapy alone in organ-sparing treatment of bladder cancer. Int J Radiat Oncol Biol Phys. 1998;40(1):121-127. https://doi.org/10.1016/s0360- 3016(97)00579-8.
- Huddart RA, Hall E, Lewis R, et al. Life and death of spare (selective bladder preservation against radical excision): reflections on why the spare trial closed. BJU Int. 2010;106(6):753-755. https:// doi.org/10.1111/j.1464-410X.2010.09537.x.
- Shipley W, Zietman A, Kaufman D, et al. Selective bladder preservation by trimodality therapy for patients with muscularis propriainvasive bladder cancer and who are cystectomy candidates? The Massachusetts General Hospital and Radiation Therapy Oncology Group experiences. Semin Radiat Oncol. 2005;15(1):36-41. https://doi.org/10.1016/j.semradonc.2004.07.008.
- Arcangeli G, Strigari L, Arcangeli S. Radical cystectomy versus organ-sparing trimodality treatment in muscle-invasive bladder cancer: A systematic review of clinical trials. Crit Rev Oncol Hematol. 2015;95(3):387-396. https://doi.org/10.1016/j.critrevonc.2015.04.006.
- Mak RH, Hunt D, Shipley WU, et al. Long-term outcomes in patients with muscle-invasive bladder cancer after selective bladderpreserving combined-modality therapy: a pooled analysis of Radiation Therapy Oncology Group protocols 8802, 8903, 9506, 9706, 9906, and 0233. J Clin Oncol. 2014;32(34):3801-3809. https:// doi.org/10.1200/JCO.2014.57.5548.
- El-Taji OM, Alam S, Hussain SA. Bladder Sparing Approaches for Muscle-Invasive Bladder Cancers. Curr Treat Options Oncol. 2016;17(3):15. https://doi.org/10.1007/s11864-016-0390-8.
- nccn.org [Internet]. NCCN Clinical Practice Guidelines in Oncology [cited 1 Apr 2019]. Available from: www.nccn.org/professionals/physicians_gls.
- Witjes JA, Comperat E, Cowan NC, et al. EAU guidelines on muscle-invasive and metastatic bladder cancer: summary of the 2013 guidelines. Eur Urol. 2014;65(4):778-792. https://doi. org/10.1016/j.eururo.2013.11.046.
- Jenkins BJ, Caulfield MJ, Fowler CG, et al. Reappraisal of the role of radical radiotherapy and salvage cystectomy in the treatment of invasive (T2/T3) bladder cancer. Br J Urol. 1988;62(4):343-346. https://doi.org/10.1111/j.1464-410X.1988.tb04362.x
- Skinner EC. Treatment of muscle-invasive bladder cancer in older patients. Am Soc Clin Oncol Educ Book. 2016;35: e228-233. https://doi.org/10.14694/EDBK_158974.
- Koga F, Kihara K. Selective bladder preservation with curative intent for muscle-invasive bladder cancer: a contemporary review. Int J Urol. 2012;19(5):388-401. https://doi.org/10.1111/j.1442- 2042.2012.02974.x.
- Walker M, French SD, Doiron RC,etal. Bladder-sparing radiotherapy for muscle-invasive bladder cancer: A survey of providers to determine barriers and enablers. Radiother Oncol. 2017;125(2):351-356. https://doi.org/10.1016/j.radonc.2017.08.036.
- Jensen TK, Jensen NV, Jorgensen SM, et al. Trends in cancer of the urinary bladder and urinary tract in elderly in Denmark, 2008-2012. Acta Oncol. 2016;55 Suppl 1:85-90. https://doi.org/1 0.3109/0284186X.2015.1115122.
- Poletajew S, Biernacki R, Buraczynski P, et al. Patterns of care in patients with muscle-invasive bladdercancer – aretrospectivecohort study. Contemp Oncol (Pozn). 2016;20(4):341-343. https:// doi.org/10.5114/wo.2016.61857.
- Clayman RH, Shipley WU, Galland-Girodet S, et al. Outcomes of selective bladder preservation in the elderly treated with conservative surgery and chemoradiation. Int J Radiat Oncol Biol Phys. 2013;87(2):S83. https://doi.org/10.1016/j.ijrobp.2013.06.216.
- Erlich A, Zlotta AR. Treatment of bladder cancer in the elderly. Investig Clin Urol. 2016;57 Suppl 1: S26-35. https://doi. org/10.4111/icu.2016.57.S1.S26.
- Byun SJ, Kim JH, Oh YK, Kim BH. Concurrent chemoradiotherapy improves survival outcome in muscle-invasive bladder cancer. Radiat Oncol J. 2015;33(4):294-300. https://doi.org/10.3857/ roj.2015.33.4.294.
- Grubmueller B, Seitz C, Shariat SF. The treatment of muscleinvasive bladder cancer in geriatric patients. Curr Opin Urol. 2016;26(2):160-164. https://doi.org/10.1097/MOU. 0000000000000262.
- Lyons MD, Smith AB. Surgical bladder-preserving techniques in the management of muscle-invasive bladder cancer. Urol Oncol. 2016;34(6):262-270. https://doi.org/10.1016/j. urolonc.2015.11.023.
- Startsev VY. The role of combined method in organ-sparing treatment of muscle-invasive bladder cancer recurrences. Arch Ital Urol Androl. 2002;74(2):54-56.
- Solsona E, Iborra I, Collado A, et al. Feasibility of radical transurethral resection as monotherapy for selected patients with muscle invasive bladdercancer.J Urol. 2010;184(2):475-480. https://doi. org/10.1016/j.juro.2010.04.008.
- Garcia MM, Gottschalk AR, Brajtbord J, et al. Endoscopic gold fiducial marker placement into the bladder wall to optimize radiotherapy targeting for bladder-preserving management of muscleinvasive bladder cancer: feasibility and initial outcomes. PLoS One. 2014;9(3):e89754. https://doi.org/10.1371/journal.pone.0089754.
- Abufaraj M, Gust K, Moschini M, et al. Management of muscle invasive, locallyadvanced and metastatic urothelialcarcinoma of the bladder: a literature review with emphasis on the role of surgery. Transl Androl Urol. 2016;5(5):735-744. https://doi.org/10.21037/ tau.2016.08.23.
- Moschini M, Luzzago S, Zaffuto E, et al. The surgical management of patients with clinical stage T4 bladder cancer: A single institution experience. Eur J Surg Oncol. 2017;43(4):808-814. https:// doi.org/10.1016/j.ejso.2016.08.024.
- Riou O, Chauvet B, Lagrange JL, et al. [Radiotherapy of bladder cancer]. Cancer Radiother. 2016;20 Suppl:S196-199. https://doi. org/10.1016/j.canrad.2016.07.010.
- Kibrom AZ, Knight KA. Adaptive radiation therapy for bladder cancer: a review of adaptive techniques used in clinical practice. J Med Radiat Sci. 2015;62(4):277-285. https://doi.org/10.1002/ jmrs.129.
- Hafeez S, Warren-Oseni K, McNair HA,etal. Prospectivestudy delivering simultaneous integrated high-dose tumor boost (≤70 Gy) with image guided adaptive radiation therapy for radical treatment of localized muscle-invasive bladder cancer. Int J Radiat Oncol Biol Phys. 2016;94(5):1022-1030. https://doi.org/10.1016/j. ijrobp.2015.12.379.
- Lutkenhaus LJ, van Os RM, Bel A, Hulshof MC. Clinical results of conformal versus intensity-modulated radiotherapy using a focal simultaneous boost for muscle-invasive bladder cancer in elderly or medically unfit patients. Radiat Oncol. 2016;11:45. https://doi. org/10.1186/s13014-016-0618-6.
- Hoskin P, Rojas A, Saunders M. Accelerated radiotherapy, carbogen, and nicotinamide (ARCON) in the treatment of advanced bladder cancer: mature results of a Phase II nonrandomized study. Int J Radiat Oncol Biol Phys. 2009;73(5):1425-1431. https://doi. org/10.1016/j.ijrobp.2008.06.1950.
- Nowak-Sadzikowska J, Skora T, Szyszka-Charewicz B, Jakubowicz J. Muscle-invasive bladder cancer treated with TURB followed by concomitant boost with small reduction of radiotherapy field with or without of chemotherapy. Rep Pract Oncol Radiother. 2016;21(1):31-36. https://doi.org/10.1016/j.rpor.2015.09.001.
- Болотина Л.В., Королева Л.А. Современные подходы к лекарственной терапии рака мочевого пузыря после первого прогрессирования // Исследования и практика в медицине. – 2015. – Т. 2. – № 2. – С. 29–34. [Bolotina LV, Koroleva LA. Modern approaches to drug therapy of bladder cancer after first progression. Issledovaniya i praktika v meditsine. 2015;2(2):29-34. (In Russ.)]
- Rose TL, Milowsky MI. Improving Systemic Chemotherapy for Bladder Cancer. Curr Oncol Rep. 2016;18(5):27. https://doi. org/10.1007/s11912-016-0512-2.
- Pokuri VK, Syed JR, Yang Z, et al. Predictors of complete pathologic response (pT0) to neoadjuvant chemotherapy in muscleinvasive bladder carcinoma. Clin Genitourin Cancer. 2016;14(1): e59-65. https://doi.org/10.1016/j.clgc.2015.09.013.
- Font A, Taron M, Gago JL, et al. BRCA1 mRNA expression and outcome to neoadjuvant cisplatin-based chemotherapy in bladder cancer. Ann Oncol. 2011;22(1):139-144. https://doi.org/10.1093/ annonc/mdq333.
- Guancial EA, Kilari D, Xiao GQ, et al. Platinum concentration and pathologic response to cisplatin-based neoadjuvant chemotherapyin muscle-invasive bladdercancer. PLoS One. 2016;11(5): e0155503. https://doi.org/10.1371/journal.pone.0155503.
- Plimack ER, Dunbrack RL, Brennan TA, et al. Defects in DNA repair genes predict responseto neoadjuvantcisplatin-based chemotherapy in muscle-invasive bladder cancer. Eur Urol. 2015;68(6):959-967. https://doi.org/10.1016/j.eururo.2015.07.009.
- Xylinas E, Hassler MR, Zhuang D, et al. An epigenomic approach to improving response to neoadjuvant cisplatin chemotherapy in bladdercancer. Biomolecules. 2016;6(3). https://doi.org/10.3390/ biom6030037.
- Sidaway P. Bladdercancer: Targeted agentsreversechemotherapy resistance in urothelial carcinoma. Nat Rev Urol. 2016;13(9):494. https://doi.org/10.1038/nrurol.2016.138.
- Sideris S, Aoun F, Zanaty M, et al. Efficacy of weekly paclitaxel treatment as a single agent chemotherapy following first-line cisplatin treatment in urothelial bladder cancer. Mol Clin Oncol. 2016;4(6):1063-1067. https://doi.org/10.3892/mco.2016.821.
- Кулева С.А., Семиглазова Т.Ю., Звягинцева Д.А., и др. Cardiovascular complications of antineoplastic therapy in children // Педиатр. – 2017. – Т. 8. – № 3. – С. 130–141. [Kuleva SA, Semiglazova TY, Zvyagintseva DA,etal. Kardiovaskulyarnaya toksichnost’ protivoopukholevogo lecheniya u detey. Pediatrician (St. Petersburg). 2017;8(3):130-141. (In Russ.)]
- Raggi D, Miceli R, Sonpavde G, et al. Second-line single-agent versus doublet chemotherapy as salvage therapy for metastatic urothelial cancer: a systematic review and meta-analysis. Ann Oncol. 2016;27(1):49-61. https://doi.org/10.1093/annonc/mdv509.
- Terashima Y. CDDP concentration of bladder tumors – comparison between intraarterial infusion and intravenous infusion. Nihon Gan Chiryo Gakkai Shi. 1988;23(4):859-866.
- Azuma H, Inamoto T, Takahara K, et al. Novel bladder preservation therapy with Osaka Medical College regimen. J Urol. 2015;193(2):443-450. https://doi.org/10.1016/j.juro.2014.08.094.
- Miyata Y, Nomata K, Ohba K, et al. Efficacy and safety of systemicchemotherapy and intra-arterial chemotherapy with/without radiotherapy for bladder preservation or as neo-adjuvant therapy in patients with muscle-invasive bladder cancer: a single-centre study of 163 patients. Eur J Surg Oncol. 2015;41(3):361-367. https:// doi.org/10.1016/j.ejso.2014.07.043.
- Maebayashi T, Ishibashi N, Aizawa T, et al. Radiotherapy for muscle-invasive bladder cancer in very elderly patients. Anticancer Res. 2016;36(9):4763-4769. https://doi.org/10.21873/anticanres.11033.
- Тимофеев Д.А., ГенераловМ.И., Балахнин П.В., и др. Чрескожно имплантируемые инфузионные системы: расширение возможностей комбинированного лечения рака мочевого пузыря // Онкоурология. – 2009. – № 3. – С. 74–78. [Timofeev DA, Generalov MI, Balakhnin PV,etal. Transcutaneousinfusion systems:extension of the capacities of multimodality treatment for urinary bladder cancer. Onkourologiya. 2009;(3):74-78. (In Russ.)]
- Горелов А.И., Симбирцев А.С., Журавский Д.А., Горелова А.А. Ингибиторы PD-1/PD-L1 в лечении рака мочевого пузыря: от медиатора иммунного ответа к таргетной терапии // Урологические ведомости. – 2018. – Т. 8. – № 2. – С. 64–72. [Gorelov AI, Simbirtsev AS, Zhuravskii DA, Gorelova AA. A review of the PD-1/PD-l1 checkpoint in bladder cancer: from mediator of immune escape to target for treatment. Urologicheskie vedomosti. 2018;8(2):64-72. (In Russ.)] https://doi.org/10.17816/ uroved8264-72.
- Zhu HJ, Zhang ZQ, Zeng XF, et al. Cloning and analysis of human UroplakinII promoter and its application for gene therapy in bladder cancer. Cancer Gene Ther. 2004;11(4):263-272. https://doi. org/10.1038/sj.cgt.7700672.
- Zhang H, Wang F, Mao C, et al. Effect of combined treatment of radiation and tissue-specific recombinant oncolytic adenovirus on bladder cancer cells. Int J Radiat Biol. 2017;93(2):174-183. https://doi.org/10.1080/09553002.2017.1231942.
- Kotwal S, Choudhury A, Johnston C, et al. Similar treatment outcomes for radical cystectomy and radical radiotherapy in invasive bladder cancer treated at a United Kingdom specialist treatment center. Int J Radiat Oncol Biol Phys. 2008;70(2):456-463. https:// doi.org/10.1016/j.ijrobp.2007.06.030.
- Ploussard G, Daneshmand S, Efstathiou JA, et al. Critical analysis of bladder sparing with trimodal therapy in muscle-invasive bladder cancer: a systematic review. Eur Urol. 2014;66(1):120-137. https://doi.org/10.1016/j.eururo.2014.02.038.
- Mathieu R, Lucca I, Klatte T, et al. Trimodal therapy for invasive bladder cancer: is it really equal to radical cystectomy? Curr Opin Urol. 2015;25(5):476-482. https://doi.org/10.1097/MOU.0000000000000203.
- Gerardi MA, Jereczek-Fossa BA, Zerini D, et al. Bladder preservation in non-metastatic muscle-invasive bladder cancer (MIBC): a single-institution experience. Ecancer medical science. 2016;10:657. https://doi.org/10.3332/ecancer.2016.657.
- Kulkarni GS, Hermanns T, Wei Y, et al. Propensity score analysis of radical cystectomy versus bladder-sparing trimodal therapy in the setting of a multidisciplinary bladder cancer clinic. J Clin Oncol. 2017;35(20):2299-2305.https://doi.org/10.1200/JCO.2016.69.2327.
- Rodel C, Weiss C. Organ-sparing multimodality treatment for muscle-invasive bladder cancer: can we continue to ignore the evidence? J Clin Oncol. 2014;32(34):3787-3788. https://doi. org/10.1200/JCO.2014.58.5521.
- Smith ZL, ChristodouleasJP, Keefe SM,etal. Bladder preservation in the treatment of muscle-invasive bladder cancer (MIBC): a review of theliteratureand a practicalapproach to therapy. BJU Int. 2013;112(1): 13-25. https://doi.org/10.1111/j.1464-410X.2012.11762.x.
- Milowsky MI, Rumble RB, Booth CM, et al. Guideline on muscleinvasive and metastatic bladder cancer (European Association of Urology Guideline): American Society of Clinical Oncology Clinical Practice Guideline Endorsement. J Clin Oncol. 2016;34(16): 1945-1952. https://doi.org/10.1200/JCO.2015.65.9797.











Комментарии