Пасечник Д.Г.1 , Набока Ю.Л.2 , Митусова Е.В.3 , Ибишев Х.С.3 , Газаев З.И.3
1 Кафедра патологической анатомии ГБОУ ВПО РостГМУМинздрава России, г.Ростов-на-Дону
2 Кафедра микробиологии и вирусологии №1 ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
3 Кафедра урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
Введение
Пиелонефрит (ПН) – неспецифический инфекционновоспалительный процесс, поражающий одновременно или последовательно канальцы, лоханку, интерстициальную ткань и паренхиму почки. ПН является одним из самых серьезных поражений почек и верхних мочевых путей и составляет 14% от всех заболеваний почек в различных возрастных группах [1, 2]. Среди пациентов ПН преобладают женщины, которые в 5 раз чаще мужчин госпитализируются по поводу ПН.
В целом, распространенность острого пиелонефрита (ОП) в России оценивается в 0,9–1,3 млн. случаев ежегодно (100 больных на 100 тыс. человек) [1, 3]. В последние годы отмечается нарастание заболеваемости острым пиелонефритом.
Отчасти данная ситуация обусловлена стремительным увеличением количества микроорганизмов, резистентных к антибактериальным препаратам различных групп.
Известно, что ПН характеризуется этиологической мультифакторностью. Заболевание вызывают различные бактерии, микоплазмы, вирусы, грибы [3, 4]. Наиболее изученным этиологическим агентом являются условно-патогенные бактерии, преимущественно относящиеся к семейству Enterobacteriaceae: E.coli, Proteus sp., Klebsiella sp. и другие [2, 5, 6, 7].
Однако по мнению современных исследователей этиология пиелонефрита остается недоизученной. Так, в последнее десятилетие исследуется причастность неклостридиальных бактерий к развитию острого пиелонефрита [8, 9].
Цель исследования: определить этиологическую причастность неклостридиальных анаэробных бактерий (НАБ) к возможности развития экспериментального острого обструктивного пиелонефрита (ООП).
Материалы и методы
Модель ООП воспроизводили по методике Giamarellos-Bourboulis E. с соавт. (2004) у кроликов [10].
Животных оперировали под наркозом: в начале подвергали седации раствором золетила внутримышечно в дозе 15 мг на 1 кг массы тела, а затем внутривенно в краевую вену уха вводили 1% водную эмульсию пропофола (дипривана) из расчета 5-7,5 мг на 1 кг массы тела.
Через верхнесрединный абдоминальный разрез длиною 4 см вскрывали брюшную полость. Кишечник перемещали вправо. Левый мочеточник после визуализации на 2,5 см дистальнее лоханки окружали нитью 3/0, которой подтягивали мочеточник к передней брюшной стенке. Оба конца нити проводили через переднюю брюшную стенку наружу и нить завязывали на коже. Бактериальные патогены в количестве 105 КОЕ/мл в 1 мл физиологического раствора вводили через иглу 26G в лоханку. Перитонеальную полость и переднюю брюшную стенку ушивали послойно.
Бактериальные культуры, используемые в эксперименте, были получены от пациентов с ООП до начала антибактериальной терапии. Микробиологическое исследование мочи проводили по методике В.В. Меньшикова (2009) [11], но с использованием расширенного набора питательных сред, в частности, для НАБ (агар и бульон Шадлера, желчно-эскулиновый агар для бактериодов, среда Блаурокка). Посевы инкубировали в аэробных и анаэробных (10% CO2, 10% H2, 80% N2) условиях. Идентификацию бактерий проводили по морфологическим, тинкториальным, культуральным и биохимическим признакам с помощью энтеро-, анаэротестов.
Для заражения животных использовали суточную взвесь E.coli, выращенную на мясопептонном агаре, и 48-часовые культуры Peptococcus niger, Eubacterium saburreum и Propionibacterium acnes, выращенные на агаре Шадлера. Исследуемые культуры смывали физиологическим раствором и стандартизировали по оптическому стандарту.
Методом случайной выборки 40 взрослых белых кроликов-самцов породы New Zealand в возрасте 3,5 мес и массой 3,11±0,69 кг были разделены на 4 группы по 10 животных в каждой: 1 группа – модель ООП, вызванного E.coli., 2 группа – модель ООП, вызванного Peptococcus niger, 3 группа – модель ООП, вызванного Eubacterium saburreum, 4 группа – модель ООП, вызванного Propionibacterium acnes. Содержание, питание, уход за животными до и после выведения из эксперимента осуществляли в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных» (приложение к приказу МЗ СССР от 12.08.1977 №5). Всех животных содержали при сходных условиях: температура 2023° С, влажность (70-75%), освещение с 12-часовым циклом свет-темнота, соответствующий рацион питания. Использование животных для настоящего эксперимента было разрешено Комитетом по этике РостГМУ. Кролики имели свободный доступ к пище и воде и в течение недели адаптировались к новой окружающей среде перед экспериментом.
После введения в эксперимент кроликов содержали в тех же условиях. Ежедневно оценивали общее поведение (активность, подвижность, аппетит, наличие озноба, диареи), измеряли ректальную температуру, исследовали уровень лейкоцитов в крови. Животные были умерщвлены 4 партиями на 1, 3, 7, 14, 21 сутки соответственно.
Для бактериологического исследования в стерильных условиях забирали мочу из лоханки левой почки, мочевого пузыря, а также сегменты обеих почек, печени, селезенки и легких. Сегменты органов помещали сепаратно в стерильные пластиковые контейнеры. Затем фрагменты органов размером 1 х 1 х 1 см гомогенизировали в тиогликолевом буфере и проводили посевы на соответствующие питательные среды. Учет результатов посевов проводили через 24, 48, 72 ч, идентификацию микроорганизмов осуществляли по вышеперечисленным признакам.
Для патогистологического исследования из различных отделов обеих почек, лоханки, клетчатки почечного синуса и паранефрия, печени, селезенки, мочевого пузыря и легких иссекали кусочки тканей с последующей фиксацией 10% забуференным нейтральным формалином. В дальнейшем препараты обезвоживали, заключали в парафин и окрашивали гематоксилином и эозином по классическом методике. Статистическую обработку материала проводили с использованием tкритерия Стьюдента при условии его применимости и непараметрических методов (критерий Манна-Уитни). При сравнении связанных групп использовали критерий Вилкоксона. Полученные различия показателей групп считали статистически значимыми при p<0,05.
Результаты
Сроки развития симптомов, характеризующих общее состояние животных и тяжесть токсического синдрома представлены в таблице 1.
Таблица 1. Сроки минифестации клинических симптомов (сутки после операции)
| Симптом | 1-я группа | 2-я группа | 3-я группа | 4-я группа |
| Озноб | 6 | 3 | 6 | 7 |
| Анорексия | 9 | 7 | 6 | 7 |
| Адинамия | 6 | 3 | 4 | 5 |
| Диарея | 4 | 3 | 3 | 3 |
Симптомы острой системной воспалительной реакции (ОСВР) у животных всех групп развивались в течение первой недели. В 1-й группе животных тяжелое состояние возникало к 4–6 суткам, во 2-й – к 3-м суткам. В 3–4-й группах диарею регистрировали на 3-е сутки, остальные симптомы – на 5-7 сутки. Необходимо отметить, что симптомы ОСВР у животных 4-й группы протекали более благоприятно в сравнении с первыми 3-мя группами: меньшая выраженность интоксикационного синдрома, гипертермии и более поздние сроки минифестации симптоматики.
Развитие лихорадки выше 38,5° С в послеоперационном периоде у животных всех групп имело место с первых суток эксперимента и оставалось постоянным на протяжении всего срока наблюдения. У животных 3-й группы гипертермию до 39,0° С и выше регистрировали с 3-х суток и до конца эксперимента.
Тяжесть клинической картины ОСВР коррелировала с уровнем лейкоцитов в крови (рисунок 1). В первой и второй группах динамика уровня лейкоцитоза была идентична и находилась в прямой зависимости от дня эксперимента. У животных третьей группы максимальные показатели лейкоцитоза отмечены к 3-м суткам, далее происходило постепенное стихание воспалительных изменений крови. У животных 4-й группы уровень лейкоцитов достигал максимума к 14-м суткам с последующим снижением к 21 дню.
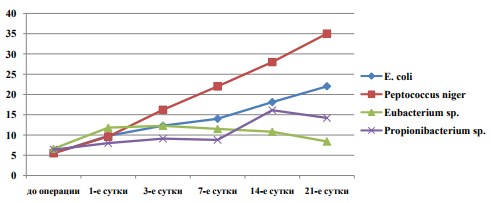
Рис.1. Уровень лейкоцитоза в крови животных
Согласно результатам гистологического исследования в I группе животных признаки острого экссудативного воспаления в левой почке отмечали с 3-х суток, в стенке лоханки и еще в большей степени в клетчатке почечного синуса выявляли очаги гнойного воспаления, септического флебита. В последующем гнойное воспаление прогрессировало, захватывая паранефрий и систему собирательных протоков, интерстиций мозгового вещества (рисунок 2).
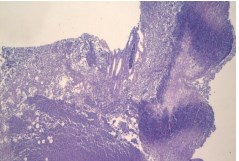
Рис. 2. Изменения в мозговом веществе почки на третьи сутки инфицирования E.coli. Очаг папиллонекроза с гнойным расплавлением. Окр. гематоксилиномэозином, ув. х100
На 7-е сутки определяли выраженные ишемические повреждения – инфаркты и очаги папиллонекроза, формирование грануляционной и фиброзной ткани. Появлялись лимфоплазмоцитарные инфильтраты в интерстиции, что свидетельствовало о развитии иммунной реакции в очагах повреждения.
К 14–21-м суткам на фоне очагов гнойного воспаления формировались абсцессы, перифокально развивалась грануляционная и фиброзная ткани.
Во II группе животных тяжелую воспалительную реакцию в левой почке наблюдали также с 3-х суток. Морфологические изменения во многом были сходны с таковыми в 1-й группе. Выраженное гнойное воспаление имело место преимущественно в клетчатке почечного синуса, сопровождаясь формированием острых абсцессов, альтеративным тромбоваскулитом с вовлечением стенки лоханки, вплоть до разрывов слизистой оболочки и образования острых язв (рисунок 3).
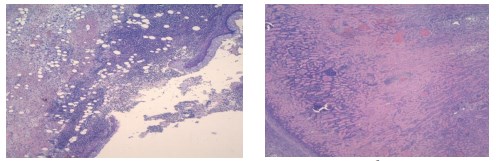
Рис. 3. Изменения в клетчатке синуса и стенке лоханки на 3 день инфицирования Peptococcus niger. (а) Диффузное гнойное воспаление в стенке лоханки с формированием острой язвы. (б) Инфаркт почки. Окр. гематоксилином-эозином, ув. х100
В почке развивались фокусы папиллонекроза с перифокальным гнойным воспалением на фоне признаков обструктивной нефропатии.
К 7-м суткам, помимо инфарктов и гнойно-некротических изменений в ткани почки, клетчатке почечного синуса и паранефрии, появлялись признаки организации в виде развития грануляционной и рубцовой ткани, в составе воспалительного инфильтрата обнаруживали лимфоциты и плазматические клетки (рисунки 4, 5).
К 14-21-м суткам отмечали регрессирование очагов гнойного воспаления с замещением их грануляционной и грубо-волокнистой соединительной тканью. Только в пирамидах сохранялись фокусы некрозов с перифокальным воспалением. В ткани почки преобладали изменения, обусловленные обструкцией.
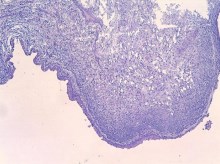
Рис. 4. Изменения в почечном синусе и лоханке на 7 сутки инфицирования Peptococcus niger. Развитие грануляцинной и фиброзной ткани с микроматозом. Очаги плоскоклеточной метаплазии уротелия. Окр. гематокилином-эозином, ув. х100
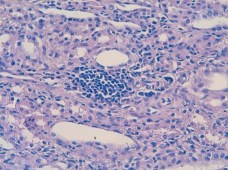
Рис. 5. Лимфо-гистиоплазмоцитарный инфильтрат в интерстиции почки. (7 день инфицирования Peptococcus niger). Окр. гематоксилином-эозином, ув. х200
К 14-21-м суткам отмечали регрессирование очагов гнойного воспаления с замещением их грануляционной и грубо-волокнистой соединительной тканью. Только в пирамидах сохранялись фокусы некрозов с перифокальным воспалением. В ткани почки преобладали изменения, обусловленные обструкцией.
В 3-й группе животных, с первых суток наблюдали диффузное гнойное воспаление и острые абсцессы в паренхиме коркового и мозгового вещества почки, в области лоханки левой почки и клетчатке почечного синуса, развитие диффузного, гнойного васкулита в клетчатке почечного синуса с острыми обтурирующими тромбами в просветах сосудов (рисунок 6).
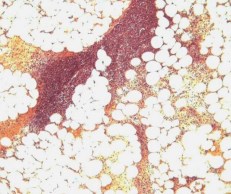
Рис. 6. Лоханка левой почки. В стенке лоханки и особенно прилежащей клетчатке диффузная лейкоцитарная инфильтрация с формированием острых абсцессов. Окр. гематоксилином-эозином, ув. х100
С 3-х по 7-е сутки происходило нарастание воспалительных изменений в области почечного синуса, лоханки, мочеточника и паренхимы левой почки с прогрессированием диффузного гнойного воспаления, формированием острых абсцессов, гнойного васкулита с тромбами. Также начиналось формирование грануляций и рыхлой волокнистой соединительной ткани (рисунок 7).
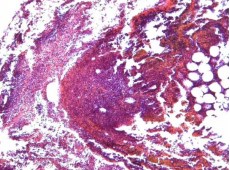
Рис. 7. 3 сутки. Левый мочеточник. В прилежащей к левому мочеточнику клетчатке диффузная лейкоцитарная инфильтрация с формированием острых абсцессов. Окр. гематоксилином-эозином, ув.х100
На 14-е сутки регистрировали резко выраженное венозное полнокровие преимущественно мозгового слоя, умеренно выраженный отек интерстиция, в строме мозгового вещества и коры определяли очаговую нейтрофильную лейкоцитарную и очаговую лимфоцитарную инфильтрацию, мелкие острые абсцессы. Отмечали начало репаративных процессов с развитием соединительной ткани и грануляций в области почечного синуса, лоханки, мочеточника (рисунок 8).
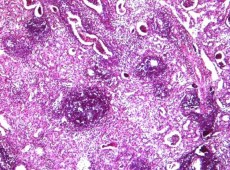
Рис. 8. Левая почка. Мелкие острые абсцессы в почках. Начало формирования рубцовых изменений в паренхиме. Окр. гематоксилином-эозином, ув.х100
К 21-м суткам продолжалось формирование нефросклероза с развитием соединительной и грануляционной тканей (рисунок 9).
В 4-й группе животных с 1-х по 3-е сутки наиболее выраженные патологические изменения происходили в области левого мочеточника и окружающей его клетчатке, лоханки левой почки и клетчатке почечного синуса с развитием мелких фокусов гнойного воспаления к концу первых суток, и возникновением в этих же структурах фокусов острого воспаления к концу третьих суток. В паренхиме левой почки воспалительных инфильтратов не определяли, имело место выраженное расширение просветов канальцев коры и мозгового вещества с очаговым уплощением эпителия (рис.10, 11).
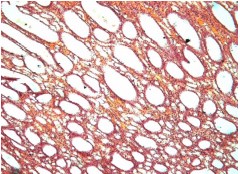
Рис. 9. Левая почка. Резко выраженная гидронефротическая эктазия прямых канальцев с атрофией паренхимы. Окр.гематоксилином-эозином, ув.х100
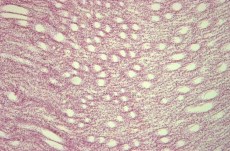
Рис. 10. 3 сутки. Левая почка. Выраженное расширение просветов канальцев мозгового вещества. Окр. гематокилином-эозином, ув. х100
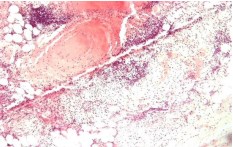
Рис. 11. 3 сутки. Левый мочеточник. В стенке мочеточника и прилежащей клетчатке очаговые нейтрофильные лейкоцитарные инфильтраты. Окр. гематоксилином-эозином, ув.х100
К концу 7 –х суток в области левого мочеточника и окружающей его клетчатке, лоханки левой почки и почечного сосочка левой почки регистрировали развитие очагов острого воспаления. В паренхиме левой почки встречались крайне редко мелкие одиночные воспалительные лимфоцитарные инфильтраты, на фоне выраженного расширения просветов канальцев коры и мозгового вещества с очаговым уплощением эпителия (рисунок 12).
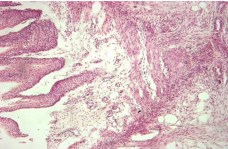
Рис. 12. Левый мочеточник. В стенке мочеточника и прилежащей жировой клетчатке нейтрофильная инфильтрация с выраженной пролиферацией фибробластов периферии, очаговая сосочковая гиперплазия переходно-клеточного эпителия. Окр. гематоксилином-эозином, ув.х100
К 14-м суткам эксперимента преобладали репаративные процессы с развитием рыхлой волокнистой соединительной ткани и грануляций в области почечного синуса, лоханки, мочеточника, в паренхиме почки отмечали формирование участков нефросклероза и гидронефроза. В паренхиме и лоханке левой почки определяли мелкие скудные воспалительные лимфоцитарные инфильтраты (рисунок 13).
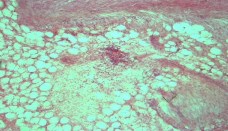
Рис. 13. 14 сутки. Лоханка левой почки. Мелкие воспалительные лимфоцитарные инфильтраты. Окр. гематоксилиномэозином, ув.х100
К 21-м суткам отмечали завершение формирования нефросклероза и гидронефроза. Воспалительные изменения были выражены минимально (рисунок 14).
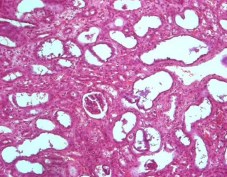
Рис. 14. 21 сутки. Левая почка. Нефросклероз с гидронефротической эктазией просветов канальцев и атрофией нефроэпителия. Окр. гематоксилином-эозином, ув.х100
Морфологические данные корреспондировали с результатами бактериологического исследования (табл.2).
Таблица 2. Степень обсемененности (КОЕ/мл и КОЕ/биоптат) различных биотопов животных
| Исследуемый материал | 1-я группа | 2-я группа | 3-я группа | 4-я группа |
| Моча лоханки левой почки | 107 -1010 | 102 -106 | 101 -107 | 101 -104 |
| Левая почка | ≥1010 | >1010 | 103 -106 | 102 -104 |
| Правая почка | 1010 | 101 -102 | 102 -106 | 102 -104 |
| Моча из мочевого пузыря | 107 -1010 | 103 -107 | 102 -106 | 101 -104 |
| Печень | 101 | 101 | 103 -105 | 102 -103 |
| Селезенка | 1010 | 101 -102 | 101 -104 | 101 -103 |
В 1-й группе животных регистрировали максимальные уровни бактериурии (107 -1010 КОЕ/мл). Во 2-й и 3-й группах уровни бактериурии в различные дни эксперимента варьировали в пределах 101-2–106-7 КОЕ/мл.
Обращает на себя внимание, что у животных 4-й группы, инфицированных Propionibacterium acnes, максимальный уровень (104 КОЕ/мл) зафиксирован лишь на 7-е сутки с последующим снижением до 101 КОЕ/мл к 21-м суткам.
У животных 1-й и 2-й групп уровень обсемененности левой почки был максимальным (≥1010 КОЕ/биоптат). У животных 3-й группы он был достоверно ниже: 104 на 1 и 7 сутки, с некоторым повышением на 3-е сутки (106 КОЕ/биоптат) и снижением к 14-м и 21-м суткам (103 КОЕ/биоптат). У животных 4-й группы максимальная обсемененность левой почки зафиксирована на 3-е и 7-е сутки (104 КОЕ/ биоптат) с дальнейшим снижением (102 -103 КОЕ/биоптат) к 14-м и 21-м суткам. Наибольшую инфицированность правой почки также регистрировали у животных 1-й группы. Уровень обсемененности правых почек у животных 3-й и 4-й групп был незначителен (101 -104 КОЕ/мл). Однако, у животных 3-й группы, инфицированных Eubacterium saburreum, максимальный уровень обсемененности регистрировали на 3-е сутки (106 КОЕ/биоптат с последующим снижением до 102-3 ).
При бактериологическом исследовании биоптатов печени и легких максимальная инфицированность органов выявлена в III и IV сериях эксперимента. Высокую инфицированность селезенки (1010 КОЕ/биоптат) регистрировали только у животных 1-й группы.
Обсуждение
Как было показано ранее, НАБ как доминирующие в макроорганизме способны вызывать инфекционновоспалительные процессы любой локализации, в том числе и в органах мочеполовой системы: острый и хронический уретрит, цистит, острый и хронический простатит, гангрену мошонки, почечный абсцесс, пиелонефрит [12, 13, 14, 15]. Причастность НАБ к развитию острого пиелонефрита изучали Kumazava J., Kiyohara H. [16]. Авторами была воспроизведена экспериментальная модель острой обструкции мочеточника на животных с контаминацией мочи лоханки Bacteroides fragilis. Этиологическая роль B. fragilis в возникновении и развитии ООП была доказана клиническими, морфологическими и микробиологическими исследованиями. Хотя еще в работе Schulte T. L. [17] были описаны случаи острого пиелонефрита, вызванного ассоциацией Bacteroides fragilis и Streptococcus sp. Таким образом, немногочисленные исследования позволили предположить, что НАБ могут быть причастны к развитию острого пиелонефрита. Однако исследование с НАБ в дальнейшем не получили своего развития.
Воспроизводя модель ООП на животных с использованием различных видов неклостридиальных бактерий, нами оценена тяжесть токсического синдрома и характер возникаю щих морфологических изменений в почке, мочевых путях в зависимости от вида микроба, инициирующего воспаление.
Морфологические исследования почек и мочевых путей показали, что у животных инфицированных Peptococcus niger, Eubacterium saburreeum, Propionibacterium acnes развитие воспаления наблюдается к 3-м суткам и изменения, возникающие в почках были идентичны модели ООП, вызванного общеизвестным уропатогеном (E.coli): гнойное воспаление клетчатки почечного синуса, возникновение очагов гнойного воспаления и абсцессов в паренхиме почки. Различия в течении ООП отмечали при оценке клиниколабораторных признаков заболевания.
Так, у животных 2-й группы по сравнению с 3-й и 4-й группами имели место более выраженные изменения уровня лейкоцитоза крови, ранняя манифестация симптомов заболевания. Животные 4-й группы, напротив, отличались более легким течением острого воспаления с меньшей выраженностью клинической симптоматики и воспалительными изменениями крови.
Выводы
Таким образом, причастность НАБ к развитию воспалительных поражений почек не вызывает сомнения, однако необходимо отметить, что выраженность клинической симптоматики, тяжесть токсического синдрома, характеристика морфологических и микробиологических изменений зависят от вида НАБ.
Литература
1. Бешлиев Д.А. Ходырева Л.А. Диагностика и лечение острого пиелонефрита // Трудный пациент. – 2007. – №12-13. – С. 5-8.
2. Лоран О.Б., Синякова Л.А., Косова И.В. Роль урогенитальных инфекций в этиологии цистита и необструктивного пиелонефрита у женщин (часть 1) // Урология. – 2005. – №2.– С. 74-79.
3. Урология: клинические рекомендации / Под ред. Н.А. Лопаткина. – М.: ГЭОТАР-Медиа, 2007. – 368 с.
4. Лопаткин Н.А., Деревянко И.И., Страчунский Л.С. Антибактериальная терапия острого цистита и пиелонефрита у взрослых // Публикация на сайте НИИ урологии МЗ РФ. – 2003 г. Url.: http://www.antibiotic.ru/rus/all/met od/ocp (дата обращения 24.04.13).
5. Бондаренко, В.М. Генетические детерминанты патогенности Escherichia coli, изолированных из мочи и фекалий детей с различными клиническими вариантами инфекции мочевой системы // Журн. микробиол. – 2004. – №4 – С. 3-7.
6. Глыбочко П.В., Хачатуров К.А., Липский В.С. и соавт. Анаэробные паразитоценозы мочевыводящих путей как фактор риска развития острого пиелонефрита // Урология. – 2006. – №2. – С. 50-54.
7. Максимов В.А., Борисик В.И., Яровой С.К. Острый гломерулонефрит, осложнившийся острым обструктивным пиелонефритом // Урология. – 2010. – №1. – С. 71-73.
8. Коган М.И., Пасечник Д.Г., Набока Ю.Л. и соавт. Могут ли неклостридиально-анаэробные бактерии вызывать острый пиелонефрит? (экспериментальное исследование) // Урология. – 2012. – №2. – С. 8-13.
9. Brook I. Urinary tract and genitourinary suppurative infections due to anaerobic bacteria // International Journal of Urology – 2004. – Vol.11, №3. – P. 133-141.
10. Giamarellos-Bourboulis E.J., Adamis T., Laoutaris G. et al. Immunomodulatory clarithromycin treatment of experimental sepsis and acute pyelonephritis caused by multidrug-resistant Pseudomonas aeruginosa. // Antimicrob Agents Chemother. – 2004. – Vol 48, №1. – P. 93-99.
11. Методики клинических лабораторных исследований. Справочное пособие / Под ред. В.В. Меньшикова. – М.: Лабора. – 2009. – 880 с.
12. Apostolopoulou C., Konstantoulaki S., Androulakakis P. et al. Isolation of anaerobic organisms from kidney in serious renal infections // Urology – 1982. – Vol. 20, №5. – P. 479-481.
13. Bartlett J.G., Gorbach S.L. Anaerobic bacteria in suppurative infections of the male genitourinary system // J. Urol. – 1981. – Vol. 125, №3. – P. 376-378.
14. Brook I. Urinary tract infection caused by anaerobic bacteria in children // Urology – 1980. – Vol. 16, №6 – P. 596-598.
15. DuPrey K.M., Leon McCrea, Rabinowitch B.L. et al. Pyelonephritis and Bacteremia from Lactobacillus delbrueckii // Case Rep Infect Dis. – 2012. – №10. – P. 1155-1158.
16. Kumazawa J., Kiyohara H., Momose S. Significance of anaerobic bacteria isolated from the urinary tract. II. Experimental studies // Invest Urol. – 1976. – Vol.13, №4. – P. 309-312.
17. Schulte T. L. Bacteroides and anaerobic streptococci in infection of the urinary tract // Proc. Mayo Clin. – 1939. – №14. – P. 536.
Статья опубликована в журнале "Вестник уролгии". Номер №1/2013 стр. 8-20











Комментарии