Д.Г. Пасечник1 , М.И. Коган1 , З.М. Ахохов2
1 ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону; 2 МБУЗ «Городская больница скорой медицинской помощи», Таганрог
В настоящее время почечно-клеточный рак (ПКР) является значимой проблемой урологии. Он составляет 3 % злокачественных новообразований у взрослого населения. Заболеваемость ПКР растет за последние десятилетия в среднем на 3–4 % в год. Возможно, этот рост связан с широким распространением методов прижизненной визуализации почек (УЗИ, компьютерная томография, магнитно-резонансная томография) [1]. Существующие способы оценки прогноза, учитывающие клинические особенности новообразования, его стадию, степень дифференцировки, гистологические особенности, несмотря на высокую прогностическую способность, не могут с достаточной точностью предсказать течение опухолевого процесса у конкретного пациента, так как не учитывают индивидуальные свойства ПКР. Кроме того, затруднена оценка прогноза при разных стадиях новообразования. В связи с этим современный подход к прогнозированию клинического течения ПКР заключается в поиске биологических маркеров, определяющих ключевые свойства опухоли, такие как повышенная пролиферативная активность, резистентность к апоптозу, способность к инвазии и метастазированию, подавление иммунных реакций [2].
Целью нашей работы было оценить особенности экспрессии молекул, связанных с фенотипом раковой стволовой клетки (CD133, N-кадгерин): TGF-α — фактора роста для эпителия канальцев и карбоангидразы IX (CAIX) — одной из ключевых молекул, связанных с VHL-молекулярным путем канцерогенеза при ПКР.
Материалом для исследования послужило 61 наблюдение ПКР (35 случаев светлоклеточного варианта ПКР, 13 — папиллярного варианта первого типа, 13 — хромофобного варианта ПКР). Для проведения морфологического исследования использовали операционный материал после радикальной нефрэктомии. Фрагменты опухоли фиксировали в 10 % забуференном нейтральном формалине, проводили и заливали в парафин по классической методике. Гистологические срезы окрашивали гематоксилином и эозином. Для иммуногистохимического исследования использовали панель антител, включающую антитела к TGF-a (TGF-α, dilution 1 : 100, Аbcam, Cambridge, United Kingdom), N-кадгерину (N-Cadherin, клон M3613; dilution 1 : 50, Dako, Glostrup, Denmark), CD133 (Prominin-1 dilution 1 : 200, Biorbyt, Cambridge, United Kingdom), карбоангидразе IX (CAIX; NCL–L-CAIX, dilution 1 : 100, Leica Biosystems, Hamburg, Germany). Выраженность экспрессии маркеров оценивали полуколичественным методом: 0 баллов — отсутствие экспрессии — при отсутствии клеток опухоли в препарате; 1 балл — слабая экспрессия — до 10 % клеток опухоли в препарате; 2 балла — умеренная экспрессия — от 11 до 30 % клеток опухоли в препарате; 3 балла — сильная экспрессия — свыше 30 % опухоли в препарате. Кроме того, учитывали топику позитивной реакции — мембранная, цитоплазматическая или ядерная. Статистическую обработку полученных параметров проводили с применением пакета прикладных программ Statistica 6.1. Для выявления различий между сравниваемыми группами использовали непараметрический критерий Манна – Уитни, для сравнения бинарных данных — точный критерий Фишера и Хиквадрат.
Результаты исследования
1. TGF-α TGF-α — мультифункциональный клеточный регуляторный пептид с широким спектром эффектов, связанных с клеточным ростом и дифференцировкой. В почке он является стимулятором пролиферации эпителия проксимальных канальцев. Эффекты TGF-α реализуются через рецепторы к эпидермальному фактору роста [3, 4].
Экспрессия TGF-α встретилась в 36 наблюдениях (59 %) ПКР. Наиболее часто TGF-α выявляли при светлоклеточном раке (55,9 %) (рис. 1–3), папиллярной форме первого типа (100 %) (рис. 4), реже при хромофобном раке (23,1 %) (рис. 5). Преимущественно экспрессия TGF-α определялась в цитоплазме опухолевых клеток (59 %), реже вдоль клеточных мембран (32,8 %). При анализе возможных взаимосвязей между экспрессией TGF-α и клиническими характеристиками ПКР установлено, что пол, возраст, индекс массы тела пациентов, наличие в анамнезе артериальной гипертензии, симптомность ПКР, наличие лабораторных признаков хронической болезни почек не влияли на экспрессию TGF-α. При анализе экспрессии TGF-α и основных морфологических характеристик ПКР, имеющих прогностическое значение (табл. 1), выявлена связь между наличием в опухоли этого маркера и степенью дифференцировки новообразования (c2 = 6,816; p < 0,05).
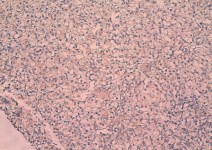
Рис. 1. Умеренно дифференцированный почечно-клеточный рак (светлоклеточный вариант), ядерный индекс 2. выраженная очаговая позитивная цитоплазматическая реакция с анти-TGF-α-антителом
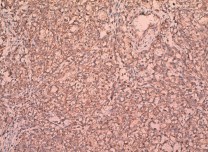
Рис. 2. Умеренно дифференцированный почечно-клеточный рак (светлоклеточный вариант), ядерный индекс 2–3. выраженная диффузная позитивная цитоплазматическая реакция с анти-TGF-α-антителом
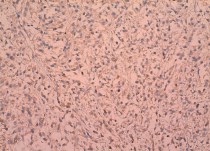
Рис. 3. Низкодифференцированный почечноклеточный рак (светлоклеточный вариант) с саркоматоидной трансформацией. выраженная диффузная позитивная цитоплазматическая реакция с анти-TGF-α-антителом
Таблица 1. Связь между экспрессией TGF-α, морфологическими и прогностическими характеристиками почечноклеточного рака
| Характеристика | Гистологический тип | Всего | X2 | |||||
| светлоклеточный | папиллярный первый тип | хромог | х>6ный | |||||
| нет | есть | нет | есть | нет | есть | |||
| экспрессии | экспрессия | экспрессии | экспрессия | экспрессии | экспрессия | |||
| Размер первичной опухоли | ||||||||
| До 4 см | 2 | 3 | 0 | 8 | 3 | 1 | 17 | |
| От 4 до 7 см | 6 | 9 | 0 | 3 | 3 | 2 | 23 | |
| Свыше 7 см | 7 | 8 | 0 | 2 | 4 | 0 | 21 | |
| Итого | 15 | 20 | 0 | 13 | 10 | 3 | 61 | 2,399 р > 0,05 |
| Стадия опухоли (Т) | ||||||||
| Т1а | 2 | 6 | 0 | 8 | 3 | 1 | 20 | |
| Tib | 1 | 1 | 0 | 2 | 1 | 1 | 6 | |
| Т2 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | |
| ТЗа | 11 | 10 | 0 | 3 | 4 | 1 | 29 | |
| ТЗЬ | 1 | 3 | 0 | 0 | 1 | 0 | 5 | |
| Итого | 15 | 20 | 0 | 13 | 10 | 3 | 61 | 5,083 р > 0,05 |
| Инвазия в клетчатку и сосуды почечного синуса, почечную вену и се ветви | ||||||||
| Есть | 11 | 10 | 0 | 3 | 4 | 1 | 29 | |
| Нет | 4 | 10 | 0 | 10 | 6 | 2 | 32 | |
| Итого | 15 | 20 | 0 | 13 | 10 | 3 | 61 | 2,637 р > 0,05 |
| Наличие регионарных лимфогенных метастазов | ||||||||
| Есть | 1 | 0 | 0 | 0 | 0 | 0 | 1 | |
| Нет | 14 | 20 | 0 | 13 | 10 | 3 | 60 | |
| Итого | 15 | 20 | 0 | 13 | 10 | 3 | 61 | 1,464 р > 0,05 |
| Нет | 13 | 19 | 0 | 11 | 10 | 3 | 56 | |
| Итого | 15 | 20 | 0 | 13 | 10 | 3 | 61 | 0.002 р > 0,05 |
| Степень дифференцировки опухоли (ядерный индекс Fuhrman) | ||||||||
| G, (ядерный индекс 1-2 балла) | 1 | 6 | 0 | 6 | 1 | 1 | 15 | |
| С. (ядерный индекс 2-3 балла) | 11 | 11 | 0 | 4 | 8 | 2 | 36 | |
| Gj (ядерный индекс 3-4 балла) | 3 | 3 | 0 | 3 | 1 | 0 | 10 | |
| Итого | 15 | 20 | 0 | 13 | 10 | 3 | 61 | 6.816 р < 0,05 |
| Наличие саркоматоидной и рабдоидной трансформации | ||||||||
| Есть | 3 | 3 | 0 | 2 | 1 | 0 | 9 | |
| Нет | 12 | 17 | 0 | 11 | 9 | 3 | 52 | |
| Итого | 15 | 20 | 0 | 13 | 10 | 3 | 61 | 0.052 р > 0,05 |
| Наличие очагов коагуляционного некроаа в опухоли | ||||||||
| Есть | 2 | 1 | 0 | 4 | 1 | 0 | 8 | |
| Нет | 13 | 19 | 0 | 9 | 9 | 3 | 53 | |
| Итого | 15 | 20 | 0 | 13 | 10 | 3 | 61 | 0.024 р > 0.05 |
2. N-кадгерин N-кадгерин — это мембранный белок из надсемейства кадгеринов, участвующий в образовании кальцийзависимых межклеточных контактов. Высокий уровень экспрессии этого кадгерина характерен для мезодермы эмбриона. Исследования последних лет указывают на то, что N-кадгерин может быть маркером эпителиально-мезенхимального перехода, определяющим приобретение опухолевыми клетками агрессивных свойств (инвазия и метастазирование) [5].
Экспрессия N-кадгерина встретилась в 38 наблюдениях рака почки (62,3 %). Достоверно часто N-кадгерин выявляли при светлоклеточном (80 %) (p < 0,0001) (рис. 6) и папиллярном вариантах ПКР (76,9 %) (p < 0,0001) (рис. 7). При хромофобном раке экспрессия N-кадгерина отсутствовала. Преимущественно N-кадгерин располагался в мембранах клеток (75 %), реже — внутрицитоплазматически (35,4 %). При анализе возможных взаимосвязей между экспрессией N-кадгерина и клинических характеристик ПКР выявлено, что у пациентов с признаками хронической болезни почек до операции (снижение СКФ менее 60) чаще отмечалась экспрессия N-кадгерина (c2 = 5,67; p < 0,05). При анализе экспрессии N-кадгерина и основных морфологических характеристик ПКР, имеющих прогностическое значение (табл. 2), выявлена связь между наличием в опухоли этого маркера и ее инвазивным потенциалом (c2 = 6,486; p < 0,05).
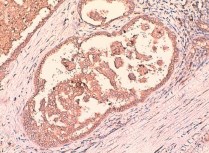
Рис. 4. высокодифференцированный почечно-клеточный рак (папиллярный вариант первого типа). диффузная позитивная цитоплазматическая и мембранная реакция с анти-TGF-α-антителом
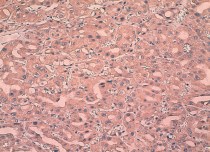
Рис. 5. Умеренно дифференцированный почечно-клеточный рак (хромофобный вариант). очаговая позитивная цитоплазматическая реакция с анти-TGF-α-антителом
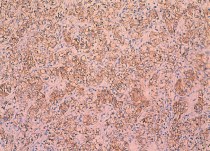
Рис. 6. Низко дифференцированный почечноклеточный рак (светлоклеточный вариант), ядерный индекс 3. выраженная диффузная позитивная мембранная реакция с анти-Nкадгерин-антителом
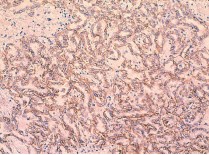
Рис. 7. Умеренно дифференцированный почечно-клеточный рак (папиллярный вариант первого типа), ядерный индекс 2. диффузная позитивная мембранная реакция с анти-Nкадгерин-антителом

Рис. 8. Умеренно дифференцированный почечно-клеточный рак (светлоклеточный вариант), ядерный индекс 2. выраженная очаговая позитивная цитоплазматическая реакция с анти-CD133-анти телом
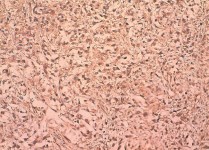
Рис. 9. Низко дифференцированный почечно-клеточный рак (светлоклеточный вариант) с саркоматоидной трансформацией, ядерный индекс 3. выраженная позитивная цитоплазматическая реакция с анти-CD133антителом
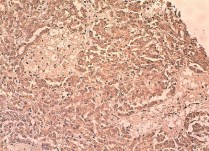
Рис. 10. Умеренно дифференцированный почечно-клеточный рак (папиллярный вариант первого типа), ядерный индекс 2–3. выраженная позитивная цитоплазматическая реакция с анти-CD133-анти телом

Рис. 11. Умеренно дифференцированный почечно-клеточный рак (светлоклеточный вариант, классическое строение), ядерный индекс 1–2. выраженная позитивная мембранная реакция с анти-карбоангидраза-Ixантителом
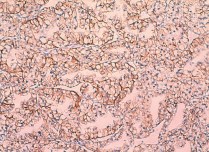
Hис. 12. Умеренно дифференцированный почечно-клеточный рак (светлоклеточный вариант, тубулопапиллярное строение), ядерный индекс 1–2. Позитивная мембранная и цитоплазматическая реакция с антикарбоангидраза-Ix-антителом
Таблица 2. Связь между экспрессией N-кадгерина, морфологическими и прогностическими характеристиками почечно-клеточного рака
| Характеристика | Гистологический тип | Всего | Г | |||||
| светлоклеточный | папиллярный первый тип | хромофобный | ||||||
| нет экспрессии | есть экспрессия | нет экспрессии | есть экспрессия | нет экспрессии | есть экспрессия | |||
| Размер первичной опухоли | ||||||||
| До 4 см | 1 | 3 | 3 | 6 | 4 | 0 | 17 | |
| От 4 до 7 см | 3 | 11 | 0 | 3 | 6 | 0 | 23 | |
| Свыше 7 см | 3 | 14 | 0 | 1 | 3 | 0 | 21 | |
| Итого | 7 | 28 | 3 | 10 | 13 | 0 | 61 | 3,52 р > 0,05 |
| Стадия опухоли (Т) | ||||||||
| Т1а | 1 | 7 | 3 | 5 | 4 | 0 | 20 | |
| Tib | 0 | 1 | 0 | 2 | 1 | 0 | 4 | |
| Т2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| ТЗа | 5 | 17 | 0 | 3 | 6 | 0 | 31 | |
| ТЗЬ | 1 | 3 | 0 | 0 | 2 | 0 | 6 | |
| Итого | 7 | 28 | 3 | 10 | 13 | 0 | 61 | 1,777 р > 0,05 |
| Инвазия в клетчатку и сосуды почечного синуса, почечную вену и ее ветви | ||||||||
| Есть | 1 | 12 | 0 | 7 | 3 | 0 | 23 | |
| Нет | 6 | 16 | 3 | 3 | 10 | 0 | 38 | |
| Итого | 7 | 28 | 0 | 10 | 13 | 0 | 61 | 6,486 р < 0,05 |
| Наличие регионарных лимфогенных метастазов | ||||||||
| Есть | 0 | 1 | 0 | 0 | 0 | 0 | 1 | |
| Нет | 7 | 27 | 3 | 10 | 13 | 0 | 60 | |
| Итого | 7 | 28 | 3 | 10 | 13 | 0 | 61 | 0.224 р > 0,05 |
| Степень дифференцировки опухоли (ядерный индекс Fuhrman) | ||||||||
| G, (ядерный индекс 1-2 балла) | 1 | 7 | 2 | 4 | 1 | 0 | 15 | |
| G. (ядерный индекс 2-3 балла) | 6 | 19 | 1 | 3 | 11 | 0 | 40 | |
| G, (ядерный индекс 3-4 балла) | 0 | 2 | 0 | 3 | 1 | 0 | 6 | |
| Итого | 7 | 28 | 3 | 10 | 13 | 0 | 61 | 2.815 р > 0.05 |
| Наличие саркомагоидной и рабдоидной трансформации | ||||||||
| Есть | 2 | 4 | 0 | 2 | 1 | 0 | 9 | |
| Нет | 5 | 24 | 3 | 8 | 12 | 0 | 52 | |
| Итого | 7 | 28 | 3 | 10 | 13 | 0 | 61 | 0,086 р > 0,05 |
| Наличие очагов коагуляционного некроза в опухоли | ||||||||
| Есть | 1 | 2 | 0 | 4 | 1 | 0 | 9 | |
| Нет | 6 | 26 | 3 | 6 | 12 | 0 | 52 | |
| Итого | 7 | 28 | 3 | 10 | 13 | 0 | 61 | 0,086 р > 0.05 |
3. CD133 СD133, или проминин-1, — трансмембранный гликопротеин, который экспрессируется в гемопоэтических стволовых клетках [6]. Последние годы экспрессию этого белка используют для выделения пула так называемых раковых стволовых клеток. Гипоксия и активация HIF-1α могут индуцировать пролиферацию CD133+-клеток. Экспрессия CD133+ может быть динамичной и меняться в зависимости от состояния микроокружения клеток [7].
Экспрессия CD133 встретилась в 37 наблюдениях рака почки (60,6 %). Наиболее часто CD133 выявляли при светлоклеточном (80 %) (рис. 8, 9) и папиллярном (рис. 10) вариантах ПКР (69,2 %). При хромофобном раке экспрессия CD133 отсутствовала. Для CD133 характерна преимущественно цитоплазматическая экспрессия (60,6 %), реже — мембранная (44,3 %).
При оценке возможных ассоциаций между экспрессией CD133 и клиническими характеристиками опухоли выявлены взаимосвязи с возрастом пациентов (c2 = 17,467; p < 0,01). Доля пациентов с сильной экспрессией маркера CD133 значительно возрастает у более молодых больных. Средний возраст у больных с сильной экспрессией составляет 56,3 ± 5,4 года, у пациентов с отсутствием экспрессии этого маркера он значимо выше — 64,8 ± 2,21 года (p = 0,014). Это распределение совпадает для мембранной и цитоплазматической экспрессии. У пациентов с риском снижения СКФ в раннем послеоперационном периоде также отмечена связь с экспрессией CD133 (c2 = 4,155; p < 0,05). Выявлена более высокая частота экспрессии CD133 у больных с метастатическими формами ПКР. Кроме того, установлена достоверная связь между выраженностью реакции в опухолевых клетках и саркоматоидной трансформацией (c2 = 6,480; р < 0,05) (табл. 3).
Таблица 3. Связь между экспрессией CD133, морфологическими и прогностическими характеристиками почечно-клеточного рака
| Характеристика | Гистологический тип | Всего |
X2 | |||||
| светлоклеточный | папиллярный первый тип | хромофобный | ||||||
| нет экспрессии | есть экспрессия | нет экспрессии | есть экспрессия | нет экспрессии | есть экспрессия | |||
| Размер первичной опухоли | ||||||||
| До 4 см | 1 | 4 | 3 | 5 | 4 | 0 | 17 | |
| От 4 до 7 см | 5 | 10 | 0 | 3 | 5 | 0 | 23 | |
| Свыше 7 см | 1 | 14 | 1 | 1 | 4 | 0 | 21 | |
| Итого | 7 | 28 | 4 | 9 | 13 | 0 | 61 | 5.810 р > 0.05 |
| Стадия опухоли (Т) | ||||||||
| Т1а | 1 | 7 | 3 | 5 | 4 | 0 | 20 | |
| Tib | 0 | 2 | 0 | 2 | 2 | 0 | 6 | |
| Т2 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | |
| ТЗа | 5 | 16 | 1 | 2 | 6 | 0 | 30 | |
| ТЗЬ | 1 | 3 | 0 | 0 | 0 | 0 | 4 | |
| Итого | 7 | 28 | 4 | 9 | 13 | 0 | 61 | 0.390 р > 0.05 |
| Инвазия в клетчатку и сосуды почечного синуса, почечную вену и ее ветви | ||||||||
| Есть | 5 | 16 | 1 | 2 | 5 | 0 | 29 | |
| Нет | 2 | 12 | 3 | 7 | 8 | 0 | 32 | |
| Итого | 7 | 28 | 4 | 9 | 13 | 0 | 61 | 0.046 р > 0,05 |
| Наличие регионарных лимсюгенных метастазов | ||||||||
| Есть | 1 | 0 | 0 | 0 | 0 | 0 | 1 | |
| Нет | 6 | 28 | 4 | 9 | 13 | 0 | 60 | |
| Итого | 7 | 28 | 4 | 9 | 13 | 0 | 61 | 1.567 р > 0.05 |
| Нет | 5 | 28 | 2 | 9 | 13 | 0 | 57 | |
| Итого | 7 | 28 | 4 | 9 | 13 | 0 | 61 | 6.599 Р < 0,05 |
| Степень дифференцировки опухоли (ядерный индекс Fuhrman) | ||||||||
| G, (ядерный индекс 1-2 балла) | 1 | 7 | 1 | 5 | 1 | 0 | 15 | |
| G. (ядерный индекс 2-3 балла) | 5 | 16 | 2 | 2 | 11 | 0 | 36 | |
| Gj (ядерный индекс 3-4 балла) | 1 | 5 | 1 | 2 | 1 | 0 | 10 | |
| Итого | 7 | 28 | 4 | 9 | 13 | 0 | 61 | 4,431 р > 0.05 |
| Наличие саркоматоидной и рабдомдной трансформации | ||||||||
| Есть | 1 | 5 | 1 | 1 | 1 | 0 | 9 | |
| Нет | 6 | 23 | 3 | 8 | 12 | 0 | 52 | |
| Итого | 7 | 28 | 4 | 9 | 13 | 0 | 61 | 6.480 р < 0.05 |
| Наличие очагов коагуляционного некроза в опухоли | ||||||||
| Есть | 1 | 2 | 2 | 2 | 1 | 0 | 8 | |
| Нет | 6 | 26 | 2 | 7 | 12 | 0 | 53 | |
| Итого | 7 | 28 | 4 | 9 | 13 | 0 | 61 | 0.438 р > 0.05 |
4. Карбоангидраза IX Карбоангидраза IX (CA-IX) является HIF-1αрегулируемым трансмембранным белком, связанным с новообразованиями, агрессивным фенотипом опухоли и неблагоприятным прогнозом при светлоклеточном раке почки [8]. Принято считать, что CA-IX помогает в регулировании внутриклеточного и внеклеточного уровней рН в ответ на гипоксию ткани опухоли.
Экспрессия CA-IX выявлена в 35 наблюдениях (57,4 %), преимущественно при светлоклеточном варианте ПКР (97,1 %) (рис. 11, 12), при хромофобном раке в 1 наблюдении отмечено слабое очаговое окрашивание антителами к CA-IX, при папиллярном раке экспрессия отсутствовала. При симптомном ПКР достоверно чаще встречалась экспрессия CA-IX (c2 = 6,213; p < 0,05). Выявлена достоверная ассоциация между экспрессией CA-IX и размером опухоли (c2 = 7,710; p < 0,05), ее стадией (c2 = 8,535; p < 0,05) и инвазивным потенциалом (c2 = 5,111; p < 0,05). Связи между степенью дифференцировки новообразования и выраженностью экспрессии установлено не было (табл. 4).
Таблица 4. Связь между экспрессией CA-IX, морфологическими и прогностическими характеристиками почечноклеточного рака
| Характеристика | Гистологический тип | Всего | у: | |||||
| светлоклеточный | папиллярный первый тип | хромофобный | ||||||
| нет экспрессии | есть экспрессия | нет экспрессии | есть экспрессия | нет экспрессии | есть экспрессия | |||
| Размер первичной опухоли | ||||||||
| До 4 см | 0 | 5 | 4 | 0 | 8 | 0 | 17 | |
| От 4 до 7 см | 1 | 14 | 3 | 0 | 4 | 1 | 23 | |
| Свыше 7 см | 0 | 15 | 6 | 0 | 0 | 0 | 21 | |
| Итого | 1 | 34 | 13 | 0 | 12 | 1 | 61 | 7,710 р < 0,05 |
| Tib | 0 | 2 | 2 | 0 | 2 | 0 | 6 | |
| T2 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | |
| ТЗа | 0 | 22 | 3 | 0 | 5 | 1 | 31 | |
| ТЗЬ | 1 | 2 | 0 | 0 | 0 | 0 | 3 | |
| Итого | 1 | 34 | 13 | 0 | 12 | 1 | 61 | 8,535 р < 0,05 |
| Инвазия в клетчатку и сосуды почечного синуса, почечную вену и ее ветви | ||||||||
| Есть | 0 | 21 | 3 | 0 | 5 | 0 | 29 | |
| Нет | 1 | 13 | 10 | 0 | 7 | 1 | 32 | |
| Итого | 1 | 34 | 13 | 0 | 12 | 1 | 61 | 5,111 р < 0,05 |
| Наличие регионарных лимфогенных метастазов | ||||||||
| Есть | 0 | 1 | 0 | 0 | 0 | 0 | 1 | |
| Нет | 1 | 33 | 13 | 0 | 12 | 1 | 60 | |
| Итого | 1 | 34 | 13 | 0 | 12 | 1 | 61 | 0,755 р > 0,05 |
| Наличие отдаленных лимфогенных и гематогенных метастазов | ||||||||
| Есть | 0 | 3 | 2 | 0 | 0 | 0 | 5 | |
| Нет | 1 | 31 | 11 | 0 | 12 | 1 | 56 | |
| Итого | 1 | 34 | 13 | 0 | 12 | 1 | 61 | 0,755 р > 0,05 |
| Степень дифференцировки опухоли (ядерный индекс Fuhrman) | ||||||||
| G, (ядерный индекс 1-2 балла) | 0 | 8 | 6 | 0 | 1 | 0 | 15 | |
| G, (ядерный индекс 2-3 балла) | 1 | 20 | 4 | 0 | 10 | 1 | 36 | |
| G, (ядерный индекс 3-4 балла) | 0 | 6 | 3 | 0 | 1 | 0 | 10 | |
| Итого | 1 | 34 | 13 | 0 | 12 | 1 | 61 | 0.142 р > 0.05 |
| Наличие саркоматоидной и рабдоидной трансформации | ||||||||
| Есть | 0 | 6 | 2 | 0 | 1 | 0 | 9 | |
| Нет | 1 | 28 | 11 | 0 | 11 | 1 | 52 | |
| Итого | 1 | 34 | 13 | 0 | 12 | 0 | 61 | 0.373 р > 0.05 |
| Наличие очагов коагуляционного некроза в опухоли | ||||||||
| Есть | 0 | 3 | 4 | 0 | 1 | 0 | 8 | |
| Нет | 1 | 31 | 9 | 0 | 11 | 1 | 53 | |
| Итого | 1 | 34 | 13 | 0 | 12 | 1 | 61 | 1.488 р > 0.05 |
Обсуждение
Наше исследование продемонстрировало, что экспрессия TGF-α, N-кадгерина, CD133 и CA-IX отличается при разных гистогенетических формах ПКР, что отражает особенности молекулярно-биологических путей, лежащих в основе их развития. Так, экспрессия CA-IX присуща только светлоклеточному варианту ПКР, экспрессия N-кадгерина, CD133 характерна для светлоклеточных опухолей и папиллярного варианта ПКР первого типа и отсутствует при хромофобных раках. Наши результаты согласуются с данными литературы. Так, В. Knebelmann et al. (2009) указали, что экспрессию TGF-α может подавлять белок VHL. Ряд исследователей продемонстрировали повышенную экспрессию TGF-α по сравнению с нормальной тканью при светлоклеточном и папиллярном вариантах почечно-клеточного рака [9, 10]. При этом показано, что этот фактор роста — один из вероятных факторов, индуцирующих развитие рака почки уже на ранних стадиях. При хромофобном варианте рака почки отсутствует экспрессия TGF-α, что, возможно, определяет низкий злокачественный потенциал этой формы новообразований и их слабую васкуляризацию [11]. Экспрессия N-кадгерина при светлоклеточном и папиллярном вариантах почечно-клеточного рака описана в работах J. Markovic-Lipkovski et al. (2001), T. Shimazui et al. (2006), C.L. Behnes et al. (2012) [12–14]. Гистогенетическая связь экспрессии этих маркеров с разными вариантами ПКР может позволить использовать их для морфологической дифференциальной диагностики. Кроме того, выявление этих молекул в биологических жидкостях (кровь, моча) может дать возможность проводить скрининг и мониторинг рака почки у пациентов.
Участие исследованных нами молекул в основных молекулярных путях развития и прогрессии ПКР определяет их прогностическое значение. Так, показана роль N-кадгерина в трансэндотелиальной миграции раковых клеток, что является важным этапом в процессе метастазирования [5]. Повышенная экспрессия этого маркера может ассоциироваться с плохим прогнозом течения рака почки [12, 15, 16].
W.H. Costa et al. (2012) выявили, что около 50 % раков почки экспрессировали CD133. Y. Zhang et al. (2013) обнаружили экспрессию CD133 в 21 % случаев почечно-клеточных опухолей. Ряд исследователей указывают, что высокая экспрессия CD133 может быть благоприятным прогностическим фактором [16–19]. Однако G. Feng et al. (2014) отметили высокий риск рецидивирования и развития метастазов у пациентов с повышенным уровнем матричной РНК гена CD133 в крови [20]. Предполагается, что CD133-позитивные клетки в почечно-клеточном раке поддерживают клеточную популяцию опухоли и служат источником дифференцированных злокачественных клеток [21].
Высокая экспрессия CA-IX связана с благоприятным прогнозом при локализованном и метастатическом ПКР [22]. Было установлено, что уровень экспрессии CA-IX обратно пропорционален риску метастазирования (р = 0,036) и высокая экспрессия CA-IX предполагает лучшую выживаемость даже после учета таких факторов, как Т-стадия, шкала Fuhrman и общее состояние пациента (все р ≤ 0,005) [23]. Низкая экспрессия CA-IX (≤ 85 %) ассоциируется с неблагоприятным исходом у больных с метастатическим ПКР (отношение рисков [OR]: 3,10; р < 0,001) даже после учета клинических и патологических факторов (OR: 4,76; р < 0,001) [24]. А. Ingles et al. (2016) также продемонстрировали, что опухоли со сниженной экспрессией CA-IX имеют худший прогноз (риск рецидивов, канцерспецифическая и общая выживаемость) [25].
Результаты нашего исследования свидетельствуют о прогностическом значении выявления экспрессии TGF-α, N-кадгерина, CD133 и карбоангидразы IX. Нами обнаружена связь между экспрессией TGF-α и степенью дифференцировки опухоли, экспрессией N-кадгерина, CD133, карбоангидразы IX и инвазивным и метастатическим потенциалом опухоли. Это может позволить использовать эти маркеры для индивидуализации прогноза течения новообразования и оценки риска прогрессии рака у конкретного больного.
Выводы
Экспрессия TGF-α достоверно чаще встречается при папиллярном варианте первого типа и светлоклеточном варианте почечно-клеточного рака по сравнению с хромофобным раком. Выявлена статистически значимая связь между наличием экспрессии TGF-α в опухоли и степенью ее дифференцировки. Экспрессия N-кадгерина достоверно чаще имеет место при папиллярном варианте первого типа и светлоклеточном варианте ПКР и отсутствует при хромофобном раке. Доказана статистически значимая связь между экспрессией N-кадгерина и наличием у пациентов хронической болезни почек стадий 3 и 4. При инвазивных формах ПКР экспрессия N-кадгерина в опухолевых клетках определяется достоверно чаще. Экспрессия СD133 достоверно чаще обнаруживается при папиллярном варианте первого типа и светлоклеточном варианте ПКР и отсутствует при хромофобном раке. CD133-экспрессирующие новообразования достоверно чаще встречаются у пациентов более молодого возраста. У пациентов с риском снижения СКФ в раннем послеоперационном периоде отмечена достоверная связь с экспрессией CD133 в опухоли. При метастатических формах ПКР чаще встречаются СD133-позитивные новообразования. Имеется достоверная связь между выраженностью реакции в опухолевых клетках и саркоматоидной трансформацией. Экспрессия карбоангидразы IX характерна для светлоклеточного варианта ПКР. Установлена достоверная связь между экспрессией опухолью карбоангидразы IX и размером опухоли, ее стадией и инвазивным потенциалом. При симптомном ПКР достоверно чаще отмечена экспрессия карбоангидразы IX.
Литература
1. Chow WH, Devesa SS, Warren JL, Fraumeni JFJr. Rising incidence of renal cell cancer in the United States. JAMA. 1999;281(17):1628-1631. doi: 10.1001/jama.281.17.1628.
2. Коган М.И., Ахохов З.М., Гусев А.А., Пасечник Д.Г. Молекулярно-биологические факторы прогнозирования течения почечно-клеточного рака(обзор литературы) // Онкоурология. – 2016. – № 3. – С. 45–50. [Kogan MI, Akhokhov ZM, Gusev AA, Pasechnik DG. Biomolecular prognostic factors in renal cell carcinoma: A literature review. Onkourologiya. 2016;12(3):45-50. (In Russ.)]. doi: 10.17650/1726-9776-2016-12-3-45-50.
3. de Paulsen N, Brychzy A, Fournier MC, et al. Role of transforming growth factor-alpha in von Hippel –Lindau (VHL)(-/-) clear cell renal carcinoma cell proliferation: a possible mechanism coupling VHL tumor suppressor inactivation and tumorigenesis. Proc Natl Acad Sci USA. 2001;98(4):1387-1392. doi: 10.1073/ pnas.031587498.
4. EverittJI, Walker CL, Goldsworthy TW, Wolf DC. Altered expression of transforming growth factor-alpha: an early event in renal cell carcinoma development. Mol Carcinog. 1997;19(3):213-19. doi: 10.1002/ (sici)1098-2744(199707)19:3 < 213:: aid-mc9>3.0.co;2-e.
5. Ramis-Conde I, Chaplain MA, Anderson AR, Drasdo D. Multiscale modelling of cancer cell intravasation: the role of cadherins in metastasis. Phys Biol. 2009;6(1):016008. doi: 10.1088/14783975/6/1/016008.
6. Mizrak D, Brittan M, Alison M. CD133: molecule of the moment. J Pathol. 2008;214(1):3-9. doi: 10.1002/path.2283.
7. Li Z. CD133: a stem cell biomarker and beyond. Exp Hematol Oncol. 2013;2(1):17. doi: 10.1186/2162-3619-2-17.
8. Tostain J, Li G, Gentil-Perret A, Gigante M. Carbonic anhydrase 9 in clear cell renal cell carcinoma: a marker for diagnosis, prognosis and treatment. Eur J Cancer. 2010;46(18):3141-3148. doi: 10.1016/j.ejca.2010.07.020.
9. Knebelmann B, Ananth S, Cohen HT, Sukhatme VP. Transforming growth factor alpha is a target for the von Hippel-Lindau tumor suppressor. Cancer Res. 1998;58(2):226-231.
10. Ramp U, Reinecke P, Gabbert HE, Gerharz CD. Differential response to transforming growth factor (TGF)-alpha and fibroblast growth factor (FGF) in human renal cell carcinomas of the clear cell and papillary types. Eur J Cancer. 2000;36(7):932-941. doi: 10.1016/s0959-8049(00)00030-7.
11. Chudek J, Schullerus D, Wilhelm M, Kovacs G. Lack of interleukin 6 (IL-6) and transforming growth factor alpha (TGF-alpha) expression in chromophobe renal cell carcinomas. Br J Cancer. 1998;78(9):1162-1164. doi: 10.1038/bjc.1998.647.
12. Shimazui T, Kojima T, Onozawa M, et al. Expression profile of N-cadherin differs from other classical cadherins as a prognostic marker in renal cell carcinoma. Oncol Rep. 2006;15(5):1181-4. doi: 10.3892/or.15.5.1181.
13. Markovic-Lipkovski J, Brasanac D, Müller GA, Müller CA. Cadherins and integrins in renal cell carcinoma: an immunohistochemical study. Tumori. 2001;87(3):173-178. 14. Behnes CL, Hemmerlein B, Strauss A, et al. N-cadherin is differentially expressed in histological subtypes of papillary renal cell carcinoma. Diagn Pathol. 2012;7:95. doi: 10.1186/17461596-7-95.
15. Zhou N, Lu F, Liu C,etal. IL-8 inducestheepithelial-mesenchymal transition of renal cell carcinoma cells through the activation of AKT signaling. Oncol Lett. 2016;12(3):1915-1920. doi: 10.3892/ ol.2016.4900.
16. Conant JL, Peng Z, Evans MF, et al. Sarcomatoid renal cell carcinoma is an example of epithelial-mesenchymal transition. J Clin Pathol. 2011;64(12):1088-1092. doi: 10.1136/jclinpath-2011-200216.
17. Costa WH, Rocha RM, Cunha IW, et al. CD133 immunohistochemical expression predicts progression and cancer-related death in renal cell carcinoma. World J Urol. 2012;30(4):553-558. doi: 10.1007/s00345-011-0769-x.
18. Cheng B, Yang G, Jiang R, et al. Cancer stem cell markers predict a poor prognosis in renal cell carcinoma: a meta-analysis. Oncotarget. 2016;7(40):65862-65875. doi: 10.18632/oncotarget.11672.
19. Matak D, Szymanski L, Szczylik C, et al. Biology of renal tumour cancer stem cells applied in medicine. Contemporary Oncology. 2015;19(1A): A44-A51. doi: 10.5114/wo.2014.47128.
20. Feng G, Jiang F, Pan C, et al. Quantification of peripheral blood CD133 mRNA in identifying metastasis and in predicting recurrence of patients with clear cell renal cell carcinoma. Urol Oncol. 2014;32(1):44.e9-14. doi: 10.1016/j.urolonc.2013.06.003.
21. Al-Lamki RS, Wang J, Yang J, et al. Tumor necrosis factor receptor 2-signaling in CD133-expressing cells in renal clear cell carcinoma. Oncotarget. 2016;7(17):24111-24124. doi: 10.18632/ oncotarget.8125.
22. Zhang BY, Thompson RH, Lohse CM, et al. Carbonic anhydrase IX (CAIX) is not an independent predictor of outcome in patients with clear cell renal cell carcinoma (ccRCC) after longterm follow-up. BJU Int. 2013;111(7):1046-1053. doi: 10.1111/ bju.12075.
23. Bui MH, Seligson D, Han KR, et al. Carbonic anhydrase IX is an independent predictor of survival in advanced renal clear cell carcinoma: implications for prognosis and therapy. Clin Cancer Res. 2003;9(2):802-11.
24. Phuoc NB, Ehara H, Gotoh T, et al. Prognostic value of the co-expression ofcarbonicanhydraseIX and vascularendothelial growth factor in patients with clear cell renal cell carcinoma. Oncol Rep. 2008;20(3):525-530. doi: 10.3892/or_00000037.
25. Ingels A, Hew M, Algaba F, et al. Vimentin over-expression and carbonic anhydrase IX under-expression are independent predictors of recurrence, specific and overall survival in non-metastatic clear-cell renal carcinoma: a validation study. World J Urol. 2017;35(1):81-87. doi: 10.1007/s00345-016-1854-y
Статья опубликована в журнале "Урологические ведомости". Номер №4/2017 стр. 5-19









Комментарии