А.Н. Сулима1,3, В.В. Литвинов3,4, П.М. Клименко2, Э.Л. Старовойтов3, И.О. Колесникова1
- 1Медицинская академия им. С.И. Георгиевского (структурное подразделение) ФГАОУ ВО «КФУ им. В.И. Вернадского», 1 медицинский факультет, кафедра акушерства, гинекологии и перинатологии № 1
- 2 Медицинская академия им. С.И. Георгиевского (структурное подразделение) ФГАОУ ВО «КФУ им. В.И. Вернадского», 1 медицинский факультет, кафедра детской хирургии с курсом урологии
- 3 ООО «Медицинская клиника «Ваш Доктор», г. Симферополь
- 4 ООО «ЭКО-центр», клиника «Альтра Вита», г. Москва
Бесплодие – это неспособность здоровой семейной пары, не применяющей средств контрацепции, достичь зачатия в течение года. На сегодняшний день процент бесплодных супружеских пар в Европе составляет 15%, а около 5% семейных пар так и остаются бесплодными даже после применения современных методов лечения [1]. В последние годы доля мужского фактора в бесплодии семейной пары сравнялась и уже превышает женский – его частота по данным Европейской ассоциации урологов (EUA) и Американского общества по репродуктивной медицине (ASRM) достигает 50-60%, из них в 20-40% этиология бесплодия остается неизвестной (идиопатическое бесплодие) [1,2]. В настоящее время проблема мужского бесплодия приобретает не только медицинскую, но и социальную значимость. Нарушение фертильности мужчины приводит к росту числа бесплодных браков, разводов и ухудшению демографических показателей. Сегодня увеличивается число семейных пар, которые начинают заниматься вопросами репродукции слишком поздно, после 35 -40 лет. Для современного мужчины 35-40 лет – это время начала возрастного андрогенного дефицита, тесно связанного с развитием метаболических нарушений. С учетом высоких рисков снижения фертильности мужчин на вредных производствах, высокой смертности мужского населения в трудоспособном возрасте и нереализованным отцовством остро может встать более глобальная проблема потери темпов экономического роста страны, снижения конкурентоспособности в стратегически важных сферах деятельности государства [3].
Субстратом для реализации репродуктивной функции мужчины является эякулят. За последние 60 лет качественные показатели эякулята снизились в среднем в 4 раза. Так в 1949 г. нормой считалось 60-300 млн. сперматозоидов в 1 мл эякулята, а уже в 2010 г. – всего 15 млн. Снижаются такие основополагающие показатели, как морфология и подвижность сперматозоидов.
Существуют несколько форм мужского бесплодия: секреторное – нарушена выработка сперматозоидов яичками; экскреторное – яички продуцируют сперматозоиды, но нарушен их транспорт по семявыносящим путям. В одной трети всех случаев бесплодие имеет сочетанный характер [4]. Мужская инфертильность может быть вызвана различными факторами: аномалии половых органов (крипотрхизм 8,4%); варикоцеле (14,8%); нарушения эрекции/эякуляции (2,4%); урогенитальные инфекции (9,3%); обструкции семявыносящих путей (2,2%); заболевания эндокринной системы (гипогонадизм – 10,1%); иммунологические и генетические отклонения (3,9%); новообразования мужских половых органов и повреждения сперматогенного эпителия, вызванные облучением, химиотерапией (7,8%); системные заболевания (2,2%); вредные привычки; высокая температура; отравление токсическими веществами; нередко прием лекарственных препаратов.
Особое внимание следует уделять молодым мужчинам, использующим разнообразные пищевые добавки, содержащие тестостерон, а также применение анаболических андрогенных стероидов, которые способствует росту распространенности гипогонадизма среди молодых мужчин. Использование анаболических стероидов нарушают механизмы эндогенной регуляции продукции тестостерона, оказывая негативное влияние на функциональные взаимоотношения гипоталамо-гипофизарногонадной системы, что приводит к нарушениям сперматогенеза и азооспермии [5]. Проведенный M.R. Gazvani и соавт. мета-анализ, в котором оценивалась причинноследственная связь между приемом анаболических андрогенных стероидов и развитием гипогонадизма, достоверно показал, что симптомы гипогонадизма (включая депрессию, потерю либидо, эректильнуюя дисфункцию и усталость) развиваются вследствие применения стероидов, причем выраженность и скорость наступления симптомов зависели от дозы, продолжительности приема и химической структуры препаратов [6]. У таких пациентов отмечалось улучшение общей и прогрессивной подвижности сперматозоидов через 20 месяцев после отмены стероидных препаратов [7].
Роль генетических причин в патогенезе нарушения созревания сперматозоидов, по некоторым данным достигает 30% и может сравниться с частотой идиопатического бесплодия [8]. Количество генов, участвующих в мужской репродукции, приближается к 3000, что исключает на данный момент какую-либо возможность их рутинного скрининга [9]. Самыми распространенными генетическими нарушениями, вызывающими мужское бесплодие, выявление которых возможно врачебной практикой, являются хромосомные (например, синдром Клайнфельтера – кариотип 47 XXX) и структурные перестройки (инверсии, транслокации, делеции AZF региона Yхромосомы), мутации гена CFTR.
Целостность цепочки ДНК сперматозоидов (тест на фрагментацию ДНК) на данный момент рассматривается как один из основополагающих факторов нормального развития беременности [2]. Причиной повышенного уровня фрагментации могут быть как внутренние факторы, такие как мутации генов, влияющие на компактизацию молекулы ДНК, так и внешние факторы: радиация, повышенная температура, окислительный стресс, курение, варикоцеле, эндокринные нарушения. Распространенность повышенного уровня фрагментации ДНК сперматозоидов достигает 8% [8].
Определение антиспермальных антител целесообразно проводить во всех случаях субфертильных показателей эякулята и выявлении признаков агглютинации сперматозоидов. Наиболее распространенным методом выявления иммунобиологического бесплодия является непрямой MAR-тест – смешанная антиглобулиновая реакция (mixed antiglobulin reaction) [1].
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Проведен ретроспективный анализ 50 амбулаторных карт пациентов мужского пола в возрасте 25-55 лет с диагностированным мужским фактором бесплодия, находившихся на обследовании и лечении в ООО «Медицинская клиника «Ваш Доктор», г. Симферополь в период с 01.01.2014 по 31.12.2018 гг. Критерием включения в данное исследование являлись изменения в показателях спермограммы в сочетании с невозможностью зачатия в браке в течение 12 мес. и более при условии репродуктивного здоровья супруги (изолированный мужской фактор бесплодия).
Оценивались данные анамнеза (возраст, длительность брака и бесплодия в данном браке, первичное/ вторичное бесплодие), проводился общий физикальный и специальный осмотры, лабораторные исследования: показатели спермограммы, наличие инфекций, передающихся половым путем, гормональный профиль, генетические и иммунологические данные.
Возраст мужчин колебался в пределах 25-55 лет, средний значение – 36,0±0,7, при этом Ме=36, Мо=41 (в возрасте 25- 29 лет было 18 (36%) пациентов, 30-35 лет – 16 (32%), 36-40 лет 9 (18%) и 41-55 лет – 7 (14%) мужчин).
Установлено, что все мужчины находились в зарегистрированном браке (100%), среди которых первый отмечен у 42 мужчин (84%), во второй – у 8 (16%). Продолжительность брака варьировала в диапазоне от 2-х до 12 – и лет, и в среднем составила 6,2±0,5 года.
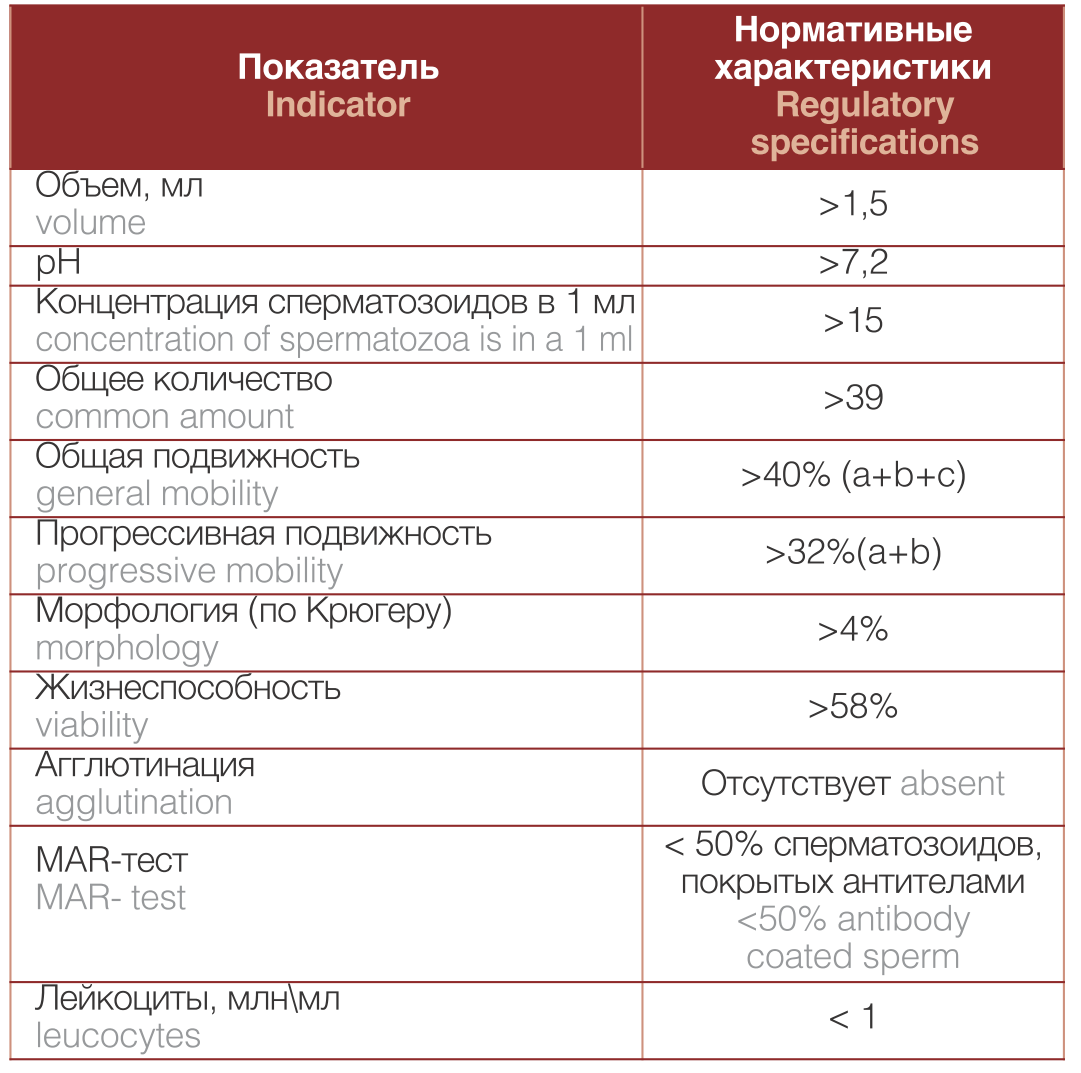
Образец эякулята получали путем семяизвержения в чистый, с широким горлышком специальный контейнер для сбора жидких биологических жидкостей, проверенного на нетоксичность для сперматозоидов. Контейнер предварительно находился в термостате при температуре 370 С, чтобы избежать резких перепадов, которые могли повредить спермаозоиды после эякуляции. Контейнер маркировался (лично или в присутствии пациента): Фамилия И.О., № амбулаторной карты, дата и временя сбора образца. В 2010 г. ВОЗ внесла новые изменения в референсные значения показателей эякулята и изменила методику его обработки исследования [10] (табл. 1).
Таблица 1. Референсные показатели спермограммы у здоровых мужчин (ВОЗ, 2010 г.)
Table 1. Reference sperm parameters in healthy men (WHO, 2010)
Статистическая обработка данных проведена при помощи программы SPSS Statistics 6,0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Чаще всего диагностировалось первичное бесплодие – у 40 пациентов (80%), в то время как вторичное отмечалось у 10 (20%). В данном браке все супружеские пары детей не имели. На наличие детей в предыдущих браках указали 3 (6%) пациента, что свидетельствовало о вторичном (приобретенном) характере мужского бесплодия у них. 39 (78%) супружеских пар до обращения в клинику вспомогательных репродуктивных технологий (ВРТ) с проблемами бесплодия проходили обследование и лечение в других лечебных учреждениях. 43 (86%) мужчины длительно лечились у урологов по поводу хронического простатита, 9 (18%) в анамнезе выполнено оперативное лечение по поводу варикоцеле.
Основным первичным исследованием мужчины с бесплодием являлся анализ спермы. При выявлении патологических изменений в спермограмме мы выполняли повторное исследование с интервалом от 2 до 3 недель при условии полового воздержания не менее 2 и не более 7 дней.
У всех 50 пациентов эякулят имел низкую фертильность и был непригоден для естественного оплодотворения (при повторном исследовании через 2-3 недели результаты коррелировали с первоначальными). Были выявлены сл. отклонения:
- тератозооспермия (морфология сперматозоидов ниже нормативного значения) – 46 (92%);
- астенозооспермия (подвижность сперматозоидов ниже нормального значения) – 24 (48%);
- олигозооспермия (концентрация сперматозоидов ниже нормального значения) – 34 (68%);
- нормозооспермия (концентрация сперматозоидов на уровне нормальных значений) 7 (14%);
- лейкоспермия – 4 (8%);
- некроспермия – 2 (1%);
- аспермия – 4 (8%);
- акинозооспермия (полная неподвижность сперматозоидов 3 (6%);
- криптозооспермия (отсутствие сперматозоидов в эякуляте, но обнаруживаемые после центрифугирования) – 2 (4%);
- гемозооспермия (присутствие эритроцитов в эякуляте) – 2 (4%).
Несоответствие числа патоспермии и общего количества обследованных связано с наличием одновременно нескольких патологических показателей у пациентов, например «астенотератозооспермия» и «олигоастенотератозооспермия» и.т.п. В данной группе пациентов изменение одного показателя отмечено в 2 случаях (1 – олигозооспермия, 1 – тератозооспермия), одновременно от 2 до 3 – в 42 образцах (84%), 4 и более – в 6 образцах (12%).
После получения аномальных показателей эякулята дальнейшее обследование мужчины с бесплодием строилось по индивидуальному плану в зависимости от результатов спермограммы и данных лабораторного и физикального обследования, основываясь на комплексной оценке состояния мужской репродуктивной и эндокринной систем, для выявления потенциально возможных причин ненаступления беременности в паре.
В диагностике причин мужской инфертильности уделили особое внимание оценке функции желез внутренней секреции. Гормональное обследование (общий тестостерон, лютеинизирующий гормон (ЛГ), фолликулстимулирующий гормон (ФСГ), пролактин, тиреотропный гормон (ТТГ), витамин D) проводилось у всех пациентов. Прогностическим признаком курабельности выявленных нарушений спермограммы являлся уровень ФСГ, который позволил провести дифференциальную диагностику между обструктивной (экскреторной) и необструктивной (секреторной) формами бесплодия. Нормальный уровень ФСГ являлся критерием сохранности сперматогенной функции яичек. Высокий уровень ФСГ крови свидетельствовал о необратимых нарушениях репродуктивной системы. Если повышенный уровень ФСГ сопровождался повышением уровня ЛГ, мы ставили диагноз гипергонадотропный гипогонадизм и наша медикаментозная терапия оказалась практически бесперспективной.
При оценке результатов гормонального профиля у обследованных мужчин были получены следующие показатели: у 36 (72%) мужчин показатели находились в пределах нормы, средние значения ФСГ составили – 6,5±1,3 мМЕд/мл, ЛГ – 4,84±0,6 мМЕд/мл, пролактина – 230,5±28,0 мМе/л. У 26 (52%) пациентов отмечено снижение уровня тестостерона, среднее значение – 7,5± 2,8 нмоль/л, у этих пациентов ИМТ превышал 25 ед. Повышение ФСГ и ЛГ выявлено у 10 (20%) пациентов, что свидетельствовало о гипергонадотропном гипогонадизме. Повышение уровня пролактина отмечено у 9 (18%) пациентов. Низкие уровни ФСГ, ЛГ выявлены у 4 (8%) пациентов, что свидетельствовало о гипогонадотропном состоянии, которое успешно коррегировано гормональной терапией. Низкий уровень витамина D выявлен у 12 (24%) пациентов, у них же отмечено снижение как подвижности, так и количества морфологически нормальных форм сперматозоидов.
Как правило, у одного пациента наблюдались изменения сразу нескольких гормональных показателей.
Трое (6%) мужчин (один – профессиональный спортсмен и 2 – активно занимались в спортивном зале на силовых тренажерах) использовали анаболические пищевые добавки. У всех выявлены признаки гипогонадизма с резко выраженной олигозооспермией, наряду с уменьшением объема тестикул имелись нарушения гормонального гомеостаза. Отмена БАДов и курсовое применение человеческих менопаузальных гонадотропинов (ЧМГ) позволило улучшить показатели ФСГ, ЛГ и сывороточного тестостерона и улучшить сперматогенез, что подтверждено в литературе [11].
В 25-30% случаев мужского бесплодия нельзя выявить явную причину, такие состояния относятся к идиопатическому бесплодию. Это привлекло наше внимание к изучению влияния неправильного образа жизни, в частности повышенному индексу массы тела (ИМТ) и ассоциированных с ним метаболических и гормональных нарушений. В нашем исследовании из 50 обследованных мужчин 29 имели повышенный ИМТ: у 21 он был 25-29 и у 8 человек – больше 30 Показатели спермограммы у этих больных соответствовали олигоастенотератозооспермии. Дополнительным простым методом диагностики вероятного гипогонадизма у мужчин служило измерение окружности живота/талии (ОЖ). Частота гипогонадизма при ожирении у мужчин с ОЖ ≥ 94 см была 94%, с ОЖ > 102 см составила 98%. Проведенное дополнительное физикальное и биохимическое обследование выявило у них гипертриглицеридемию (низкие уровни холестерина липопротеидов высокой плотности), повышенное АД, повышение содержания глюкозы в плазме крови натощак. Это позволили в 100% случаев диагностировать гипогонадизм в исследуемой группе с ожирением. Повышенный вес приводит к уменьшению объема эякулята и повышению уровня фрагментации ДНК сперматозоидов [6], а дислипидемия, системный оксидантный стресс (инсулинорезистентность) и состояние хронического воспаления приводят к увеличению активных форм кислорода в эякуляте с последующим повреждением мембран сперматозоидов [12].
В ходе исследования оценивалось влияние профессиональных факторов вредности условий труда: 9 (18%) пациентов подвергались воздействию химически неблагоприятных факторов, 35 (70%) мужчин работали в сфере обслуживания (программисты, таксисты, офисные работники и т. д.) и имели малоподвижный образ жизни, вызывающий застойные явления в органах малого таза. Это, возможно, явилось причиной нарушения сперматогенеза при отсутствии других явных изменений. Только у 6 (12%) обследованных профессия соответствовала активному образу жизни. Вредные привычки отмечены у 36 (72%) мужчин: алкогольные напитки употребляли 19 (38), курение сигарет – 22 (44%).
Эпидемический паротит перенесли в детстве 2 (4%) пациента.
Кариотипирование подтвердило наличие нормального мужского кариотипа 46ХУ у 49 (98%) пациентов, в 1 случае выявлен синдром Клайнфельтера (47 ХХY). В 1 случае выявлен синдром тотальной глобозооспермии (при исследовании эякулята у 100% сперматозоидов отсутствовала акросома, которая нужны для растворения оболочки яйцеклетки при оплодотворении).
Своевременная диагностика заболеваний мужской половой сферы играет ключевую роль в успешном лечении бесплодия. У 35 (70%) исследованных мужчин отмечен хронический простатит у 21 (42%) – варикоцеле, у 7 (14%) – кисты придатков яичек, у 3 (6%) – доброкачественная гиперплазия предстательной железы. Оперативное лечение варикоцеле проведено у 5 (10%) пациентов из 42% мужчин с данным заболеванием. Всем пациентам произведен забор уретрального материала для исключения заболеваний, передающихся половым путем. Полимеразной цепной реакцией (ПЦР) были выявлены инфекции мочеполового тракта: микоплазмоз – 3 (6%), уреаплазмоз – 12 (24%), гарднереллез – 5 (10%), трихомониаз – 2 (4%), хламидиоз – 1 (2%).
Проведенное ультразвуковое исследование предстательной железы и органов мошонки выявило наличие патологических изменений предстательной железы у 36 (72%) пациентов, и органов мошонки – у 23 (46%).
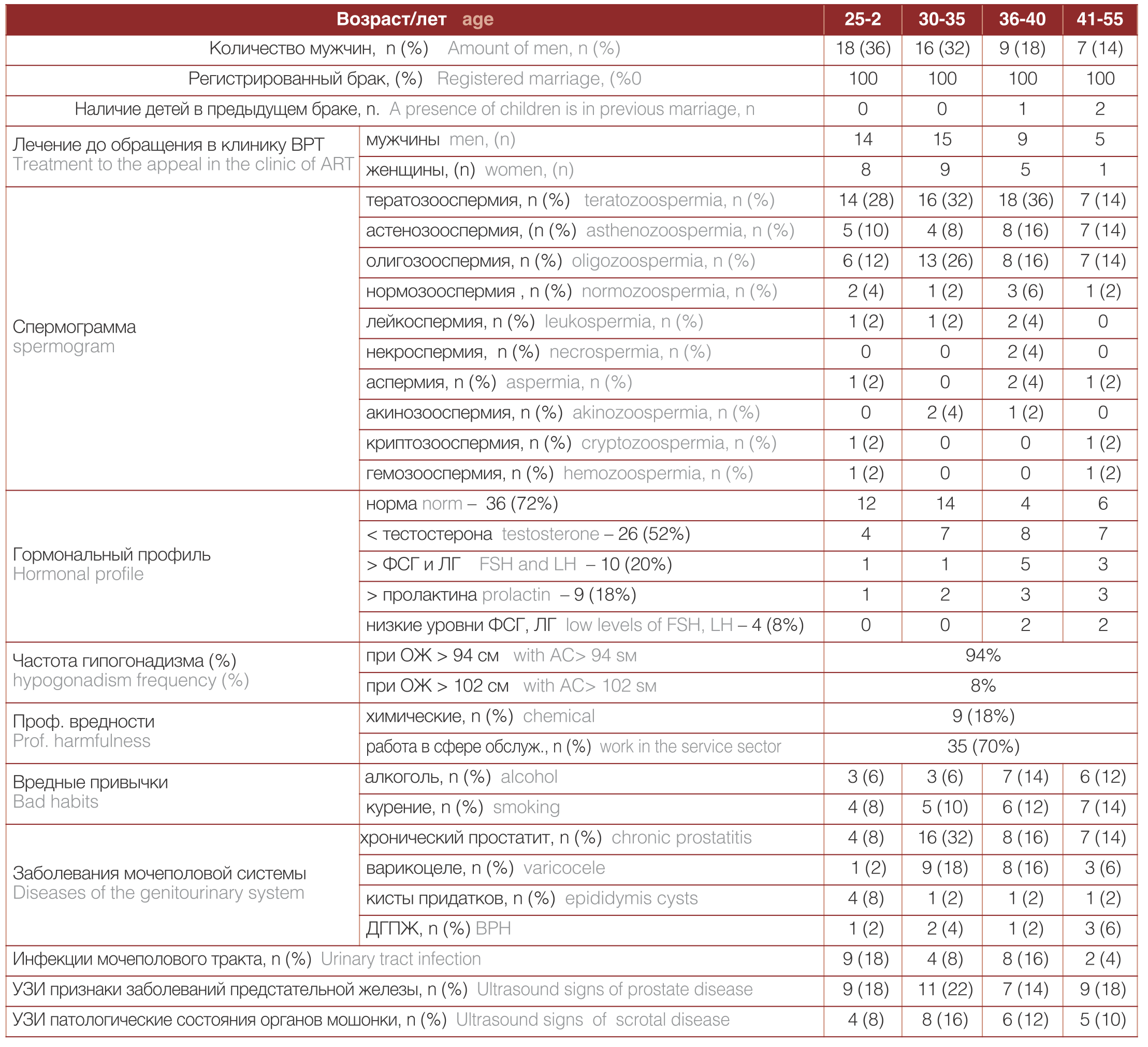
В таблице 2 представлены основные данные обследования мужчин с бесплодием.
Таблица 2. Результаты обследования мужчин с бесплодием
Table 2. Examination results for men with infertility
ЗАКЛЮЧЕНИЕ
Проведенное нами исследование показало, что первичное бесплодие у мужчин диагностировалось чаще вторичного. При оценке спермограммы у всех пациентов эякулят имел низкую фертильность и был непригоден для естественного оплодотворения. Гормональное обследование диагностировало гипергонадотропный гипогонадизм, гипогонадотропный гипогонадизм, частота встречаемости которого прямо пропорциональна степени ожирения у мужчин; пролактинемию. Среди заболеваний мужской половой сферы наиболее часто встречались хронический простатит и варикоцеле. В большинстве случаев профессиональная деятельность мужчин была связана с малоподвижным образом жизни и воздействием неблагоприятных профессиональных факторов.
При обращении супружеской пары с проблемой бесплодия к врачам акушерам-гинекологам, урологам, андрологам необходимо уделять внимание обследованию обоих супругов в соответствии с приказом № 107н МЗ РФ и соблюдению сроков для установления причин бесплодия (3 – 6 месяцев). Направление пациентов в специализированные клиники ВРТ должно проводиться, если назначенная терапия признается неэффективной (отсутствие беременности в течение 9 – 12 месяцев).
ЛИТЕРАТУРА
- Архангельский В. Н., Божевольнов Ю. В., Зверева Н. В., Зинькина Ю. В., Коротаев А. В., Малков А. С., и др. Через 10 лет будет поздно. Демографическая политика Российской Федерации: вызовы и сценарии. URL: https://publications.hse.ru/ mirror/pubs/share/folder/g97fsn8h9z/direct/134970807 [Arkhangel'skiy V.N., Bozhevol'nov YU. V., Zvereva N. V., Zin'kina YU. V., Korotayev A. V., Malkov A. S., i dr. In 10 years it will be too late. Demographic policy of the Russian Federation: challenges and scenarios. URL: https://publications.hse.ru/mirror/pubs/ share/folder/g97fsn8h9z/direct/134970807 (In Russian)]
- Jungwirth A, Diemer T, Kopa Z, Krausz C, Minhas S, Tournaye H. EAU Guidelines on Male Infertility. URL: https://uroweb.org/wp-content/uploads/EAU-Guidelines-onMale-Infertility-2018-large-text.pdf
- Li C, Zhou X. Gene transcripts in spermatozoa: markers of male infertility. Clin Chim Acta 2012;413(13-14):1035-8. doi: 10.1016/j.cca.2012.03.002
- Rahnema CD, Lipshultz LI, Crosnoe LE, Kovac JR, Kim ED. Anabolic steroid–induced hypogonadism: diagnosis and treatment. Fertil Steril 2014;101(5):1271-9. doi: 10.1016/ j.fertnstert.2014.02.002.
- Boivin J, Bunting L, Collins JA, Nygren KG. International estimates of infertility prevalence and treatment-seeking: potential need and demand for infertility medical care. Human Reprod 2007;22:1506-12. doi: 10.1093/humrep/dem046
- Chavarro JE, Toth TL, Wright DL, Meeker JD, Hauser R. Body mass index in relation to semen quality, sperm DNA integrity, and serum reprodactiv hormone levels among men attending an infertility clinic. Fertil Steril 2010;93(7):2222-31. doi: 10.1016/ j.fertnstert.2009.01.100
- Gazvani MR, Buckett W, Luckas MJ, Aird IA, Hipkin LJ, Lewis-Jones DI. Conservative management of azoospermia following steroid abuse. Hum Reprod 1997;12(8):1706-8. doi: 10.1093/humrep/12.8.1706
- Ramasamy R, Armstrong JM, Lipshultz LI. Preserving fertility in the hypogonadal patient: an update. Asian J Androl 2015;17(2):197-200. doi: 10.4103/1008-682X.142772.
- Kasturi SS, Tannir J, Brannigan RE. e metabolic syndrome and male infertility. J Androl 2008;29(3):251-9. doi: 10.2164/jandrol.107.003731
- The Practice Committee of the American Socity for Reproductive Madicine. Diagnostic evaluation of the infertile male: a committee opinion. Fertil Steril 2012 Aug;98(2):294-301. doi: 10.1016/j.fertnstert.2012.05.033
- Rowe PJ, Comhaire FH, Hargreave TB, Mahmoud AM. WHO manual for the standardized investigation and diagnosis of the infertile couple. Cambridge: Cambridge University Press: 2000, 91p.
- Xing W, Krishnamurthy H, Sairam MR. Role of follitropin receptor signaling in nuclear proyein transitions and chromatin condensation during spermatogenesis. Biochem Biophys Res Commun 2003;312(3):697-701. doi: 10.1016/ j.bbrc.2003.10.177
Статья опубликована в журнале "Экспериментальная и клиническая урология" №4 2019, стр. 68-73













Комментарии