С.А. Репина1, 2, С.А. Красовский3 , Р.В. Роживанов4 , Т.М. Сорокина1 , Л.В. Шилейко1 , М.И. Штаут1 , Л.Ф. Курило1 , Г.В. Шмарина1 , Т.А. Адян1, 2, Н.Ю. Каширская1 , А.В. Поляков1 , В.Б. Черных1, 2
1 ФГБНУ «Медико-генетический научный центр»; Россия, 115522 Москва, ул. Москворечье, 1;2 кафедра молекулярной генетики и клеточной генетики ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России; Россия, 117437 Москва, ул. Островитянова, 1
3 ФГБУ Научно-исследовательский институт пульмонологии ФМБА России; Россия, 115682 Москва, Ореховый бульвар, 28;
4 ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России; Россия, 117036 Москва, ул. Дмитрия Ульянова, 11 Контакты: Вячеслав Борисович Черных chernykh@med-gen.ru
Введение
Мутации гена CFTR (cystic fibrosis transmembrane conductance regulator) – один из наиболее частых генетических факторов мужского бесплодия [1–3]. Наличие 2 мутаций приводит к развитию муковисцидоза или ассоциированных заболеваний (CFTR-патий): врожденной двусторонней аплазии семявыносящих протоков (congenital bilateral aplasia of vas deferens, CBAVD), изолированной обструктивной азооспермии, хронического панкреатита, диссеминированных бронхоэктазов. Выделяют легочную и смешанную (с панкреатической недостаточностью) формы муковисцидоза. У 97–98 % мужчин с муковисцидозом и у всех пациентов с синдромом CBAVD наблюдается бесплодие вследствие обструктивной азооспермии [3–5].
Ген CFTR располагается на хромосоме 7 (локус 7q31.2), имеет размер около 250 т. п. н. и состоит из 27 экзонов [1, 4, 6]. Белок цАМФ-зависимого хлорного канала, кодируемый данным геном, участвует в регуляции трансмембранного транспорта хлора, натрия, бикарбоната и других ионов [4, 6]. Хлорный канал располагается на апикальной поверхности мембраны эпителиальных клеток и состоит из 2 АТФ-гидролитических (нуклеотид-связывающих) доменов, регуляторного домена и 2 трансмембранных доменов. Причиной нарушения работы хлорного канала являются мутации или сочетания полиморфизмов (комплексные аллели) в гене CFTR [1]. В зависимости от степени нарушения продукции/функционирования белка CFTR мутации в гене CFTR подразделяют на «тяжелые» и «мягкие». Для легочной формы муковисцидоза характерны генотипы с наличием 1 или 2 «мягких» CFTR-мутаций. Для смешанной формы характерно наличие 2 «тяжелых» мутаций [1, 7].
Нарушение фертильности у большинства мужчин с муковисцидозом возникает в результате нарушения проходимости семявыносящих путей вследствие аплазии семявыносящих протоков, семенных пузырьков, эпидидимиса [3]. Семявыносящие протоки имеют наибольшую чувствительность к снижению доли функционального белка хлорного канала, кодируемого геном CFTR, поэтому поражаются в первую очередь по сравнению с другими органами и тканями-мишенями для данного гена [1]. Нарушение фертильности у мужчин без муковисцидоза/CBAVD, имеющих мутации гена CFTR, чаще подразумевает патозооспермию, сниженное количество сперматозоидов и их худшие свойства [1, 8–10].
Цель исследования – изучить влияние генотипа по гену CFTR, клинической формы муковисцидоза и возраста на мужскую репродуктивную систему и фертильность, гормональные и спермиологические показатели.
Материалы и методы
Обследован 71 российский мужчина с муковисцидозом. Возраст пациентов составил от 17 до 39 лет (в среднем 24,9 ± 5,3 года). Пациенты были разделены на 2 группы: с легочной (n = 34) и смешанной (n = 37) формами заболевания, в зависимости от сохранности функции поджелудочной железы.
Все пациенты дали добровольное информированное согласие на участие в исследовании, которое одобрено локальным этическим комитетом Российского национального исследовательского медицинского университета им. Н.И. Пирогова.
Выполнены анамнестическое и генеалогическое исследование, осмотр, ультразвуковое исследование (УЗИ) органов мошонки, стандартное и биохимическое спермиологическое исследование и анализ уровня гормонов (тестостерона) в сыворотке крови.
УЗИ проводили на аппарате Aloka ProSound SSD-α 10 (Hitachi Aloka, Япония) с использованием линейного датчика с частотой 10 МГц.
Результаты стандартного спермиологического исследования и биохимического анализа эякулята (на уровень фруктозы, лимонной кислоты, α-гликозидазы) оценивали согласно рекомендациям и нормативам Руководства Всемирной организации здравоохранения (2010) [11]. Использовали коммерческие диагностические наборы: для лимонной кислоты – FertiPro Citric Acid Test, для фруктозы – FertiPro Fructose Test, для нейтральной α-глюкозидазы – EpiScreen Plus Neutral Alpha-Glucosidase, исследование проводили в соответствии с протоколами производителя (FertiPro NV, Бельгия). В качестве референсных значений использованы данные T.G. Cooper и соавт.: уровень фруктозы в семенной жидкости – 13 мкмоль (2,4 мг в эякуляте), лимонной кислоты – 2,4 мкмоль (10 мг в эякуляте) и нейтральной α-глюкозидазы (20 мME в эякуляте) [12].
Концентрацию тестостерона определяли на автоматическом анализаторе Vitros ECi (Johnson & Johnson, Великобритания) методом усиленной хемилюминесценции. Уровень общего тестостерона исследовали в 3 аликвотах сыворотки крови. Кровь забирали в пробирки типа «вакутейнер» в утреннее время натощак из локтевой вены. Гипогонадизм диагностировали при уровне общего тестостерона крови менее 12 нмоль/л [13].
Молекулярно-генетическое исследование проведено на геномной ДНК, выделенной из лейкоцитов периферической крови. Анализировали наличие 30 частых мутаций в гене CFTR. Для регистрации точечных мутаций использовали метод мультиплексного аллельспецифичного лигирования с последующей амплификацией (multiplex ligation probe-depended amplification); небольшие инсерционно-делеционные мутации определяли методом анализа полиморфизма длин амплифицированных фрагментов (amplified fragment length polymorphism), и в случае необнаружения мутации выполняли секвенирование ДНК по Сэнгеру.
Статистический анализ результатов осуществляли с помощью программы StatSoft Statistica 8.0 (Dell Technologies, США). Сравнение данных проводили, применяя точный критерий Фишера и критерий Манна– Уитни. Статистически значимыми считали различия при уровне вероятности p <0,05.
Результаты
В зарегистрированном или гражданском браке состоял 31 из 71 (43,7 %) мужчины с муковисцидозом. Из анамнеза известно, что у 2 пациентов фертильность ранее была сохранена (беременность супруг в анамнезе). У 3 пациентов с легочной формой муковисцидоза, имевших азооспермию, после успешной тестикулярной биопсии и прохождения программ экстракорпорального оплодотворения (ЭКО), использующих технологию интрацитоплазматической инъекции сперматозоида (intracytoplasmic sperm injection, ICSI), у супруг наступила беременность и родились здоровые дети.
У всех пациентов развитие половых органов соответствовало возрасту и полу. У 21 % пациентов в анамнезе были паховая грыжа (n = 9), варикоцеле (n = 4), гидроцеле (n = 2), крипторхизм (n = 1), перекрут яичка (n = 1); 6 пациентов с паховой грыжей имели смешанную форму муковисцидоза. Средний возраст наступления пубертата составил 15,0 ± 1,8 года (у пациентов с легочной формой – 14,6 ± 0,8 года; со смешанной формой – 15,4 ± 1,7 года). Пубертат был поздним (позже 14 лет) у 54 % пациентов – у 43 % (n = 6) пациентов с легочной формой и у 65 % (n = 17) со смешанной формой муковисцидоза.
УЗИ органов мошонки проведено у 35 пациентов. Средний объем яичек составил 27,4 ± 7,8 см3 (левое яичко – 13,0 ± 4,0 см3 ; правое – 14,4 ± 4,3 см3 ) (рис. 1). Односторонняя или двусторонняя гипоплазия яичек выявлена у 40,5 % пациентов с муковисцидозом, немного чаще у пациентов со смешанной формой, чем с легочной – 41,7 % против 38,5 % (см. таблицу). Морфологические изменения отмечены у 62 % пациентов. Диффузные изменения эпидидимиса и кисты эпидидимиса и/или яичек обнаружены у 33,3 и 23,0 % соответственно; у 11,4 % пациентов присутствовали оба изменения. У пациентов со смешанной формой чаще, чем у больных с легочной формой (66,7 % против 53,9 %) обнаружены диффузные изменения придатков, кисты яичек или придатков яичек. У 2 мужчин (у 1 с легочной и у 1 со смешанной формой муковисцидоза) при обследовании выявлены объемные образования яичек. При дополнительном андрологическом обследовании (магнитно-резонансная томография (МРТ) органов мошонки, анализ наличия онкомаркеров: лактатдегидрогеназы, хорионического гонадотропина человека, альфа-фетопротеина) данных, указывающих на наличие новообразований тестикул, не получено (результаты исследования не приведены).
Изменения мужских половых органов, выявленные при ультразвуковом исследовании у пациентов с легочной и смешанной формой муковисцидоза
| Структурные изменения | Число пациентов, % | |
| c легочной формой, n = 13 | со смешанной формой, n = 24 | |
| со смешанной формой, n = 24 | 38,5 | 41,7 |
| Диффузные изменения придатков яичек | 23,0 | 33,3 |
| Кисты эпидидимиса и/или яичек | 15,4 | 25,0 |
| Диффузные изменения придатков яичек + кисты эпидидимиса и/или яичек | 15,4 | 8,3 |
Стандартное спермиологическое исследование выполнено у 69 пациентов; из них у 5 – двукратно (у 3 с легочной формой и у 2 со смешанной); 2 пациента со смешанной формой муковисцидоза не смогли сдать эякулят.
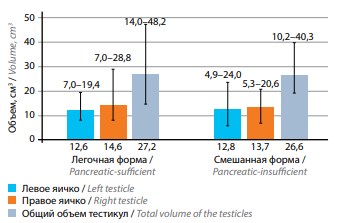
Рис. 1. Объем тестикул у мужчин с легочной и смешанной формами муковисцидоза. Результаты представлены в виде средних значений с указанием диапазона (минимальное – максимальное значение)
Олигоспермия и азооспермия/криптозооспермия выявлены соответственно в 80 и 88,4 % образцов эякулята. Олиго-/астенозооспермия и нормозооспермия обнаружены соответственно у 7 и 1 пациента; все они имели легочную форму муковисцидоза. Азооспермия и криптозооспермия зафиксированы соответственно у 26 (78,8 %) пациентов с легочной и у 33 (100 %) с легочно-кишечной формой. Олигоспермия обнаружена соответственно в 76,7 и 100 % образцов данных групп. Выявлено статистически значимое различие встречаемости азооспермии/криптозооспермии и олигоспермии у пациентов с разными формами муковисцидоза (p = 0,002). Таким образом, установлено, что частота сохранения проходимости семявыносящих путей зависела от клинической формы заболевания.
«Мягкие» формы патозооспермии (n = 7) или нормозооспермия (n = 1) выявлены у 8 из 14 пациентов с мутацией 3849+10kbС>T, характерной для легочной формы муковисцидоза. Данная мутация обнаружена у 9,8 % пациентов с обструкцией семявыносящих путей и у 100 % пациентов без обструкции (рис. 2). У 2 мужчин с мутацией 3849+10kbС>T беременность супруги в анамнезе наступила естественным путем, 1 беременность закончилась родами, а 2-я прервана медицинским абортом по желанию.
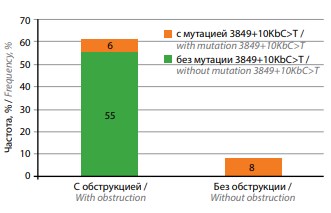
Рис. 2. Частота обструкции семявыносящих протоков у пациентов с муковисцидозом, имеющих и не имеющих мутацию 3849+10kbC>T (p <0,0001). Расчет выполнен на группе из 69 пациентов, поскольку у 2 пациентов эякулят не получен
Частота сохранения проходимости и наличия двусторонней обструкции vas deferens зависела от возраста пациентов (рис. 3). Среди пациентов в возрасте от 17 до 24 лет (n = 36) «мягкие» формы патозооспермии выявлены у 4 (11,4 %), нормальный объем эякулята – у 8 (22,9 %). Среди пациентов в возрасте 25 лет и старше (n = 32) «мягкие» формы патозооспермии диагностированы у 3 (9,7 %), нормальный объем эякулята – у 4 (12,9 %).
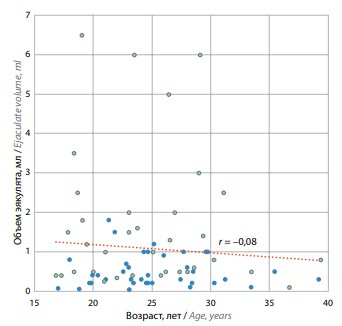
Рис. 3. Объем эякулята у пациентов с муковисцидозом разного возраста. Желтым цветом обозначены показатели пациентов с легочной формой муковисцидоза, голубым – со смешанной формой
Изменения в показателях спермограммы у повторно сдавших эякулят (с интервалом 1–5 лет) позволили констатировать ухудшение показателей эякулята, у 2 из 5 пациентов – уменьшение объема (олигоспермию). У 2 мужчин с мутацией 3849+10kbC>T, у которых диагностирована азооспермия, в анамнезе отмечена беременность супруги.
Биохимическое исследование семенной жидкости выполнено у 27 пациентов. Снижение уровня фруктозы обнаружено в 26 (96 %) из 27 образцов, нейтральной α-глюкозидазы – в 16 (73 %) из 22, цитрата – в 8 (50 %) из 16. Это указывает на непроходимость семявыносящих протоков, аплазию или гипоплазию семенных пузырьков и нарушение секреции предстательной железы умужчин смуковисцидозом. Наблюдали выраженное снижение уровня фруктозы у пациентов со смешанной формой муковисцидоза. У остальных мужчин биохимическое исследование эякулята не выполнено вследствие недоступности биологического материала или малого объема эякулята.
Уровень общего тестостерона в сыворотке крови определен у 32 пациентов. Средний уровень тестостерона составил 19,1 ± 5,7 нмоль/л (норма 12,0–33,3 нмоль/л). Снижение этого показателя имело место в 3 (9,7 %) случаях (у 1 мужчины с легочной формой муковисцидоза и у 2 со смешанной); из них двусторонняя гипоплазия тестикул отмечена у обоих пациентов со смешанной формой муковисцидоза и не отмечена у пациента с легочной формой.
Обсуждение
Результаты представленного и предыдущих исследований [1, 14, 15] свидетельствуют о том, что мутации в гене CFTR не влияют на дифференцировку пола и внутриутробное развитие половых органов. У мужчин с муковисцидозом наблюдается не отсутствие, а аплазия семявыносящих протоков. Наличие единичных сперматозоидов в эякуляте может свидетельствовать о неполном нарушении проходимости семявыносящих путей, а прогрессирование поражения семявыносящих протоков и семенных пузырьков с возрастом требует дальнейшего исследования патогенетических механизмов обструкции примуковисцидозе и синдроме CBAVD.
Очевидно, что на фертильность у мужчин с муковисцидозом оказывает влияние не только отсутствие или выраженное снижение количества нормального белка CFTR, но и сопутствующая антибиотикотерапия, низкий индекс массы тела и другие генетические и средовые факторы. Негативное воздействие муковисцидоза на половую систему у мальчиков-подростков с муковисцидозом проявляется и задержкой полового созревания в среднем на 1–1,5 года. Однако задержка полового созревания наблюдается не у всех и зависит от формы муковисцидоза и генотипа. Поздний пубертат более характерен для пациентов со смешанной формой муковисцидоза и низким индексом массы тела, поскольку при гипотрофии метаболизм стероидных гормонов замедляется. По результатам УЗИ органов мошонки и малого таза, выполненного у мальчиков с муковисцидозом в возрасте от 2 до 12 лет, семенные пузырьки выявлены у 5 из 12 пациентов (у 8 из 16 в контроле), в то время как двустороннюю аплазию/гипоплазию семявыносящих протоков и семенных пузырьков диагностируют более чем у 98 % взрослых мужчин с муковисцидозом [14].
Нами выявлена статистически значимая зависимость состояния репродуктивной системы от формы муковисцидоза, генотипа, возраста пациентов. Наличие в генотипе 2 «тяжелых» CFTR-мутаций («тяжелого» генотипа), смешанная форма муковисцидоза являются неблагоприятными прогностическими признаками в отношении обструкции семявыносящих путей и повышения частоты морфологических изменений органов мошонки. Легочная форма муковисцидоза, молодой возраст, наличие мутации 3849+10kbС>T – благоприятные факторы для сохранения проходимости семявыносящих путей и фертильности у мужчин с муковисцидозом.
В других исследованиях также отмечены тестикулярный микролитиаз у пациентов со смешанной формой муковисцидоза (в 4 из 18 тестикул у 12 мальчиков), наличие кист, гипо- или гиперэхогенность головки эпидидимиса (при смешанной форме – в 5 из 18 тестикул, при легочной форме – в 1 из 6) [14]. При клиническом обследовании 25 мужчин с муковисцидозом установлены характерные андрологические нарушения: отсутствие хвоста эпидидимиса и семявыносящих протоков, азооспермия, олигоспермия и низкий pH, низкие показатели маркеров семенных пузырьков и придатка яичка, при этом отмечен нормальный объем тестикул [16]. Авторы не выявили взаимосвязь между характеристикой эякулята и генотипом, зарегистрировали нормальные показатели секреторной функции предстательной железы (уровень лимонной кислоты). У обследованных нами пациентов с муковисцидозом также обнаружены характерные УЗИ-признаки нарушения проходимости семявыносящих путей и секреторной функции придаточных половых желез (гипоплазия яичек, диффузные изменения придатков яичек, кисты придатков и/или яичек), спермиологических показателей (азооспермия, олигоспермия, низкий pH), биохимических показателей семенной жидкости (низкий уровень фруктозы), эпидидимиса (низкий уровень α-глюкозидазы) и предстательной железы (низкий уровень лимонной кислоты) [17, 18].
Мутация 3849+10kbC>T относится к «мягким» мутациям гена CFTR. У носителей и компаунд-гетерозигот по данной мутации в сочетании с «тяжелой» мутацией могут быть сохранены проходимость семявыносящих путей и репродуктивная функция [1, 7]. У большинства обследованных нами носителей мутации 3849+10kbC>T также сохранена проходимость семявыносящих путей.
Возрастной фактор негативно влияет на состояние репродуктивной системы многих пациентов с нарушением фертильности, в том числе мужчин с муковисцидозом. Так, у более молодых чаще наблюдаются мягкие формы патозооспермии и сохранный объем эякулята, свидетельствующие о проходимости семявыносящих путей и нормальной секреторной функции половых желез. Негативные изменения в спермограмме указывают на возможное ухудшение ее показателей с возрастом. Выявленное снижение концентрации тестостерона у 10 % мужчин с муковисцидозом указывает на наличие гипогонадизма, однако вопрос о необходимости терапии препаратами мужских половых гормонов остается открытым [19].
С появлением новых подходов в лечении, включая генотерапию, медиана продолжительности жизни пациентов с муковисцидозом в США, Западной Европе, Москве, Московской области увеличилась и приблизилась к 40 годам [4, 20]. Возросло число мужчин, достигших репродуктивного возраста, и возникли вопросы об их репродуктивном и сексуальном здоровье. Вопрос о фертильности и контрацепции у мужчин с муковисцидозом должен быть поставлен в 16–18 лет [8]. Рекомендовано обследование состояния репродуктивной системы мальчиков с муковисцидозом с 12 лет, так как характерно раннее возникновение урогенитальных аномалий и их прогрессирование. При сохраненной фертильности у мальчиков-подростков с муковисцидозом может быть рекомендована оценка в динамике показателей сперматогенеза и при их ухудшении – криоконсервация сперматозоидов для последующего деторождения с помощью вспомогательных репродуктивных технологий (ЭКО/ICSI).
Согласно полученным нами сведениям, 44 % взрослых мужчин с муковисцидозом состояли в официальном или гражданском браке, малое их число имеет собственное потомство – 7 %. В Великобритании 26 % мужчин с муковисцидозом состоят в браке, и только у 1,3 % есть дети [21]. Существует несколько вариантов получения потомства у пациентов с муковисцидозом: 1) самопроизвольное; 2) с помощью вспомогательных репродуктивных технологий (биопсии яичек для получения сперматозоидов и программ ЭКО/ICSI); 3) искусственное оплодотворение донорской спермой; 4) усыновление. Исследование, проведенное во Франции, продемонстрировало хорошую эффективность применения ЭКО/ICSI в парах, где мужчина болен муковисцидозом, – в 40 % случаев наступала беременность, которая в 47 % случаев закончилась рождением ребенка [16]. Важно правильное ведение таких пациентов, применение новых технологий лечения бесплодия, таких как ЭКО/ICSI, чтобы с успехом сравнивать понятия качества и продолжительности жизни [21].
Преконцепционная профилактика муковисцидоза у пациентов и супружеских пар с муковисцидозом при планировании беременности должна включать медико-генетическое консультирование, так как у них повышен риск рождения ребенка с муковисцидозом [21–23]. Рекомендуется проведение анализа частых мутаций гена CFTR у супруга пациента с муковисцидозом, а в случае выявления носительства патогенных вариантов гена CFTR – проведение преимплантационной и/или пренатальной диагностики [8, 21].
Заключение
У мужчин с муковисцидозом наблюдается гетерогенность поражения репродуктивной системы – от сохранной функции до явного поражения. Состояние репродуктивной системы зависит от фенотипических (возраст, степень поражения органов бронхолегочной системы) и генетических факторов. Легочная форма муковисцидоза, молодой возраст, наличие мутации 3849+10kbС>T являются благоприятными факторами для сохранения проходимости семявыносящих путей и фертильности у мужчин с муковисцидозом. При планировании беременности рекомендовано молекулярногенетическое обследование супруги на наличие частых мутаций гена CFTR, раннее решение вопроса репродукции.
Выявленные случаи объемных образований тестикул у пациентов с муковисцидозом требуют онкологической настороженности и проведения соответствующего обследования (МРТ, определение уровня лактатдегидрогеназы, хорионического гонадотропина человека, альфа-фетопротеина). Остается открытым вопрос о гормональной терапии у пациентов с муковисцидозом. Алгоритмы ведения этих пациентов с решением проблем репродукции требуют разработки. Деторождение у мужчин с обструкцией семявыносящих протоков возможно при использовании вспомогательных репродуктивных технологий (криоконсервации сперматозоидов в молодом возрасте, биопсии яичка для получения сперматозоидов, программ ЭКО/ICSI).
Литература
- Черных В.Б. Ген муковисцидоза и нарушение фертильности у мужчин. Андрология и генитальная хирургия 2010;(4):23–31. [Chernykh V.B. Cystic fibrosis gene and fertility disorders in men. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2010;(4):23–31. (In Russ.)].
- Черных В.Б., Степанова А.А., Бескоровайная Т.С. и др. Частота и спектр мутаций и IVS8-T-полиморфизма гена CFTR среди российских мужчин с бесплодием. Генетика 2010;46(6):844–52. [Chernykh V.B., Stepanova A.A., Beskorovainaya T.S. et al. The frequency and spectrum of mutations and the IVS8-T polymorphism of the CFTR gene in Russian infertile men. Genetika = Russian Journal of Genetics 2010;46(6):844–52. (In Russ.)].
- Claustres M. Molecular pathology of the CFTR locus in male infertility. Reprod Biomed Online 2005;10(1):14–41. PMID: 15705292.
- Муковисцидоз. Под ред. Н.И. Капранова, Н.Ю. Каширской. М.: Медпрактика-М, 2014. [Cystic fibrosis. Ed. by N.I. Kapranov, N.Yu. Kashirskaya. Moscow: Medpraktika-M, 2014. (In Russ.)].
- Bombieri C., Claustres M., De Boeck K. et al. Recommendations for the classification of diseases as CFTR-related disorders. J Cyst Fibros 2011;10(2):86–102. DOI: 10.1016/S1569-1993(11)60014-3. PMID: 21658649.
- Биохимические и молекулярно-генетические основы патогенеза муковисцидоза. Под ред. Т.Э. Иващенко, В.С. Баранова. СПб.: Интермедика, 2002. [Biochemical and molecular genetic basis of cystic fibrosis pathogenesis. Ed. by T.E. Ivashchenko, V.S. Baranov. Saint Petersburg: Intermedica, 2002. (In Russ.)].
- Красовский С.А., Петрова Н.В., Степанова А.А. и др. Клиническое течение заболевания у взрослых больных муковисцидозом – носителей «мягких» мутаций. Пульмонология 2012;(6):5–11. [Krasovsky S.A., Petrova N.V., Stepanova A.A. et al. Clinical course of cystic fibrosis on adult patients carrying “mild” mutations. Pul’monologiya = Russian Pulmonology 2012;(6):5–11. (In Russ.)]. DOI: 10.18093/0869- 0189-2012-0-6-5-11.
- Thorpe-Beeston J.G. Contraception and pregnancy in cystic fibrosis. J R Soc Med 2009;102(1):3–10. DOI: 10.1258/jrsm.2009.s19002. PMID: 19605868.
- Xu W.M., Chen J., Chen H. et al. Defective CFTR-dependent CREB activation results in impaired spermatogenesis and azoospermia. PLoS One 2011;6(5):e19120. DOI: 10.1371/journal.pone.0019120. PMID: 21625623.
- Li C.Y., Jiang L.Y., Chen W.Y. et al. CFTR is essential for sperm fertilizing capacity and is correlated with sperm quality in humans. Hum Reprod 2010;25(2):317–27. DOI: 10.1093/humrep/dep406. PMID: 19923167.
- Руководство ВОЗ по исследованию и обработке эякулята человека. Пер. с англ. Н.П. Макарова. Науч. ред. Л.Ф. Курило. 5-е изд. М.: Капитал Принт, 2012. [WHO Laboratory manual for the examination and processing of human semen. Trans. from English by N.P. Makarova. Scientific ed. by L.F. Kurilo. 5th ed. Moscow: Kapital Print, 2012. (In Russ.)].
- Cooper T.G., Weidner W., Nieschlag E. The influence of inflammation of the human male genital tract on secretion of the seminal markers alphaglucosidase, glycerophosphocholine, carnitine, fructose and citric acid. Int J Androl 1990;13(5):329–36. PMID: 2283178.
- Dohle G.R., Arver S., Bettocchi C. et al. Guidelines on male hypogonadism. European Association of Urology, 2015. 24 p. Available at: http://uroweb.org/wpcontent/uploads/18-MaleHypogonadism_LR1.pdf.
- Blau H., Freud E., Mussaffi H. et al. Urogenital abnormalities in male children with cystic fibrosis. Arch Dis Child 2002;87(2):135–82. PMID: 12138064.
- Marcorelles P., Gillet D., Friocourt G. et al. Cystic fibrosis transmembrane conductance regulator protein expression in the male excretory duct system during development. Hum Pathol 2012;43(3):390–7. DOI: 10.1016/ j.humpath.2011.04.031. PMID: 21840567.
- Hubert D., Patrat C., Guibert J. et al. Results of assisted reproductive technique in men with cystic fibrosis. Hum Reprod 2006;21(5):1232–6. DOI: 10.1093/humrep/dei453. PMID: 16431902.
- Штаут М.И., Шилейко Л.В., Репина С.А. и др. Комплексное сперматологическое обследование пациентов с муковисцидозом. Андрология и генитальная хирургия 2017;18(4): 69–76. [Shtaut M.I., Schileiko L.V., Repina S.A. et al. Comprehensive semen examination in patients with cystic fibrosis. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2017;18(4):69–76. (In Russ.)]. DOI: 10.17650/2070-9781-2017-18-4-69-76.
- Von Eckardstein S., Cooper T.G., Rutscha K. et al. Seminal plasma characteristics as indicators of cystic fibrosis transmembrane conductance regulator (CFTR) gene mutations in men with obstructive azoospermia. Fertil Steril 2000;73(6):1226–31. PMID: 10856487.
- Green H.D., Barry P.J., Jones A.M. Anabolic agent use in adults with cystic fibrosis. Paediatr Respir Rev 2015;16(1):28–30. DOI: 10.1016/j.prrv.2015.07.014. PMID: 26410285.
- Красовский С.А., Черняк А.В., Амелина Е.Л. и др. Динамика выживаемости больных муковисцидозом в Москве и Московской области за периоды 1992–2001 и 2002–2011 гг. Пульмонология 2012;(3):79–86. [Krasovsky S.A., Chernyak A.V., Amelina E.L. et al. Survival trends of cystic fibrosis patients in Moscow and Moscow region in 1992–2001 and 2002– 2011. Pul’monologiya = Russian Pulmonology 2012;(3):79–86. (In Russ.)]. DOI: http://dx.doi.org/10.18093/0869-01 89-2012-0-3-79-86.
- Boyd J.M., Mehta A., Murphy D.J. Fertility and pregnancy outcomes in men and women with cystic fibrosis in the United Kingdom. Hum Reprod 2004;19(10):2238–43. DOI: 10.1093/humrep/deh405. PMID: 15243000.
- labador M.A., Pagin A., LefebvreMaunoury C. et al. Congenital bilateral absence of vas defference: the impact of spermatogenesis quality on intracytoplasmic sperm injection outcomes in 108 men. Andrology 2015;3(3):473–80. DOI: 10.1111/andr.12019. PMID: 25755137.
- Radpour R., Gourabi H., Dizaj A.V. et al. Genetic investigations of CFTR mutations in congenital absence of vas deferens, uterus and vagina as a cause of infertility. J Androl 2008;29(5):506–13. DOI: 10.2164/jandrol.108.005074. PMID: 18567645.
Статья опубликована в журнале "Андрология и генитальная хирургия" №2 2018, стр. 31-39













Комментарии