Рак полового члена – редко встречающаяся злокачественная опухоль, однако, когда она диагностируется, то наносит тяжелую психологическую травму пациенту. Для врача уролога она представляет вызов его профессиональным способностям. Доброкачественные, предраковые и злокачественные образования необходимо отличать друг от друга.
Локализация рака полового члена
Опухоль полового члена чаще всего локализуется на головке (48%) и крайней плоти (21%). Сочетанное опухолевое поражение – головка и крайняя плоть - 9%, венечная борозда – 6%, и реже всего – тело полового члена – 2%. Такая локализация опухоли может объясняться канцерогенным действием смегмы и других раздражителей.
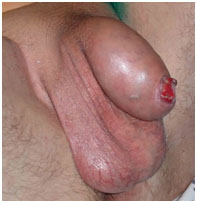
Рак полового члена T2N0M0
У пациентов, имеющих опухоль менее 2 см, есть множество различных вариантов лечения, особенно если опухоль ограничена крайне плотью. Злокачественные опухоли полового члена могут длительное время ограничиваться только кожей, но когда наступает момент инвазии, то они проникают глубоко внутрь, прорастая в кровеносные и лимфатические сосуды.
Частота встречаемости рака полового члена
Рак полового члена редко встречается в Западных странах, он диагностируется приблизительно у 1000 мужчин ежегодно. Этот вид рака составляет 0,4-0,6% всех злокачественных заболеваний в США и Европе. В остальной части мира ситуация различна, и в некоторых странах представляет большую проблему. Например, в странах Азии, Африки и Южной Америки это заболевание составляет 20-30% всех онкологических заболеваний.
Редко раком полового члена страдают обрезанные мужчины, особенно те, которые были обрезаны в детстве. Болезнь чаще развивается в пожилом возрасте, имеется тенденция к резкому увеличению частоты этого заболевания после 60 лет. Максимум пика встречается у 80-летних мужчин. Однако, в последнее время опухоль стала чаще встречаться у молодых мужчин – 22% пациентов моложе 40 лет и 7% моложе 30 лет.
Этиология рака полового члена
Частота развития рака полового члена прямо пропорциональна гигиеническим и культурным привычкам, религиозным верованиям. Фимоз встречается у 25-75% пациентов с раком полового члена, но эта информация часто не регистрируется в слаборазвитых странах. Поэтому для этого вида рака обрезание (циркумцизио) является адекватной превентивной мерой. Данные большинства исследований продемонстрировали, что болезнь почти никогда не встречается у мужчин, которым обрезание было произведено в детстве. Чаще РПЧ встречается у пациентов, которым обрезание было выполнено в период половой зрелости. Если обрезание было выполнено во взрослом возрасте, то на развитие опухоли это вообще не влияет и не является защитой от возникновения РПЧ в будущем.
Пока нет никаких убедительных исследований, доказывающих канцерогенное действие смегмы, хотя это мнение широко распространено. Роль вирусной инфекции продолжает изучаться. Рак полового члена у мужчин и рак шейки матки у женщин связан с вирусом простого герпеса и вирусом папилломы человека (ВПЧ). У женщин, партнером которых является мужчина с раком полового члена, рак шейки матки встречается чаще в 3-8 раз. Вирус папилломы человека типов 16,18 был выявлен у 1/3 пациентов с РПЧ. Есть ли взаимосвязь между этими вирусами и РПЧ, или вирусы играют роль сапрофитов, неизвестно.
Данные по частоте встречаемости рак полового члена в России
Рак полового члена составляет 1-2% всех опухолей мочеполовой системы в России.
В 1998 году было зафиксировано 384 новых случая, что составило 0,09% всех злокачественных онкологических заболеваний.
В 2000г. - 366 новых случаев рака полового члена. Средний возраст пациентов составил 62,3 года. Ни одного больного моложе 15 лет не зафиксировано. Наибольшая заболеваемость приходилась на больных старше 75лет. В возрасте до 40 лет заболевание встречается крайне редко, а у детей - казуистически редко.
В 2002 году в России зарегистрировано 385 случаев злокачественных опухолей полового члена.Гистологическая картина рака полового члена
Предопухолевые (предраковые) заболевания полового члена делятся на 2 группы:
- Факультативные (низкий риск развития рака полового члена) – кожный рог, папилломы полового члена.
- Облигатные (высокий риск развития рака полового члена) – эритроплазия Кейра, болезнь Боуэна, облитерирующий баланит.
Злокачественные заболевания полового члена:
- Основная гистологическая форма рака полового члена – плоскоклеточный рак, который составляется 95% всех опухолей полового члена и проявляется кератинизацией, эпителиальными «жемчужными» образованиями и другими видами митотической активности. Нормальное строение тканей полового члена нарушается, происходит инвазия и пенетрация опухоли через базальную мембрану окружающие структуры. Высокодифференцированнный плоскоклеточный рак полового члена характеризуется утолщением эпидермиса, гиперкератозом, папилломатозом и растущими вглубь пальцевидными выростами атипичных шиповатых клеток с наличием в толще комплексов концентрических образований, состоящих из уплощенных клеток с ороговением в центре («роговых жемчужин»); эпителиальные клетки имеют интактные десмосомы и легкую атипию, увеличенные плеоморфные ядра, встречаются фигуры митозов; в толще дермы обнаруживается плотный лимфоцитарный или смешанный воспалительный инфильтрат.

- Значительно реже встречаются злокачественная меланома полового члена
- Базально-клеточный рак.
- Мезенхимальные опухоли (саркома Капоши, ангиосаркома, эпителиоидная гемангиоэндотелиома) встречаются еще реже.
- Веррукозная (бородавчатая) карцинома полового члена.
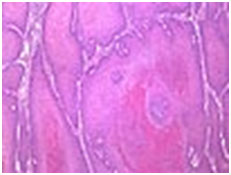
- Веретенообразный рак полового члена (псевдосаркоматозный рак) по гистологическим признакам напоминает саркому, опухолевые клетки имеют веретенообразную форму. Опухоль отличается высокой степенью злокачественности.
- Псевдожелезистый (акантолитический), плоскоклеточный рак характеризуется наличием железистоподобных структур, образовавшихся вследствие дискератоза и акантолиза опухолевых клеток.
Патофизиология рака полового члена
Рак полового члена начинается как маленькая ранка или повреждение кожи головки или крайней плоти. Они постепенно растут по поверхности, покрывая всю головку и переходя на тело полового члена. Опухолевые образования могут быть папиллярными и экзофитными, или плоскими и язвенными. Если не лечить, может произойти самоампутация полового члена.
Темпы роста папиллярных и язвенных образований приблизительно одинаковы, но язвенные опухоли имеют тенденцию раннего метастазирования в лимфатические узлы, и поэтому связаны с меньшей 5-летней выживаемостью. Опухолевые образования размерами более 5 см и вовлекающими в процесс более 75% тела полового члена, связаны с высокой распространенностью метастазов в лимфоузлы и низкой выживаемостью. Но четкой взаимосвязи между размерами опухоли, распространенностью метастазов в паховые лимфоузлы и выживаемостью не выявлено.
Метастазирование в паховые и бедренные лимфоузлы – самый ранний путь метастазирования опухоли. Лимфоотток происходит от лимфатических сосудов крайней плоти в лимфатические сосуды тела полового члена и оттуда – в поверхностные паховые лимфоузлы, потом в глубокие, которые располагаются под фасцией lata. Отсюда осуществляется лимфоотток к тазовым лимфоузлам.
При отсутствии лечения метастатическое поражение региональных лимфоузлов может приводить к некрозу кожи, хронической инфекции, и, в конечном счете, смерти от сепсиса или вторичного кровотечения от эрозии бедренных сосудов. Клинически проявляющиеся отдаленные метастазы в легкие, печень, кости, мозг обычно развиваются на поздних стадиях болезни, уже после первичного лечения. Их появление обычно связано с вовлечением региональных лимфоузлов.
Рак полового члена неустанно прогрессирует, что для нелеченных пациентов означает смерть в течение 2х лет. В литературе нет никаких данных о спонтанных ремиссиях и чудесных излечениях.
Психология пациента, страдающего раком полового члена
Пациенты с раком полового члена задерживают обращение в медицинское учреждение. Около 15-50% пациентов обращаются только спустя год и более. Эта задержка обращения объясняется смущением, чувством вины, страхом, невежеством, игнорированием симптомов, личной небрежностью к собственному здоровью. Пациенты часто пытаются заниматься самолечением, применяя различные кремы, лосьоны и мази. Они могут казаться эффективными на какое-то время, но на самом деле только задерживают обращение пациента в лечебное учреждение и затягивают установку диагноза.
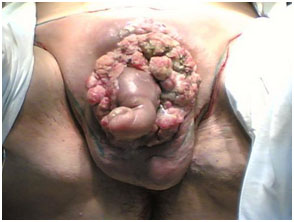
Поздняя диагностика может произойти и из-за врача общей практики. Пациенты сообщают, что они получают различные мази и антибиотики, которые им назначаются на первичном осмотре, еще до того, как они попадут на прием к урологу. Неясно, влияет ли такого рода задержка диагностики и такой терапии на выживаемость, но на быстрое устранение рака с сохранением удовлетворительных функциональных и косметических результатов она оказывает влияние.
Клиническая картина рака полового члена
Пациенты обращаются с длительно незаживающими повреждениями полового члена, тонкой едва заметной индурацией кожи полового члена, маленькими наростами, папулами, пустулами, бородавчатыми разрастаниями, или уже с большими экзофитными опухолями. Рак может проявляться в виде эрозий, язв, с покатыми краями. Поскольку большинство пациентов необрезаны, у них может иметь место фимоз, скрывающий опухоль, которая по этой причине остается незамеченной. Большинство мужчин не обращаются за медицинской помощью, пока не возникает полное разрушение крайней плоти, не возникает зловоние из-за инфекции и некроза. В некоторых случаях рак полового члена находят случайно, при гистологическом исследовании крайней плоти после циркумцизио.

Редко манифестация заболевания происходит из-за роста опухоли, изъязвления, нагноения и кровотечения в паховой области из-за метастазирования в лимфоузлы.
Кроме внешних признаков пациенты редко отмечают какие-либо другие признаки развития опухолевого процесса. Даже когда происходит существенная деструкция тканей, болевые ощущения возникают редко. При распространенном метастатическом процессе пациенты могут сообщить о слабости, потере веса, усталости, кровоточивости опухоли полового члена.
Наличие незаживающего повреждения полового члена побуждает пациента обратиться к врачу. Большое значение имеет дифференциальный диагноз – так как карцинома может проявляться лишь небольшой гиперемией головки полового члена, а эритроплазия Кейра может выглядеть как язва на внутренней поверхности препуциального мешка.
Все образования полового члена можно разделить на доброкачественные, предраковые и раковые.
- Доброкачественные опухоли – включают «жемчужные» папулы полового члена, «волосатые» папилломы, венечные папилломы.
- Некоторые гистологически доброкачественные образования являются потенциально злокачественными (или предраковыми) и могут быть связаны с плоскоклеточным раком.
- одним из таких образований является склероатрофический лихен (balanitis xerotica obliterans) – изменение кожи белого цвета на крайней плоти и/или головке полового члена, который может распространяться на наружное отверстие уретры.
- кожный рог (cutaneous horns)

- псевдоэпителиоматозный кератоз (pseudoepitheliomatous keratotic)

- грибковые баланиты (micaceous balanitis)

- лейкоплакия – одиночные или множественные белесоватые бляшки на головке полового члена, которые могут вовлекать в процесс меатус. Она может быть связана с плоскоклеточным раком ПЧ.
- вирусные поражения включают остроконечные кондиломы, которые характеризуются мягким папилломатозным ростом. Они еще известны как венерические бородавки и обычно располагаются в аноурогенитальной области. Они передаются половым путем. Типы вирусов 6, 11, 42, 44 вызывают дисплазию низкой степени злокачественности. Типы 16, 18, 31, 33, 35, 39 связаны с неопластическими изменениями.

- саркома Капоши – проявляется как кожное неоваскулярное повреждение – выпуклые, болезненные, голубоватого цвета образования, которые могут изъязвляться. Часто развивается у пациентов с ВИЧ-инфекцией.

- гигантская остроконечная кондилома (опухоль Buschke-Löwenstein) – отличается от обычных кондилом тем, что она смещает, сдавливает и разрушает смежные структуры. А обычная кондилома остается поверхностной и никогда не инвазирует подлежащие ткани. Несмотря на свой большой размер, опухоль Buschke-Löwenstein не является злокачественной при гистологическом исследовании.

- интраэпителиальная неоплазия полового члена – также считается предраковым состоянием, но только из 5-15% развивается инвазивный плоскоклеточный рак полового члена.
- Злокачественные образования – включают такие злокачественные варианты плоскоклеточного рака, как CIS, эритроплазия Кейра (erythroplasia of Queyrat или Bowen disease). Диагноз зависит от внешнего вида и локализации. Эритроплазия вовлекает головку, крайнюю плоть или тело полового члена. Когда поражается кожа препуциального мешка она называется болезнью Боуэна. Независимо от терминологии и клинического проявления они являются карциномами с тем же злокачественным потенциалом. Должна быть выполнена биопсия, и карцинома должна быть стадирована и пролечена.

Болезнь Боуэна - Интраэпителиальная неоплазия полового члена – также считается предраковым состоянием, но только из 5-15% развивается инвазивный плоскоклеточный рак полового члена.
Обследование при раке полового члена
Лабораторные исследования.
- Для диагностики РПЧ не существует никаких специфических лабораторных исследований или опухолевых маркеров.
- Общие исследования – клинический анализ крови, биохимический анализ крови с печеночными пробами, оценка функции почек, сердца, легких – могут оказаться полезными для диагностики и обнаружения различных проблем.
- У пациентов с распространенным опухолевым процессом может иметь место анемия, лейкоцитоз и гипоальбуминемия.
- Гиперкальциемия может иметь место и при отсутствии метастазов.
Методы визуализации
- УЗИ и МРТ используются для стадирования местных форм рака, установления степени распространения и для оценки состояния паховых лимфоузлов. МРТ может использоваться для оценки инвазии в кавернозные и спонгиозные структуры опухолей размерами более 2 см, расположенными по поверхности полового члена.
- МРТ и КТ используются для диагностики тазовой и ретроперитонеальной лимфоаденопатии.
- Рентгенография грудной клетки может использоваться как самый простой способ диагностики отдаленных метастазов во внутригрудные лимфоузлы.
Диагностические процедуры
Биопсия – самая важная манипуляция в диагностике рака полового члена.
- эксцизионная (хирургическая) биопсия – если размеры опухоли малы, если она ограничена крайней плотью и возможно выполнение циркумцизио.
- биопсийный материал должен быть достаточным и содержать не только опухоль, но и окружающую ткань, что поможет правильно стадировать опухоль.
- возможна тонкоигольная пункция увеличенных лимфоузлов под КТ-контролем, которая поможет в определении дальнейшей тактики.
- биопсия сторожевых лимфоузлов необходима для определения необходимости паховой лимфоаденэктомии.
Стадирование рака полового члена
Т – первичная опухоль,
N – регионарные лимфатические узлы (поверхностные и глубокие паховые и тазовые)
М – отдаленные метастазы
G – гистологическая градация (уровень дифференцировки клеток опухоли)
TX: Недостаточно данных для определения первичной опухоли
T0: Нет первичной опухоли.
Tis: Преинвазивная карцинома (карцинома in situ, CIS).
Ta: Неинвазивная бородавчатая карцинома.
T1: Опухоль распространяется на субэпителиальную соединительную ткань
T2: Опухоль распространяется на губчатое и пещеристое тела
T3: Опухоль распространяется на уретру и предстательную железу
Т4: Опухоль распространяется на другие окружающие структуры
Nx Недостаточно данных для оценки состояния регионарных лимфоузлов
N0 Нет признаков поражения метастазами регионарных лимфоузлов
N1 Метастаз в одном поверхностном паховом лимфатическом узле
N2 Метастазы в нескольких поверхностных паховых лимфатических узлах или метастазы с обеих сторон
N3 Метастазы в глубоких паховых лимфатичечских узлах или метастазы в лимфатическом узле или узлах таза с одной или обеих сторон
Мх Недостаточно данных для определения отдаленных метастазов
М0 Нет признаков отдаленных метастазов
М1 Имеются отдаленные метастазы
Grade 1 – Хорошо дифференцированная опухоль с менее 33% недифференцированных клеток
Grade 2 – Умеренно-дифференцированная опухоль с 33%-66% недифференцированных клеток
Grade 3 – Низко- или недифференцированная опухоль с более, чем 66% недифференцированных клеток.
Метастазирование при раке полового члена
При раке полового члена метастазы распространяются лимфогенным и гематогенным путями. Лимфогенно поражаются паховые и подвздошные лимфатические узлы. Гематогенно поражаются легкие, печень, кости, головной и спинной мозг, сердце.
Показания к лечению при раке полового члена
Показания и методы лечения зависят от гистологического заключения, локализации и размера опухоли, наличия или отсутствия паховой лимфоаденопатии. Все пациенты с раком полового члена требуют лечения, т. к. не зафиксировано ни одного случая спонтанного регресса опухоли и, в конечном счете, опухоль достаточно быстро приводит к смертельному исходу.
Rippentrop et al изучили результаты лечения 1605 пациентов по таким показаниям, как выживаемость, эпидемиология и конечные результаты. Хирургическое лечение было выполнено 1422 пациентам, из которых 721 (50,7%) получили некоторые виды хирургических вмешательств. Наружная биопсия была выполнена в 19,7% пациентов, местную терапию (лазер или криоабляция) в 0,3% случаев. Также 13,1% пациентов была выполнена частичная пенэктомия без лимфоаденэктомии, 2,1% - комбинированное лечение и только 0,5% пациентов была выполнена радикальное хирургическое вмешательство.
Противопоказания к лечению
Никаких противопоказаний к лечению или паллиативной терапии не существует.
Лечение рака полового члена
Основная цель лечения рака полового члена – максимальное сохранение эстетического вида и функциональных способностей полового члена при положительных онкологических результатах.
Достижение этой цели зависит от своевременности диагностики заболевания и раннего начала лечения. Диагностика заболевания предполагает взятие биопсии всех подозрительных участков на головке, крайней плоти и теле полового члена.
Интраэпителиальные образования (болезнь Боуэна, эритроплазия Кейра) могут быть пролечены консервативно путем местного применения 5-фторурацила. Но перед этим должна быть проведена биопсия для исключения инвазии базальной мембраны.
1. Лучевая терапия
У некоторых пациентов лучевая терапия может рассматриваться как альтернатива хирургическому лечению. Психологическая травма, связанная с частичной или полной ампутацией полового члена, подтолкнула врачей радиологов к разработке и внедрению новых методов лучевой терапии при раке полового члена. Но, к сожалению, количество пациентов с раком полового члена, по отношению к которым можно применить лучевые методы, крайне мало.
Главным преимуществом лучевой терапии является сохранение потенции.
Недостатки: рак полового члена может быть устойчивым к лучевой терапии, а высокие дозы лучевой нагрузки могут вызвать образование свищей, стриктур уретры, некроз полового члена, боль, отек. Если рак сопровождается воспалительным процессом, что нередкость, то риск осложнений повышается, а эффективность лучевой терапии уменьшается.
Кандидатами на проведение лучевой терапии могут быть молодые пациенты с поверхностной экзофитной опухолью размерами менее 3 см, или пациенты с неинвазивным раком головки и венечной борозды полового члена, либо пациенты, отказывающиеся от других методов лечения.
Для опухолей, локализующихся на крайней плоти, до начала лучевой терапии рекомендовано выполнение обрезания крайней плоти (циркумцизио). Это позволяет точнее оценить распространенность опухоли и минимизировать осложнения лучевой терапии.
Наружная лучевая терапия – лучевая нагрузка при опухолях, размерами менее 4 см, составляет 4 Гр, 20 фракций в течение 4 недель на всю поверхность полового члена. Края опухоли и сама первичная опухоль дополнительно облучаются в дозе 0,02 Гр. Эффективность и локальный контроль достигается в 60-90% случаев. Спасительная наружная лучевая терапия может быть применена в случае местного рецидива или отрицательной динамике при других методах лечения.
Брахитерапия – существует две методики при лечении рака полового члена.
- При первой методике – радиоактивные зерна помещаются в половой член, и пациент носит их в течение 12 часов ежедневно на протяжении 7 дней. Это позволяет донести до опухоли дозу радиации 0,6 Гр и до уретры 0,5 Гр.
- Вторая методика – применяется иридий 192, который помешается в половой член и удаляется при достижении необходимой дозы.
Условия выполнения брахитерапии при раке полового члена: перед выполнением брахитерапии рекомендуется выполнить циркумцизио (обрезание крайней плоти), опухоль должны быть менее 4 см, и инвазия в тела полового члена не более 1 см. Если эти условия соблюдаются, то половой член удается сохранить в 58-89% случаев.
2. Химиотерапия
Препараты, наиболее часто применяемые при раке полового члена – цисплатин, блеомицин, метотрексат, фторурацил. Их назначают при наличии метастазов в паховые и внутритазовые лимфоузлы.
Процент ответа при монотерапии цисплатином составляет 15-23%, причем ответ даже в этих случаях бывает частичным и кратковременным. Химиотерапия блемицином в виде монотерапии или в сочетании с лучевой терапией, винкристином, метотрексатом может увеличивать процент ответа на лечение до 45%, но у пациентов с минимальным количеством метастазов.
Хотя химиотерапия была вообще неэффективна в лечении пациентов с большими опухолями, в литературе было сообщено о 10 пациентах с поражением тазовых и паховых лимфоузлов, которым было проведено хирургическое лечение в сочетании с химиотерапией (фосфамид, паклитаксел, цисплатин). У 4х пациентов наблюдался полный ответ, у 1 пациента – частичный, и у 5 пациентов – отсутствие эффекта. Среднее время выживания составило 26 месяцев, а у пациентов с минимальным количеством пораженных лимфоузлов выживаемость составила 48 месяцев.
3. Хирургическое лечение
Открытые операции
Стандарт хирургического лечения рака полового члена начинается с местной эксцизии и любого другого варианта органосохраняющего лечения и до полной пенэктомии. Агрессивная тактика обусловлена быстрым метастазированием, большим количеством запущенных заболеваний, поздней обращаемостью, высокой морбидностью.
У пациентов с маленькими опухолями полового члена, ограниченными крайней плотью, местное лечение может заключаться в циркумцизио (обрезании крайней плоти). Но такая же тактика в отношении опухолей размером 1,5 см и более, приводит к 50%-ному рецидивированию. Для уменьшения вероятности рецидивирования традиционно применяется иссчение опухоли с 2 см здоровой ткани вокруг. Но не все гистологические формы рака требуют такого широкого иссечение краев. Например, при плоскоклеточном раке полового члена хирургический край должен быть 2 см, при болезни Боуэна - ширина может быть уменьшена. С целью оценки адекватности хирургического края во время операции проводится экстренное гистологическое исследование, а заключение патолога является руководством к дальнейшему действию.
Частичная ампутация показана, когда рак локализуется на головке и дистальном отделе ствола полового члена. В этом случае показано соблюдение принципа иссечения 2 см окружающей ткани, т. к. в противном случае очень высок риск рецидива и повторного оперативного вмешательства. Местная клиновидная резекция применима лишь в некоторых ситуациях, но она также сопряжена с 50%-м рецидивированием. Если клиновидная резекция не обеспечивает отрицательный хирургический край, то рассматривается выполнение полной пенэктомии. При длине культи полового члена и уретры, недостаточных для мочеиспускания, выполняется перинеальная уретростомия.
Другая техника, называемая техникой Mohs, является микрографической хирургией (MMS). Она применима в случае неинвазивного рака полового члена и заключается в последовательном иссечении тонких полосок пораженной кожи с последующей микроскопической оценкой удаленных тканей. Это попытка удалить пораженную раком ткань, не затрагивая окружающие структуры. Результаты этой техники пока недостаточны для рекомендаций ее применения в рутинной практике, т. к. изучено еще небольшое количество случаев.
Shindel и коллеги сообщили о 33 пациентах, которые были пролечены по этой методике. Всего им было выполнено 41 операция Mohs. В 5 случаях лечение было неадекватным из-за положительного хирургического края и больших размеров дефекта. Последующему исследованию подверглись 25 пациентов, период наблюдения за которыми составил 58-63 месяца. Рецидивы были отмечены у 8 пациентов (32%), из них 7 пациентам были выполнены повторные операции Mohs, 1 пациенту – полная пенэктомия. В последующем у 2х пациентов наблюдалась прогрессия заболевания, 1 пациент умер от метастазирования.
Другой ученый Brandes сообщил о выполнении 28 операций Mohs по поводу 28 локализаций рака полового члена 20 пациентам. Из 28 опухолей 18 были расположены на стволе полового члена и 10 опухолей – на головке полового члена. Средний размер дефекта кожи при операции Mohs составил 44,9 * 30,9 кв мм. 5 процедур были закончены из-за положительного хирургического края, из них у 4 пациентов была обнаружена инвазия в уретру, и у одного пациента размер дефекта оказался слишком большим для продолжения этого вида оперативного лечения. У 13 пациентов имелся CIS, плоскоклеточный рак у 10 пациентов, веррукозный рак – у 4. По стадиям опухоли распределились следующим образом: Tis у 5, T1 у 2, T2 у 8, T3 у 2 пациентов. Ни у одного из пациентов не было обнаружено метастазов. Всем пациентам с Т2-3 или высокой степенью злокачественности опухоли было рекомендовано выполнение лимфаденэктомии, но все они отказались. Дефекты кожи закрылись первичным натяжением или грануляциями у 8 пациентов, пересадка кожи потребовалась 8 пациентам, реконструктивная хирургия и уретропластика были применена у 5 пациентов.
Средний период наблюдения за пациентами составил 40 месяцев (диапазон 3-109 месяцев). Из 20 пациентов 19 оставались живыми, 1 пациент умер от сопутствующей патологии, не связанной с раком полового члена. Местный рецидив наблюдался у 6 (30%) из 20 пациентов, прогрессия опухоли имел место у 1 из этих 6 пациентов. Ни у одного из пациентов не было обнаружено поражения лимфоузлов или отдаленных метастазов. 2 пациента с рецидивами были пролечены по этой же методике Mohs. Авторы исследования сделали вывод, что хотя случаи рецидивов высоки (30%), выживаемость была высокой, а количество случаев прогрессии мало.
Gulino и коллеги сообщили о своей разработанной методике, которая заключается в использовании дистального отдела уретры для реконструкции головки полового члена. Они продемонстрировали диссекцию и мобилизацию избыточной части пенильной уретры для закрытия кавернозных тел. У большинства из пациентов сохранилась функциональность полового члена.
4. Лазерная хирургия
Лазерная хирургия применима у пациентов с поверхностными доброкачественными и злокачественными повреждениями. Для лечения рака полового члена применяются 4 типа лазеров: лазер с углекислым газом, аргоновый лазер, Nd:YAG-лазер, калий-титанил-фосфатный лазер (KTP). Лазерная методика с углекислым газом заключается в вапоризации тканей, глубина воздействия составляет 0,1 мм, возможна коагуляция сосудов размерами 0,5 мм и менее. Nd:YAG-лазер воздействует на глубину 3-6 мм и коагулирует сосуды размерами 5 мм. Калий-титанил-фосфатный (KTP) и аргоновый лазеры меньшую глубину воздействия, чем лазер с углекислым газом, и применяются редко.
Криохирургия - применима у пациентов с поверхностными доброкачественными и злокачественными повреждениями.
5. Лимфаденоэктомия
После местного хирургического лечения рака полового члена необходимо рассмотреть целесообразность удаления паховых региональных лимфоузлов. Решение об удалении паховых лимфоузлов у пациентов без клинических и инструментальных проявлений лимфоаденопатии всегда вызывает споры. Уровень скрытых метастазов у этой группы пациентов составляет 20-25%.
Kroon и коллеги сообщают о том, что раннее удаление лимфоузлов улучшает выживаемость пациентов по сравнению с отстроченной лимаденэктомией. Из-за высокой морбидности, связанной с хирургическим лечением рака полового члена, некоторые урологи утверждают, что наблюдение пациентов безопасно. Решение выполнить лимфаденэктомию зависит от вида рака полового члена и его местной распространенности. Рак полового члена с инвазией базальной мембраны значительно чаще метастазирует, чем поверхностный рак.
Bouchot и коллеги предложили свой подход в этой ситуации, который 8-кратно уменьшил количество осложнений лимфаденэктомии. Но при гистологическом исследовании 95% удаленных лимфоузлов оказались негативными.
D’Anacona предложил следующий доступ для лимфаденэктомии – разрез 5 см в области бедренного канала, с сохранением saphenous vein (подкожной вены бедра). Если при срочном гистологическом исследовании будут обнаружены метастазы в лимфоузлы, то границами ЛАЭ служат: медиальная граница m. adductor longus, латеральная граница - femoral и saphenous вены, верхняя граница - паховое кольцо. При таком подходе количество осложнений уменьшилось с 87,5% до 38,9%.
Билатеральная ЛАЭ необходима при пальпируемых лимфоузлах, или признаках их поражения по данным компьютерной томографии или МРТ. При увеличении паховых лимфоузлов с одной стороны, в 60% случаев отмечается двустороннее поражение. Даже когда у пациента поражено 1-2 лимфоузла, то ЛАЭ эффективна в 75% случаев. Только 20% пациентов с распространенным поражением лимфоузлов можно вылечить. Отрицательные лимфоузлы (непальпируемые или непораженные по данным КТ или МРТ) не означают, что в них нет метастазов. У 20% пациентов имеются скрытые метастазы в лимфоузлы.
Прогностическими факторами в поражении лимфоузлов является стадия рака и степень его злокачественности. Высокая вероятность того, что у пациента с высокой степенью злокачественности и высокой стадией будет поражение лимфоузлов. Tabatabaei и McDougal говорят о том, что у 80-100% таких пациентов имеется лимфоаденопатия по сравнению с 24% пациентов, имеющих умеренно-дифференцированный рак полового члена. Также они сообщили, что у пациентов со стадией Т2 риск поражения лимфоузлов составляет 61 %-75 %, а при Т1 – 5-10%. Это исследование подчеркивает, что метастазы в лимфоузлы не исключены и при низкой стадии, и при низкой степени злокачественности.
Таким образом, только с помощью хирургического лечения можно адекватно воздействовать на метастазы в лимфоузлах. Применение химиотерапии весьма ограниченно улучшает результаты лечения. Лучевая терапия на пораженные лимфоузлы не показала никакой эффективности.
Наличие метастазов в лимфоузлы не является противопоказанием к органосохраняющему лечению.
Выживаемость и прогноз при раке полового члена
Общая 5-летняя выживаемость больных, страдающих раком полового члена:
- T1N0M0 (первая стадия заболевания) - 70-100%,
- T1-2N0-1M0 (вторая стадия) – 66-88%,
- T1-3N0-2M0 (третья стадия) – 8-40,3%,
- T1-4N0-3M1 (четвёртая стадия) – менее 5%.
Опухолевое поражение лимфоузлов снижает 5-летнюю выживаемость с 53%-100% до 20%-86%.
Национальным институтом рака по изучения выживаемости, эпидемиологии и исходов (SEER) проводилось специальное исследование по изучения данных 1605 мужчин, у которых был диагностирован плоскоклеточный рак полового члена. CIS был выявлен у 37% пациентов, локализованный рак – 39%, региональный рак – 13%, отдаленные метастазы у 2,3% и нестадированная опухоль – у 7,9%. Количество пациентов, выявляемых ежегодно с CIS, увеличивается, а количество с локализованными формами заболевания – уменьшается. В более старшем возрасте встречаются более поздние стадии заболевания.
Среднее время от выявления заболевания до смерти пациента составляет:
- при CIS – 66,6 месяцев
- при локализованных формах – 50,1 месяц
- при местно-распространенных формах – 32,4 месяцев
- при наличии отдаленных метастазов – 7,4 месяцев.
Неблагоприятные факторы
- поражение регионарных лимфоузлов - в работе Young M.J. (1991) 5 лет не пережил ни один пациент с регионарными метастазами.
- размер первичного поражения, превышающий 4 см.
- молодой возраст пациента
- эндофитный характер опухоли
- высокая стадия заболевания (5-летняя выживаемость при Т1 - 83,3%, Т2 – 60,4%, Т3 – 39,5%.)
- степень анаплазии (5-летняя выживаемость при гистопатологической дифференцировке первой степени - 90,3%, второй – 58,6%, третьей - 16,7%).
Факторы риска развития рака полового члена
- Возраст старше 60 лет
- Курение
- Несоблюдение личной гигиены
- Большое количество половых партнеров
- Фимоз
Профилактика рак полового члена
- Устранение фимоза
- Лечение баланопоститов, ЗППП (заболеваний, передающихся половым путем)
- Ежедневные гигиенические мероприятия, направленные на удаление смегмы
- Постоянный половой партнер
- Отсутствие и своевременное лечение инфекций, передающихся половым путем
- Срочная консультация уролога/онкоуролога при малейших изменениях наружных половых органов.







Комментарии