Шадёркина В.А .
Уролог, СЕО Uroweb.ru
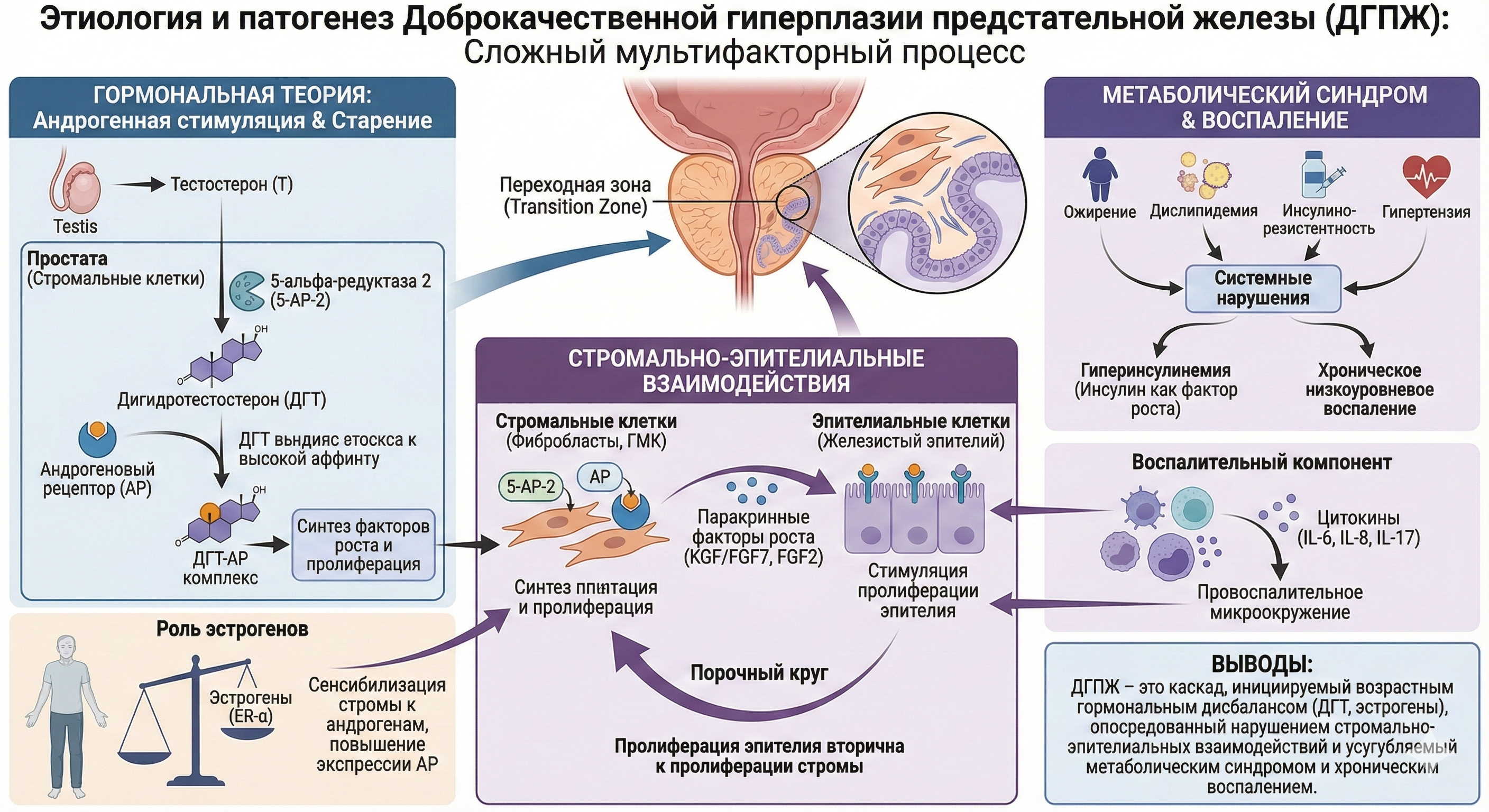
Доброкачественная гиперплазия предстательной железы (ДГПЖ) представляет собой не просто увеличение органа, а сложный патологический процесс, характеризующийся пролиферацией эпителиальных и, в большей степени, стромальных элементов переходной зоны простаты.
Несмотря на десятилетия исследований, этиология ДГПЖ остается мультифакторной, объединяя гормональные, генетические и средовые факторы.
Гормональная теория: Андрогенная стимуляция
Ключевым и неоспоримым фактором развития ДГПЖ является андрогенная стимуляция в условиях старения. Клинически известно, что у мужчин, кастрированных до пубертата, ДГПЖ не развивается.
Центральная роль в этом процессе отводится не столько самому тестостерону, сколько его более мощному внутрипростатическому метаболиту – дигидротестостерону (ДГТ).
- Ферментативная конверсия –тестостерон (Т) конвертируется в ДГТ преимущественно под действием фермента 5-альфа-редуктазы 2-го типа (5-АР-2), локализованного в стромальных клетках простаты.
- Высокая аффинность –ДГТ обладает в 2-3 раза большей аффинностью к андрогеновым рецепторам (АР), чем тестостерон, и образует более стабильный комплекс «ДГТ-АР», что является мощным индуктором синтеза факторов роста и пролиферации.
Стромально-эпителиальные взаимодействия
Современное понимание ДГПЖ сместилось от чисто «эпителиальной» модели к «стромально-эпителиальной». Пролиферация железистого эпителия является по большей части вторичной по отношению к пролиферации стромы.
Именно стромальные клетки (фибробласты и гладкомышечные клетки) экспрессируют 5-АР-2 и АР. Под действием ДГТ они синтезируют паракринные факторы роста (например, KGF/FGF7, FGF2), которые, в свою очередь, стимулируют пролиферацию эпителиальных клеток. Нарушение этого тонкого паракринного баланса является ядром патогенеза ДГПЖ.
Роль эстрогенов и метаболического синдрома
С возрастом у мужчин происходит изменение андроген-эстрогенового баланса в пользу последних (относительная гиперэстрогения). Эстрогены (эстрадиол), действуя через эстрогеновые рецепторы (ER-α) в строме, сенсибилизируют ткань простаты к действию андрогенов, повышая экспрессию АР и стимулируя стромальную пролиферацию.
В последние годы активно изучается связь ДГПЖ с метаболическим синдромом. Ожирение, дислипидемия, инсулинорезистентность и артериальная гипертензия являются доказанными факторами риска.
Ключевые медиаторы – гиперинсулинемия (инсулин как фактор роста) и хроническое низкоуровневое воспаление.
Воспалительный компонент
Наличие хронического воспалительного инфильтрата в тканях ДГПЖ (особенно при ХП категории IV) коррелирует с объемом железы и тяжестью симптомов. Цитокины (IL-6, IL-8, IL-17), секретируемые иммунными клетками, создают провоспалительное микроокружение, которое стимулирует пролиферацию стромы и эпителия, замыкая порочный круг.
Выводы
Этиология ДГПЖ – это сложный каскад, инициируемый возрастным гормональным дисбалансом (ДГТ, эстрогены), опосредованный нарушением стромально-эпителиальных взаимодействий и значительно усугубляемый системными метаболическими нарушениями и хроническим воспалением.
Список литературы
- Клинические рекомендации Европейской Ассоциации Урологов (EAU).Рекомендации по ведению ДГПЖ/СНМП у мужчин. (EAU Guidelines on Management of Non-Neurogenic Male LUTS). 2024.
- Roehrborn C.G.Pathology of benign prostatic hyperplasia. Int J Impot Res. 2008; 20 (Suppl 3): S11–S18. DOI: 10.1038/ijir.2008.55.
- Аляев Ю.Г., Винаров А.З., Локшин В.Л.Этиология и патогенез доброкачественной гиперплазии предстательной железы. Урология. 2017; (3): 102-108.
- De Nunzio C., Presicce F., Tubaro A.Inflammation and benign prostatic hyperplasia: a new target for drug development? Curr Opin Urol. 2015; 25(1): 5-10. DOI: 10.1097/MOU.0000000000000126.
- Wang S., Wang Z., Liu H., et al.Metabolic syndrome and the risk of benign prostatic hyperplasia: a systematic review and meta-analysis. Medicine (Baltimore). 2020; 99(11): e19515. DOI: 10.1097/MD.0000000000019515.
erid: 2W5zFHwGoX6 ООО «Айти-сервис» ИНН 7704322416







Комментарии