Н.Ю. Сафина1 , Т.А. Яманди1 , В.Б. Черных2, 3, Л.В. Акуленко1 , С.В. Боголюбов4 , И.И. Витязева4 , О.П. Рыжкова2 , А.А. Степанова2 , Т.А. Адян2 , Е.А. Близнец2 , А.В. Поляков2
1 ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России; Россия, 127473 Москва, ул. Делегатская, 20, стр. 1;
2 ФГБНУ «Медико-генетический научный центр»; Россия, 115522 Москва, ул. Москворечье, 1;
3 ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России; Россия, 117437 Москва, ул. Островитянова, 1;
4 ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России; Россия, 117036 Москва, ул. Дмитрия Ульянова, 11 Контакты: Наталия Юрьевна Сафина natal.s@mail.ru
Введение
Бесплодие диагностируют у 5–7 % мужчин в общей популяции [1]. Нарушение репродуктивной функции может быть вызвано генетическими, средовыми факторами, а также их сочетанием. К генетическим факторам нарушения фертильности относят хромосомные и генные мутации, эпигенетические изменения. Хромосомными аномалиями, обусловливающими нарушения фертильности у мужчин, являются числовые аномалии половых хромосом (синдром Клайнфельтера, гоносомный мозаицизм, сбалансированные структурные перестройки хромосом и несбалансированные перестройки хромосом, вариации числа копий (copy number variation)) [2].
Частыми генетическими нарушениями, которые связаны с мужским бесплодием, считаются синдром Клайнфельтера, микроделеции Y-хромосомы, мутации и полиморфизмы в гене муковисцидоза (CFTR) и в гене андрогенового рецептора (AR/HUMARA) [3].
Наиболее изученные микроструктурные хромосомные перестройки при мужском бесплодии – микроделеции длинного плеча Y-хромосомы. Их обнаруживают с частотой примерно 1 на 1000 мужчин [4]. AZF-делеции могут быть полными, т. е. целиком удаляющими один или более регион локуса AZF (AZFa, AZFb или AZFс), и частичными, не полностью захватывающими какой-либо из AZF-регионов. Почти все полные AZFделеции являются мутациями de novo и приводят к секреторной азооспермии или олигозооспермии тяжелой степени. Влияние частичных AZF-делеций на сперматогенез и фертильность мужчин может быть негативным, а может отсутствовать [5].
Мутации гена CFTR достаточно часто встречаются у мужчин с нарушением фертильности. Они вызывают муковисцидоз, синдром врожденной двусторонней аплазии семявыносящих протоков (congenital bilateral aplasia of vas deferens, CBAVD), обструктивную форму азооспермии [6, 7].
У мужчин с нарушением фертильности наблюдаются различные варианты CAG-полиморфизма в экзоне 1 гена AR/HUMARA. Нарушение сперматогенеза выявляется чаще у носителей «длинных» (27 и более) CAG-аллелей, чем у фертильных мужчин [3, 8].
Анализ научных публикаций свидетельствует о том, что, несмотря на большое количество исследований, четкой классификации генетических причин мужского бесплодия, которая учитывала бы все формы и фенотипические проявления, до сих пор не существует. Мало или фрагментарно изучены сочетания различных генетических факторов, снижающих фертильность, их клинические последствия и фенотипические эффекты.
Цель исследования – установить частоту генетических факторов, влияющих на мужскую репродуктивную функцию, их сочетаний и изучить их влияние на сперматогенез и сперматологические показатели.
Материалы и методы
Обследованы 393 неродственных российских мужчины, обратившихся по поводу бесплодия в браке. Проводили стандартное спермиологическое, цитогенетическое, молекулярно-генетическое исследование (микроделеций локуса AZF, мутаций и полиморфизмов гена CFTR и числа CAG-повторов гена AR).
По результатам цитогенетического исследования были сформированы 3 группы: 1-я группа – 135 мужчин с числовыми аномалиями половых хромосом (с синдромами Клайнфельтера, дисомии Y-хромосомы); 2-я группа – 58 мужчин, имеющих сбалансированные структурные мутации хромосом (реципрокные и робертсоновские транслокации, инверсии); 3-я группа – 200 мужчин с нормальным кариотипом (46,XY).
Стандартный спермиологический анализ выполняли по общепринятой методике; его результаты оценивали по критериям Руководства Всемирной организации здравоохранения по лабораторному исследованию эякулята человека и взаимодействия сперматозоидов с цервикальной слизью [9].
Для цитогенетического исследования использовали препараты метафазных хромосом культивированных лимфоцитов периферической крови в соответствии со стандартной процедурой с использованием GТGокрашивания. Результаты цитогенетического исследования приведены согласно Международной системе цитогенетической номенклатуры хромосом человека [10]
Молекулярно-генетическое исследование выполняли на ДНК, выделенной из лимфоцитов периферической крови с помощью набора реактивов для выделения DNA Prep100 по протоколу производителя.
Для поиска микроделеций Y-хромосомы применяли метод мультиплексной амплификации. Для определения микроделеций в локусе AZF использовали набор из 19 маркеров (SRY, ZFY, sY84, sY86, sY127, sY134, sY254, sY255, sY615, sY1237, sY1235, sY121, sY124, sY1302, sY142, sY1192, sY1197, sY1206, sY1125). Детально методика описана ранее [11].
Ген CFTR анализировали на наличие 22 частых мутаций (F508del, CFTRdele2,3 (21kb), 394delTT, I507del, 1677delTA, 2143delT, 2184insA, 394delTT, 3821delT, L138ins, G542X, W1282X, N1303K, R334W, 3849+10kbC>T, 604insA, 3944delGT, S1196X,621+1q>t, E92K, 4022insT, 4015delA, 3272-26A>T), суммарно составляющих около 77 % от общего числа поврежденных хромосом, а также полиморфизм IVS8-Tn. Детально методика описана ранее [6].
Для анализа CAG-полиморфизмов экзона 1 гена AR/HUMARA применяли подход, предложенный R.C.Allen и соавт. [12].
Статистический анализ проводили с помощью программы Excel из пакета программ Microsoft Office 2013, используя точный критерий χ2 Пирсона. Значимыми считали различия при уровне вероятности р <0,05.
Результаты
Микроделеции Y-хромосомы выявлены у 71 (18 %) обследованного пациента. Полные AZF-делеции в 1-й группе не обнаружены, а во 2-й и 3-й группах обнаружены соответственно у 1 (1,7 %) и 25 (12,5 %) пациентов. Частичные делеции региона AZFс определены у 43 мужчин: у 13 (9,6 %), 7 (12 %) и 23 (11,5 %) пациентов соответственно 1, 2 и 3-й групп. Не установлено значимых различий частоты частичных AZFc-делеций как между группами, так и между мужчинами, имеющими и не имеющими аномалии кариотипа (χ2 = 0,131; p >0,05).
Частые мутации и полиморфизм IVS8-5Т гена CFTR проанализированы у 164 пациентов: у 25 мужчин из 1-й группы, 16 пациентов 2-й группы, 123 пациентов 3-й группы. Мутации или IVS8-5Т (аллель 5Т – мягкая варьирующая мутация гена CFTR) обнаружены у 18 пациентов: у 2 пациентов I группы (5T), у 3 мужчин 2-й группы (мутация и гомозиготность по 5Т), у 13 пациентов 3-й группы (3 мутации и 10 аллелей 5T). Между этими группами не выявлено значимых различий в частоте мутаций (χ2 = 0,971; p >0,05). Обнаружены следующие мутации: у 8 пациентов – аллель 5Т, у 3 – мутации в гетерозиготной форме (F508del/N, 2184insA/N, N1303K/N), у 2 – мутации CFTR в компаунд-гетерозиготном состоянии с IVS8-5Т (mutCFTR/5T), что характерно для генотипа, не вызывающего муковисцидоз, но приводящего у мужчин к развитию синдрома CBAVD и обструктивной азооспермии.
Полиморфизм числа CAG-повторов в экзоне 1 гена AR/HUMARA исследован у 152 мужчин: у 86 пациентов 1-й группы, 16 пациентов 2-й группы и 52 пациентов 3-й группы. Количество CAG-повторов варьировало от 14 до 37. Среднее количество CAG-повторов существенно не различалось между группами и составило в 1-й группе 22 ± 3, во 2-й группе – 22 ± 3, в 3-й группе – 23 ± 3. Полные мутации данного локуса гена AR (количество CAG-повторов более 40) не выявлены ни у одного из обследуемых. Повышенное количество CAGповторов (≥ 27) обнаружено у 11 (13 %) пациентов 1-й группы, у 1 (7 %) пациента 2-й группы и у 7 (13,4 %) пациентов 3-й группы. Сниженное (≤ 17) количество CAGповторов определено у 5 (5,8 %) мужчин с синдромом Клайнфельтера и 1 (7 %) пациента из 2-й группы. Среди пациентов 3-й группы «короткие» CAG-аллели не выявлены. Значимых различий частоты «длинных» CAG-аллелей между пациентами с нормальным и аномальным кариотипом не обнаружено (χ2 = 0,003; р >0,5).
Сперматологическая характеристика мужчин с нарушениями репродуктивной функции, имеющих числовые аномалии половых хромосом (1-я группа). В этой группе обследовано 120 пациентов с синдромом Клайнфельтера и 15 пациентов с дисомией Y-хромосомы, имеющих их мозаичные или другие цитогенетические варианты (табл. 1).
Наиболее частый цитогенетический вариант синдрома Клайнфельтера представлен кариотипом 47,ХХY, который выявлен у 105 (87,5 %) пациентов. Мозаичные формы и другие цитогенетические варианты синдрома Клайнфельтера обнаружены у 15 (12,5 %) пациентов.
Среди мужчин с дисомией Y-хромосомы ее регулярная форма – кариотип 47,XYY – определен у 13 (86,6 %). У 2 (13,4 %) мужчин с дисомией Y-хромосомы выявлены мозаичный вариант 46,XY/47,XYY и сочетание дисомии Y-хромосомы с робертсоновской транслокацией – 46,XYY,der(13;14)(q10;q10).
В 1-й группе спермиологическое исследование проводили у 87 пациентов, из них 76 – с синдромом Клайнфельтера и 11 – с дисомией Y-хромосомы. Анализ эякулята не выполнен остальным пациентам в связи с недоступностью биологического материала. Нарушения сперматогенеза различной степени тяжести диагностированы у всех обследованных пациентов (табл. 1).
Таблица 1. Цитогенетическая и сперматологическая характеристика пациентов 1-й группы
| Кариотип | Число пациентов | Форма патозооспермии | Число пациентов | |||
| абс | % | абс. | % | |||
| Цитогенетические варианты синдрома Клайнфельтера | ||||||
| 47,XXY | 105 | 87,5 | Азооспермия | 55 | 52,4 | |
| Олигоастенотератозооспермия тяжелой степени | 6 | 5,7 | ||||
| Криптозооспермия | 2 | 1,9 | ||||
| mos 46,XY/47,XXY | 9 | 12 | 10 | Азооспермия | 7 | 58,3 |
| 2 | 16,6 | |||||
| mos 46,XX/47,XXY | 1 | Астенотератозооспермия | 2 | 16,6 | ||
| mos 46,XY/46,XX/47,XXY | 1 | Азооспермия | 1 | 8,3 | ||
| mos 46,XY/47,XХY/48,XXXY | 1 | Олигоастенотератозооспермия тяжелой степени | ||||
| Цитогенетические варианты синдрома дисомии Y-хромосомы | ||||||
| 47,XYY | 13 | 86,7 | Азооспермия | 4 | 36,3 | |
| Олигоастенотератозооспермия тяжелой степени | 5 | 45,4 | ||||
| Астенотератозооспермия | 1 | 9 | ||||
| Астенозооспермия | 1 | 9 | ||||
| mos 46,XY/47,XYY | 1 | 0,7 | Не исследовали | - | - | |
| 46,XYY,der(13;14)(q10;q10) | 1 | 0,7 | Не исследовали | - | - | |
Азооспермия или криптозооспермия обнаружена у 67 (88 %), олигоастенотератозооспермия тяжелой степени – у 7 (9 %), астенотератозооспермия – у 2 (2,6 %), астенозооспермия – у 3 % спермиологически обследованных пациентов с синдромом Клайнфельтера. Азооспермия обнаружена у 4 (36,4 %), олигоастенотератозооспермия – у 5 (45,5 %), астено-/тератозооспермия – у 2 (18 %) спермиологически обследованных пациентов с дисомией Y-хромосомы.
При молекулярно-генетическом анализе у 23 (17 %) из 123 обследованных пациентов 1-й группы выявлены различные генетические факторы: у 12 пациентов с синдромом Клайнфельтера, у 3 пациентов с дисомией Y-хромосомы – частичные делеции региона AZFc (b2/b3, gr/gr), у 7 пациентов с синдромом Клайнфельтера – увеличенное (27 и более), у 2 – уменьшенное (17 и менее) количество CAG-повторов в экзоне 1 гена AR/HUMARA. Гетерозиготность по CAGаллелям определена у 55 пациентов, гомозиготность – у 53 пациентов с синдромом Клайнфельтера, в том числе среди мозаиков гетерозиготы – 3, гомозиготы – 9.
У всех пациентов, имеющих сочетание хромосомных аномалий и генных мутаций/факторов нарушения мужской фертильности, выявлены тяжелые формы патозооспермии (табл. 2).
Таблица 2. Сочетания аномалий половых хромосом с генетическими факторами, связанными со снижением фертильности у мужчин
| Генотип | Число пациентов, n = 23 | Тип патозооспермии | Число пациентов,n = 21 | ||
| абс. | % | абс. | % | ||
| 47,XXY; del b2/b3 | 5 | 22 | Азооспермия | 4 | 100 |
| 47,XXY; del gr/gr | 3 | 13 | Азооспермия | 2 | 100 |
| mos 46,XY/47,XXY; del b2/b3 | 2 | 9 | Азооспермия | 2 | 100 |
| 47,XXY; CAG˃28 | 5 | 22 | Азооспермия | 5 | 100 |
| 47,XXY; CAG˂16 | 1 | 4 | Не исследовали | – | – |
| 47,XXY; del b2/b3; CAG˂16 | 1 | 4 | Азооспермия | 1 | 100 |
| mos 46,XХ/47,XXY; CAG˃28 | 1 | 4 | Азооспермия | 1 | 100 |
| 47,XXY; IVS8-5T(5T/9T); CAG˃28 | 1 | 4 | Азооспермия | 1 | 100 |
| mos 46,XY/47,XXY; del b2/b3; IVS8-5T(5T/7T) | 1 | 4 | Азооспермия | 1 | 100 |
| 47,XYY; del b2/b3 | 3 | 13 | Азооспермия | 1 | 33,3 |
| Олигоастенотератозооспермия тяжелой степени | 2 | 66,6 | |||
Сперматологическая характеристика мужчин с нарушением репродуктивной функции, имеющих структурные мутации хромосом (2-я группа). Данная группа включала 58 пациентов с первичным бесплодием, у которых по результатам цитогенетического исследования выявлены сбалансированные структурные мутации хромосом. Эта группа составила 30 % обследованных пациентов с хромосомными аномалиями.
В спектре исследованных структурных мутаций хромосом большую часть составили сбалансированные реципрокные (преимущественно аутосомно-аутосомные) транслокации, обнаруженные у 27 (47 %) пациентов, а также робертсоновские транслокации, в основном с вовлечением хромосом 13 и 14 (кариотип 45,XY,der(13;14)(q10;q10)), выявленные у 23 (40 %) пациентов. Перицентрические инверсии определены у 4 (7 %) пациентов, из них аутосомные (хромосом 7, 18) – у 3, хромосомы Y – у 1. Комплексные хромосомные перестройки выявлены у 3 (5 %) пациентов: 46,XY,t(5;15) (р22;q32);t(6;12)(q15;q21); 46,XY,t(5;11)(q31,1;q33)t(6;18) (q25,1;р11,2), сочетание транслокации и инверсии – 46,XY,t(7;9)(q31;q34)inv(9)(q32;q34). У 1 мужчины с азооспермией обнаружена кольцевая хромосома 22 (кариотип 46,XY,r(22)(::р11→q13::)).
Спермиологическое исследование выполнено у 37пациентов со структурными мутациями хромосом (табл. 3). Различные формы патозооспермии диагностированы у 36 (97 %) пациентов: азооспермия – у 8 (21 %), криптозооспермия – у 1 (3 %), олигоастенотератозооспермия тяжелой степени – у 18 (46 %), астенотератозооспермия – у 8 (21 %). У 1 пациента с робертсоновской транслокацией (13;14) определена нормозооспермия.
Таблица 3. Сперматологическая характеристика у мужчин с нарушением репродукции, имеющих структурные мутации хромосом
| Тип аномалии хромосом | Число пациентов | Тип патозооспермии | Число пациентов | ||
| абс. | % | абс. | % | ||
| Транслокации | 33 | 89 | Азооспермия | 7 | 18 |
| Олигоастенотератозооспермия | 17 | 43,5 | |||
| Астенотератозооспермия | 7 | 18 | |||
| Криптозооспермия | 1 | 2,6 | |||
| Нормозооспермия | 1 | 2,6 | |||
| Инверсии | 2 | 5,5 | Олигоастенотератозооспермия | 1 | 2,6 |
| Астенотератозооспермия | 1 | 2,6 | |||
| Кольцевая хромосома (22) | 1 | 2,7 | Азооспермия | 1 | 2,6 |
| Транслокация, инверсия | 1 | 2,7 | Астенозооспермия | 1 | 2,6 |
При молекулярно-генетическом исследовании у 11 (19 %) из 58 пациентов 2-й группы обнаружено сочетание структурных мутаций хромосом с другими генетическими факторами бесплодия (микроделеции Y-хромосомы, мутации гена CFTR и «коротких» или «длинных» CАG-повторов гена AR).
У одного мужчины с робертсоновской транслокацией установлено наличие полной делеции региона AZFc (del b2/b4) Y-хромосомы (табл. 4). Частичные микроделеции региона AZFc (del b2/b3, del gr/gr) выявлены у 6 (14,3 %) пациентов (от общего числа пациентов с транслокациями) и у 1 пациента с инверсией. Сочетание структурных перестроек хромосом и мутаций или аллели 5Т гена CFTR выявлено у 3 (3,5 %) пациентов.
Таблица 4. Сочетание структурных хромосомных мутаций с генетическими нарушениями, связанными с нарушением фертильности у мужчин
| Тип аномалии / генотип | Число пациентов | Нарушения сперматогенеза | Число пациентов | ||
| абс | % | абс | % | ||
| Робертсоновская транслокация, полная (b2/b4) делеция AZFc | 1 | 1,6 | Олигоастенотератозооспермия тяжелой степени | 1 | 100 |
| Робертсоновская транслокация, частичная делеция AZFc (del b2/b3) | 4 | 6,4 | Олигоастенотератозооспермия тяжелой степени | 3 | 75 |
| Робертсоновская транслокация, IVS8-5T вариант гена CFTR | 2 | 3,2 | Астенозооспермия | 2 | 100 |
| Реципрокная транслокация, частичная делеция AZFc (del b2/b3) | 2 | 3,2 | Олигоастенотератозооспермия тяжелой степени | 2 | 100 |
| Реципрокная транслокация, CFTR-мутация N1303K/- | 1 | 1,6 | Азооспермия | 1 | 100 |
| Инверсия, частичная делеция AZFc (del b2/b3) | 1 | 1,6 | Не исследовали | – | – |
Таким образом, у пациентов с сочетанием хромосомных и генных мутаций выявлены преимущественно тяжелые формы патозооспермии (азооспермия, олигозооспермия тяжелой степени).
Сперматологическая характеристика мужчин с нарушением репродуктивной функции, имеющих нормальный кариотип (группа 3-я). К данной группе отнесены пациенты, обратившиеся поповоду первичного бесплодия, укоторых в ходе цитогенетического исследования не обнаружено хромосомных аномалий. В нее вошли 200 мужчин c различными формами патозооспермии или нарушения сперматогенеза и нормальным мужским кариотипом (46,XY).
В структуре спермиологических заключений у 186 (93 %) пациентов 3-й группы отмечена азооспермия, криптозооспермия или олигозооспермия тяжелой степени, у 13 (6,5 %) – астено-/тератозооспермия или олигозооспермия умеренной степени. У 1 пациента выявлена нормозооспермия (см. рисунок).
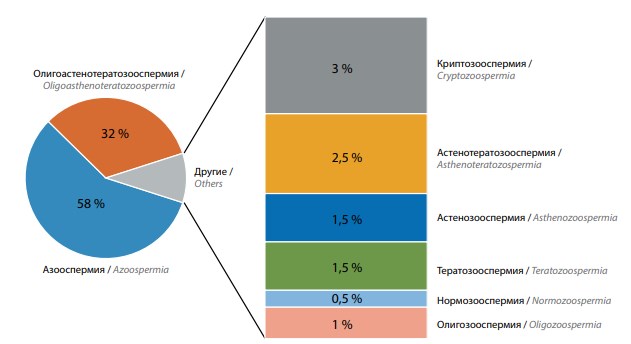
Спектр спермиологических нарушений у мужчин 3-й группы
При молекулярно-генетическом исследовании у 56 (28,7 %) пациентов 3-й группы диагностированы различные генетические факторы мужского бесплодия (табл. 5). Полные делеции одного AZF-региона (a, b или c) обнаружены у 19 (34 %) мужчин 3-й группы. У 5 (9 %) пациентов выявлены делеции AZFb+с, в том числе у 1 – в сочетании вариантом IVS8-5T гена CFTR в гетерозиготном состоянии (см. табл. 5).
Таблица 5. Типы и частота генетических аномалий у пациентов с нормальным мужским кариотипом (3-я группа)
| Тип аномалии / генотип | Число пациентов | Тип патозооспермии | Число пациентов | |||
| абс | % | абс | % | |||
| Делеция AZFb+c | 5 | 9 | Азооспермия | 5 | 100 | |
| Делеция AZFa | 1 | 1,8 | Азооспермия | 1 | 100 | |
| Делеция AZFb | 4 | 3,6 | Азооспермия | 2 | 50 | |
| Криптозооспермия | 2 | 50 | ||||
| Полная делеция AZFc | 14 | 2,6 | Азооспермия | 11 | 79 | |
| Олигоастенотератозооспермия | 2 | 14 | ||||
| Криптозооспермия | 1 | 7 | ||||
| Частичная делеция AZFc | del b2/b3 | 12 | 21 | Азооспермия | 7 | 58 |
| Олигоастенотератозооспермия | 5 | 42 | ||||
| del gr/gr | 8 | 14,3 | Азооспермия | 5 | 63 | |
| Олигоастенотератозооспермия | 3 | 38 | ||||
| Мутация CFTR (F508del) | 1 | 1,8 | Азооспермия | 1 | 100 | |
| IVS8-5T(5Т/7Т) | 3 | 5,4 | Олигоастенотератозооспермия | 3 | 100 | |
| Полная делеция AZFb+c, IVS8-5T (5T/7T) | 1 | 1,8 | Азооспермия | 1 | 100 | |
| Частичная делеция AZFc (del b2/b3; del gr/gr), IVS8-5T(5T/7T) | 2 | 3,6 | Азооспермия | 1 | 50 | |
| Олигоастенотератозооспермия | 1 | 50 | ||||
| Частичная делеция AZFc (del b2/b3), CAG = 30 Partial AZFc deletion (del b2/b3), CAG = 30 | 1 | 1,8 | Олигоастенотератозооспермия | 1 | 100 | |
| IVS8-5T(5Т/7Т) | CAG = 33 | 2 | 3,6 | Азооспермия | 1 | 50 |
| CAG = 28 | Олигоастенотератозооспермия | 1 | 50 | |||
| Мутация CFTR, IVS8-5T | F508del/5Т | 1 | 3,6 | Азооспермия | 1 | 100 |
| 2184insA/5T | 1 | Азооспермия | 1 | 100 | ||
Таблица 6. Формы патозооспермии у мужчин с сочетанием различных генетических факторов мужского бесплодия (AZF, CFTR, AR)
| Тип патозооспермии | Вид сочетания генетических факторов | |||||
| Числовые хромосомные аномалии, генные варианты, n = 21 | Структурные хромосомные аномалии, генные варианты, n = 10 | Нормальный кариотип, генные варианты, n = 56 | ||||
| абс. | % | абс. | % | абс. | % | |
| Азооспермия | 19 | 90,5 | 1 | 10 | 37 | 66 |
| Олигоастенотератозооспермия тяжелой степени | 2 | 9,5 | 6 | 60 | 16 | 28,6 |
| Астенотератозооспермия | – | – | 1 | 10 | 3 | 5,4 |
| Астенозооспермия | – | – | 2 | 20 | – | – |
У 1 (1,8 %) пациента диагностирована мутация F508del гена CFTR. Мутации в гене CFTR в компаундгетерозиготе с вариантом IVS8-5T выявлены у 2 (3,6 %) пациентов с обструктивной формой азооспермии (генотипы 2184insA/N,5T/7T и F508del/N,5T/9T). У 2 мужчин обнаружено сочетание варианта IVS8-5T гена CFTR и увеличенное количество CAG-повторов гена AR (генотипы CFTR 5T/7T; AR CAGn = 28 и CFTR 5Т/7Т; CAGn = 33).
Как можно видеть из табл. 5, среди генетических факторов (AZF, CFTR и AR) чаще всего отмечены микроделеции региона AZFc, выявленные у 23 (41 %) пациентов 3-й группы. У 3 мужчин определены частичные делеции региона AZFc (del b2/b3), которые сочетались у одного пациента с повышенным (n = 30) количеством CAG-повторов гена AR, а у 2 – с вариантом IVS8-5T гена CFTR в гетерозиготном состоянии. Сочетание нескольких различных генетических факторов, связанных с нарушением фертильности у мужчин, выявлено у 6 (10,7 %) пациентов 3-й группы.
В выявленных случаях сочетания генетических факторов мужского бесплодия во всех 3 группах преобладали тяжелые формы патозооспермии (азооспермия, олигоастенотератозооспермия тяжелой степени), которые выявлены соответственно у 100, 70 и 94,5 % пациентов 1, 2 и 3-й групп (табл. 6). У мужчин с сочетанием генетических факторов бесплодия не обнаружено изолированной тератозооспермии и нормозооспермии.
Обсуждение
В данном исследовании впервые изучены сочетания различных генетических факторов, связанных с нарушением мужской фертильности (AZF, CFTR, AR), у мужчин с нормальным кариотипом и с хромосомными мутациями (с числовыми и структурными аномалиями).
В группе пациентов с числовыми аномалиями хромосом встречали частичные AZF-делеции, изменение количества CAG-повторов гена AR и не встречали полные делеции региона AZF, мутации в гене CFTR. У пациентов со структурными перестройками хромосом выявлены частичные AZF-делеции, мутации в гене CFTR, но не обнаружены «короткие» и «длинные» CAG-повторы гена AR. Это может указывать на то, что наличие у пациента 2 генетических причин мужского бесплодия (например, хромосомной мутации и полной делеции региона AZF) является случайным, встречается редко, и, очевидно, эти генетические факторы не зависят друг от друга.
У мужчин с бесплодием, не имеющих аномалий кариотипа, частота других исследованных генетических факторов, нарушающих сперматогенез (AZF, CFTR и AR), примерно в 2 раза превысила совокупную частоту данных факторов в группах пациентов с числовыми и структурными аномалиями хромосом. У пациентов с нормальным кариотипом сочетания микроструктурных перестроек Y-хромосомы и генных вариантов (в генах CFTR и AR) обнаружены чаще, чем у пациентов с хромосомными аномалиями. Сочетание 2 изменений в одном и том же факторе – мутации и аллели 5Т в гене CFTR – может вызывать синдром CBAVD или обструктивную азооспермию.
Примечательно, что в структуре патозооспермии обследованных групп нами выявлено сходство.
В частности, азооспермию у мужчин с нормальным кариотипом и мужчин с хромосомными аномалиями регистрировали с одинаковой частотой – 58 %.
Наличие дополнительных генетических факторов, очевидно, существенно не влияло на тяжесть нарушения сперматогенеза у пациентов с синдромом Клайнфельтера, у которых в основном диагностирована азооспермия. У мужчин со структурными аномалиями чаще обнаруживали олигозооспермию тяжелой степени. Больше всего сочетаний генетических факторов, приводящих к тяжелым формам патозооспермии, выявлено у пациентов с нормальным кариотипом.
Наличия полной делеции AZF-региона(ов), мутаций в генах AR или CFTR достаточно для развития тяжелых генетически обусловленных форм мужского бесплодия, как правило первичного. Для данных микроделеций Y-хромосомы характерно тяжелое угнетение сперматогенеза, вплоть до синдрома наличия только клеток Сертоли и секреторной азооспермии, криптозооспермии или олигозооспермии тяжелой степени. Наличие в генотипе мутаций или аллели 5Т в гене CFTR может приводить к развитию синдрома CBAVD, проявляющегося первичным бесплодием вследствие обструктивной формы азооспермии [6]. Следует подчеркнуть, что наличие частичных микроделеций AZFc-региона, только 1 мутации или аллели 5Т гена CFTR, увеличенное или уменьшенное количество CAG-повторов в гене AR не сами по себе вызывают мужское бесплодие, а только в сочетании с другими факторами, поскольку нарушение фертильности имеет мультифакторную этиологию. Их чаще отмечают у мужчин с тяжелыми формами патозооспермии, в частности с азооспермией и олигозооспермией тяжелой степени, однако они встречаются у мужчин с различной фертильностью и показателями спермограммы [3].
Заключение
Данное исследование свидетельствует, что у пациентов с бесплодием может наблюдаться сочетание 2 и более разных генетических факторов, влияющих на мужскую фертильность. Подобные сочетания генетических факторов в генотипе (в частности, микроделеций Y-хромосомы, мутаций гена CFTR и увеличенного числа CAG-повторов гена AR) могут чаще встречаться у пациентов с бесплодием. Если они выявляются в комбинации друг с другом, это производит аддитивный эффект, усиливает негативное действие каждого, утяжеляет клинические (фенотипические) проявления. Дальнейшее изучение данного вопроса очень важно как для понимания причин мужского бесплодия, выбора адекватной тактики лечения, в том числе с помощью вспомогательных репродуктивных технологий, так и для планирования профилактики генетических нарушений у потомства.
Литература
- Skakkebaek N.E., Rajpert-De Meyts E., Buck Louis G.M. et al. Male reproductive disorders and fertility trends: influences of environment and genetic susceptibility. Physiol Rev 2016;96(1):55–97. DOI: 10.1152/physrev.00017.2015/ PMID: 26582516.
- Курило Л.Ф., Сорокина Т.М., Черных В.Б. и др. Структура генетически обусловленных заболеваний органов репродуктивной системы. Андрология и генитальная хирургия 2011; (3):17–25. [Kurilo L.F., Sorokina T.M., Chernykh V.B. et al. Structure and pathogenesis of hereditary disorders of the human reproductive system organs. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2011;(3):17–25. (In Russ.)].
- Черных В.Б., Руднева С.А., Сорокина Т.М. и др. Влияние СAG-полиморфизма гена андрогенового рецептора (AR) на сперматогенез у мужчин с бесплодием. Андрология и генитальная хирургия 2015;16(4):55–61. [Chernykh V.B., Rudneva S.A., Sorokina T.M. An influence of androgen receptor (AR) gene СAG-polymorphism on spermatogenesis in infertile men. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2015; 16(4):55–61. (In Russ.)]. DOI: 10.17650/ 2070-9781-2015-16-4-55-61.
- Krausz С., Hoefsloot L., Simoni M., Tüttelmann F. EAA/EMQN best practice guidelines for molecular diagnosis of Ychromosomal microdeletions: state-ofthe-art 2013. Andrology 2014;2(1):5–19. DOI: 10.1111/j.2047-2927.2013.00173.x. PMID: 24357628.
- Черных В.Б. AZF-делеции – частая генетическая причина бесплодия у мужчин: современное состояние исследований. Проблемы репродукции 2009;(1):10–5. [Chernykh V.B. AZF deletions as frequent genetic cause of male infertility: current state of study. Problemy reproduktsii = Russian Journal of Human Reproduction 2009;(1):10–5. (In Russ.)].
- Черных В.Б., Степанова А.А., Бескоровайная Т.С. и др. Частота и спектр мутаций и IVS8-T-полиморфизма гена CFTR среди российских мужчин с бесплодием. Генетика 2010;46(6):844–52. [Chernykh V.B., Stepanova A.A., Beskorovainaya T.S. et al. The frequency and spectrum of mutations and the IVS8-T polymorphism of the CFTR gene in Russian infertile men. Genetika = Russian Journal of Genetics 2010;46(6):844–52. (In Russ.)].
- Штаут М.И., Шилейко Л.В., Репина С.А. и др. Комплексное сперматологическое обследование пациентов с муковисцидозом. Андрология и генитальная хирургия 2017;18 (4):69–76. [Shtaut M.I., Schileiko L.V., Repina S.A. et al. Comprehensive semen examination in patients with cystic fibrosis. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2017;18(4):69–76. (In Russ.)]. DOI: 10.17650/2070-97812017-18-4-69-76.
- Nenonen H.A., Giwercman A., Hallengren E., Giwercman Y.L. Nonlinear association between androgen receptor CAG repeat length and risk of male subfertility – a meta-analysis. Int J Androl 2011;34(4):327–32. DOI: 10.1111/j. 1365-2605.2010.01084.x. PMID: 20579136.
- Руководство ВОЗ по исследованию и обработке эякулята человека. 5-е изд., 2010 г. Пер. с англ. Н.П. Макарова. Науч. ред. Л.Ф. Курило. М.: Капитал Принт, 2012. [WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th ed., 2010. Trans. from English by N.P. Makarova. Scientific ed. by L.F. Kurilo. Moscow: Kapital Print, 2012. (In Russ.)].
- ISCN 2013: An International System for Human Cytogenetic Nomenclature. Recommendations of the International Standing Committee on Human. Ed.: L.G. Shaffer, J. McGowan-Jordan, M. Schmid. Basel: Karger, 2013. 140 р.
- Черных В.Б., Чухрова А.Л., Бескоровайная Т.С. и др. Типы делеций Y-хромосомы и их частота у мужчин с бесплодием. Генетика 2006;42(8):1130–6. [Chernykh V.B., Chukhrova A.L., Beskorovainaya T.S. et al. Types of y chromosome deletions and their frequency in infertile men. Genetika = Russian Journal of Genetics 2006;42(8):1130–6. (In Russ.)].
- Allen R.C., Zoghbi H.Y., Moseley A.B. et al. Methylation of HpaII and HhaI sites near the polymorphic CAG repeat in the human androgen-receptor gene correlates with X chromosome inactivation. Am J Hum Genet 1992;51(6):1229–39. PMID: 1281384.
Статья опубликована в журнале "Андрология и генитальная хирургия" №2 2018, стр. 40-50











Комментарии