М.И. Штаут1 , Л.В. Шилейко1 , С.А. Репина3 , С.А. Красовский2 , Г.В. Шмарина1 , Т.М. Сорокина1 , Л.Ф. Курило1 , В.Б. Черных1, 3
1 ФГБНУ «Медико-генетический научный центр»; Россия, 115478 Москва, ул. Москворечье,
1; 2 ФГБУ «НИИ пульмонологии ФМБА России»; Россия, 105077 Москва, 11-я Парковая ул., 32, корп.
4; 3 ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России; Россия, 117513, Москва, ул. Островитянова, 1 Контакты: Вячеслав Борисович Черных chernykh@med-gen.ru
Введение
Муковисцидоз (МВ) – частое моногенное заболевание (встречаемость МВ в России в среднем составляет 1 на 8–10 тыс. населения), вызванное мутациями гена CFTR и имеющее аутосомно-рецессивный тип наследования [1]. К настоящему времени идентифицировано более 2 тыс. мутаций и 250 полиморфизмов этого гена. Кодируемый данным геном белок МВТР (муковисцидозный транспортный регулятор) функционирует в составе цАМФ (циклический аденозинмонофосфат) – зависимого ионного канала на апикальной поверхности эпителиальных клеток, обеспечивая трансмембранный транспорт ионов хлора, натрия, бикарбоната и некоторых молекул [2]. В результате мутации нарушается функция белка хлорного канала, участвующего в водно-электролитном обмене эпителия, выстилающего просветы протоков внешней секреции, в том числе органы репродуктивной системы [3]. Нарушение функции МВТР приводит к системному прогрессирующему поражению: хроническому воспалению желез внешней секреции, в первую очередь бронхолегочной системы (легочная форма МВ) и/или поджелудочной железы (смешанная форма МВ), при этом форма и тяжесть заболевания зависит от типа мутаций CFTR или генотипа [1].
У большинства мужчин, страдающих МВ, поражаются семявыносящие протоки (vas deferens), семенные пузырьки. У них часто отмечают аномалии развития и кисты эпидидимиса и микролитиаз предстательной железы [4]. Изменения на уровнях тканей и клеток включают поражения соединительной ткани, сперматогенного эпителия и клеток Сертоли [5, 6]. У 97–98 % взрослых мужчин, больных МВ, диагностируют бесплодие вследствие обструктивной азооспермии [4]. Для них характерен небольшой (на нижней или близкий к нижней границе нормы) или сниженный объем (менее 1,5 мл) эякулята относительно нормативных значений (вплоть до выраженной олигоспермии), а также сдвиг в сторону кислой среды семенной жидкости (pH <7,0). Биохимические показатели эякулята характеризуют состояние органов мужской половой системы: уровень лимонной кислоты и цинка отражает секреторную функцию предстательной железы, нейтральной α-гликозидазы – проходимость и секреторную функцию эпидидимиса. При исследовании эякулята мужчин с МВ внимание обращают на уровень фруктозы (основной источник энергии для сперматозоидов), секреция которой происходит в семенных пузырьках [7]. В зависимости от механизма возникновения азооспермии ее разделяют на обструктивную и необструктивную. Первая вызвана нарушением проходимости семявыносящих путей, частой причиной которых являются мутации гена МВ. В некоторых случаях отмечают сочетание нарушения сперматогенеза различной степени, двустороннее или одностороннее нарушение проходимости семявыносящих путей.
Целью работы являлось исследование нарушений проходимости семявыносящих путей, экскреторной функции половых желез и состояния сперматогенеза у мужчин с МВ.
Материалы и методы Группу обследованных пациентов составили 44 мужчины в возрасте от 17 до 39 лет с клинически и генетически подтвержденным диагнозом «муковисцидоз». Из них 20 больных имели легочную форму МВ и 24 – смешанную. Пациенты направлены из ФГБУ «НИИ пульмонологии ФМБА России» в ФГБНУ «Медикогенетический центр», где им проводилось обследование с 2009 по 2017 г
Всем пациентам выполняли стандартное спермиологическое исследование согласно рекомендациям ВОЗ (2010 г.) [7], а также количественный кариологический анализ (ККА) соотношения разных стадий сперматогенеза незрелых половых клеток (НПК) из эякулята (патент проф. Курило Л.Ф. на изобретение № 2328736 от 01.02.2007 г. «Способ цитологической диагностики нарушения сперматогенеза»). Данный метод позволяет оценивать процесс сперматогенеза и его нарушения на различных стадиях без проведения биопсии яичка [8, 9]. ККА НПК проводили на суховоздушных препаратах половых клеток из суспензии эякулята после окрашивания по Романовскому – Гимзе. На 500–1000 полей зрения полученных препаратов морфологически идентифицировали НПК на следующих стадиях сперматогенеза: сперматоциты на стадиях предпахитенного развития (прелептотены, лептотены и зиготены профазы I), пахитены, диплотены профазы I, метафазы I и II мейоза и две объединенные стадии сперматогенеза (сперматоциты II + сперматиды, так как стадия сперматоцитов II относится к непродолжительной профазе II мейоза). Один из характерных признаков нарушений сперматогенеза – образование двухъядерных сперматоцитов II и двухъи четырехъядерных сперматид. Они формируются в результате неполного расхождения хромосом в анаи телофазе делений или незавершенной цитотомии при образовании дочерних клеток. При наличии такой патологии вычислялась доля двухъи четырехъядерных НПК от общей суммы сперматоцитов II + сперматид. Также в общую сумму подсчитанных ядер НПК включены и трудно идентифицируемые ядра незрелых половых клеток. При обнаружении на препаратах 1000 и более сперматозоидов подсчитывали индекс НПК (число НПК на 1000 сперматозоидов). Для каждого образца анализировали 200–300 ядер НПК (если таковые были). Параллельно учитывали другие типы клеток (эпителиальные, лейкоциты) [10].
Биохимическое исследование маркеров семенной плазмы (лимонная кислота, фруктоза и нейтральная α-гликозидаза) выполняли с помощью общепринятых методик в соответствии с рекомендациями упомянутого руководства ВОЗ [7]. Для оценки их содержания в семенной жидкости использовали коммерческие диагностические наборы: для лимонной кислоты – FertiPro Citric Acid Test, для фруктозы – FertiPro Fructose Test, для нейтральной α-глюкозидазы – EpiScreen Plus™ Neutral Alpha-Glucosidase, а исследование проводили в соответствии с протоколами их производителя (FertiPro NV, Бельгия). В качестве референсных значений содержания в семенной жидкости фруктозы (13 мкмоль/ 2,4 мг на эякулят), лимонной кислоты (2,4 мкмоль/10 мг на эякулят) и нейтральной α-гликозидазы (20 мЕд на эякулят) приведены данные S. von Eckardstein и соавт. [11].
]. Статистический анализ результатов выполняли с использованием программы StatSoft Statistica 8 (Dell Technologies, США). Статистическое сравнение полученных данных проводили, применяя критерий Манна–Уитни, значимыми считали различия при уровне вероятности p <0,01.
Результаты По результатам стандартного спермиологического исследования из 44 мужчин в исследованной выборке пациентов с МВ у 34 (77,3 %) выявлена азооспермия, у 6 (13,6 %) – крипто-/олигозооспермия тяжелой степени (концентрация сперматозоидов в эякуляте менее 1 млн/мл), у 4 (9,1 %) – другие сперматологические диагнозы, среди которых: олигоастенотерато(n = 2), астенотерато(n = 1) и нормозооспермия (n = 1) [1] (табл. 1).
Таблица 1. Результаты стандартного спермиологического исследования у пациентов с муковисцидозом (МВ), медиана (диапазон)
| Группа пациентов Patient group |
Эякулят Ejaculate | |||
| объем, мл volume, ml |
pH | вязкость, мм viscosity, mm |
концентрация, млн/мл concentration, million/ml |
|
| Смешанная форма МВ, n = 24 Pancreatic-insufficient form, n = 24 | 0,53 ± 0,47 (0,2–1,8) | 6,0 ± 0,5 (5,5–6,5) | 18,0 ± 32,0 (5–50) | 0,002 ± 0,048 (0,00–0,05) |
| Легочная форма МВ, n = 20 Pancreatic-sufficient form, n = 20 | 1,7 ± 4,3 (0,35–6,00) | 6,79 ± 1,11 (5,6–8,0) | 17,2 ± 42,8 (5–60) | 20,962 ± 222,038 (0–243) |
| Всего пациентов, N = 44 Total number of patients, N = 44 | 1,1 ± 4,9 (0,2–6,0) | 6,4 ± 0,9 (5,5–8,0) | 17,6 ± 42,4 (5–60) | 10,48 ± 232,52 (0–243) |
Обнаружено существенное различие в структуре сперматологических диагнозов между группами пациентов (рис. 1). Группу с легочной формой МВ представляли мужчины с различными сперматологическими диагнозами (от нормо-, астенои олигозооспермии различной степени до азооспермии). У всех пациентов со смешанной формой МВ обнаружены только тяжелые формы патозооспермии (азоо-/криптозооспермия) и олигозооспермия тяжелой степени.
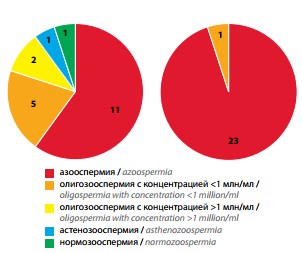
Рис. 1. Структура спермиологических диагнозов в группах пациентов с муковисцидозом: а – легочной (n = 20), б – смешанной (n = 24) форм (цифрами дано число пациентов с данным диагнозом)
У 3 пациентов (у 2 с легочной формой МВ и 1 со смешанной формой) спермиологическое исследование проводили двукратно, у 2 из них в обоих исследованиях выявлена азооспермия, у 3-го пациента диагностирована олигозооспермия тяжелой степени (0,1 млн/мл) в первичном анализе, в повторном – азооспермия.
Объем полученных образцов эякулята варьировал от 0,2 до 6 мл, при этом объем менее 1,5 мл выявлен у 38 (86,4 %) пациентов с МВ. Олигоспермия значимо чаще (р = 0,007) встречалась в группе мужчин со смешанной формой МВ – 95,8 % (у 23 из 24), чем у пациентов с легочной формой МВ – 70 % (у 14 из 20).
Олигоспермия отмечена у 37 (92,5 %) из 40 пациентов с МВ, имеющих азооили олигозооспермию тяжелой степени. У 1 пациента со смешанной формой МВ и азооспермией, обследованного дважды, при первичном спермиологическом исследовании обнаружен нормальный (1,8 мл) объем эякулята, а при повторном – сниженный (1,0 мл). Среди 4 пациентов с МВ, имеющих олиго(n = 2), астено(n = 1) и нормозооспермию (n = 1), только у 1 пациента с астенозооспермией показатель объема эякулята был ниже нормативных показателей (1,0 мл при первичном анализе, 0,5 мл – при повторном).
Кислотность эякулята варьировала от кислой до щелочной (pH от 5,5 до 8,0). У 36 (81,8 %) пациентов ее показатель был меньше нормы (рН ≤7,2), при этом в группе мужчин со смешанной формой МВ не отмечено значений pH выше 6,5. Среднее значение рН являлось значимо большим (p = 0,00005) в группе пациентов с легочной формой МВ. У 11 из 16 пациентов с азооили олигозооспермией тяжелой степени выявлены олигоспермия и сниженный рН эякулята, из остальных 5 пациентов этой группы у 2 отмечена олигоспермия при нормальном рН, у 1 – нормальный объем при сниженном рН и у 2 – нормальные объем и рН.
Следует отметить, что помимо олигои азооспермии и низкого рН семенной жидкости у большинства пациентов с МВ отмечены наличие эякулята белого цвета и отсутствие прозрачности/полупрозрачности, характерной для азоои олигозооспермии тяжелой степени. В норме эякулят непрозрачен и имеет бело-серый цвет или сероватый оттенок [1]. Вязкость эякулята пациентов с МВ выраженно варьировала: от нормальных (5–20 мм) до повышенных значений (до 60 мм). Ее средний показатель значимо не различался между группами пациентов (p = 0,287).
Концентрация лейкоцитов в эякуляте ни у одного мужчины из выборки обследованных пациентов с МВ не превышала нормативных значений (1 млн/мл) [1].
В результате проведенного ККА НПК у мужчин c МВ, в том числе у всех пациентов с азооспермией (по данным стандартного спермиологического анализа), в осадке эякулята обнаружены сперматозоиды (2–207), а у 42 мужчин и НПК (8–423), представленные сперматидами и сперматоцитами разных стадий развития (табл. 2). У 2 пациентов с азоо-/криптозооспермией найдены сперматозоиды без НПК. Все сперматозоиды в анализах пациентов с азоо-/криптозооспермией, олигозооспермией тяжелой степени имели аномалии строения головки и жгутика (рис. 2).
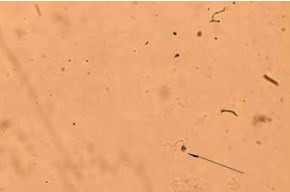
Рис. 2. Сперматозоид с атипичной формой головки и жгутика (указан стрелкой) в препарате осадка эякулята пациента с муковисцидозом; окрашивание по Романовскому – Гимзе; ×400
Таблица 2. Результаты количественного кариологического анализа соотношения разных стадий сперматогенеза незрелых половых клеток (ПК) у пациентов с муковисцидозом (МВ)
| Группа пациентов Patient group | ПК до пахитены, % GC before pachytene, % | Сперматоциты, % Spermatocytes, % | Нерасхождение ядер ПК, % GC nuclear nondisjunction, % | Неидентифицированные ядра ПК, % Non-identified GC nuclei, % |
| Контрольная (референсные значения*) Control (reference values*) | 0,66 ± 0,16 | 91,99 ± 0,89 | 22,98 ± 2,65 | 5,85 ± 0,85 |
| Смешанная форма МВ, n = 24 Pancreatic-insufficient form, n = 24 | 2,58 ± 8,12 (0–38) | 92,9 ± 29,9 (63–100) | 14,27 ± 11,48 (0–48,8) | 5,88 ± 8,31 (0–30,7) |
| Легочная форма МВ, n = 20 Pancreatic-sufficient form, n = 20 | 2,34 ± 2,41 (0–7,2) | 88,83 ± 8,37 (63–100) | 17,82 ± 15,96 (0–66) | 6,44 ± 7,12 (0–28,4) |
| Cмешанная и легочная формы МВ, n = 44 Pancreatic-sufficient and pancreatic-insufficient CF, n = 44 | 2,69 ± 8,10 (0–38) | 91,48 ± 9,84 (63–100) | 15,85 ± 13,52 (0–66) | 5,97 ± 7,46 (0–30) |
*Референсные значения взяты из статьи Л.Ф. Курило и соавт. [8]. *Reference values were taken from L.F. Kurilo et al. [8].
В ряде образцов эякулята, в том числе от некоторых пациентов с азооспермией (по данным стандартного спермиологического анализа), сперматозоиды обнаружены в агрегатах микробных биопленок (рис. 3). Конгломераты, содержащие сперматозоиды, выявлены у 6 из 34 (17,6 %) мужчин с азоо-/криптозооспермией, из них у 3 пациентов отмечено наличие легочной формы МВ и еще у 3– смешанной формы.
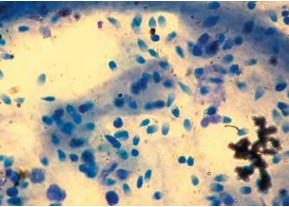
Рис. 3. Сперматозоиды с атипичной формой головки (большинство без жгутиков) в агрегатах микробных биопленок в препарате из суспензии эякулята пациента с МВ и азоо-/криптозооспермией; окрашивание по Романовскому – Гимзе; ×400
Стандартное спермиологическое исследование и ККА НПК были проведены 4 пациентам с МВ, имеющим сохраненную проходимость семявыносящих путей, в том числе с олигозооспермией (n = 2), астенозооспермией (n = 1) и нормозооспермией (n = 1) (табл. 3). У 3 из этих 4 пациентов отмечен нормальный объем эякулята, у 1 – сниженный. Показатель рН семенной жидкости у всех 4 пациентов находился в пределах нормы. Вязкость эякулята была нормальной у 3 и повышенной – у 1 больного. У 2 мужчин (коды 28605 и 51591) выявлена нетяжелая форма олигозооспермии, еще у 2 (коды 34062 и 49465) – концентрация сперматозоидов в пределах нормы. У 1 пациента количество морфологически нормальных сперматозоидов находилось в пределах нормы, у 3 диагностирована тератозооспермия. Морфологически аномальные сперматозоиды имели различные формы атипии, наиболее частые среди них представлены нарушениями строения акросомы. У всех 4 пациентов индекс НПК превышал нормативные значения (2–4 %), отмечено повышенное количество сперматоцитов на допахитенных стадиях.
Таблица 3. Результаты стандартного спермиологического исследования и количественного кариологического анализа соотношения разных стадий сперматогенеза незрелых половых клеток (НПК) у пациентов с муковисцидозом без азоо-/криптозооспермии, n = 4
| Данные исследования эякулята Data studies ejaculate | Номер образца Sample number | |||
| 28605 | 34062 | 49465 | 51591 | |
| Возраст пациента, лет Patient age, years | 19 | 17 | 25 | 18 |
| Объем, мл Volume, ml | 1,8 | 3,5 | 1,0 | 2,5 |
| pH | 7,4 | 7,5 | 7,8 | 7,8 |
| Вязкость, мм Viscosity, mm | 10 | 15 | 15 | 60 |
| Концентраты сперматозоидов. млн/мл Sperm concentration, million/ ml | 7,2 | 158.0 | 243.0 | 10,5 |
| Живые сперматозоиды. % Alive spermatozoa. % | 94 | 92 | 98 | 84 |
| Морфологически нормальные. % Morphologically normal % | 0 | 12 | 0 | 0 |
| Сперматозоиды с поступательным движением. % Progressive motile spermatozoa. % | 13 | 39 | 2 | 31 |
| Лейкоциты.млн/мл Leukocytes, million/ml | 0.5 | 1.0 | 0.5 | 0.8 |
| Индекс НПК, % IGC index. % | 24.0 | 7,4 | 10.0 | 7.0 |
| Сперматоциты I порядка (прелептотена, зиготена), % Primary spermatocytes (preleptotene, zygotene), % | 7,2 | 2,3 | 3.0 | 6.0 |
| Сперматоциты 11 порядка. % Secondary spermatocytes, % | 63.8 | 87.0 | 84.0 | 81.0 |
| Нерасхождение ядер сперматид. % Spermatid nuclear nondisjunction, % | 29 | 16 | 16 | 14 |
| Нсидентифицируемые НПК.Я Non-idcntifiable ЮС. % | 28.апр | 04.май | 13.0 | 10,6 |
Биохимическое исследование семенной жидкости выполнено у 12 мужчин с МВ, в том числе у 7 пациентов со смешанной формой МВ и у 5 – с легочной формой (табл. 4). У остальных пациентов биохимическое исследование не проведено вследствие недоступности биологического материала или малого объема эякулята.
Таблица 4. Сперматологические и биохимические показатели эякулята у пациентов с муковисцидозом (МВ), n = 12
| Код пациента Patient code |
Возраст, лет Age, years | Форма МВ CF type | Спермиологический диагноз Spermiological diagnosis | Объем эякулята, мл Ejaculate volume, ml | рН эякулята Ejaculate pH | Биохимический показатель во всем объеме семенной жидкости Biochemical characteristic in the seminal fluid volume |
||
| Фруктоза (≥10 мг*) Fructose (>10 mg*) | Нейтральная α-гликозидаза, (≥20 мМЕ*) Neutral α-glycosidase, (≥20 mIU) | Лимонная кислота, мг (≥2,4 мг*) Cytric acid, mg (≥2.4 mg*) | ||||||
| 48468 | 27 | Смешанная Pancreaticinsufficient | Азооспермия Azoospermia | 0,9 | 6.0 | 0,099 | 18,81 | Н. и. N. s |
| 51947 | 22 | 0,7 | 6.0 | 0,112 | 17,57 | 7,0 | ||
| 52744 | 29 | 1,0 | 5,9 | 0,12 | 26,1 | 11,5 | ||
| 52942 | 26 | 1,0 | 6,0 | 0,12 | 26,5 | Н. и. N. s | ||
| 53039 | 23 | 0,6 | 6,0 | 0,102 | 13,44 | 1,56 | ||
| 53478 | 24 | 0,2 | 6.0 | 0,04 | 4,32 | Н. и. N. s | ||
| 54413 | 28 | 1,0 | 6,1 | 0,26 | 30,5 | 2,6 | ||
| 50838 | 23 | Легочная Pancreaticsufficient | Азооспермия Azoospermia | 6,0 | 8.0 | 1,98 | 126,6 | 47,4 |
| 51625 | 26 | Олигозооспермия тяжелой степени Severe oligospermia | 5,0 | 7,2 | 8,85 | 119,5 | 30,5 | |
| 53204 | 29 | Азооспермия Azoospermia | 1,4 | 6,0 | 1,498 | 30,38 | Н. и. N. s. | |
| 53363 | 27 | Олигозооспермия тяжелой степени Severe oligospermia | 0,5 | 6,2 | 0,075 | 10,75 | Н. и. N. s. | |
| 53807 | 28 | Азооспермия Azoospermia | 0,6 | 6,0 | 0,216 | 13,74 | 5,94 | |
Среднее значение содержания фруктозы в семенной жидкости в группе пациентов со смешанной формой МВ составило 0,122 ± 0,067 мг, а в группе пациентов с легочной формой МВ – 2,524 ± 3,629 мг. Только в 1 из 12 образцов ее концентрация была нормальной, в 2 других – ближе к нижней границы нормы, в остальных 9 – значительно ниже (менее 0,3 мг) нормы. У 3 из 5 обследованных мужчин с легочной формой МВ выявлено более высокое содержание фруктозы по сравнению с пациентами со смешанной формой МВ.
Среднее значение нейтральной α-гликозидазы в семенной жидкости у обследованных пациентов с МВ равнялось 36,52 ± 41,24 мМЕ (табл. 4). Количество данного фермента в исследованных образцах эякулята у 6 пациентов находилось в пределах нормы (в том числе у обоих мужчин с нормальными объемом и рН эякулята), а у 6 пациентов оно было ниже нормативных значений (менее 20 мМЕ). У мужчин с МВ, у которых обнаружено нормальное количество α-гликозидазы в семенной жидкости, объем эякулята был не менее 1 мл. Зависимости данного биохимического маркера от формы МВ не выявлено.
На концентрацию лимонной кислоты в семенной жидкости (биохимический маркер секреторной функции предстательной железы и эндокринной функции яичек) исследовано 7 мужчин с МВ. Ее содержание в эякуляте варьировало от 1,56 до 47,4 мг, при этом у 4 пациентов было сниженным, а у 3 – нормальным.
У 2 пациентов (коды 50838 и 51625) из 12 мужчин сМВ, которым проведено биохимическое исследование, диагностирована соответственно азоои олигозооспермия тяжелой степени (табл. 4). По результатам комплексного спермиологического исследования данные пациенты не имели двусторонней обструкции семявыносящих путей, поскольку показатели объема, pH и биохимических показателей свидетельствовали о возможном сохранении проходимости семявыносящих путей.
Обсуждение
Полученные данные свидетельствуют о наличии выраженных спермиологических нарушений примерно у 90 % мужчин с МВ, что объясняет высокую (97–98 %) частоту бесплодия у данных пациентов. Азоо-/криптозоо-, олигоспермия и выраженное снижение уровня рН и содержания фруктозы в семенной жидкости у мужчин с МВ, как и у пациентов с синдромом CBAVD (сongenital bilateral absence of the vas deferens – врожденная двусторонняя аплазия семявыносящих протоков), обусловлены двусторонней обструкцией семявыносящих протоков и аплазией семенных пузырьков, секрет которых составляет большую часть объема семенной жидкости [12]. При неполной обструкции семявыносящих путей на уровне семявыносящего протока и/или эпидидимиса в семенной жидкости обнаруживают малое число сперматозоидов и НПК [13–16].
Результаты обследования мужчин с МВ и с синдромом CBAVD позволили выделить сперматологические признаки, характерные для обструкции семявыносящих путей: олигоспермию (объем эякулята менее 1,5 мл), эякулят белого цвета и/или с pH менее 7,0, а также низкое (≤2,4 мг) содержание фруктозы в семенной жидкости. Для пациентов с МВ характерно нарушение экскреции желез внешней секреции из-за густого вязкого секрета, его застоя, инфицирования и хронического воспаления. У обследованных нами пациентов с МВ врожденные пороки развития и воспалительные заболевания половых органов в анамнезе не отмечены, выявлена нормальная концентрация лейкоцитов и у большинства нормальная вязкость эякулята, что свидетельствовало о невоспалительном характере поражения семявыносящих путей и половых желез. Согласно результатам биохимического исследования семенной жидкости мужчин с МВ экскреторная функция эпидидимиса может быть сохранна у половины из них, в том числе у 1/3 пациентов с обструктивной формой азооспермии, а секреторная функция предстательной железы – у большинства.
Нарушение проходимости семявыносящих протоков, функции хлорного канала в половых клетках и клетках Сертоли с возрастом пациента с МВ прогрессивно нарастают [17].
В норме сперматогенез протекает при активном участии клеток Сертоли: в них экспрессируется белок CFTR [5, 18]. Белок способствует секреторной и нутритивной функции клеток Сертоли в отношении половых клеток, регулирует движение жидкости в извитых семенных канальцах яичка. Секреция жидкости в семявыносящих канальцах важна для нормального прохождения процессов спермиогенеза, обеспечивая созревание и транспорт сперматозоидов в эпидидимис. Возможным механизмом нарушения сперматогенеза при мутациях гена МВ могут быть как нарушение регуляторной функции клеток Сертоли, так и снижение экспрессии белка CFTR в НПК. Повышенное количество сперматоцитов на допахитенных стадиях и резко повышенный или неопределяемый индекс НПК свидетельствуют о нарушении прохождения мейоза у мужчин, страдающих МВ. Изменения в клетках Сертоли вызывают прогрессирующее поражение. Таким образом, тяжесть непроходимости в семенных канальцах зависит от типа CFTR мутаций/генотипа и возраста пациентов [17]. А также у мужчин с МВ сперматологические нарушения могут иметь сочетанный характер поражения в результате как нарушений проходимости семявыносящих путей и секреции придаточных половых желез (в основном), так и поражения собственно сперматогенеза.
С развитием репродуктивных технологий у мужчин с азоои олигозооспермией тяжелой формы появилась возможность иметь собственных детей. Но у пациентов с МВ повышается риск рождения детей, больных МВ. При планировании деторождения необходимо провести обследование супруги на носительство мутаций гена CFTR с последующим медико-генетическим консультированием по поводу вероятности передачи МВ потомству, а в случае наличия мутаций (высокий риск наследования МВ) рекомендовать соответствующую дородовую (преимплантационную или пренатальную) ДНК-диагностику.
Заключение
Бесплодие, отмечаемое у большинства мужчин с МВ, обусловлено нарушением проходимости семявыносящих протоков, приводящим, как следствие, к обструктивной азооспермии. Частичная сохранность проходимости семявыносящих путей, а также выявленные случаи прогрессирования с возрастом аплазии vas deferens и семенных пузырьков у пациентов с МВ свидетельствуют не о первичном отсутствии (агенезии), а о нарушении развития данных производных вольфовых протоков. Характерными сперматологическими признаками при этом являются азоо-/криптозооспермия в сочетании с олигоспермией и низкими показателями pH и содержания фруктозы эякулята. У молодых мужчин с легочной формой МВ чаще встречается сохраненная проходимость семявыносящих протоков и возможная фертильность. Учитывая высокую вероятность прогрессирования поражения репродуктивной системы и нарушения фертильности, молодым мужчинам с МВ необходимо рекомендовать криоконсервацию сперматозоидов для дальнейшего использования в программах ЭКО/ICSI (экстракорпоральное оплодотворение/интрацитоплазматическая инъекция сперматозоидов).
Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Муковисцидоз. Под ред. Н.И. Капранова, Н.Ю. Каширской. М.: Медпрактика-М., 2014. ISBN: 978-5-98803-314-1. [Cystic fibrosis. Eds.: N.I. Kapranov, N.Yu. Kashirskaya. Moscow: MedpraktikaM., 2014. (In Russ.) ISBN: 978-5-98803314-1]. Riordan J.R., Rommens J.M., Kerem B. et al. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA. Science 1989;245 (4922):1066–73. DOI: 10.1126/science. 2475911. PMID: 2475911.
2. Chen M., Du J., Jiang W. et al. Functional expression of cystic fibrosis transmembrane conductance regulator in rat oviduct epithelium. Acta Biochim Biophys Sin (Shanghai) 2008;40(10):864–72. DOI: 10.1111/j.1745-7270.2008.00469.x. PMID: 18850051.
3. Черных В.Б. Ген муковисцидоза и нарушение фертильности у мужчин. Андрология и генитальная хирургия 2010;4: 23–31. [Chernykh V.B. Cystic fibrosis gene and fertility disorders in men. Andrologiya i Genitalnaya Khirurgiya = Andrology and Genital Surgery 2010;4:23–31. (In Russ.)].
4. Boockfor F.R., Morris R.A., DeSimone D. C. et al. Sertoli cell expression of the cystic fibrosis transmembrane conductance regulator. Am J Physiol 1998; 274(4 Pt 1): 922–30. DOI: 10.1152/ajpcell.1998.274(4):922–30. PMID: 9575788.
5. Teixeira S., Sá R., Grangeia A. et al. Immunohystochemical analysis of CFTR in normal and disrupted spermatogenesis. Syst Biol Reprod Med 2013;59:53–9. DOI: 10.3109/19396368.2012.718851. PMID: 22989055.
6. Руководство ВОЗ по исследованию и обработке эякулята человека. 5-е изд., 2010 г. Пер. с англ. Н.П. Макарова. Науч. ред. Л.Ф. Курило. М.: Капитал Принт, 2012. [WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th ed., 2010. Trans. from English N.P. Makarova. Scientific. ed. by L.F. Kurilo. Moscow: Kapital Print, 2012.].
7. Руководство ВОЗ по исследованию и обработке эякулята человека. 5-е изд., 2010 г. Пер. с англ. Н.П. Макарова. Науч. ред. Л.Ф. Курило. М.: Капитал Принт, 2012. [WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th ed., 2010. Trans. from English N.P. Makarova. Scientific Ed.: L.F. Kurilo. Moscow: Kapital Print, 2012.].
8. Курило Л.Ф., Чеботарев А.Н., Шилейко Л.В. др. Сравнительный анализ соотношения незрелых половых клеток на разных стадиях их дифференцировки в биоптате яичка и эякуляте у пациентов с азоои олигозооспермией. Проблемы репродукции 1997;1:80–4. [Kurilo L.F., Dubinskiy V.P., Ostroumova T.V. et al. Evaluation of spermatogenesis in the immature germ cells in ejaculate. Problemy Reproduktsii = Russian Journal of Human Reproduction 1995;1(3):33–8. (In Russ.)].
9. Андреева М.В., Хаят С.Ш., Шилейко Л.В. и др. Количественный кариологический анализ незрелых половых клеток из эякулята как часть протокола обследования мужчин с бесплодием в браке. Андрология и генитальная хирургия 2017;18(1):62–9. DOI: 10.17650/2070-9781-2017-18-1-62-69. [Andreeva M.V., Khayat S.S., Schileiko L.V. et al. Quantitative karyological analysis of immature germ cells from ejaculate as part of examination of patients with infertility in marriage. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2017;18(1):62–9. (In Russ.)].
10. Cooper T.G., Weidner W., Nieschlag E. The influence of inflammation of the human male genital tract on secretion of the seminal markers alpha-glucosidase, glycerophosphocholine, carnitine, fructose and citric acid. Int J Androl 1990;13 (5): 329–36. DOI: 10.1111/j.1365-2605.1990. tb01040.x. PMID: 2283178.
11. von Eckardstein S., Cooper T.G., Rutscha K. et al. Seminal plasma characteristics as indicators of cystic fibrosis transmembrane conductance regulator (CFTR) gene mutations in men with obstructive azoospermia. Fertil Steril 2000;73(6):1226–31. DOI: 10.1016/S0015-0282 (00) 00516–1. PMID: 10856487.
12. Silber S.J., Rodriguez-Rigau L.J. Quantitative analysis of testicle biopsy: determination of partial obstruction and prediction of sperm count after surgery for obstruction. Fertil Steril 1981;36(4):480–5. DOI: 10.1016/S0015–0282(16)45798-5. PMID: 7286271.
13. Jarow J.P., Budin R.E., Dym M. et al. Quantitative pathologic changes in the human testis after vasectomy. A controlled study. N Engl J Med 1985;313(20):1252–6. DOI: 10.1056/NEJM198511143132003. PMID: 4058505.
14. Mak V., Zielenski J., Tsui L.C. et al. Proportion of cystic fibrosis gene mutations not detected by routine testing in men with obstructive azoospermia. JAMA 1999; 281(23):2217–24. DOI: 10.1001/jama. 281.23.2217. PMID: 10376575.
15. Mak V., Zielenski J., Tsui L.C. et al. Cystic fibrosis gene mutations and infertile men with primary testicular failure. Hum Reprod 2000;15(2):436–9. DOI: 10.1093/ humrep/15.2.436. PMID: 10655318.
16. Diao R., Fok K.L., Zhao L. et al. Decreased expression of cystic fibrosis transmembrane conductance regulator impairs sperm quality in aged men. Reproduction 2013;146(6):637–45. DOI: 10.1530/REP-13-0146. PMID: 24077955.
17. Rato L., Socorro S., Cavaco J.E. et al. Tubular fluid secretion in the seminiferous epithelium: ion transporters and aquaporins in Sertoli cells. J Membr Biol 2010;236(2):215–24. DOI: 10.1007/s00232-010-9294-x. PMID: 20697886.
Статья опубликована в журнале "Андрология и генитальная хирургия" выпуск №4/2017, стр. 69-76









Комментарии