С. Х. Аль-Шукри, С. Ю. Боровец, М. А. Рыбалов
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. И. П. Павлова» Минздрава России; Россия, 197022 Санкт-Петербург, ул. Льва Толстого, 6–8
Контакты: Сергей Юрьевич Боровец sborovets@mail.ru
Введение
В настоящее время нарушения структуры ДНК сперматозоидов относят к ключевым факторам, влияющим на развитие эмбриона [1]. Повышенная (патологическая) степень фрагментации ДНК сперматозоидов (ФДС) в большинстве случаев возникает под действием оксидативного стресса и может приводить не только к бесплодию у мужчины, но и к замершей на ранних сроках беременности у его супруги или половой партнерши [2–5].
По данным многочисленных исследований, именно дефицит витаминов и микроэлементов (либо нарушение их обмена) в результате изменения среды обитания современного человека, характера его питания и образа жизни усугубляет оксидативный стресс, что отрицательно влияет на функционирование репродуктивной системы мужского организма [6–10].
В последние годы в терапии мужского бесплодия используют комплексы биологически активных веществ, обладающие антиоксидантными свойствами [11, 12]. Комплекс микронутриентов «УльтраФертил Плюс» является источником L-карнитина, коэнзима Q10, витамина E, цинка, селена, фолиевой кислоты и др.
L-карнитин увеличивает количество сперматозоидов и их подвижность, стимулирует их созревание, способствует элиминации их патологических форм [13, 14].
Цинк входит в состав супероксиддисмутазы (одного из важных антиоксидантных ферментов), участвует в биохимических процессах организма, повышает концентрацию сперматозоидов, увеличивает число сперматозоидов с нормальной морфологией и прогрессивно-подвижных сперматозоидов, а также является необходимым для синтеза тестостерона, играющего ключевую роль в обеспечении процессов спермато- и спермиогенеза [10].
Фолиевая кислота имеет большое значение для нормализации процессов сперматогенеза, способствует увеличению объема эякулята и улучшению его качества [10]. Прием фолиевой кислоты уменьшает количество дефектных форм сперматозоидов [15].
Селен – микроэлемент, способный сдерживать активность окислительного стресса. Он необходим для созревания сперматозоидов и нормального развития тканей яичек [16]. Прием селена способствует увеличению количества прогрессивно-подвижных форм сперматозоидов и снижению частоты их повреждения активными формами кислорода [7].
Витамин E – главный жирорастворимый антиоксидант, защищающий клеточные мембраны от окислительного повреждения. Витамин Е повышает жизнеспособность сперматозоидов, увеличивает их подвижность и концентрацию [10]. Прием витамина Е снижает интенсивность окислительного стресса в ткани яичек, улучшает способность сперматозоидов проникать в яйцеклетку [16].
Коэнзим Q10 – антиоксидант, играющий ключевую роль в переносе энергетических субстратов и образовании энергии в клетке. Он способен улучшать ключевые параметры спермограммы: концентрацию сперматозоидов, их подвижность и морфологию [17].
Важно отметить, что комбинация вышеуказанных компонентов обладает синергическими свойствами и повышает эффективность лечения в большей степени, чем использование каждого из компонентов по отдельности.
Цель исследования – оценить влияние комплекса «УльтраФертил Плюс» на динамику показателей эякулята при мужской идиопатической инфертильности.
Материалы и методы
В исследование включены 45 мужчин в возрасте от 24 до 48 лет (медиана 31 год), страдающих бесплодием в браке. Все пациенты принимали по 2 капсулы «УльтраФертила Плюс» 1 раз в день утром во время завтрака в течение 3 мес. Никакой другой терапии в период приема «УльтраФертила Плюс» пациенты не получали. У всех пациентов до и после курса оценивали гормональный статус, параметры спермограммы, результаты MAR-теста, определяли степень ФДС методом проточной цитофлюориметрии на аппарате FACSCantoll с использованием моноклональных антител (Roche). Нормальным уровнем сперматозоидов с фрагментированной ДНК считали ≤15 %.
Статистический анализ данных проводили с использованием программы Statistica 10.0. Данные представлены в виде медианы (Me) и интерквартильного размаха Me (Q25–Q75). Поскольку распределение значений отличалось от нормального (по результатам теста Колмогорова–Смирнова), все сравнения проведены с использованием непараметрического теста Вилкоксона для попарно связанных совокупностей данных.
Таблица 1. Показатели спермограммы пациентов с нарушениями репродуктивной функции до и после приема «УльтраФертила Плюс», Me (Q25–Q75 )
Table 1. Spermogram parameters in patients with abnormal reproductive function before and after a course of UltraFertile Plus, Me (Q25–Q75 )

Коэффициент корреляции вычисляли при помощи непараметрического теста Спирмена. Для выявления ассоциации патологического уровня ФДС с изучаемыми показателями гормонального статуса и сперматогенеза использовали метод логистической регрессии в модуле нелинейного оценивания. С этой целью пациентам, имевшим уровень ФДС ≤15 %, присваивали ранг «0», >15 % – ранг «1».
Результаты
После курса «УльтраФертила Плюс» у больных улучшились основные параметры спермограммы (табл. 1). Концентрация сперматозоидов увеличилась с 43,5 до 62,0 млн/мл (p <0,001), доля прогрессивно-подвижных форм (категорий А + В) – с 29,3 до 44,4 % (p <0,001), доля сперматозоидов снормальной морфологией (по данным тонкой морфометрии по Крюгеру) – с 3,0 до 4,0 % (p <0,001). Прием «УльтраФертила Плюс» статистически значимо снижал уровень ФДС – с 14,7 до 10,1 % (p = 0,001), но эффективность наблюдалась при значении ФДС, не превышающем 22 %. Прием комплекса не оказывал статистически значимого влияния на динамику результатов MAR-теста.
При оценке гормонального статуса установлено статистически значимое положительное влияние комплекса «УльтраФертил Плюс» на уровень общей и свободной фракций тестостерона (p <0,001, p = 0,004 соответственно), лютеинизирующего гормона (p <0,001) и фолликулостимулирующего гормона (p <0,001) в плазме крови (табл. 2). Прием комплекса не оказывал статистически значимого влияния на уровень ингибина В и глобулина, связывающего половые гормоны, в плазме крови.
Таблица 2. Гормональный статус пациентов с нарушениями репродуктивной функции, Me (Q25–Q75 )
Table 2. Hormonal status of patients with abnormal reproductive function, Me (Q25–Q75 )
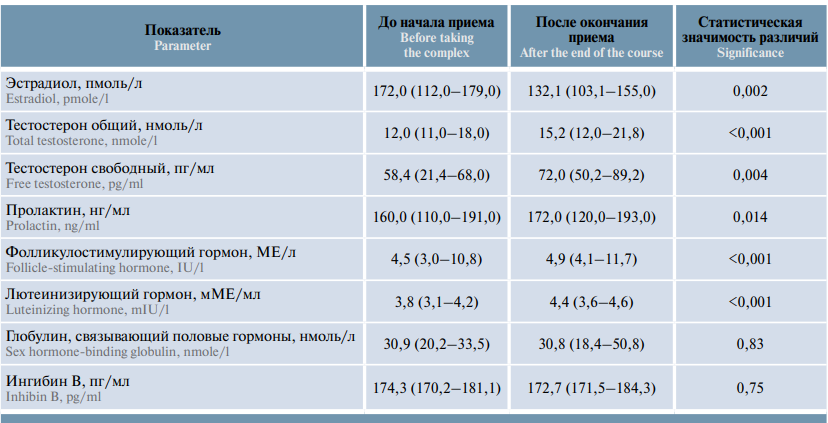
Таблица 3. Корреляция уровня гормонов с возрастом пациентов с нарушениями репродуктивной функции до начала приема «УльтраФертила Плюс»
Table 3. Correlation between hormone levels and age in patients with abnormal reproductive function before a course of UltraFertile Plus
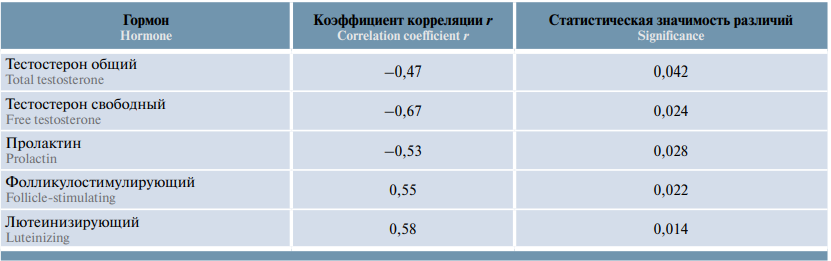
Проведенный корреляционный анализ выявил отрицательную корреляцию возраста пациентов с уровнем тестостерона (общего и свободного) и пролактина и положительную корреляцию – с уровнем фолликулостимулирующего и лютеинизирующего гормона до начала исследования (табл. 3). Давность заболевания положительно коррелировала с уровнем тестостерона, как общего (r = 0,53; p = 0,19), так и свободного (r = 0,90; p <0,001).
До начала приема «УльтраФертила Плюс» не было выявлено статистически значимой корреляции давности заболевания и параметров спермограммы. Возраст больных статистически значимо коррелировал с концентрацией сперматозоидов (r = 0,44; p = 0,008). Прием биоактивного комплекса «УльтраФертил Плюс» не повлиял на изменение исходных корреляционных зависимостей.
Обсуждение
В ходе исследования были получены данные о способности «УльтраФертила Плюс» улучшать основные показатели спермограммы у мужчин с идиопатической формой инфертильности – повышать концентрацию сперматозоидов, улучшать их морфологию и подвижность.
Исходя из полученных данных, можно заключить, что прием биоактивного комплекса «УльтраФертил Плюс» способствует снижению уровня патологической ФДС при ее исходном уровне <22 %, а также улучшает гормональный статус пациентов.
Заключение
Прием биоактивного комплекса «УльтраФертил Плюс» способствует снижению степени ФДС, увеличению количества сперматозоидов, их нормальных форм и повышению их подвижности. Отмечено статистически значимое положительное влияние биоактивного комплекса «УльтраФертил Плюс» на уровень общего и свободного тестостерона в плазме крови у пациентов с бесплодием.
Литература
- Божедомов В.А. Мужской фактор бездетного брака – пути решения проблемы. Урология 2016;(1, прил. 1):28–34. [Bozhedomov V.A. The male factor in childless marriage – problem solving strategies. Urologiya = Urology 2016;(1 Suppl 1):28–34. (In Russ.)].
- Sharlip I.D., Jarow J.P., Belker A.M. et al. Best practice policies for male infertility. Fertil Steril 2002;77(5):873–82.
- WHO manual for the standardized investigation, diagnosis and management of the infertile male. Cambridge: Cambridge University Press, 2000. 91 p.
- Kashir J., Jones C., Lee H.C. et al. Loss of activity mutations in phospholipase C zeta (PLCζ) abolishes calcium oscillatory ability of human recombinant protein in mouse oocytes. Hum Reprod 2011;26(12):3372–87. DOI: 10.1093/humrep/der336.
- Брагина Е.Е., Замятнина В.А., Гаврилов Ю.А. и др. Упаковка хроматина и фрагментация ДНК: два типа нарушений наследственного материала сперматозоидов. Медицинская генетика 2009;8(10):29–35. [Bragina E.E., Zamjatnina V.A., Gavrilov Ju.A. et al. Chromatin packing and DNA fragmentation: two types of infringements of a sperm hereditary material. Meditsinskaya genetika = Medical Genetics 2009;8(10):29–35. (In Russ.)].
- Wong W.Y., Thomas C.M., Merkus J.M. et al. Male factor subfertility: possible causes and the impact of nutritional factors. Fertil Steril 2000;73(3):435–42. DOI: 10.1016/s0015-0282(99)00551-8.
- Brody S.A. Мужское бесплодие и окислительный стресс: роль диеты, образа жизни и пищевых добавок. Андрология и генитальная хирургия 2014;15(3):33–41. [Brody S.A. Male factor infertility and oxidative stress: role of diet, lifestyle and nutritional supplements. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2014;15(3):33–41. (In Russ.)]. DOI: 10.17650/2070-9781-2014-3-33-41.
- Kumar R., Gautam G., Gupta M.P. Drug therapy for idiopathic male infertility: rationale versus evidence. J Urol 2006;176(4 Pt 1):1307–12. DOI: 10.1016/j.juro.2006.06.006.
- Showell M.G., Brown J., Yazdani A. et al. Antioxidants for male subfertility. Cochrane Database Syst Rev 2011;(1): CD007411. DOI: 10.1002/14651858. CD007411.pub2.
- Трухан Д.И., Макушин Д.Г. Роль и место антиоксидантов в комплексной терапии мужского бесплодия. Consilium Medicum 2015;17(7):37–43. [Trukhan D.I., Makushin D.G. Role and position of antioxidants in complex therapy of male infertility. Consilium Medicum 2015;17(7):37–43. (In Russ.)].
- Кореньков Д.Г., Павлов А.Л., Казимзаде Э.Д. Влияние препарата БЕСТФертил на репродуктивную функцию у мужчин с идиопатическим бесплодием. Андрология и генитальная хирургия 2018;19(4):54–9. [Korenkov D.G., Pavlov A.L., Kazimzade E.D. The influence of BESTFertil towards male reproductive function in idiopathic fertility. Andrology and Genital Surgery 2018; 19(4):54–9. (In Russ.)]. DOI: 10.17650/ 2070-9781-2018-19-4-54-59.
- Нашивочникова Н.А., Крупин В.Н., Селиванова С.А. Антиоксидантная терапия бесплодного брака. Урология 2015;(3):71–4. [Nashivochnikova N.A., Krupin V.N., Selivanova S.A. Antioxidant therapy for infertile couples. Urologiya = Urology 2015;(3):71–4. (In Russ.)].
- Павлов В.Н., Галимова Э.Ф., Катаев В.А. и др. Сравнительный анализ антиоксидантных эффектов коэнзима Q и L-карнитина у мужчин с идиопатической патоспермией. Медицинский вестник Башкортостана 2013;8(6):161–3. [Pavlov V.N., Galimova E.F., Kataev V.A. et al. The comparative analysis of coenzyme Q and L-carnitine antioxidanteffects in men with idiopathic pathospermia. Meditsinsky vestnik Bashkortostana = Bashkortostan Medical Journal 2013;8(6):161–3. (In Russ.)].
- Виноградов И.В., Блохин А.В., Афанасьева Л.М. и др. Опыт применения L-карнитина в лечении секреторного бесплодия у мужчин (обзор литературы). Андрология и генитальная хирургия 2009;10(2):19–22. [Vinogradov I.V., Blokhin A.V., Afanaseva L.M. Usage of L-carnitine in the treatment of the male infertility (a review). Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2009;10(2):19–22. (In Russ.)].
- Ebisch I.M., Thomas C.M., Peters W.H. et al. The importance of folate, zinc and antioxidants in the pathogenesis and prevention of subfertility. Hum Reprod Update 2007;13(2):163–74. DOI: 10.1093/humupd/dml054.
- Momeni H.R., Eskandari N. Effect of vitamin E on sperm parameters and DNA integrity in sodium arsenite-treated rats. Iran J Reproductive Med 2012;10(3):249–56.
- Safarinejad M.R. The effect of coenzyme Q10 supplementation on partner pregnancy rate in infertile men with idiopathic oligoasthenoteratozoospermia: an open-label prospective study. Int Urol Nephrol 2012;44(3):689–700. DOI: 10.1007/s11255-011-0081-0.













Комментарии