А.Б. Батько
Многопрофильная клиника «Семейный доктор»; Россия, 197349 Санкт-Петербург, ул. Парашютная, 23, корп. 2
Введение
Доброкачественная гиперплазия предстательной железы (ДГПЖ) – распространенное заболевание [1]. Частота ДГПЖ с отягчающей симптоматикой возрастает с 11,3 % в возрасте 40–49 лет до 81,4 % в возрасте 80 лет [2]. Несмотря на изученность этиологии и патогенеза ДГПЖ, остаются спорными вопросы лечения и профилактики данного заболевания с сопутствующими проявлениями: симптомами со стороны нижних мочевых путей, эректильной дисфункцией (ЭД) [3]. Возрастной андрогеннный дефицит (ВАД), проявляясь снижением самочувствия, снижением мышечной силы, сексуального влечения и т. д., усиливает эти симптомы, что приводит к «замыканию» больного на своем заболевании [4]. М. Marberger и соавт. показали, что у 84 % мужчин симптомы ДГПЖ привели к выраженному снижению качества жизни (КЖ), что квалифицирует ее как значимое заболевание [5].
Основные клинические рекомендации и стандарты лечения ДГПЖ базируются на длительном использовании лекарственных препаратов, а для коррекции ВАД рекомендованы препараты тестостерона [6, 7]. Однако пациенты не всегда регулярно посещают врача и проходят лабораторные исследования, а иногда самостоятельно отменяют препараты из-за побочных явлений, что не позволяет считать терапию адекватной.
Лечение ЭД – одна из важных составляющих комплексной терапии ДГПЖ. Результаты многоцентрового эпидемиологического исследования свидетельствуют овысокой распространенности ЭД, которая достигает 89,9 % [8]. В связи с открытием новой группы препаратов – ингибиторов фосфодиэстеразы 5-го типа (ИФДЭ-5) – рынок заполнили оригинальные препараты, а затем и дженерики, основными потребителями которых стали пациенты старшей возрастной группы, в том числе и принимающие селективные α1 -адреноблокаторы [9]. В 2012 г. в США рынок продаж препаратов ИФДЭ-5 оценивался в 2 млрд долл. Согласно отчету министерства обороны США с 2011 по 2014 г. военные закупили препараты группы ИФДЭ-5 на сумму 294 млн долл., а годовой объем продаж этих препаратов в Германии оценивается в 160 млн евро [10]. Такой спрос способствовал появлению на фармацевтическом рынке лекарственных препаратов сомнительного качества с незарегистрированными побочными эффектами.
Практически все синтетические лекарственные средства имеют большое количество побочных эффектов, что определяет их строгие курсовые дозы и необходимость постоянного лабораторного и врачебного контроля. Лечение больных с ДГПЖ с сопутствующей ЭД и ВАД не является исключением. В основном это связано с проведением гормонзаместительной терапии синтетическими препаратами у лиц старшей возрастной группы [11, 12]. Доверие к многовековому опыту фитотерапии заставляет потребителей отдавать предпочтение малотоксичным препаратам на основе растительных экстрактов, достоинствами которых являются возможность длительного применения и минимальная необходимость врачебного контроля.
Безопасность и эффективность растительных препаратов во многом зависят от их качества. В связи с популярностью растительных препаратов в последней резолюции Всемирная ассамблея здравоохранения по традиционной медицине обратилась к Всемирной организации здравоохранения с просьбой предоставить техническую поддержку для развития методов контроля и обеспечения качества, эффективности и безопасности продукции, после чего было разработано руководство GMP [13].
Обстоятельный литературный обзор на русском языке, посвященный фитопрепаратам, использующимися при ЭД, был представлен в 2017 г. [14]. Недостаток этого обзора в том, что он описывает только их основные клинические эффекты с предполагаемым механизмом действия. Репродуктивная система мужчины испытывает частичный дефицит различных биологически активных веществ. Это связано с питанием современными продуктами, что приводит к недостаточному образованию разнообразных коферментов, энзимов и прогормонов [15]. На репродуктивную сферу также влияют гормоноподобные ксенобиотики [16]. Таким образом, фитобиохимический взгляд на проблему изменений в предстательной железе при ДГПЖ, особенно с сопутствующей ЭД, дает направление для формирования новой парадигмы лечения – фармаконутритивной терапии [17], нормативы которой определены не только физиологически [18, 19], но и законодательно [20, 21].
Перспективность фитотерапии у больных ДГПЖ с сопутствующей ЭД мы изучили на примере оригинальной многокомпонентной биологически активной добавки к пище «Виалиссил для мужчин», разработанной специалистами отечественной компании «Фармакор продакшн». Основные компоненты Виалиссила®– экстракты эврикомы длиннолистной и эпимедиума. Подобная композиция имеет высокий биологический потенциал. Препарат прошел государственную регистрацию (№ RU. 77.99.88.003. Е. 003919.09.18 от 10.09.2018) и разрешен к применению в клинической практике. Представляет особый интерес оценка клинической эффективности данного препарата при лечении больных с ДГПЖ и сопутствующей ЭД в амбулаторных условиях.
Цель исследования – оценить клиническую эффективность фитопрепарата Виалиссил® в лечении пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ) и эректильной дисфункцией.
Материалы и методы
На базе многопрофильной клиники «Семейный доктор» (Санкт-Петербург) проведено обследование 34 пациентов в возрасте от 55 до 67 лет (средний возраст 59,6 ± 0,7 года) с ДГПЖ и сопутствующей ЭД, не требующих оперативного лечения. Длительность заболевания с момента постановки диагноза варьировала от 4 мес до 5 лет (в среднем 2,5 ± 1,6 года).
Критерии включения: наличие клинических и лабораторных признаков ВАД, отсутствие очаговых изменений предстательной железы и остаточной мочи при трансректальном ультразвуковом исследовании, отсутствие лабораторных и клинических признаков бактериального простатита.
Критерии исключения: объем остаточной мочи >50 мл, клинически значимая обструкция нижних мочевых путей, хронический простатит (исключая категории III и IIIB), уровень общего простатспецифического антигена >4 нг/мл.
Для первичной оценки ВАД использовали стандартизированный опросник AMS (Aging Males’ Symptoms Scale, шкала оценки симптомов старения мужчин). Отдельно оценивали психологический, соматический, сексологический симптомокомплексы, а затем подсчитывали общую сумму баллов. Степень выраженности ЭД оценивали с использованием международного индекса эректильной функции (International Index оf Erectile Function, МИЭФ-5).
Концентрацию общего тестостерона (ОТ), лютеинизирующего гормона (ЛГ), эстрадиола (Е2 ) и глобулина, связывающего половые гормоны (ГСПГ), определяли методом твердофазного хемилюминесцентного иммуноанализа. Расчет индекса свободных андрогенов (ИСА) осуществляли по формуле: ИСА = (ОТ/ ГСПГ) × 100, предложенной M. Carruthers [22].
В задачи исследования входило:
- оценить динамику клинических симптомов заболевания, лабораторных и психоэмоциональных показателей при применении Виалиссила®;
- изучить переносимость и безопасность Виалиссила® при ежедневном приеме внутрь в виде капсул 1 раз в сутки в течение 30 дней.
До начала терапии и после ее окончания проводили анкетирование пациентов, а также лабораторное изучение гормонального статуса. Побочные эффекты оценивали с помощью карты регистрации нежелательных явлений.
Все пациенты получали назначенную ранее симптоматическую терапию ДГПЖ и ЭД (α1 -адреноблокаторы и ИФДЭ-5 по требованию). Пациенты были распределены по 2 сопоставимым группам. В основную группу включили 18 пациентов, которым дополнительно был назначен Виалиссил® внутрь в виде капсул 1 раз в сутки в течение 30 дней. Остальные 16 пациентов составили контрольную группу.
В состав препарата Виалиссил® входят: экстракт эврикомы длиннолистной, экстракт эмпедиума, цинк (16,0 ± 5 мг), токоферол (10,0 ± 02 мг), экстракт йохимбе (1,2 мг), икариин (10 мг) экстракт пальмы сабаль, селен (70,0 ± 10 мкг). Препарат разрешен к применению в качестве биологически активной добавки. Противопоказаниями к приему препарата являются индивидуальная непереносимость, нарушения сердечного ритма, выраженный атеросклероз.
Эврикома длиннолистная (Eurycoma longifolia) – вид кустарниковых растений из семейства симарубовых. Экстракт корня эврикомы (КЭ) много веков используется в традиционной медицине Востока как стимулятор полового влечения и как естественная альтернатива заместительной гормональной терапии [23]. В 2014 и 2017 гг. были опубликованы систематические обзоры, включившие более 300 рандомизированных исследований и показавшие эффективность использования КЭ в лечении ЭД [24, 25]. В то же время большинство научных источников не дают сведений о механизмах действия экстракта КЭ, описывая только клинические эффекты его применения. КЭ содержит фенольные соединения (эврикоманоны, эврикоманол, эврикомалактон), алкалоиды, дубильные вещества. Многие исследователи сравнивают механизм действия экстракта КЭ с биохимическими эффектами препаратов на основе Tribulus terrestis, но это отчасти неверно, так как данное растение содержит фуростаноловые гликозиды, среди которых преобладает протодиосцин. Последний метаболизируется до дегидроэпиандростерона, который является самостоятельным полифункциональным стероидным гормоном [26]. Следовательно, стимуляция выработки ОТ при использовании КЭ может быть связана с ингибированием ароматазы и/или снижением концентрации ГСПГ, что будет приводить к повышению концентрации биологически доступного тестостерона.
Трава эпимедиума (горянки) (Epimedii herba) (ТЭ) широко используется в восточной традиционной медицине и занимает ведущее место в китайской государственной фармакопее [27]. На сегодняшний день из растений этого рода выделено и идентифицировано более 60 флавоноидов, представленных в большом количестве пренилированными гликозидами кемпферола. Помимо флавоноидов, биологическая активность (в основном, антиоксидантная) обусловлена присутствием моносахаридов (маннозы, глюкозы, 6-деоксиманнозы, галактозы, арабинозы), витамина С и галактуроновой кислоты [28]. В исследованиях in vitro и in vivo продемонстрирована эффективность ТЭ, главным образом одного из содержащихся в ней веществ – икариина,– приоксидативном стрессе. Антиоксидантные свойства ТЭ связаны с индуцированием активности каталазы и глютатионпероксидазы, вследствие чего токсичные свободные радикалы и перекиси превращаются в нейтральные метаболиты, а также с тем, что флавоноиды нейтрализуют свободные радикалы, отдавая им свои электроны [29].
Достоверность результатов клинических исследований оценивали при помощи критерия Стьюдента. Для этого определяли среднее арифметическое (М), ошибку среднего арифметического (m), коэффициент статистической значимости (p).
Результаты и обсуждение
Сравнение исходной оценки ВАД в исследуемых группах показало отсутствие различий, что свидетельствует об их сопоставимости (поэтому данные о состоянии пациентов до лечения приводятся без деления на группы).
До лечения суммарная оценка выраженности симптоматики по шкале AMS была сопоставимой (средней) в обеих группах больных. Выявлено почти одинаковое распределение по всем симптомокомплексам (психологическому, соматическому, сексологическому).
После лечения в обеих группах больных отмечено снижение выраженности общей симптоматики: в контрольной группе – на 4 балла, с наибольшим снижением оценки психологического компонента шкалы. В основной группе выраженность ВАД уменьшилась на 10 баллов, причем не только за счет психологического компонента, но и за счет сексологической составляющей (табл. 1). Изменения в сексуальной сфере подтверждены при использовании опросника МИЭФ-5 (табл. 2).
Таблица 1. Выраженность симптомов возрастного андрогенного дефицита до и после лечения (по шкале Aging Males’ Symptoms Scale)
| Показатель | Число пациентов, абс. (%) | Выраженность андрогенного дефицита, баллы, М ± m | ||
| До лечения | Контрольная группа (n = 16) | Основная группа (n = 18) | ||
| Суммарная оценка | 34 (100) | 38,7 ± 1,4 | 34,2 ± 1,4 | 28,4 ± 1,4* |
| Психологический симптомокомплекс | 21 (61,8) | 21,6 ± 1,4 | 18,1 ± 1,4 | 16,1 ± 1,4 |
| Соматический симптомокомплекс | 5 (14,7) | 6,7 ± 1,4 | 6,5 ± 1,4 | 4,1 ± 1,4 |
| Сексологический симпто- мокомплекс | 8 (23,5) | 10,4 ± 1,4 | 9,6 ± 1,4 | 6,2 ± 1,4 |
*Различия с исходными значениями статистически значимы (р <0,05).
Таблица 2. Значения международного индекса эректильной функции у пациентов с доброкачественной гиперплазией предстательной железы до и после лечения
| Степень тяжести эректильной дисфункции | Число пациентов, абс. (%) | Индекс, баллы, M ± m | ||
| До лечения | Контрольная группа (n = 16) | Основная группа (n = 18) | ||
| Легкая | 18 (52,9) | 20,4 ± 2,6 | 21,5 ± 2,3 | 25,4 ± 2,9 |
| Средняя | 9 (26,5) | 15,6 ± 1,8 | 17,4 ± 2,1 | 21,4 ± 2,2* |
| Значительная | 7 (20,6) | 6,9 ± 1,6 | 8,8 ± 1,7 | 14,5 ± 1,9* |
*Различия с исходными значениями статистически значимы (р <0,05).
До лечения оценка степени эректильной дисфункции в обеих группах статистически не различалась. После курса терапии эректильная функция улучшилась в обеих группах, однако только в группе пациентов, которые дополнительно принимали Виалиссил®, это улучшение было статистически значимым.
Важнейшую роль в диагностике патологических состояний урогенитальной сферы, ведущих к нарушению половой функции у мужчин, играет исследование гормонального статуса. Как видно из табл. 3, через 1 мес комплексной терапии ДГПЖ и ЭД уровень ОТ повысился у всех пациентов, но только после применения Виалиссила® отмечено статистически значимое повышение. В контрольной группе пациентов, получавших стандартную терапию, содержание ОТ повысилось на 10,8 %, а в основной группе, пациенты которой принимали дополнительно Виалиссил®, уровень ОТ вырос на 16,5 %. Концентрации ЛГ и Е2 не изменились, что позволяет судить об отсутствии влияния исследуемого препарата на гипоталамо-гипофизарную ось и процессы ароматизации тестостерона. Наибольший интерес представляет значительное повышение содержания биодоступного тестостерона, установленное при расчете ИСА в основной группе пациентов. Этот показатель не изменился в контрольной группе, а после 30-дневного приема Виалиссила® увеличился в 2 раза. Такая динамика позволяет предположить, что Виалиссил® повышает уровень биологически доступного (активного) тестостерона в крови за счет снижения концентрации ГСПГ. Данная гипотеза является рабочей и требует проведения дополнительных исследований на большем материале, а также биохимических и гормональных исследований. Мы не нашли в доступной литературе источники, описывающие данный механизм действия, что определяет актуальность дальнейших исследований.
Благодаря входящим в состав растительным компонентам и микроэлементам, способствующим повышению уровня биологически доступного тестостерона и снижению проявлений ЭД, применение Виалиссила® эффективно при ДГПЖ с сопутствующей ЭД и проявлениями ВАД. Побочных эффектов за время наблюдения отмечено не было.
Ретроспективный анализ отечественной и иностранной литературы для определения точек приложения компонентов исследуемого препарата позволил судить об их механизме действия. Отметим, что обширный массив изученной литературы посвящен историческим аспектам традиционной медицины. Однако в последнее десятилетие появились исследования биохимических аспектов действия экстрактов ТЭ и КЭ.
Икариин – наиболее изученный флавоноид в составе ТЭ. Активность икариина обусловлена высвобождением оксида азота (NO) в эндотелии сосудов, что доказано в эксперименте на крысах с индуцированным диабетом. Выраженность наблюдаемых у крыс признаков ЭД (снижение внутрикавернозного давления, уменьшение соотношения гладкой мускулатуры и коллагена) снижалась при применении икариина, т. е. он способствовал сохранению гемодинамики в половом члене, нормализации соотношения гладкой мускулатуры и коллагена и поддерживал экспрессию NO-синтазы [30]. В другом исследовании икариин ингибировал активность фосфодиэстеразы 5-го типа (ФДЭ-5) и повышал уровень циклического гуанозинмонофосфата в гладкомышечных клетках пещеристых тел [31]. Укрыс с ЭД, смоделированной путем перевязки внутренней половой артерии, после перорального применения икариина в дозах 5 и 10 мг/кг/сут в течение 30 дней наблюдалось улучшение эректильной функции – повышение давления в пещеристых телах и восстановление экспрессии NO [32]. Несомненно, полученные экспериментальные данные нельзя экстраполировать на человеческий организм, но результаты проведенных экспериментов показывают механизм действия растительного сырья.
Таблица 3. Содержание половых гормонов в сыворотке крови у пациентов с доброкачественной гиперплазией предстательной железы и эректильной дисфункцией до и после лечения
| Показатель | Контрольная группа (n = 16) | Основная группа (n = 18) | ||
| До лечения | Через 1 мес после лечения | До лечения | Через 1 мес после лечения | |
| Лютеинизирующий гормон, МЕ/л | 4,2 ± 0,6 | 4,3 ± 0,7 | 3,9 ± 0,3 | 3,8 ± 0,8 |
| Глобулин, связывающий половые гормоны, нмоль/л | 43,1 ± 4,4 | 44,8 ± 5,5 | 42,8 ± 4,8 | 24,3 ± 2,5 |
| Эстрадиол, пкмоль/л | 63 ± 5,4 | 65 ± 4,9 | 59 ± 5,1 | 60 ± 4,7 |
| Тестостерон, нмоль/л | 10,1 ± 0,9 | 11,2 ± 1,3 | 10,9 ± 1,3 | 12,7 ± 1,7 |
| Индекс свободных андрогенов расчетный, % | 24 ± 1,3 | 25 ± 1,4 | 25 ± 1,4 | 52 ± 5,1* |
*Различия с исходными значениями статистически значимы (р <0,05).
В последующих исследованиях доказан дозозависимый эффект и установлены концентрации, при которых икариин и другие флавоноиды ТЭ и КЭ угнетают действие ферментов, ответственных за развитие ЭД: ФДЭ-5, аргиназы и ангиотензин-1-превращающего фермента [33–36]. Оценивали концентрацию IC50, которая ингибирует действие 50 % соответствующего энзима (табл. 4).
Таблица 4. Сравнение ингибирующего влияния на фосфодиэстеразу 5-го типа некоторых компонентов Виалисссила® (биофлавоноидов и их гликозидов) и препаратов сравнения (данные из [33–36])
| Компонент | Концентрация полумаксимального ингибирования (IC50), мкмоль/л |
| Компоненты Виалиссила®: Eurycoma longifolia икариин |
0,43 0,23 |
| Препараты сравнения: Comparison drugs: силденафила цитрат sildenafil citrate папаверина гидрохлорид |
>0,0035* 0,68 |
*В соответствии с официальной инструкцией к препарату
Из таблицы 4 видно, что экстракты растительных препаратов хотя и обладают ингибирующим действием на ФДЭ-5, но в меньшей концентрации, чем селективный ингибитор (силденафила цитрат), однако клинический эффект применения экстрактов КЭ и ТЭ свидетельствует об определенной точке приложения, а безопасность курсового применения положительно характеризует фитотерапию больных с ЭД.
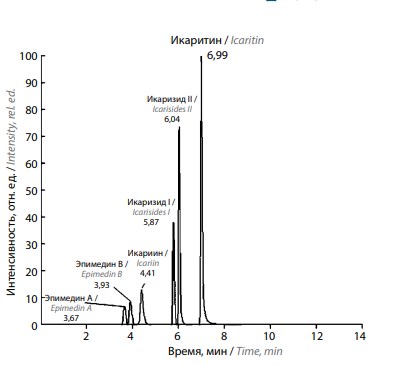
Хроматограмма различных флавоноидов травы эпимедиума [37]
Как отмечено выше, наиболее изученным флавоноидом ТЭ является икариин. Однако последние исследования, проведенные на химическом факультете Московского государственного университета им. М.В.Ломоносова, вносят коррективы в это положение. Методом тандемной масс-спектрометрии с высоким разрешением произведена точная идентификация флавоноидов ТЭ (см. рис.) [37]. Всвязи с этим расширяются перспективы изучения основных биологических компонентов ТЭ, что позволяет выделить их с целью создания лекарственного препарата направленного действия.
Заключение
Применение препарата Виалиссил® сопровождается улучшением состояния пациента и улучшением эректильной функции по МИЭФ-5 при ДГПЖ. Виалиссил® в составе комплексной терапии ДГПЖ и проявлений ВАД улучшает гормональный статус больных – повышает уровень биологически доступного тестостерона (индекс свободных андрогенов) за счет снижения уровня глобулина, связывающего половые гормоны. Экстракты КЭ и ТЭ ингибируют действие ферментов, ответственных за эректильную функцию. Прием Виалиссила®, содержащего экстракты ТЭ и КЭ, внутрь в капсулах в течение 30 дней является безопасным и может быть рекомендован для коррекции сексуальных расстройств у больных с ДГПЖ, а также проведения реабилитационной консервативной терапии после завершения основного лечения этого заболевания.
Литература
- Тюзиков И.А., Калинченко С.Ю., Ворслов Л.О. и др. Бессимптомная доброкачественная гиперплазия предстательной железы: три стороны одной проблемы. Русский медицинский журнал 2013;21(34):1768–72. [Tuzikov I.A., Kalinchenko S.Yu., Vorslov L.O. et al. Asymptomatic benign prostatic hyperplasia: the three faces of the same problem. Russky meditsinsky zhurnal = Russian Medical Journal 2013;21(34):1768–72. (In Russ.)].
- Калинина С.Н., Бурлака О.О., Александров М.С., Выдрин П.С. Диагностика и лечение симптомов нижних мочевых путей и эректильной дисфункции у больных с доброкачественной гиперплазией предстательной железы. Урологические ведомости 2018;8(1):26–33. [Kalinina S.N., Burlaka O.O., Aleksandrov M.S., Vydryn P.S. Diagnosis and treatment of lower urinary tract symptoms and erectile dysfunction in patients with benign prostate hyperplasia. Urologicheskie vedomosti = Urological Statements 2018;8(1):26–33. (In Russ.)]. DOI: 10.17816/uroved8126-33.
- Петричко М.И., Волков А.А., Будник Н.В., Духин А.Р. Оценка симптомов нижних мочевых путей и эректильной дисфункции как основы качества жизни у больных с ДГПЖ до начала медикаментозной терапии. Дальневосточный медицинский журнал 2012;(1):51–5. [Petrichko M.I., Budnik N.V., Volkov A.A., Dukhin A.R. Lower urinary tract symptoms and erectile dysfunction assessment, as quality of life baseline in patients with BPH, before medical treatment. Dal’nevostochny meditsinsky zhurnal = Far East Medical Journal 2012;(1):51–5. (In Russ.)].
- Тюзиков И.А., Калинченко С.Ю. Доброкачественная гиперплазия предстательной железы как системное гормонально-метаболическое заболевание: время изменить парадигмы патогенеза и фармакотерапии. Эффективная фармакотерапия 2016;(33):32–53. [Tyuzikov I.A., Kalinchenko S.Yu. Benign prostatic hyperplasia as a systemic hormone-metabolic disease: time to change paradigm of pathogenesis and drug therapy. Effektivnaya farmakoterapiya = Effective Pharmacotherapy 2016;(33):32–53. (In Russ.)].
- Marberger M., Harkaway R., de la Rosette J. Optimising the medical management of benign prostatic hyperplasia. Eur Urol 2004;45(4):411–9. DOI: 10.1016/j.eururo.2003.10.016. PMID: 15041103.
- Berkseth K.E., Thirumalai A., Amory J.K. Pharmacologic therapy in men’s health: hypogonadism, erectile dysfunction and benign prostatic hyperplasia. Med Clin North Am 2016;100(4);791–805. DOI: 10.1016/j.mcna.2016.03.006. PMID: 27235615.
- Люненфельд Б., Мсхалая Г.Ж., Зицман Н. и др. Рекомендации по диагностике, лечению и мониторированию гипогонадизма у мужчин. Эффективная фармакотерапия 2015;(27):6–20. [Lunenfeld B., Mskhalaya G.Zh., Zitzmann M. et al. Recommendations on the diagnosis, treatment and monitoring of hypogonadism in men. Effektivnaya farmakoterapiya = Effective Pharmacotherapy 2015;(27):6–20. (In Russ.)].
- Пушкарь Д.Ю., Камалов А.А., Аль-Шукри С.Х. и др. Анализ результатов эпидемиологического исследования распространенности эректильной дисфункции в Российской Федерации. Урология 2012;(6):5–9. [Pushkar D.Yu., Kamalov A.A., Al-Shukri S.Kh. et al. Analysis of the results of epidemiological study on prevalence of erectile dysfunction in the Russian Federation. Urologiya = Urology 2012;(6):5–9. (In Russ.)].
- Батько А.Б., Осешнюк Р.А. Проблемы применения генериков в урологической практике. Биомедицина 2010;(4):68–9. [Bat’ko A. B., Oseshnyuk R.A. Problems of application of generics in urologycal practice. Biomeditsina = Biomedicine 2010;(4):68–9. (In Russ.)].
- Раввинская Т. Будущее нестоящего. Vademecum 2015;27(94):26–31. [Ravvinskaya T. The future of not standing. Vademecum 2015;27(94):26–31. (In Russ.)].
- Ефремов Е.А., Красняк С.С. Возможные риски при терапии тестостероном. Экспериментальная и клиническая урология 2017;(1):90–6. [Efremov E.A., Krasnyak S.S. Potential risks of testostetone replacement therapy. Eksperimentalnaya i klinicheskaya urologiya = Experimental and Clinical Urology 2017;(1):90–6. (In Russ.)].
- Hassan J., Barkin J. Testosterone deficiency syndrome: benefits, risks, and realities associated with testosterone replacement therapy. Can J Urol 2016;23(Suppl 1):20–30. PMID: 26924592.
- World Health Organization monographs. Updated supplementary guidelines for the manufacture of herbal medicine. Geneva: WHO, 2006. 357 p.
- Хаджиева Б.Р. Клиническая оценка влияния основных фитопрепаратов на эректильную функцию с позиции доказательной медицины. Consilium Medicum 2017;19(7):86–8. [Khadzhieva B.R. Clinical evaluation of the effect of basic phytopreparations on erectile function from the perspective of evidence-based medicine. Consilium Medicum 2017;19(7):86–8.(In Russ)]. DOI: 10.26442/2075-1753_19.7.86–88.
- Лысиков Ю.А. Роль и физиологические основы обмена макро- и микроэлементов в питании человека. Экспериментальная и клиническая гастроэнтерология 2009;(2):120–31. [Lysikov Yu.А. Role and physiological elements of macro- and microelements exchange in the human nutrition. Eksperimentalnaya i klinicheskaya gastroenterologiya = Experimental and Clinical Gastroenterology 2009;(2):120– 31. (In Russ.)].
- Никитин А.И. Гормоноподобные ксенобиотики и их роль в репродуктивной функции человека. Медицинская экология 2006;(1):9–16. [Nikitin А.I. Hormone-like xenobiotics and its role in the human reproductive function. Меditsinskaya ekologiya = Меdical Ecology 2006;(1):9–16. (In Russ.)].
- Батько А.Б., Тагиров Т.Н., ИдрисовШ.Н. и др. Возможности применения растительных препаратов в стероидогенезе у мужчин с гипогонадизмом. Андрология и генитальная хирургия 2016;17(2):112–8. [Bat’ko A. B., Tagirov N.S., Idrisov Sh.N. et al. Possibility of the use of herbal medicines in steroidogenesis in hypogonadal men. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2016; 17(2):112–8. (In Russ.)]. DOI: 10.17650/ 2070-9781-2016-17-2-112-118.
- Нотова С.В. Элементный статус человека – возрастной аспект. Гигиена окружающей и производственной среды 2005;1(6):91–3. [Notovа S.V. Human elemental status – age-related aspect. Gigiena okruzhayushchey i proizvodstvennoy sredy = Environmental and Industrial Hygiene 2005;1(6):91–3. (In Russ.)].
- Gropper S.S., Smith J.L. Advanced nutrition and human metabolism, 6th edn. Wadsworth, 2013. 608 p.
- Mетодические рекомендации МР 2.3.1.2432–08. Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации (утверждено Роспотребнадзором 18.12.2008). [Меthodic Recommendations 2.3.1.2432–08. Norms of physiological needs for energy and nutrient materials for different population groups of the Russian Federation(approved by Rospotrebnadzor 18.12.2008). (In Russ.)].
- Всемирная организация здравоохранения. Региональные публикации ВОЗ. Европейская серия. № 96. Питание и здоровье в Европе: новая основа для действий. М.: Весь Мир, 2005. 505 с. [World Health Organization. WHO Regional Publications. European Series. No. 96. Food and health in Europe: a new basis for action. Moscow: Ves mir, 2005. 505 p. (In Russ.)].
- Каррузерс М. Революция тестостерона. Пер. с англ. М., Медпрактика-M, 2005. C. 34–35. [Carruthers M. The Testosterone Revolution. Transl. from English. Moscow: Medpraktika-M, 2005. Pp. 34–35. (In Russ.)].
- George A., Henkel R. Phytoandrogenic properties of Eurycoma longifolia as natural alternative to testosterone replacement therapy. Andrologia 2014;46(7):708–21. DOI: 10.1111/and. 12214. PMID: 24386995.
- Kotirum S., Ismail S.B., Chaiacunapruk N. Efficacy of Tongkat Ali (Eurycoma longifolia) on erectile function improvement: systematic review and meta-analysis of randomized controlled trials. Complement Ther Med 2015;23(5):693–8. DOI: 10.1016/j. ctim.2015.07.009. PMID: 26365449.
- Thu H.E., Mohamed I.N., Hussain Z. et al. Eurycoma Longifolia as a potential adoptogen of male sexual health: a systematic review on clinical studies. Chin J Nat Med 2017;15(1):71–80. DOI: 10.1016/S1875-5364(17)30010-9. PMID: 28259255.
- Попов С.В. Применение трибестана в лечении андрологических заболеваний. Русский медицинский журнал 2011;(16):1013–7. [Popov S.V. Administration of Tribestan in management of andrological diseases. Russkiy meditsinskiy zhurnal = Russian Medical Journal 2011;(16):1013–7. (In Russ.)].
- Editorial Committee of Pharmacopoeia of Ministry of Health PR China. The Pharmacopoeia of People’s Republic of China: part II. Beijjing: China Chemical Industry Press, 2010. P. 306.
- Sze S.C., Tong Y., Ng T.V. et al. Herba Epimedii: anti-oxidative properties and its medical implications. Molecules 2010;15(11):7861–70. DOI: 10. 3390/ molecules15117861. PMID: 21060294.
- Азарова О.В., Галактионова Л.П. Флавоноиды: механизм противовоспалительного действия. Химия растительного сырья 2012;(4):61–78. [Azarova O.V., Galaktionova L.P. Flavonoids: the mechanism of antiinflammatory action. Khimiya rastitelnogo syr’ya = Chemistry of Plant Raw Materials 2012;(4):61–78. (In Russ.)].
- Lui T., Xin H., Li W.R. et al. Effects of icariin on improving erectile function in streptozotocin-induced diabetic rats. J Sex Med 2011;8(10):2761–72. DOI: 10.1111/j. 1743–6109.2011.02421. PMID: 21967314.
- Ning H., Xin Z.C., Lin. et al. Effects of icariin on phosphodiesterase-5 activity in vitro and cyclic guanosine monophosphate level in cavernous smooth muscle cells. Urology 2006;68(6):1350–4. DOI: 10.1016/j.urology.2006.09.031. PMID: 17169663.
- Tian L., Xin Z.C., Lui W.J. et al. Effect of icariin on the erectile function and expression of nitrogen oxide synthaze isoforms in corpus cavernosum of arterigenic erectile dysfunction rat model. Zhonghua Yi Xue Za Zhi 2004;84(11):954–7. PMID: 15329286.
- Oboh G., Adebayo A.A., Ademosun A.O. Phenolic-rich extract of Eurycoma longifolia and Cilicodiscus gabunensis inhibt enzymes responsible for the development of erectile dysfunction and are antioxidants. J Basic Clin Pharmacol 2018;29(6):689–96. DOI: 10.1515/ jbcpp-2017-0160. PMID: 29777610.
- Xin Z.C., Kim E.K., Lin C.S. et al. Effects of icariin on cGMP-specific PDE5 and cAMP-specific PDE4 activities. Asian J Androl 2003;5(1):15–8. PMID: 12646997.
- Adefegha S.A., Oboh G., Okeke B.M. et al. Comparative effects of alkaloid extracts from Aframomum melegueta (Alligator pepper) and Aframomum danielli(Bastered melegueta) on enzymes relevant to erectile dysfunction. J Diet Suppl. 2017;14(5):542–52. DOI: 10.1080/19390211.2016.1272661. PMID: 28165832.
- Shindel A.W., Xin Z.C., Lin G. et al. Erectogenic and neurotprophic effects of icariin, a purified extract of horny goat weed(Epimedium spp.) in vitro and in vivo. J Sex Med 2010;4(1):1518–28. DOI: 10/1111/j.1743-6109.2009.01699. PMID: 20141584.
- Шевлякова О.А., Васильев К.Ю., Ихалайнен И.К. и др. Идентификация флавоноидов горянки методом тандемной масс-спектрометрии высокого разрешения. Журнал аналитической химии 2016;71(8):800–8. DOI: 10.7868/S00444450216080132. [Shevlyakova O.A., Vasilyev K.Y., Ikhalainen I.K. et al. Identification of Goryanka flavonoids by high-resolution tandem mass spectrometry. Zhurnal Analiticheskoy Khimii = Journal of Analytical Chemistry 2016;71(8):800–8. (In Russ.)].
Статья опубликована в журнале "Андрология и генитальная хирургия" выпуск №4 2018, стр. 46-53









Комментарии