А.А. Капто
ФГАОУ ВО «Российский университет дружбы народов»; Россия, 117198 Москва, ул. Миклухо-Маклая, 6
Введение
Компрессия левой общей подвздошной вены и фиброзные спайки в ней впервые были описаны немецким патологом R. Virchow в 1851 г. [1]. Он отметил, что глубокие илеофеморальные тромбозы встречались в 5 раз чаще в левой ноге, чем в правой. По данным исследователей [2–5], компрессия левой общей подвздошной вены – широко распространенная патология, которая встречается у 22–50 % населения (без разделения по половому признаку) (табл. 1).
Таблица 1. Частота выявления фиброзных спаек в просвете левой общей подвздошной вены при аутопсиях (без разделения по половому признаку)
| Автор | Год публикации | Количество аутопсий, абс. | Частота выявления спаек, % |
| J.P. McMurrich [2] | 1908 | 57 | 30 |
| W.E. Ehrich, E.B. Krumbhaar [3] | 1943 | 412 | 23,8 |
| R. May, J. Thurner [4] | 1957 | 430 | 22 |
| N. Usui и соавт. [5] | 1978 | 90 | 50 |
В англоязычной литературе синдром компрессии левой общей подвздошной вены чаще называют синдромом Мея–Тернера (May–Thurner syndrome). Бессимптомная компрессия левой общей подвздошной вены у взрослого населения, по данным H.C. Baron и соавт., встречается в 16–20 % случаев [6]. Естественное течение синдрома Мея–Тернера является предпосылкой развития илеофеморального тромбоза и посттромботического синдрома. Развернутая клиническая картина илеофеморального тромбоза у больных с синдромом компрессии левой общей подвздошной вены также называется синдромом Кокетта (Cockett syndrome) [7, 8].
До недавнего времени актуальность проблемы синдрома Мея–Тернера связывали только с его тромботическими осложнениями. При нетромботической компрессии левой общей подвздошной вены развивается клиническая картина, обусловленная полнокровием как внутренней, так и наружной подвздошных вен. Полнокровие внутренней подвздошной вены обусловливает полнокровие вен органов малого таза из-за развития коллатерального кровообращения. Полнокровие наружной подвздошной вены приводит к появлению ретроградного кровотока во впадающей в нее левой кремастерной вене и формированию илеосперматического типа варикоцеле.
Изучение артериовенозных конфликтов как причины варикозной болезни вен органов малого таза у мужчин началось сравнительно недавно. Гипотеза о роли венозного полнокровия органов малого таза в развитии различных урологических заболеваний была высказана еще в 1895 г. немецким урологом K. Posner в его монографии «Диагностика мочеполовых болезней» [9]. В.В. Яковенко (1955) впервые предположил, что причиной развития варикоцеле является венозный застой в мочеполовом сплетении [10]. H. Sakamoto и Y. Ogawa (2008) исследовали взаимосвязь между варикоцеле и венозным сплетением предстательной железы (ПЖ) при помощи скротальной доплерографии и трансперинеальной цветной доплерографии. У всех 209 мужчин, включенных в исследование, диаметр вен простатического сплетения (ПС) положительно коррелировал с диаметром вен правого и левого гроздевидных сплетений. Таким образом авторы установили, что варикоцеле, особенно двустороннее, связано с венозными аномалиями ПЖ [11]. А.И. Неймарк и соавт. (2013) предложили выделять 2 вида варикоцеле: 1) изолированное, при котором отмечаются минимальные нарушения гемодинамики в правом семеннике, а ПЖ не вовлечена в патологический процесс; 2) сочетающееся с тазовой конгестией, при котором нарушения затрагивают не только левое, но и правое яичко, а также ПЖ [12]. Критериями варикозной болезни малого таза у мужчин А.Ю. Цуканов и Р.В. Ляшев (2014) считали диаметр вен парапростатического сплетения >5 мм и/или наличие ретроградного кровотока при пробе Вальсальвы, регистрируемого при дуплексном сканировании вен с использованием ректального датчика [13]. А.А. Капто, О.Б. Жуков (2016) представили первый в мире обзор литературы по варикозной болезни вен органов малого таза у мужчин [14]. В 2017 г. нами предложена ультразвуковая классификация варикозного расширения вен ПС как маркера варикозной болезни вен органов малого таза у мужчин [15].
В настоящее время не существует ни частных, ни общих рекомендаций по диагностике и лечению тазовой венозной конгестии и илеофеморальных сосудистых конфликтов у мужчин с урологической и андрологической патологией. В связи с этим цель настоящего исследования – изучение методов диагностики и лечения подвздошной венозной компрессии у мужчин с урологической и андрологической патологией и варикозной болезнью вен органов малого таза.
Материалы и методы
С 2015 по 2018 г. обследованы 110 пациентов в возрасте от 17 до 69 лет (в среднем 33,2 года) с двусторонним варикоцеле, варикозной болезнью вен органов малого таза и синдромом Мея–Тернера.
Диагноз варикоцеле был верифицирован по данным осмотра и ультразвукового исследования (УЗИ) с доплерографией органов мошонки. В качестве ультразвукового критерия постановки диагноза варикоцеле мы приняли диаметр вен гроздевидного сплетения >2 мм в покое в клиностазе, что отражает общепринятую точку зрения [16–20].
Диагноз варикозной болезни вен органов малого таза был верифицирован при помощи трансректального УЗИ (ТРУЗИ) с использованием критериев и классификации, предложенной нами в 2017 г. (табл. 2) [21].
Таблица 2. Ультразвуковая классификация варикозного расширения вен предстательной железы по А.А. Капто [21]
| Стадия | Определение варикоза | Максимальный диаметр вен, мм | Скорость кровотока, см/с | Скорость кровотока при пробе Вальсальвы, см/с |
| I | Видимый | <4 | <3 | <5 |
| II | Значимый | 5–10 | 3–5 | 5–15 |
| III | Выраженный | >10 | >5 | >15 |
Синдром Мея–Тернера диагностировали при помощи магнитно-резонансной томографии (МРТ) вен с контрастированием. Исследование произведено на магнитно-резонансном томографе GE Opima MR360 (General Electric, США). Для диагностики аортомезентериальной компрессии определяли величину аортомезентериального угла (aortomesenteric angle) (норма 28–65°) и аортомезентериальное расстояние (aortomesenteric distance) (норма 10–34 мм) [22, 23], для диагностики синдрома Мея–Тернера – величину нижнего угла поясничного лордоза (lower lumbar lordosis angle) (норма >134,3°) и диаметр туннеля подвздошной вены (норма >4,2 мм). [24]. Варианты артериовенозных конфликтов илеокавального сегмента оценивали при помощи предложенной нами в 2018 г. классификации (рис. 1) [25].
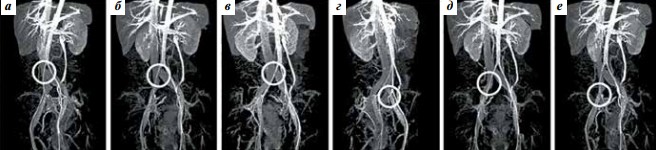
Рис. 1. Топографо-анатомическая классификация вариантов компрессии подвздошных вен по А.А. Капто [25]. Магнитно-резонансное исследование нижней полой вены и сосудов малого таза (моделирование): а – центральный проксимальный (высокая бифуркация аорты, при которой правая общая подвздошная артерия сдавливает нижний отдел нижней полой вены до ее деления на подвздошные вены); б – центральный дистальный (высокая бифуркация аорты, при которой правая общая подвздошная артерия сдавливает нижний отдел нижней полой вены в месте ее деления на подвздошные вены); в – левый проксимальный (правая общая подвздошная артерия сдавливает левую общую подвздошную вену (синдром Мея–Тернера)); г – левый дистальный (компрессия левой наружной и/или левой внутренней подвздошной артерией левой наружной подвздошной вены); д – правый проксимальный (компрессия правой общей подвздошной артерией правой общей подвздошной вены); е – правый дистальный (компрессия правой наружной и/или правой внутренней подвздошной артерией правой наружной подвздошной вены)
Для диагностики эректильной дисфункции применяли международный индекс эректильной функции (International Index of Erectile Function, МИЭФ-5) [26], проводили доплерографию сосудов полового члена в состоянии покоя и при фармакологически индуцированной эрекции. При подозрении на веногенную эректильную дисфункцию выполняли динамическую фармакокавернозографию, позволявшую верифицировать проксимальный, дистальный и смешанный типы патологического венозного оттока из кавернозных тел полового члена.
У пациентов с урологическими и андрологическими заболеваниями абсолютным показанием к эндоваскулярной операции было сочетание следующих признаков подвздошной венозной компрессии:
- выраженных симптомов со стороны тазовых органов (боли, дизурии, эректильной дисфункции);
- двустороннего и/или рецидивного варикоцеле; 3) варикозного расширения вен ПЖ II–III степени (максимальный диаметр вен ПС >5 мм);
- компрессии подвздошных вен по данным МРТ и флебографии;
- наличие коллатеральных ветвей подвздошных вен по данным флебографии.
Изолированная патоспермия без других клинических проявлений встречалась крайне редко (n = 4) и не рассматривалась как абсолютное показание к ангиопластике и стентированию подвздошных вен.
Оперативное лечение синдрома Мея–Тернера проводилось под местной анестезией в условиях рентгеноoперационной и включало следующие этапы:
- пункцию бедренной или подколенной вены (под ультразвуковым контролем);
- мультипроекционную интраоперационную флебографию;
- баллонную ангиопластику;
- имплантацию стента;
- постдилатацию стентированного сегмента;
- контрольную флебографию.
Пред- и послеоперационное ведение пациента включало:
- антикоагулянтную терапию ривароксабаном в дозе 20 мг/сут в течение 1 нед до операции и 6 мес после нее;
- УЗИ подвздошных сосудов в 1-е сутки после операции, через 2 нед и через 1, 3, 6 мес;
- УЗИ органов мошонки с цветным доплеровским картированием до операции и через 1, 3, 6, 9 и 12 мес после нее;
- ТРУЗИ ПЖ и вен ПС до операции и через 1, 3, 6, 9 и 12 мес после нее;
- оценку состояния пациента с помощью МИЭФ-5, международной шкалы тяжести симптомов при заболеваниях ПЖ (International Prostatic Symptom Score, IPSS) [27], индекса симптомов хронического простатита Национальных институтов здравоохранения США (National Institutes of Health Chronic Prostatitis Symptom Index, NIH-CPSI) [28] до операции и через 1, 3, 6, 9 и 12 мес после нее.
Статистическую обработку результатов провели с помощью статистических пакетов Microsoft Office, программы Excel. Статистическую значимость различий показателей, имеющих нормальное распределение, оценивали по критерию Стьюдента, U-критерию Манна–Уитни.
Результаты
Возраст 110 пациентов, включенных в исследование, варьировал от 17 до 69 лет и в среднем составлял 33,2 года.
Причиной обращения пациентов были боли (внизу живота, в области наружных половых органов, внизу поясницы), дизурия (ирритативная и обструктивная симптоматика), эректильная дисфункция (ухудшение утренних, спонтанных и адекватных эрекций), патоспермия (олиго-, астено- и тератозооспермия), пиоспермия (как маркер воспалительного процесса в ПЖ), рецидивирующий и не поддающийся лечению хронический простатит, двустороннее и рецидивное варикоцеле. Чаще всего пациенты предъявляли жалобы на боли. Из сопутствующих хирургических патологий в большинстве случаев встречались геморрой и варикозное расширение вен нижних конечностей.
Варикоцелэктомия в анамнезе была у 39 пациентов: 1 операция – у 23, 2 – у 9, 3 – у 2, 4 – у 1, 5 – у 1. Из них 15 пациентов были ранее прооперированы нами.
При УЗИ органов мошонки во всех случаях верифицировали двустороннее варикоцеле, более выраженное с левой стороны
По данным ТРУЗИ, объем ПЖ варьировал от 6,6 до 76,6 см3 и в среднем составлял 21,2 см3 . Кисты ПЖ были обнаружены у 2 пациентов. Увеличенная средняя доля ПЖ была выявлена у 18 пациентов (в возрасте от 20 до 55 лет, в среднем 36,3 года). Объем ПЖ у пациентов с увеличенной средней долей варьировал от 9,3 до 37,9 см3 и в среднем составлял 23,3 см3 (рис. 2).
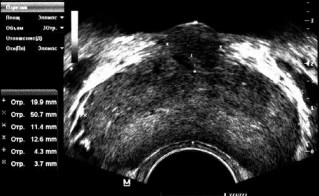
Рис. 2. Трансректальное обследование предстательной железы пациента Х., 39 лет, с синдромом Мея–Тернера, рецидивным двусторонним варикоцеле (3 операции в анамнезе), варикозной болезнью вен органов малого таза III стадии, увеличенной средней долей предстательной железы при ее объеме 22,2 см3 и выраженной дизурией (ирритативной и обструктивной симптоматикой). По данным урофлоуметрии, средняя скорость потока мочи составила 6,2 см/с
Вены ПС при ТРУЗИ визуализированы у всех пациентов. Максимальный диаметр вен ПС справа – от 2,3 до 14,1 мм, в среднем 7,1 мм. Максимальный диаметр вен ПС слева – от 5,0 до 17,1 мм, в среднем 9,7 мм. При доплерографии сосудов ПЖ при пробе Вальсальвы отмечалось увеличение скорости кровотока по венам с 5 до 15 см/с. Таким образом, у всех пациентов выявлено билатеральное расширение вен ПС, что указывало на двусторонний характер варикоцеле. Преобладание левостороннего варикоцеле над правосторонним положительно коррелировало с преобладанием максимального диаметра вен ПС слева над максимальным диаметром вен справа.
МРТ нижней полой вены и сосудов малого таза и верификация подвздошной венозной компрессии проведены у 110 пациентов. Анализ полученных данных позволил нам выделить 4 стадии развития (или формы) синдрома Мея–Тернера (рис. 3).
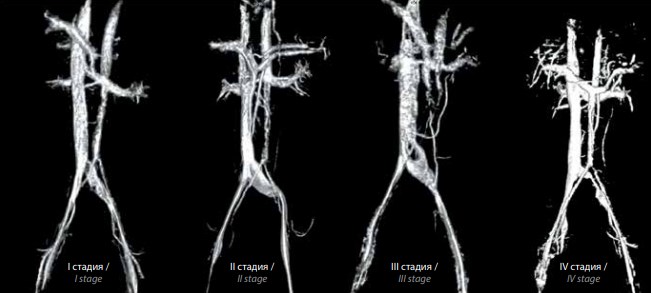
Рис. 3. Стадии синдрома Мея–Тернера по данным магнитно-резонансной томографии нижней полой вены и сосудов малого таза с 3D-реконструкцией: I – компрессия левой общей подвздошной вены; II – компрессия левой общей подвздошной вены с ее дилатацией; III – компрессия левой подвздошной вены со смыканием стенок сосуда в центральной его части и с ее дилатацией; IV – выраженное и протяженное сужение просвета левой общей подвздошной вены
Артериовенозный конфликт диагностировали также с использованием значений аортомезентериального угла, аортомезентериального расстояния, нижнего угла поясничного лордоза и диаметра туннеля подвздошной вены (табл. 3).
Таблица 3. Показатели артериовенозного конфликта по данным магнитно-резонансной томографии вен, n = 110
| Показатель | Минимум | Максимум | Среднее | Норма |
| Аортомезентериальный угол, градусы | 9,6 | 120,6 | 43,6 | 28–65 |
| Аортомезентериальное расстояние, мм | 2,5 | 49,2 | 13,7 | 10–34 |
| Нижний угол поясничного лордоза, градусы | 112,2 | 134,3 | 123,9 | 134,33– 136,76 |
| Диаметр туннеля подвздошной вены, мм | 0,9 | 5,1 | 2,5 | 4,18– 4,50 |
По данным МРТ вен аортомезентериальная компрессия (синдром аортомезентериального пинцета, синдром орехокола, nutcracker syndrome) в сочетании с синдромом Мея–Тернера была диагностирована у 32 (29,1 %) пациентов. Ретроаортальная левая почечная вена (задний синдром орехокола, posterior nutcracker syndrome) в сочетании с синдромом Мея–Тернера была выявлена в 4 (3,6 %) случаях. Сдавление подвздошной вены без сочетания с аортомезентериальной компрессией наблюдалось у 74 (67,3 %) пациентов. Центральный проксимальный артериовенозный конфликт был обнаружен у 4 пациентов, центральный дистальный – у 7, левый проксимальный – у 90, левый дистальный – у 43, правый проксимальный – у 3, правый дистальный – у 5 пациентов. Различные сочетания артериовенозных конфликтов подвздошных сосудов были выявлены в 43 (39,1 %) случаях. Анализ полученных данных позволил нам отметить, что тот или иной конфликт диагностирован у 70 (63,6 %) пациентов, а их сочетанные формы – у 40 (36,4 %) (табл. 4).
Таблица 4. Распространенность различных типов артериовенозных подвздошных конфликтов, n = 110
| Тип конфликта | Число случаев | |
| абс. | % | |
| Левый проксимальный, или синдром Мея– Тернера | 56 | 51 |
| Левый дистальный | 6 | 5 |
| Левый проксимальный + левый дистальный | 32 | 29 |
| Левый проксимальный + правый проксимальный | 2 | 2 |
| Левый проксимальный + правый дистальный | 1 | 1 |
| Центральный проксимальный | 3 | 3 |
| Центральный дистальный | 2 | 2 |
| Центральный дистальный + левый дистальный | 4 | 3 |
| Правый дистальный | 3 | 3 |
| Центральный дистальный + левый дистальный + правый дистальный | 1 | 1 |
| Всего | 110 | 100 |
Жалобы на недостаточную эрекцию предъявляли 78 (70,9 %) из 110 пациентов. Доплерографию сосудов полового члена в состоянии покоя и при фармакологически индуцированной эрекции выполнили у 48 пациентов. В 40 случаях верифицировали веногенную эректильную дисфункцию. Динамическую фармакокавернозографию провели у 22 пациентов; патологический венозный дренаж обнаружили у 18: проксимального типа – у 10, дистального – у 2, смешанного – у 6.
Флебографию как комплексное ангиографическое исследование для выявления артериовенозных конфликтов верхнего (синдрома аортомезентериального пинцета) и нижнего (синдрома Мея–Тернера) уровней выполнили у 41 пациента. Она включала в себя ренокаваграфию и илеокаваграфию с флеботонометрией. Во всех случаях был выявлен синдром Мея–Тернера, а в 12 случаях он сочетался с синдромом аортомезентериального пинцета.
Анализ полученных при флебографии илеокавального сегмента данных позволил нам выделить 4 стадии синдрома Мея–Тернера в зависимости от наличия и выраженности коллатерального кровообращения (рис. 4).
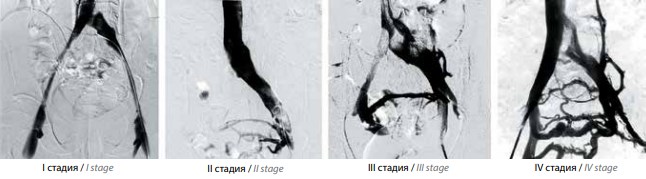
Рис. 4. Стадии синдрома Мея–Тернера по данным илеокаваграфии в зависимости от наличия и выраженности коллатерального кровообращения: I – отсутствие контрастирования вен таза; II – контрастирование вен таза; III – контрастирование вен таза с перетоком контраста в контралатеральную правую общую подвздошную вену; IV – контрастирование вен таза с перетоком контраста в правую общую подвздошную вену и восходящие поясничные вены слева
Мы пришли к выводу, что повышение давления в общей подвздошной вене при выполнении пробы Вальсальвы более чем в 3 раза может указывать на наличие подвздошной венозной компрессии (табл. 5).
Оперативное лечение синдрома подвздошной венозной компрессии осуществили у 26 пациентов. Учитывая то, что фиброзные спайки в сдавленной подвздошной вене встречаются в большинстве случаев, являясь неизбежным патогенетическим звеном этого заболевания, проведение ангиопластики перед стентированием мы считали обязательным (рис. 5). Для баллонной ангиопластики чаще всего мы использовали дилатационные катетеры Atlas Gold PTA Dilatation Catheter (Bard Peripheral Vascular).
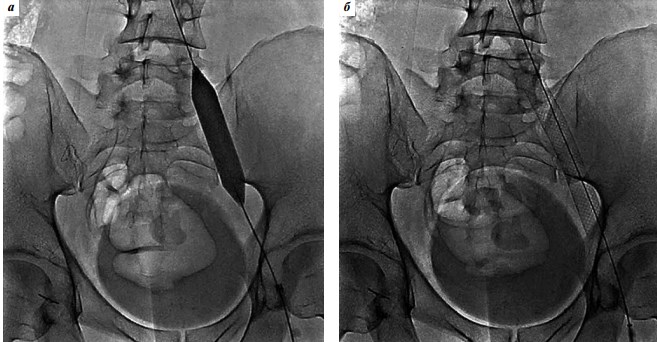
Рис. 5. Баллонная ангиопластика (а) и стентирование (б) левой общей подвздошной вены при оперативном лечении синдрома Мея–Тернера
Таблица 5. Результаты флеботонометрии у пациентов с подвздошной венозной компрессией, n = 25
| Вена | Давление, мм рт. ст | Кратность увеличения давления | |
| в покое | при пробе Вальсальвы | ||
| Нижняя полая | 5,25 | 10,35 | 1,97 |
| Правая общая подвздошная | 6,22 | 15,25 | 2,45 |
| Левая общая подвздошная | 8,35 | 26,28 | 3,14 |
С нашей точки зрения, баллонная ангиопластика без других методов неэффективна, а имплантация стента обязательна. Для имплантации мы использовали венозные стенты Wallstent-Uni Endoprosthesis (Boston Scientific) из сплава Elgiloy (на основе никеля, кобальта и хрома). Диаметр и длину стента подбирали в ходе операции. Стент имплантировали таким образом, чтобы его верхняя часть плотно прилегала к стенкам левой общей подвздошной вены, а его верхний край не выходил в просвет нижней полой вены. Устанавливаемые венозные стенты являются самораскрывающимися. Несмотря на это, во всех случаях оперативного лечения синдрома подвздошной венозной компрессии после имплантации стента мы проводили постдилатацию стентированного участка в проксимальном и дистальном отделах. После стентирования выполняли контрольную флебографию и флеботонометрию, которые подтверждали отсутствие компрессии левой общей подвздошной вены, отсутствие коллатерального кровообращения и венной подвздошной гипертензии. Вбольшинстве случаев требовалась имплантация 1 стента, даже если подвздошная венозная компрессия носила сочетанный характер (например, левый проксимальный + левый дистальный конфликты). Однако у 2 пациентов установили по 2 стента: у 1 – в левую общую и левую наружную подвздошную вены, у 1 – в левую и в правую общие подвздошные вены.
Наиболее выраженные изменения жалоб и объективных данных наблюдались к 3-му месяцу после ангиопластики и стентирования (рис. 6). Нами были получены следующие средние значения: МИЭФ-5 до операции – 17,4, через 3 мес после нее – 20,9; IPSS соответственно 21,7 и 15,3; NIH-CPSI – 28,4 и 22,3.
Через 3 мес после ангиопластики и стентирования во всех случаях максимальный диаметр вен ПЖ уменьшился на 20–70 % (в среднем на 45,6 %) по данным ТРУЗИ.
У 13 пациентов с изолированной подвздошной компрессией (без сочетания с синдромом аортомезентериального пинцета) к 3-му месяцу после ангиопластики и стентирования происходила редукция варикоцеле: во всех случаях диаметр левой и правой яичковых вен в клиностазе в спокойном состоянии стал <2 мм.
У 4 пациентов с сочетанием синдрома аортомезентериального пинцета и подвздошной венозной компрессии через 6 мес после ангиопластики и стентирования левой общей подвздошной вены была выполнена двусторонняя варикоцелэктомия из срединного мошоночного доступа по линии Веслинга с положительным результатом.
Обсуждение
B.L. Coolsaet в 1980 г. по результатам ангиографического обследования 67 пациентов выделил 3 типа левостороннего варикоцеле:
- рефлюкс из левой почечной вены во внутреннюю яичковую вену (реносперматический тип);
- рефлюкс из левой общей подвздошной вены в экстрафуникулярные вены, что вызвано обструкцией левой общей подвздошной вены, куда они впадают (илеосперматический тип);
- комбинация первых 2 типов (смешанный тип) [29].
Таким образом, B.L. Coolsaet впервые определил роль подвздошной венозной компрессии, или, в более узком смысле, синдрома Мея–Тернера, в развитии варикоцеле. M.D. Bomalaski и соавт. в 1993 г. впервые описали устойчивое к хирургическому лечению варикоцеле, развившееся вследствие компрессии левой общей подвздошной вены. Этот случай продемонстрировал необходимость отказа от стандартной хирургической техники в таких случаях [30].
Проведенный ранее анализ причин рецидивов варикоцеле у 14 (6,3 %) из 223 пациентов, у которых на протяжении 10 лет выполняли операцию из трансскротального доступа по линии Веслинга, позволил нам верифицировать во всех случаях синдром Мея– Тернера [31]. Вместе с тем в современных клинических руководствах России, Европы и Америки нет указаний на то, что результативность традиционного хирургического лечения может снизиться вследствие синдрома Мея–Тернера.
Консервативных методов лечения синдрома Мея– Тернера не существует. C.A. Binkert и соавт. в 1998 г. впервые опубликовали отчет об успешной ангиопластике и стентировании левой общей подвздошной вены при синдроме Мея–Тернера и тромботической болезни у 8 пациентов (7 женщин и 1 мужчины) [32]. С тех пор в течение 20 лет рентгенохирурги проводят подобное лечение по поводу тромбозов и тромбоэмболии легочной артерии у пациентов с синдромом Мея– Тернера.
Несмотря на то что роль подвздошной венозной компрессии в развитии варикоцеле была определена еще в 1980 г. B.L. Coolsaet, предложившим гемодинамическую классификацию, которой пользуется в настоящее время большинство урологов, до 2017 г. ангиопластика и стентирование у пациентов с урологическими и андрологическими заболеваниями не выполнялись. Первое в мире стентирование левой общей подвздошной вены у пациентов с илеосперматическим типом варикоцеле осуществлено нами 28.03.2017 вМоскве [33]. Спустя 4 мес J.R. Stern и соавт. в Нью-Йорке выполнили стентирование у пациента с варикоцеле, развившимся вследствие синдрома Мея–Тернера [34]. На настоящий момент мы провели ангиопластику и стентирование у 26 пациентов с синдромом Мея–Тернера, илеосперматическим типом варикоцеле и варикозной болезнью вен органов малого таза и получили положительные результаты.
Тактика ведения пациентов с сочетанием синдрома аортомезентериального пинцета и подвздошной венозной компрессии включала следующие этапы:
- флебографию, ангиопластику и стентирование левой общей подвздошной вены;
- оценку состояния скротального и пельвикального венозного полнокровия через 6 мес с целью определения показаний к оперативному лечению варикоцеле.
Во всех случаях уменьшение интенсивности болевого синдрома и его исчезновение положительно коррелировали со снижением выраженности тазовой венозной гиперволемии и уменьшением диаметра вен ПЖ. Это наблюдение позволяет под новым углом рассмотреть проблему хронической тазовой боли и хронического простатита. Устранение венозного полнокровия тазовых органов в результате ангиопластики и стентирования левой общей подвздошной вены сопровождалось улучшением или полным восстановлением эрекции без применения ингибиторов фосфодиэстеразы 5-го типа или проведения какой-либо другой терапии. Это позволило нам оценить веногенную эректильную дисфункцию как составную часть проблемы варикозной болезни вен органов малого таза у мужчин.
Заключение
В настоящей работе представлен первый и самый большой в мире опыт оперативного лечения синдрома илеофеморальной компрессии как причины двустороннего варикоцеле (в том числе рецидивного) и варикозной болезни вен органов малого таза у мужчин.
Анализ полученных данных позволил нам предложить 2 новые классификации: 1) 4 стадии развития синдрома Мея–Тернера по данным МРТ нижней полой вены и сосудов малого таза с 3D-реконструкцией; 2) 4 стадии компрессии левой общей подвздошной вены при синдроме Мея–Тернера в зависимости от наличия и выраженности коллатерального кровообращения при флебографии илеокавального сегмента.
Полученные нами данные свидетельствуют о том, что синдром Мея–Тернера может быть причиной рецидивного варикоцеле. Современный диагностический алгоритм у пациентов с варикоцеле не ориентирован на выявление синдрома Мея–Тернера. Показания к традиционному хирургическому лечению варикоцеле у пациентов с синдромом Мея–Тернера нуждаются в пересмотре.
До недавнего времени диагноз рецидивного варикоцеле вследствие илеофеморальной компрессии, в частности синдрома Мея–Тернера, был для урологов и андрологов «тупиковым» в плане лечения. Наиболее популярная в последнее время операция по J.L. Marmar и соавт. (субингвинальная варикоцелэктомия) [35] не в состоянии решить проблему илеофеморальной компрессии, вторичной тазовой венозной гиперволемии, которая в этом случае с высокой степенью вероятности становится рецидивной.
Ангиопластика и стентирование подвздошных вен при артериовенозных конфликтах – высокоэффективный метод лечения пациентов с варикозной болезнью вен органов малого таза в сочетании с варикоцеле.
Литература
- Virchow R. Uber die Erweiterung Kleinerer Gefasse. Arch Path Anat 1851;3(3):427–9. DOI: 10.1007/BF01960918.
- McMurrich J.P. The occurrence of congenital adhesions in the common iliac veins and their relation to thrombosis of the femoral and iliac veins. Am J Med Sci 1908;135:342–5. DOI: 10.1097/ 00000441-190803000-00004.
- Ehrich W.E., Krumbhaar E.B. A frequent obstructive anomaly of the mouth of the left common iliac vein. Am Heart J 1943;26(6):737–50. DOI: 10.1016/S0002-8703(43)90285–6.
- May R., Thurner J. The cause of the predominantly sinistral occurrence of thrombosis of the pelvic veins. Angiology 1957;8(5):419–27. DOI: 10.1177/000331975700800505. PMID: 13478912.
- Usui N., Muraguchi K., Yamamoto H. et al. [Ilium and femoral vein thrombosis. (In Japanese)]. Surgery 1978;40:983.
- Baron H.C., Shams J., Wayne M. Iliac vein compression syndrome: a new method of treatment. Am Surg 2000;66(7):653–5. PMID: 10917476.
- Cockett F.B., Thomas M.L. The iliac compression syndrome. Br J Surg1965;52(10):816–21. PMID: 5828716.
- Cockett F.B., Thomas M.L., Negus D. Iliac vein compression – its relation to iliofemoral thrombosis and the postthrombotic syndrome. Br Med J 1967;2(5543):14–9. DOI: 10.1136/ bmj.2.5543.14. PMID: 6020994.
- Большая медицинская энциклопедия. Под. ред. Н.А. Семашко М.: Советская энциклопедия, 1933. Т. 26. С. 70. [Big medical encyclopedia. Ed. by N.A. Semashko. Moscow: Sovetskaya entsiklopediya, 1933. Vol. 26. P. 70. (In Russ.)].
- Яковенко В.В. Венозные образования яичка, семенного канатика и хирургическое лечение варикоцеле. Реферат дис. … канд. мед. наук. Ленинград, 1955. 15 с. [Yakovenko V.V. Venous formation of the testis, spermatic cord and surgical treatment of varicocele. Abstract of dis. ... cand. of med. sciences. Leningrad, 1955. 15 p. (In Russ.)].
- Sakamoto H., Ogawa Y. Is varicocele associated with underlying venous abnormalities? Varicocele and the prostatic venous plexus. J Urol 2008;180(4):1427–31. DOI: 10.1016/j. juro.2008.06.048. PMID: 18710746.
- Неймарк А.И., Попов И.С., Газаматов А.В. Особенности микроциркуляции предстательной железы и гонад у юношей, страдающих изолированным варикоцеле и варикоцеле в сочетании с тазовой конгестией. Экспериментальная и клиническая урология 2013;(2):56–60. [Neymark A.I., Popov I.S., Gazamatov A.V. The character istics of the prostate and gonadal microcirculation in the adolescents with isolated varicocele and varicocele with the pelvic congestion. Eksperimental»naya i klinicheskaya urologiya = Experimental and Clinical Urology 2013;(2):56–60. (In Russ.)].
- Цуканов А.Ю., Ляшев Р.В. Нарушение венозного кровотока как причина хронического абактериального простатита (синдрома хронической тазовой боли). Урология 2014;(4):37–42. [Tsukanov A.Yu., Lyashev R.V. Disorders of venous blood flow as a cause of chronic abacterial prostatitis(chronic pelvic pain syndrome). Urologiya = Urology 2014;(4):37–42. (In Russ.)].
- Капто А.А., Жуков О.Б. Варикозная болезнь малого таза у мужчин (обзор литературы). Андрология и генитальная хирургия 2016;17(2):10–9. [Kapto A.A., Zhukov O.B. Varicose veins in the male small pelvis (a review of literature). Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2016;17(2):10–9. (In Russ.)].
- Капто А.А. Варикозное расширение вен предстательной железы у пациентов с варикоцеле. Экспериментальная и клиническая урология 2017;(1): 98–103. [Kapto A.A. Varicose veins of the prostate in patients with varicocele. Eksperimental’naya i klinicheskaya urologiya = Experimental and Clinical Urology 2017;(1):98–103. (In Russ.)].
- Wolverson M.K., Houttuin E., Heiberg E. et al. High-resolution real-time sonography of scrotal varicocele. AJR Am J Roentgenol 1983;141(4):775–9. DOI: 10.2214/ajr.141.4.775. PMID: 6604430.
- Rifkin M.D., Foy P.M., Kurtz A.B. et al. The role of diagnostic ultrasonography in varicocele evaluation. J Ultrasound Med 1983;2(6):271–5. https://doi. org/10.7863/jum.1983.2.6.271. PMID: 6876259.
- Gonda R.L. Jr, Karo J.J., Forte R.A., O’Donnell K.T. Diagnosis of subclinical varicocele in infertility. AJR Am J Roentgenol 1987;148(1):71–5. http://dx.doi.org/10.2214/ajr.148.1.71. PMID: 3024475.
- Gerscovich E.O. High-resolution ultrasonography in the diagnosis of scrota1 pathology. I. Normal scrotum and benign disease. J Clin Ultrasound 1993;21(6):355–73. PMID: 8227378.
- Kocakoc E., Serhatlioglu S., Kiris A. et al. Color Doppler sonographic evaluation of inter-relations between diameter, reflux and flow volume of testicular veins in varicocele. Eur J Radiol 2003;47(3):251–6. DOI: https://doi. org/10.1016/S0720-048X(02)00182-1. PMID: 12927671.
- Капто А.А. Варикозная болезнь органов малого таза у мужчин. В кн.: Диагностика и лечение веногенной эректильной дисфункции. Под ред. Д.Г. Курбатовa. М.: Медпрактика-М, 2017. С. 140–166. [Kapto A.A. Varicose disease of the small pelvic organs in men. In: Diagnosis and treatment of venogenic erectile dysfunction. Ed. by D.G. Kurbatov. M.: Medpraktika-M, 2017. Pp. 140–166. (In Russ.)].
- Felton B.M., White J.M., Racine M.A. An uncommon case of abdominal pain: superior mesenteric artery syndrome. West J Emerg Med 2012;13(6):501–2. DOI: 10.5811/westjem.2012.6.12762. PMID: 23358897.
- Vulliamy P., Hariharan V., Gutmann J., Mukherjee D. Superior mesenteric artery syndrome and the “nutcracker phenomenon”. BMJ Case Rep 2013;2013. DOI: 10.1136/bcr-2013-008734. PMID: 23524345. 24.
- Ou-Yang L., Lu G.M. Underlying anatomy and typing diagnosis of maythurner syndrome and clinical significance an observation based on CT. Spine(Phila Pa 1976) 2016;41(21):E1284–91. DOI: 10.1097/BRS.0000000000001765. PMID: 27379417.
- Капто А.А. Эндоваскулярная хирургия подвздошных вен при двустороннем варикоцеле и варикозной болезни вен органов малого таза у мужчин. Урологические ведомости 2018;8(1):11–7. [Kapto A.A. Endovascular surgery of the iliac veins with bilateral varicocele and varicose veins of the pelvic organs in men. Urologicheskie vedomosti = Urological Statements 2018;8(1):11–7. (In Russ.)]. DOI: 10.17816/ uroved8111-17.
- Rosen R.C., Riley A., Wagner G. et al. The international index of erectile function(IIEF): a multidimensional scale for assessment of erectile dysfunction. Urology 1997;49(6):822–30. PMID: 9187685.
- International Prostate Symptom Score (I-PSS). Available at: http://www.urospec. com/uro/Forms/ipss.pdf.
- Litwin M.S., McNaughton-Collins M., Fowler F.J. J. et al. The National Institutes of Health chronic prostatitis symptom index: development and validation of a new outcome measure. J Urol 1999;162(2):369–75. PMID: 10411041.
- Coolsaet B.L. The varicocele syndrome: venography determining the optimal level for surgical management. J Urol 1980;124(6):833–9. DOI: 10.1016/S0022-5347(17)55688-8. PMID: 7441834.
- Bomalaski M.D., Mills J.L., Argueso L.R. et al. Iliac vein compression syndrome: an unusual cause of varicocele. J Vasc Surg. 1993;18(6):1064–8. DOI: 10.1016/0741–5214(93)90564-3. PMID: 8264037.
- Капто А.А. Трансскротальный доступ по линии Веслинга при оперативном лечении варикоцеле (10-летний опыт применения). Урологические ведомости 2018;8(Спец. вып.):53–4. [Kapto A.A. Transscrotal access via the Wesling line in the surgical treatment of varicocele (10 years of experience). Urologicheskie vedomosti = Urological Statements 2018;8(Special Iss.):53–4. (In Russ.)].
- Binkert C.A., Schoch E., Stuckmann G. et al. Treatment of pelvic venous spur (May–Thurner syndrome) with selfexpanding metallic endoprostheses. Cardiovasc Intervent Radiol 1998;21(1):22–6. DOI:10.1007/ s002709900205. PMID: 9473541.
- Капто А.А., Виноградов И.В., Харпунов В.Ф., Мамедов Р.Э. Рентгенэндоваскулярная ангиопластика и стентирование у мужчины при May– Thurner syndrome. В кн.: Сборник тезисов 12-го Конгресса Профессиональной ассоциации андрологов России. Сочи, 2017. С. 62. [Kapto A.A., Vinogradov I.V., Kharpunov V.F., Mamedov R.E. Endovascular angioplasty and stenting in men with May–Thurner syndrome. In: Proceedings of the 12th Congress of the Professional Association of Andrologists of Russia. Sochi, 2017. P. 62. (In Russ.)].
- Stern J.R., Patel V.I., Cafasso D.E. et al. Left-sided varicocele as a rare presentation of May–Thurner syndrome. Ann Vasc Surg 2017;42:305.e13–6. DOI: 10.1016/j.avsg.2016.12.001. PMID: 28258018.
- Marmar J.L., DeBenedictis T. J., Praiss D. The management of varicoceles by microdissection of the spermatic cord at the external inguinal ring. Fertil Steril 1985;43(4):583–8. PMID: 3987926.
Статья опубликована в журнале "Андрология и генитальная хирургия" выпуск №4 2018, стр. 28-38









Комментарии