А.В. Кондрашина, Л.М. Рапопорт, Е.А. Безруков, Р.Б. Суханов, Г.Е. Крупинов
ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России; Россия, 119991 Москва, ул. Большая Пироговская, 2, стр. 1
Введение
В XXI в. рак предстательной железы (РПЖ) является важной общемировой проблемой. В США в 2015 г. зарегистрировано 220 800 новых случаев РПЖ и 27 540 случаев смерти [1]. В Российской Федерации в 2014 г. выявлено 36 493 случая РПЖ, а его распространенность за 10 лет (с 2004 г.) возросла с 38,4 до 116,4 случая на 100 тыс. человек. В 2014 г. в России среди других онкологических заболеваний у мужчин удельный вес РПЖ составил 5,2 %, в связи с чем он занял 4-е место по частоте среди всех злокачественных новообразований [2]. В 2015 г. зарегистрировано 11 988 случаев смерти от РПЖ [2]. Несмотря на все положительные тенденции, летальность больных остается высокой [3].
Положительная динамика эпидемиологических показателей за 10 лет связана только с уменьшением доли РПЖ поздних стадий среди впервые выявленных случаев: III стадия в 2014 г. диагностирована у 29,0 % (в 2004 г. у 38,4 %), IV стадия – у 16,5 % (в 2004 г. у 22,7 %). Это обусловлено внедрением скрининговых методов, в том числе с использованием простатспецифического антигена (ПСА).
Увеличение доли пациентов с I и II стадиями РПЖ, повышение доступности лекарственных средств и качества оказываемой медицинской помощи актуализировали проблему кастрационной рефрактерности, проявляющейся прогрессированием опухолевого процесса на фоне адекватно проводимого гормонального лечения и требующей принципиально иных подходов к лечению. В настоящий момент не выявлены точные причины формирования данного состояния [4, 5].
В 1996 г. были получены данные об улучшении качества жизни больных с кастрационно-рефрактерным РПЖ (КРРПЖ) при приеме митоксантрона (благодаря уменьшению болевого синдрома). Однако в исследовании, проведенном канадскими учеными, не обнаружено увеличения общей выживаемости на фоне данной терапии [6]. С 2004 г. появилось несколько новых препаратов для лечения КРРПЖ, доказанно улучшающих качество жизни пациентов и повышающих общую выживаемость [7–10]. Среди этих препаратов следует отметить абиратерона ацетат и доцетаксел – именно они одобрены в качестве терапии КРРПЖ как 1-й, так и 2-й линии и применяются уже длительное время.
Цель исследования – сравнить эффективность различных схем лечения КРРПЖ с применением абиратерона ацетата и доцетаксела.
Материалы и методы
На базе клиники урологии ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России с 2002 по 2017 г. обследованы 83 пациента в возрасте 48–83 лет (в среднем 70,9 ± 1,6 года). У всех пациентов диагноз подтвержден морфологически. У большинства верифицирована стадия Т3 – у 69 (83,1 %). Оценка по шкале Глисона у 60,2 % пациентов составила 8 баллов и более, у 39,8 % – менее 8 баллов.
Предшествующее лечение (дистанционную лучевую терапию, простатэктомию, брахитерапию, ультразвуковую абляцию) прошли 53 % пациентов. Отдаленные метастазы у 60,2 % больных локализовались в костях. Все пациенты получали гормональную терапию согласно рекомендациям. От установления диагноза РПЖ до выявления кастрационной рефрактерности в среднем проходило 51,0 ± 3,2 (2–157) мес. Примерно половина пациентов на момент начала лечения КРРПЖ имела симптомы заболевания (55,4 %). Средний уровень ПСА составил 218,8 ± 40,4 (4,9–2130,3) нг/мл.
Пациенты были разделены на 2 группы в зависимости от последовательности назначения препаратов. В 1-й группе (n = 41) назначалась сначала химиотерапия доцетакселом, а затем гормональная терапия абиратерона ацетатом, во 2-й группе (n = 42) последовательность была обратной. Пациенты 1-й и 2-й групп статистически значимо не различались (p >0,05). Дозировка и кратность приема препаратов соответствовали рекомендованным. Премедикация перед химиотерапией была стандартной.
Проводили общий, биохимический анализ крови, определяли уровень ПСА, выполняли мультиспиральную компьютерную томографию органов брюшной полости, остеосцинтиграфию. Контрольное лабораторное обследование при приеме абиратерона ацетата осуществляли каждые 2 нед, при проведении химиотерапии – через 1 нед после введения препарата и накануне следующего введения; 1 раз в 3 мес назначали контрольные визуализирующие исследования.
Эффективность лечения оценивалась по уровню ПСА и по ответу очагов по данным радиологических исследований. Прирост ПСА в первые 3 мес не считался признаком неэффективности терапии. Общая выживаемость оценивалась от начала лечения КРРПЖ до даты смерти пациента или до даты последнего контрольного приема. Анализ кривых выживаемости проводился при помощи метода Каплана–Майера, сравнение кривых выживаемости проводилось посредством логарифмического рангового критерия (log-rank).
Статистическая значимость различий частот в изучаемых признаках оценивалась с помощью критерия χ2 , для малых выборок рассчитывался точный критерий Фишера. Статистически значимыми считались различия при р <0,05.
Результаты и обсуждение
На момент завершения исследования 48,2 % пациентов умерли, при этом в 95 % случаев причиной смерти явилось прогрессирование основного заболевания. Не зафиксировано случаев смерти из-за развившихся во время лечения осложнений. Ввиду диссеминированности заболевания среднее время от окончания лечения до смерти составило 2,1 ± 0,5 (1,0–11,2) мес. Оценка отдаленных результатов продемонстрировала, что статистически значимые различия между группами в уровне 2-летней выживаемости отсутствуют (73,2 % в 1-й группе, 69 % во 2-й группе). При оценке 3-летней выживаемости были установлены статистически значимые различия: в 1-й группе – 29,3 %, во 2-й группе – 16,7 % (p <0,05). Ввиду малого числа пациентов, включенных в исследование и проживших более 5 лет на фоне терапии, 5-летняя выживаемость не оценивалась.
Общая выживаемость в зависимости от схемы лечения
| Схема лечения | 2-летняя ОВ, % | 3-летняя ОВ, % | Медиана ОВ, мес | Средняя ОВ, мес |
| Доцетаксел – абиратерон, n = 41 | 73,2 | 29,3 | 30,4 | 32,0 |
| Абиратерон – доцетаксел, n = 42 | 69,0 | 16,7 | 26,3 | 27,0 |
Примечание. ОВ – общая выживаемость
В таблице и на рисунке представлены сравнительные данные о выживаемости пациентов на фоне 2 исследованных схем применения препаратов.
Среднее значение общей выживаемости при назначении сначала доцетаксела, а затем абиратерона ацетата составило 32 мес, при обратной схеме (абиратерона ацетат, затем доцетаксел) – 27 мес (p = 0,01).
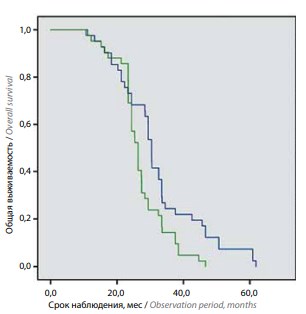
Общая выживаемость в зависимости от схемы лечения: доцетаксел – абиратерон (синяя линия), абиратерон – доцетаксел (зеленая линия)
Заключение
Повышение доступности препаратов для лечения РПЖ и улучшение качества медицинской помощи делают особенно актуальной проблему КРРПЖ. Ведется поиск оптимальной последовательности назначения препаратов для лечения пациентов на данной стадии заболевания. В нашем исследовании при сравнении эффективности терапии на основе доцетаксела и абиратерона ацетата установлено, что схема с последовательностью доцетаксел – абиратерона ацетат более эффективно увеличивает общую и 3-летнюю выживаемость.
Литература
1. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2015. CA Cancer J Clin 2015;65(1):5–29. DOI: 10.3322/ caac.21254. PMID: 25559415.
2. Федеральная служба государственной статистики. Естественное движение населения. Доступно по: http://www. gks.ru/wps/wcm/connect/rosstat_main/ rosstat/ru/statistics/population/ demography/#.2015. [Federal state statistics service. The natural movement of population. Available at: http://www. gks.ru/wps/wcm/connect/rosstat_main/ rosstat/ru/statistics/population/ demography/#.2015. (In Russ.)].
3. Cостояние онкологической помощи населению России в 2014 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена, 2015. C. 18, 26–28, 31. [The state of cancer care to the population of Russia in 2014. Ed. by A.D. Kaprin, V.V. Starinskiy, G.V. Petrova. Moscow, MROI n. a. P.A. Herzen, 2015. P. 18, 26–28, 31. (In Russ.)].
4. Crawford E.D., Eisenberger M.A., McLeod D.G. et al. A controlled trial of leuprolide with and without flutamide in prostatic carcinoma. N Engl J Med 1989;321(7):419–24. DOI: 10.1056/NEJM198908173210702. PMID: 2503724.
5. Ross R.W., Xie W., Regan M.M. et al. Efficacy of androgen deprivation therapy (ADT) in patients with advanced prostate cancer: association between Gleason score, prostate-specific antigen level, and prior ADT exposure with duration of ADT effect. Cancer 2008;112(6):1247–53. DOI: 10.1002/cncr.23304. PMID: 18293426.
6. Tannock I.F., Osoba D., Stockler M.R. et al. Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points. J Clin Oncol 1996;14(6):1756–64. DOI: 10.1200/ JCO.1996.14.6.1756. PMID: 8656243.
7. Tannock I.F., de Wit R., Berry W.R. et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004;351(15):1502–12. DOI: 10.1056/ NEJMoa040720. PMID: 15470213.
8. Fizazi K., Scher H.I., Molina A. et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, doubleblind, placebo-controlled phase 3 study. Lancet Oncol 2012;13(10):983–92. DOI: 10.1016/S1470-2045(12)70379-0. PMID: 22995653.
9. Beer T.M., Armstrong A.J., Rathkopf D.E. et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014;371(5):424–33. DOI: 10.1056/NEJMoa1405095. PMID: 24881730. PMCID: PMC4418931.
10. Yap T.A., Pezaro C.J., de Bono J.S. Cabazitaxel in metastatic castration-resistant prostate cancer. Expert Rev Anticancer Ther 2012;12(9):1129–36. DOI: 10.1586/era.12.88. PMID: 23098113.
Статья опубликована в журнале "Андрология и генитальная хирургия" выпуск №1/2018, стр. 57-60









Комментарии