О.Л. Коломиец1 , М.А. Лелекова1 , А.А. Кашинцова1 , Л.Ф. Курило2 , Е.Е. Брагина2 , В.Б. Черных2 , М.Ю. Габлия3 , И.В. Виноградов3 , И.И. Витязева4 , С.В. Боголюбов4 , В.Е. Спангенберг1
1 ФГБУН Институт общей генетики им. Н.И. Вавилова РАН; Россия, 119991 Москва, ГСП-1, ул. Губкина, 3;
2 ФГБНУ «Медико-генетический научный центр»; Россия, 115522 Москва, ул. Москворечье, 1;
3 кафедра клинической андрологии факультета повышения квалификации медицинских работников ФГАОУ ВО «Российский университет дружбы народов»; Россия, 117198 Москва, ул. Миклухо-Маклая, 21, к. 3;
4 ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России; Россия, 117036 Москва, ул. Дмитрия Ульянова, 11 Контакты: Оксана Леонидовна Коломиец olkolomiets@mail.ru
Введение
Бесплодие диагностируется в среднем у 15 % супружеских пар, и приблизительно в половине случаев оно связано с нарушением фертильности мужчин. Мужское бесплодие – сложное полиэтиологическое заболевание, причину которого не удается установить, по разным данным, в 30–50 % случаев [1–4]. Угнетение сперматогенеза может быть обусловлено генетическими нарушениями (хромосомными и генными мутациями) [3–6], эпигенетическими механизмами [7], патологиями эндокринной, иммунной и нервной систем, инфекциями, анатомическими дефектами яичка и семявыносящих протоков [1, 3, 4], травмами, стрессом, негативным воздействием факторов среды [1].
Известно, что нарушение фертильности нередко вызвано сбоями в течении ключевых событий центрального звена сперматогенеза (профазы I мейоза) – в процессе формирования и репарации запрограммированных разрывов ДНК (double strand breaks, DSBs), синапсиса, мейотической рекомбинации и десинапсиса гомологов. Нормальное развитие перечисленных событий профазы I мейоза в конечном итоге обеспечивает формирование из диплоидных сперматоцитов гаплоидных сперматозоидов [8–13].
Синапсис, кроссинговер и десинапсис гомологичных хромосом протекают с участием уникальной структуры мейотического ядра – синаптонемного комплекса (СК). Он открыт в 1956 г. независимо друг от друга американскими исследователями М. Мозесом [14] и Д. Фоссетом [15] при электронно-микроскопическом исследовании ультратонких срезов клеток яичек животных и человека. СК представляет собой трехполосную структуру, состоящую из латеральных (боковых) и центрального элементов. Осевые элементы хромосом формируются на стадии лептотены профазы I мейоза. Далее на стадии зиготены происходят конъюгация и синапсис гомологов. Осевые элементы становятся латеральными элементами СК. Синапсис распространяется вдоль всего мейотического бивалента; между латеральными элементами встраивается центральный элемент СК, образованный поперечными фибриллами, которые соединяют латеральные элементы наподобие зубцов застежки-«молнии» [8, 16].
Как показало время, открытие СК сыграло революционную роль в исследовании мейоза. Особое значение, несомненно, имело широкое внедрение в практику цитогенетических исследований предложенного S. Counce и G. Meyer [17] метода получения и анализа тотальных препаратов распластанных СК или распластанных ядер сперматоцитов I порядка. Сущность этого метода заключается в том, что под действием гипотонического раствора ядра сперматоцитов I порядка разрываются. Петли хроматина растягиваются в стороны от СК и практически не мешают анализу собственно структуры СК. При исследовании под электронным микроскопом таких распластанных ядер (так называемых спредов), контрастированных азотнокислым серебром, хорошо видны латеральные элементы СК, поведение которых является парадигмой поведения каждого гомолога в структуре СК. Поэтому у гетерозигот по хромосомным аберрациям удается идентифицировать тонкие различия в структуре гомологов. Таким образом, этот метод позволяет выявлять кольцевые хромосомы, петли в структуре СК у гетерозигот по дупликациям и делециям, мультиваленты у гетерозигот по робертсоновским транслокациям, реципрокным и нереципрокным транслокациям [9]. Следует сказать, что мейотические хромосомы в 10 раз длиннее митотических хромосом, вследствие чего при анализе СК можно обнаружить даже микроаберрации, недоступные для выявления в структуре более компактных дифференциально окрашенных митотических хромосом. При этом относительная длина и центромерные индексы мейотических и митотических хромосом совпадают, что позволяет проводить СК-кариотипирование сперматоцитов I порядка. Важно, что анализ СК выявляет аберрации хромосом, которые затрагивают только половые клетки, т. е. те, что сформированы в яичке de novo, в том числе под воздействием мутагенных факторов окружающей среды [9, 18, 19].
В последние годы большинство исследований мейоза проводится с применением иммуноморфологического анализа клеток, позволяющего идентифицировать белки в структуре клетки с помощью меченных флуорохромами антител.
Внедрение этого метода исследования значительно расширило представления о роли белков мейоза в обеспечении процессов синапсиса хромосом, о формировании и репарации DSBs, кроссинговере, транскрипции и подавлении транскрипции в мейозе, эпигенетических событиях, роли «контрольно-пропускных пунктов» (checkpoints) мейоза [20, 21].
К настоящему моменту установлено, что репарация запрограммированных DSBs играет ведущую роль в синапсисе гомологов, формировании хиазм, а в дальнейшем и в правильном разделении гомологичных хромосом.
У носителей мутаций, нарушающих репарацию мейотических DSBs, мейоз блокируется на стадии ранней пахитены. Частичное нарушение формирования хиазм может приводить к анеуплоидии гамет, а тотальное нарушение – к «аресту» сперматогенеза [12]. Даже ограниченный локальный асинапсис аутосом на стадии пахитены вызывает инактивацию транскрипции асинаптированного хроматина, ассоциацию асинаптированных аутосомных СК-бивалентов с половым (ХY) бивалентом и прекращение дифференцировки сперматоцитов на стадии средней пахитены – так называемый пахитенный арест [11, 20, 21].
Таким образом, у гетерозигот по хромосомным аберрациям и у носителей мутаций генов, нарушающих процесс синапсиса хромосом и сопряженной с ним репарации DSBs, «арест» мейоза в профазе I в конечном итоге влечет за собой нарушение фертильности [11, 20, 21].
Было установлено, что на стадии диплотены, когда структура СК постепенно разрушается, элементы СК сохраняются в зоне хиазм вплоть до анафазы I мейоза. Так была выяснена важнейшая механическая роль СК в стабилизации хиазм, удерживающих гомологи в паре вплоть до их расхождения на стадии анафазы I мейоза, и, соответственно, в правильном распределении генетического материала между половыми клетками [9–11].
Было установлено, что на стадии диплотены, когда структура СК постепенно разрушается, элементы СК сохраняются в зоне хиазм вплоть до анафазы I мейоза. Так была выяснена важнейшая механическая роль СК в стабилизации хиазм, удерживающих гомологи в паре вплоть до их расхождения на стадии анафазы I мейоза, и, соответственно, в правильном распределении генетического материала между половыми клетками [9–11].
Достоинства метода анализа СК очевидны, и он остается мощным инструментом выяснения механизмов нарушения сперматогенеза и оогенеза у человека, животных, растений и грибов [11, 18, 19, 22–25].
Целесообразность выявления механизмов патологии мейоза с помощью электронно-микроскопического и иммуноцитохимического анализа тотальных препаратов распластанных СК доказана в многочисленных исследованиях на экспериментальных моделях, в первую очередь на нуль-мутантах по генам мейоза [4, 26, 27]. Методы анализа СК человека давно внедрены в работу репродуктивных центров многих стран [4, 5, 8, 28–31].
Настоящее сообщение основано на собственном опыте электронно-микроскопического и иммуноморфологического анализа препаратов СК в распластанных ядрах сперматоцитов I порядка человека.
Целью исследования является демонстрация возможностей применения методов анализа СК для установления причин нарушения сперматогенеза и для оценки генетических и репродуктивных рисков использования тестикулярных сперматозоидов в программах экстракорпорального оплодотворения (ЭКО), использующих технологию интрацитоплазматической инъекции сперматозоида (intracytoplasmic sperm injection, ICSI).
Материалы и методы
Стандартное спермиологическое исследование в соответствии с рекомендациями ВОЗ [32] и патентом РФ «Способ цитологической диагностики нарушения сперматогенеза» [33], стандартное цитогенетическое исследование (анализ кариотипа на культивированных лимфоцитах периферической крови, GTG-окрашивание) и молекулярно-генетическое исследование на наличие частых генетических факторов мужского бесплодия (микроделеций Y-хромосомы в локусе AZF и мутаций гена CFTR) проведены в ФГБНУ «Медико-генетический научный центр».
Биоптаты яичек от мужчин с бесплодием получали методом экстракции сперматозоидов из яичка с использованием микрохирургической техники (microsurgical testicular sperm extraction, micro-ТЕSE) на клинических базах ФГАОУ ВО «Российский университет дружбы народов» и ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России. Для исследования СК представлен материал, оставшийся после извлечения из канальцев тестикулярных сперматозоидов для дальнейшего использования их в процедурах ЭКО/ICSI. Все пациенты дали добровольное информированное согласие на проведение цитогенетического исследования клеток яичка.
Иммуноцитохимический и электронно-микроскопический анализ распластанных ядер сперматоцитов выполнен в лаборатории цитогенетики ФГБУН Институт общей генетики им. Н.И. Вавилова РАН (ИОГен РАН).
Исследование одобрено этическим комитетом ИОГен РАН.
Приготовление и светомикроскопический анализ суспензии клеток тестикулярной ткани. Фрагменты ткани яичка измельчали в среде Игла, суспензию клеток гомогенизировали с помощью автоматической пипетки. Далее под световым микроскопом оценивали степень гомогенизации клеток и наличие в суспензии сперматоцитов I порядка, тестикулярных сперматозоидов, атипичных и дегенерирующих клеток.
Приготовление препаратов распластанных ядер сперматоцитов I порядка. На поверхность тефлоновой пластины наносили капли 0,2 М раствора сахарозы, на них наслаивали по 1 капле суспензию клеток. Через 2 мин, после распластывания ядер, касались поверхности капель стеклом, покрытым поли-L-лизином (для иммуноцитологического исследования) или пленкой Falcon (для последующего электронно-микроскопического исследования). Далее фиксировали препараты охлажденным раствором 4 % параформальдегида (рН 8,2). Отмывали препараты в 3 сменах 0,4 % раствора Fotoflo (Kodak, США) (рН 8,2), высушивали и хранили при t −20 °С.
Электронно-микроскопическое исследование тотальных препаратов распластанных ядер сперматоцитов. Препараты контрастировали 50 % раствором азотнокислого серебра на водяной бане в термостате при t +58 °С в течение 3–4 ч. Под световым микроскопом отбирали хорошо распластанные ядра, вырезали пленку с помощью алмазного метчика (Carl Zeiss, Германия). Вокруг обведенного кружка пластика капали воду. Всплывший кружок пластика с клетками переносили на бленду для электронной микроскопии. Препараты исследовали и фотографировали под электронным микроскопом JEM-100B (Jeol, Япония).
Иммуноокрашивание препаратов. Для уменьшения риска неспецифического связывания антител с клеточными антигенами антитела разводили в буфере DBS (dilution buffer solution), содержащем 3 % бычьего сывороточного альбумина, 0,05 % Triton X-100 и 0,05 % азида натрия [24].
В качестве первичных антител использовали: 1) кроличьи (илимышиные) поликлональные антитела к белку SCP3 – основному белку СК и осевых элементов мейотических хромосом (Abcam, Великобритания); 2) мышиные моноклональные антитела к фосфорилированному гистону γH2AX, маркирующие участки незавершенной репарации DSBs, в которых транскрипционная активность хроматина подавлена; 3) поликлональные кроличьи антитела к белку RAD51, маркирующие ранние рекомбинационные узелки (Abcam, Великобритания); 4) моноклональные мышиные антитела к белку MLH1, маркирующие поздние рекомбинационные узелки – участки формирования хиазм (Abcam, Великобритания); 5) поликлональные аутоантитела человека к белкам кинетохора (CREST), маркирующие центромерный район хромосом (Invitrogen, США).
В качестве вторичных антител использовали: 1) бычьи антитела к IgG кролика, конъюгированные с FITC (Santa Cruz, США); 2) куриные антитела к IgG кролика, конъюгированные с Alexa Fluor 594 (Invitrogen, США); 3) лошадиные антитела к IgG мыши, конъюгированные с FITC; 4) бычьи антитела к IgG кролика, конъюгированные с FITC (Jackson, США); 5) козьи aнтитела к IgG мыши, конъюгированные с Alexa Fluor 546 (Invitrogen, США); 6) козьи aнтитела к IgG человека, конъюгированные с Alexa Fluor 546 (Invitrogen, США).
Препараты инкубировали с первичными антителами при t +4° С в течение ночи; промывали в 3 сменах натрий-фосфатного буфера. Далее наносили вторичные антитела и инкубировали препараты в течение 2 ч при t +37 °С. Затем промывали в натрий-фосфатном буфере и заключали в среду Vectashield (Vector Laboratories, США), содержащую флуоресцирующий голубой краситель DAPI, избирательно окрашивающий ДНК.
Препараты анализировали с помощью универсального флуоресцентного микроскопа Axio Imager D1 (Carl Zeiss, Германия), соответствующего стандарту IC2 S-оптики, оборудованного объективами Plan-Neofluar (при использовании 40× и 100×), ртутной лампой НВО, черно-белой CCD-камерой накопления сигнала AxioCam HRm Rev. 2 (Carl Zeiss, Германия), набором комбинированных фильтров для флуорохромов, имеющего выход на компьютер (Fujitsu-Siemens Technology Solutions, Германия). Документирование фотоизображений выполняли с помощью программы Axiovision rel. 4.6. Изображения обрабатывали в программе Adobe Photoshop CS6 (Adobe Systems, США). На иммуноокрашенных препаратах каждую клетку фотографировали, записывали их нониусы. В некоторых случаях проводили 2-й и 3-й раунды иммуноокрашивания, детали многораундового иммуноокрашивания описаны нами ранее [23, 25].
Результаты
Светомикроскопическое исследование суспензии тестикулярных клеток, полученных из микробиоптатов яичка пациентов. Исследование суспензий позволяет быстро, за несколько минут, оценить степень нарушения сперматогенеза, выявить клетки в профазе I мейоза и, следовательно, определить возможность и целесообразность проведения довольно длительных процедур распластывания ядер сперматоцитов I порядка, фиксации и иммуноокрашивания препаратов. При отсутствии сперматоцитов (рис. 1а) изготовить препарат СК и тем более получить из такой «пустой» суспензии тестикулярные сперматоциты не удастся.
На рис. 1б и 1в приведены фотографии суспензий, в которых видны типичные сперматоциты I порядка и единичные тестикулярные сперматозоиды. Таким образом, предварительный анализ позволяет оценить перспективы не только получения тотальных препаратов распластанных СК из клеток биоптата, но и извлечения из таких суспензий тестикулярных сперматозоидов для ICSI.
Электронно-микроскопическое исследование синаптонемного комплекса. При электронно-микроскопическом исследовании распластанных ядер сперматоцитов, контрастированных азотнокислым серебром, структура СК выявляется четко. У многих пациентов встречаются как атипичные, так и нормальные сперматоциты.
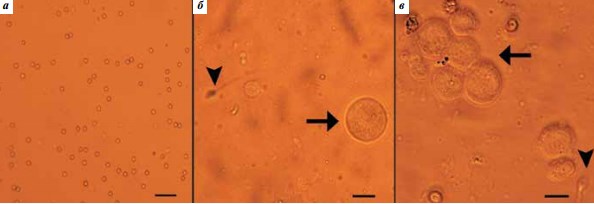
Рис. 1. Суспензии тестикулярных клеток, полученных из микробиоптатов яичка 3 пациентов с азооспермией: а – отсутствие половых клеток; б – единичный сперматоцит I порядка (стрелка) и тестикулярный сперматозоид (головка стрелки); в – большое количество сперматоцитов I порядка (стрелка) и тестикулярный сперматозоид (головка стрелки). Световая микроскопия. Масштабный отрезок 10 мкм
На рис. 2 представлен нормальный сперматоцит I порядка, полученный из микробиоптата пациента с секреторной азооспермией. Сперматоцит на стадии средней пахитены, в нем не выявлено отклонений от нормы. Все аутосомные СК полностью сформированы. Половой (XY) бивалент находится на периферии ядра и формирует типичное для самцов млекопитающих «половое тельце».

Рис. 2. Тотальный препарат распластанных синаптонемных комплексов (СК), полученный из биоптата пациента с секреторной азооспермией. Стадия средней пахитены. Видны 22 аутосомных СК-бивалента и расположенное на периферии ядра «половое тельце», образованное половым (ХY) бивалентом. Электронная микроскопия. ×5000
Однако у многих инфертильных пациентов нормальные сперматоциты встречаются довольно редко или не встречаются вообще. При анализе полученных результатов в первую очередь необходимо определить, на какой стадии профазы I мейоза находится каждый сперматоцит. Опорными маркерами стадий профазы I в мужском мейозе служат специфические для каждой из них особенности ультраструктуры осевых элементов полового (ХY) бивалента и, конечно, соответствующие каждой стадии особенности структуры осевых элементов и СК аутосом [28].
Идентифицировать половые хромосомы до стадии поздней зиготены довольно трудно. Идентифицировать половой бивалент среди длинных аутосом удается начиная со стадии поздней зиготены, когда аутосомы почти завершают синапсис, а асинаптированными остаются лишь Хи Y-хромосомы (рис. 3а). Далее на стадии ранней пахитены Хи Y-хромосомы сближаются теломерными концами, и между ними формируется короткий участок СК. На протяжении пахитены участок синапсиса между Хи Y-хромосомами увеличивается, осевые элементы приобретают выросты, рядом с асинаптированными участками осевых элементов начинают группироваться глобулы электронно-плотного материала, в осевом элементе Х-хромосомы иногда различаются 2 нити (рис. 3б). В конце средней пахитены ХY-бивалент формирует «половое тельце»: превращается в клубок тонких нитей и выселяется на периферию ядра (рис. 3в).
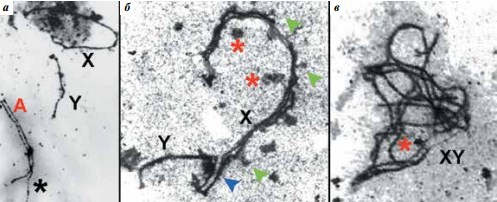
Рис. 3. Структура полового бивалента на 3 стадиях профазы I мейоза. Электронная микроскопия: а – поздняя зиготена: Хи Y-хромосомы сближены; аутосомы частично асинаптированы (звездочка). ×5000; б – конец ранней пахитены: между Хи Y-хромосомами сформирован короткий фрагмент синаптонемного комплекса (синяя стрелка); асинаптированный участок осевого элемента утолщен и раздвоен; вблизи XYбивалента видны скопления электронно-плотного материала (красная звездочка). ×9000; в – конец средней пахитены: «половое тельце» сформировано и располагается на периферии ядра; тонкие осевые элементы Хи Y-хромосом формируют клубок. ×11 000
Электронно-микроскопическое исследование распластанных ядер сперматоцитов позволяет обнаружить в них различные типы нарушений. У пациентов с нарушением фертильности «арест» сперматогенеза может происходить на стадиях ранней лептотены – диплотены, однако наиболее часто встречаются сперматоциты с признаками «ареста» мейоза на стадии пахитены. Типичным признаком пахитенного ареста является нарушение формирования структуры «полового тельца» – ассоциация полового бивалента с аутосомами и «заякоривание» Хи Y-хромосом среди аутосом (рис. 4а). У мужчин как с обструктивным, так и с необструктивным (секреторным) бесплодием признаки пахитенного «ареста» нередко удается выявить в ядрах сперматоцитов, в которых никаких нарушений синапсиса аутосом не обнаруживается. У пациентов с делециями локуса AZF часто наблюдается фрагментация хромосом.
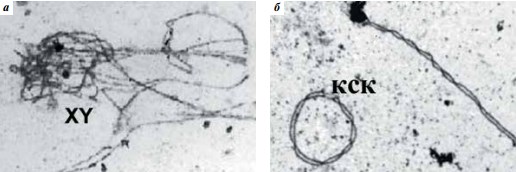
Рис. 4. Нарушения в структуре синаптонемных комплексов (СК) в распластанных ядрах сперматоцитов. Электронная микроскопия: а – типичный признак пахитенного «ареста» – ассоциация полового (ХY) бивалента с частично асинаптированными аутосомными СК-бивалентами. ×7000; б – кольцевой СК-бивалент (КСК). ×6000
У пациентов с нарушением фертильности и нормальным кариотипом часто выявляются кольцевые хромосомы (рис. 4б). У пациента с установленной ломкостью хромосомы 22 в 1 ядре встречали по 2 и даже по 3 кольцевых СК-бивалента.
Иммуноцитохимическое исследование распластанных ядер сперматоцитов. Этот метод также позволяет изучить клетки на всех стадиях профазы I мейоза. На стадии лептотены в распластанных ядрах сперматоцитов видны осевые элементы хромосом, которые выявляются с помощью антител к SCP3. Постепенно осевые элементы формируются вдоль каждой хромосомы (рис. 5а). На стадии зиготены начинается синапсис гомологичных хромосом. При иммуноокрашивании антителами к гистону γН2АХ наблюдается широкое распространение этого гистона по участкам асинаптированного хроматина (рис. 5б), так как в асинаптированных участках еще не произошла репарация большинства запрограммированных DSBs. Прямым доказательством незавершенности репарации является и множество фокусов белка RAD51, маркирующего ранние рекомбинационные узелки (рис. 5в). На этих стадиях идентифицировать половой (ХY) бивалент трудно. Начиная со стадии ранней пахитены в иммуноокрашенных препаратах половой бивалент легко идентифицировать с помощью разных комбинаций антител: к белкам SCP3 и RAD51 (рис. 5г), или к SCP3 и гистону γН2АХ, или к SCP3 и белкам кинетохора. На рис. 5д представлено распластанное ядро сперматоцита I порядка на стадии средней пахитены. На этой стадии половой бивалент легко идентифицируется по конфигурации осевых элементов. Сигналы белка MLH1 выявлены на всех аутосомных СК и половом биваленте.
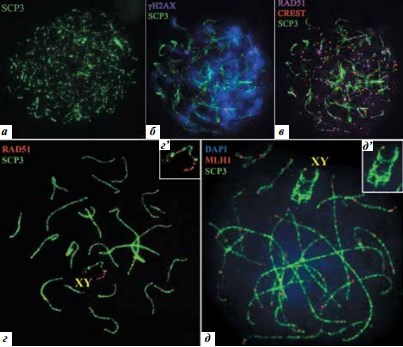
Рис. 5. Распластанные ядра сперматоцитов на стадиях лептотены – поздней пахитены. Иммуноцитохимическое исследование: а – лептотена: видны тонкие формирующиеся осевые элементы хромосом, маркированные антителами к белку SCP3 (зеленый); б – ранняя зиготена: осевые элементы хромосом и формирующиеся участки синаптонемных комплексов (СК) (зеленый); хроматин, связанный с асинаптированными осевыми элементами, маркирован антителами к гистону γН2АХ (фиолетовый); в – та же клетка, что и на рис. 5б: множественные фокусы белка RAD51 (розовый), SCP3 (зеленый); центромеры маркированы антителами CREST (красный); г – ранняя пахитена: на аутосомных СК (зеленый) видны единичные сигналы RAD51 (красный); ХY-бивалент лежит в центре распластанного ядра сперматоцита, вдоль асинаптированных осевых элементов Хи Y-хромосом сохраняется множество фокусов белка RAD51 (г’); д – поздняя пахитена: фокусы белка MLH1 (красный) видны на всех аутосомах и в структуре «полового тельца» (XY) (д’); хроматин окрашен DAPI (синий)
На рис. 6 представлены наиболее типичные нарушения в структуре распластанных ядер сперматоцитов, которые наблюдаются у пациентов с азооспермией: в ядрах с типичными признаками пахитенного «ареста» (см. рис. 6а, б, г) наблюдается ассоциация Хи Y-хромосом с аутосомами, «половое тельце» не сформировано и не вынесено на периферию ядра. Кроме того, в 1 из 2 ядер на рис. 6б в структуре полового бивалента отсутствует фокус белка MLH1, что свидетельствует об отсутствии хиазмы между Xи Y-хромосомами.
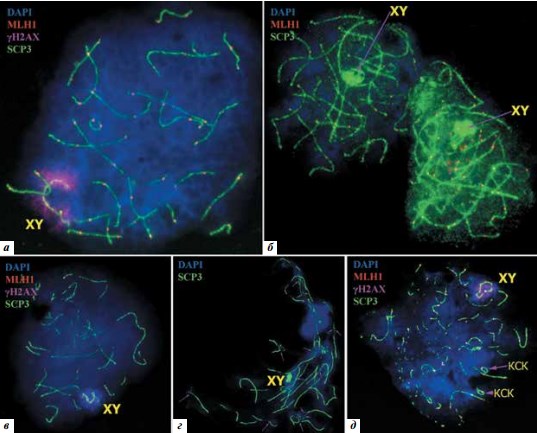
Рис. 6. Типичные нарушения в распластанных ядрах сперматоцитов. Иммуноцитохимическое исследование. Препараты маркированы антителами к белкам: SCP3 (зеленый), MLH1 (красный), гистону γH2AX (фиолетовый). Хроматин окрашен DAPI (синий): а – ранняя пахитена: ассоциация полового бивалента (ХY) с аутосомой; б – средняя пахитена: ассоциация полового бивалента (ХY) c аутосомами; отсутствие сигнала MLH1 в структуре полового бивалента (ХY); в – единичные фрагменты синаптонемных комплексов; г – нарушение архитектоники ядра; ассоциация полового бивалента (ХY) c аутосомами; фрагментация синаптонемных комплексов; д – тотальная фрагментация синаптонемных комплексов, кольцевые синаптонемные комплексы (КСК) в ядре дегенерирующего сперматоцита
Характерными нарушениями структуры ядер у пациентов с секреторной азооспермией являются аномалии архитектоники ядер (см. рис. 6г) и фрагментация СК (см. рис. 6в–д). Причем фрагменты СК могут встречаться на стадиях от ранней до поздней пахитены. Иногда наряду с фрагментами в них могут формироваться и кольцевые СК-биваленты (см. рис. 6д).
Обсуждение
Значительный прогресс в расширении представлений о причинах мужского бесплодия в последние десятилетия, несомненно, связан с внедрением в практику репродуктивных центров процедуры TESE, впервые обеспечившей широкий доступ к исследованию мейоза и сперматогенеза человека [11, 29–31, 34]. Следует подчеркнуть, что предварительный анализ суспензий герминативных клеток, полученных с помощью TESE, весьма информативен. В этом отношении особую значимость имеют данные китайских ученых, выполнивших сравнительное исследование результативности гистологического анализа срезов ткани яичка и анализа суспензий тестикулярных клеток, полученных методом TESE от 1112 пациентов с необструктивной азооспермией. Эти авторы статистически подтвердили целесообразность контроля суспензии клеток тестикулярной ткани, результаты которого по информативности сопоставимы с результатами гистологического анализа. И, что не менее важно, эти авторы показали возможность извлечения из таких суспензий сперматозоидов для использования их в ICSI в тех случаях, когда это не удается осуществить методом micro-TESE [35].
Анализ суспензий клеток тестикулярной ткани для исследования мейоза человека и животных проводится нами в течение 30 лет, при работе с модельными объектами мы используем суспензии клеток целого яичка. По нашим наблюдениям, этот простой метод дает очень важную, а подчас и совершенно неожиданную информацию о состоянии сперматогенеза. Так, недавно нами обнаружено множество атипичных тестикулярных сперматозоидов в суспензиях клеток семенных канальцев, полученных от триплоидных самцов межвидовых гибридов скальных ящериц Darevskia. При анализе СК у этих самцов выявлено тотальное нарушение синапсиса хромосом в профазе I мейоза [23]. Подобные нарушения у самцов млекопитающих неизбежно ведут к «аресту» мейоза на стадии пахитены [23].
Второе значимое событие в исследовании мейоза – открытие СК и совершенствование методов исследования мейоза на основе анализа распластанных ядер сперматоцитов. Выше мы продемонстрировали возможности электронно-микроскопического и иммуноморфологического анализа СК. На основе анализа СК удается определить мельчайшие дефекты синапсиса хромосом, выявить хромосомные перестройки, которые, как известно, могут формироваться в мейозе de novo у пациентов с нормальным кариотипом соматических клеток. Хорошо визуализируются нарушения архитектоники ядер, которые, по нашим наблюдениям, всегда связаны с «арестом» мейоза. И наконец, электронномикроскопический анализ СК дает информацию о стадии, на которой блокируется мейоз, а по нашим данным, у бесплодных пациентов блок мейоза в профазе I может осуществляться на всех стадиях, от прелептотены до диплотены [9].
Иммуноцитохимическое исследование позволяет не только выявить нарушения синапсиса гомологов или признаки «ареста» мейоза, но и установить детали формирования и репарации DSBs, мейотической рекомбинации, особенности транскрипционной инактивации хроматина, признаки апоптоза сперматоцитов. Эти детали крайне важны для установления механизмов «ареста» мейоза у каждого пациента с тяжелыми формами нарушения сперматогенеза, патозооспермии и мужского бесплодия, для оценки риска формирования анеуплоидных сперматозоидов [29–31, 34, 36].
Необходимость выявления рисков формирования анеуплоидных сперматозоидов подтверждают и данные литературы о том, что частота мейотических ошибок в формирующихся половых клетках человека по крайней мере на порядок выше, чем у животных. Хромосомные аномалии выявляются у 0,5–0,7 % новорожденных, 5–6 % мертворожденных детей и 50–60 % спонтанных абортусов. У мужчин повышенное количество сперматозоидов с анеуплоидией половых хромосом встречается довольно часто [29]. Это увеличивает риск появления потомства с синдромами Клайнфельтера, Шерешевского–Тернера, дисомией по Y-хромосоме и полиплоидией по гоносомам [4]. Известно, что большинство эмбрионов с хромосомными аномалиями погибают на ранних стадиях эмбрионального развития. Однако трисомики по хромосомам 13, 18 и 21 жизнеспособны, как и носители некоторых хромосомных транслокаций, в том числе множественных. Носители таких хромосомных аномалий могут иметь умственные, психические, физические отклонения, нарушения полового развития и репродукции [3, 4, 29]. Оценить уровень анеуплоидии в мужских гаметах по различным хромосомам возможно с помощью иммунофлуоресцентной гибридизации сперматозоидов in situ (fluorescence in situ hybridization). Особую актуальность данное исследование представляет для мужчин с аномалиями кариотипа, повторными случаями анеуплоидии у потомства или плода, неудачами ЭКО/ICSI. Основным подходом к выявлению рисков формирования анеуплоидных сперматозоидов является анализ распределения фокусов белка MLH1 в структуре пахитенных СК. К настоящему времени установлена клиническая значимость данных, полученных при исследовании СК у инфертильных пациентов, именно в отношении риска формирования анеуплоидных сперматозоидов [2, 4, 29, 31, 34, 36]. В совокупности эти данные подтверждают целесообразность исследования СК у инфертильных пациентов, а в случае выявления риска формирования анеуплоидных сперматозоидов – необходимость преимплантационной генетической диагностики у эмбрионов.
Естественно, особый интерес представляют данные о мужском мейотическом бесплодии, обусловленном мутациями генов, которые ответственны за прогрессию мейоза и сперматогенеза в целом. К настоящему времени получены убедительные данные о роли в формировании мужского бесплодия делеций локуса AZF длинного плеча Y-хромосомы, мутаций гена CFTR. Поиск указанных мутаций проводят с помощью полимеразной цепной реакции [4, 6, 7, 17, 36]. По данным литературы, известные генетические факторы ответственны приблизительно за треть случаев азооспермии. При этом 40 % случаев классифицируются как идиопатические и, по мнению многих авторов, могут быть связаны с неизвестными генетическими аномалиями [2, 4, 9, 36].
Нарушения мейоза, обнаруженные у пациентов с азооспермией, играют важную роль в определении направления молекулярно-генетических исследований, поиска мутаций генов, ответственных за прогрессию мейоза.
Заключение
Представленные данные свидетельствуют о том, что выявление аномалий структуры СК, процесса его формирования и деградации служит надежным индикатором характера нарушений мейоза при нарушении фертильности у человека. Нарушения архитектоники ядер, синапсиса и репарации DSBs могут вызывать «арест» мейоза на стадии средней пахитены и являться причиной бесплодия пациентов как с обструктивной, так и с необструктивной азооспермией. Нарушение гомологичной рекомбинации в профазе I мейоза может приводить к анеуплоидии сперматозоидов и плода, служить причиной неудачи ICSI, нарушения развития беременности или рождения детей с хромосомными нарушениями. Поэтому в случае выявления нарушений гомологичной рекомбинации в профазе I мейоза необходимо проведение у эмбриона преимплантационной генетической диагностики.
Показана целесообразность использования в практике работы репродуктивных центров предварительного светомикроскопического исследования суспензий клеток биоптата тестикулярных канальцев, полученных методом TESE, для оценки состояния сперматогенеза и дополнительного способа получения тестикулярных сперматозоидов для использования их в ICSI.
Литература
1. Райцина С.С. Сперматогенез и структурные основы его регуляции. М.: Наука, 1985. 206 с. [Raytsina S.S. Spermatogenesis and structural basis of regulation. Moscow: Nauka, 1985. 206 p. (In Russ.)].
2. Carrell D.T., De Jonge C., Lamb D.J. The genetics of male infertility: a field of study whose time is now. Arch Androl 2006;52(4):269–74. DOI: 10.1080/01485010500503603. PMID: 16728342.
3. Курило Л.Ф., Сорокина Т.М., Черных В.Б. и др. Структура генетически обусловленных заболеваний органов половой системы у человека. Андрология и генитальная хирургия 2011;12(3):17–26. [Kurilo L.F., Sorokina T.M., Chernykh V.B. et al. Structure and pathogenesis of hereditary disorders of the human reproductive system organs. Andrologiya i genital’naya khirurgiya = Andrology and Genital Surgery 2011;12(3):17–26. (In Russ.)].
4. Hamada A.J., Esteves S.C., Agarwal A. A comprehensive review of genetics and genetic testing in azoospermia. Clinics (Sao Paulo) 2013;68(1):39–60. DOI: 10.6061/clinics/2013(Sup01)06. PMID: 23503954.
5. Sciurano R.B., Luna Hisano C.V., Rahn M. et al. Focal spermatogenesis originates in euploid germ cells in classical Klinefelter patients. Hum Reprod 2009;24(9):2353–60. DOI: 10.1093/humrep/dep180. PMID: 19443454.
6. Черных В.Б. AZF делеции – частая генетическая причина бесплодия у мужчин: современное состояние исследований. Проблемы репродукции 2009;15(1):10–5. [Chernykh V.B. AZF deletions are common genetic cause of male infertility: the current state of research. Problemy reproduktsii = Russian Journal of Human Reproduction 2009;15(1):10–5. (In Russ.)].
7. Khalil A.M., Wahlestedt C. Epigenetic mechanisms of gene regulation during mammalian spermatogenesis. Epigenetics 2008;3(1):21–7. DOI: 10.4161/ epi.3.1.5555. PMID: 184160296.
8. Moses M.J. New cytogenetic studies on mammalian meiosis. In: Animal Models in Human Reproduction. Ed. by M. Serio, L. Martini. N.-Y., 1980. Pp. 169–190.
9. Dobson M.J., Pearlman R.E., Karaiskakis A. et al. Synaptonemal complex proteins: occurrence, epitope mapping and chromosome disjunction. J Cell Sci 1994;107(Pt10):2749–60. PMID: 7876343.
10. Heyting C. Synaptonemal complex: structure and function. Curr Opin Cell Biol 1996;8(3):389–96. PMID: 8743892.
11. Богданов Ю.Ф., Коломиец О.Л. Синаптонемный комплекс – индикатор мейоза и изменчивости хромосом. М., 2007. 358 с. [Bogdanov Yu.F., Kolomiets O.L. Synaptonemal complex as indicator of chromosome variability. Moscow, 2007. 358 p. (In Russ.)].
12. Pacheco S., Marcet-Ortega M., Lange J. et al. The ATM signaling cascade promotes recombination-dependent pachytene arrest in mouse spermatocytes. PLoS Genet 2015;11(3):e1005017. DOI: 10.1371/journal.pgen.1005017. PMID: 25768017.
13. Zickler D., Kleckner N. Recombination, pairing, and synapsis of homologs during meiosis. Cold Spring Harb Perspect Biol 2015;7(6).pii:a016626. DOI: 10.1101/ cshperspect.a016626. PMID: 25986558.
14. Moses M.J. Chromosomal structures in crayfish spermatocytes. J Biophys Biochem Cytol 1956;2(2):215–8. PMID: 13319383. PMCID: PMC2223961.
15. Fawcett D.W. The fine structure of chromosomes in the meiotic prophase of vertebrate spermatocytes. J Biophys Biochem Cytol 1956;2(4):403–6. PMID: 13357504. PMCID: PMC2229679.
16. King R.C. The meiotic behavior of the Drosophila oocyte. Int Rev Cytol 1970;28:125–68. DOI: 10.1016/ S0074-7696(08)62542-5. PMID: 4908567.
17. Counce S., Meyer G. Differentiation of the synaptonemal complex and the kinetochore in Locusta spermatocytes studied by whole mount electron microscopy. Chromosoma 1973;44(2):231–53. PMID: 4778070.
18. Коломиец О.Л., Aбудуев Н.К., Мазурова Т.Ф. и др. Повреждающее действие антибиотиков на структуру синаптонемных комплексов мейотических хромосом мыши. Генетика 2001;37(2):197–206. [Kolomiets O.L., Abuduev N.K., Mazurova T.F. et al. Damaging effect of antibiotics on the structure of synaptonemal complexes of meiotic chromosome of mice. Genetika = Genetics 2001;37(2):197–206. (In Russ.)]. PMID: 11253426.
19. Коломиец О.Л., Ацаева М.М., Дадашев С.Я. и др. Нарушения структуры синаптонемных комплексов и селекции сперматоцитов I порядка мыши в ответ на введение лекарственных препаратов. Генетика 2013;49(11):1261–9. [Kolomiets O.L., Atsaeva M.M., Dadashev S.Yа. et al. Damage to synaptonemal complex structure and peculiarities of selection of mouse spermatocytes I at response to drug administration. Genetika = Genetics 2013;49(11):1261–9. (In Russ.)]. PMID: 25470926.
20. Turner J., Mahadevaiah S., FernandezCapetillo O. et al. Silencing of unsynased meiotic chromosomes in the mouse. Genetics 2005;37(1):41–7. DOI: 10.1038/ng1484. PMID: 15580272.
21. Homolka D., Jansa P., Forejt J. Genetically enhanced asynapsis of autosomal chromatin promotes transcriptional dysregulation and meiotic failure. Chromosoma 2012;121(1):91–104. DOI: 10.1007/s00412-011-0346-5. PMID: 22002499.
22. Коломиец О.Л., Мазурова Т.Ф., Богданов Ю.Ф. и др. Анализ структуры и поведения синаптонемных комплексов самцов мыши после длительного введения неоаквасепта. Генетика 1993;29(12):1982–91. [Kolomiets O.L., Mazurova T.F., Bogdanov Yu.F. et al. Synaptonemal complexes of chromosomes of male mice after prolonged administration of neoaquasept. Genetika = Genetics 1993;29(12): 1982–91. (In Russ.)]. PMID: 8119577.
23. Spangenberg V., Arakelyan M., Galoyan E. et al. Reticulate evolution of the rock lizards: meiotic chromosome dynamics and spermatogenesis in diploid and triploid males of the genus Darevskia. Genes (Basel) 2017;8(6).pii:E149. DOI: 10.3390/genes8060149. PMID: 28538689.
24. Moens P.B., Earnshaw W.C. Antitopoisomerase II recognizes meiotic chromosome cores. Chromosoma 1989;98(5):317–22. PMID: 2558860.
25. Matveevsky S.N., Pavlova S.V., Atsaeva M.M. et al. Dual mechanism of chromatin remodeling in the common shrew sex trivalent (XY1Y2). Comp Cytogen 2017;11(4):727–45. DOI: 10.3897/CompCytogen. v11i4.13870. PMID: 29114363. PMCID: PMC5672328.
26. Jamsai D., O’Bryan M.K. Mouse models in male fertility research. Asian J Androl 2011;13(1):139–51. DOI: 10.1038/ aja.2010.101. PMID: 21057516.
27. Feng C.A., Spiller C., Merriner D.J. et al. SOX30 is required for male fertility in mice. Sci Rep 2017;7(1):17619. DOI: 10.1038/s41598-017-17854-5. PMID: 29247201.
28. Solari A.J. Synaptonemal complexes and associated structures in microspread human spermatocytes. Chromosoma 1980;81(3):315–37. PMID: 7192619.
29. Martin R.H. Meiotic errors in human oogenesis and spermatogenesis. Reprod Biomed Online 2008;16(4):523–31. PMID: 18413061.
30. Tempest H.G. Meiotic recombination errors, the origin of sperm aneuploidy and clinical recommendations. Syst Biol Reprod Med 2011;57(1–2):93–101. DOI: 10.3109/19396368.2010.504879. PMID: 21204593.
31. De Vries M., Ramos L., de Boer P. Immunofluorescent characterization of meiotic recombination in human males with variable spermatogenesis. Andrology 2013;1(2):262–73. DOI: 10.1111/j.2047-2927.2012.00039.x. PMID: 23413139.
32. WHO laboratory manual for the examination and processing of human semen. 5th ed. WHO Press, 2010.
33. Патент на изобретение № 2328736/ 10.07.2008. Бюл. № 19. Курило Л.Ф. Способ цитологической диагностики нарушения сперматогенеза. [Patent RUS № 2328736/10.07.2008. Bull. № 19. Kurilo L.F. Method of cytogenetic diagnosis of spermatogenesis violation. (In Russ.)]. Доступно по: http://www.freepatent.ru/ patents/2328736. Ссылка активна на 20.02.2018.
34. Sun F., Kozak G., Scott S. Variation in meiotic recombination frequencies among human males. Hum Genet 2005;116(3):172–8. DOI: 10.1093/ humrep/deh335. PMID: 15578224.
35. Tang W.H., Jiang H., Ma L.L. et al. Detection of spermatozoa in the testicular tissue of non-obstructive azoospermia patients: cell suspension examination versus histopathology. Zhonghua Nan Ke Xue 2013;19(1):68–71. PMID: 23469666.
36. Miyamoto T., Minase G., Shin T. et al. Human male infertility and its genetic causes. Reprod Med Biol 2017;16(2):81–8. DOI: 10.1002/rmb2.12017. PMID: 29259455.
37. Gardner R.J.M., Sutherland G.R., Grant R. Chromosome Abnormalities and Genetic Counseling. 4th ed. Oxford University Press, 2011. 648 p.
Статья опубликована в журнале "Андрология и генитальная хирургия" выпуск №1/2018, стр. 22-31









Комментарии