Т.Х. Назаров, И.В. Рычков
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России; Россия, 191015 Санкт-Петербург, ул. Кирочная, 41 Контакты: Тоирхон Хакназарович Назаров tair-nazarov@yandex.ru
Введение
Рак предстательной железы (РПЖ) признан одним из наиболее злокачественных новообразований у мужчин в мире. Во многих странах он занимает 2-е или 3-е место в структуре онкологических заболеваний после рака легкого и рака желудка [1, 2]. После успешного лечения РПЖ, особенно на начальных стадиях, многих пациентов беспокоят симптомы дефицита тестостерона. Важно, что андрогенный дефицит не является сугубо сексуальной проблемой – он ведет к развитию других нарушений, таких как метаболический синдром, сахарный диабет, сердечно-сосудистые заболевания, остеопороз, уролитиаз и др. [3, 4]. Но если пациентам без онкопатологии в анамнезе можно назначать заместительную терапию тестостероном (ЗТТ) без опасений, то у пациентов с РПЖ вопрос о безопасности и эффективности применения андрогенов остается открытым.
Многие клиницисты сомневаются, назначать ли ЗТТ пациентам с синдромом андрогенной недостаточности после радикального лечения РПЖ – брахитерапии или радикальной простатэктомии (РПЭ), опасаясь того, что увеличение уровня андрогенов может вызвать прогрессию опухоли или ее рецидив. Однако результаты проспективных эпидемиологических исследований не подтвердили наличие корреляции между уровнем эндогенного тестостерона и риском развития РПЖ [2, 5]. Первые данные об этом появились более 10 лет назад. P. Stattin и соавт. в 2004 г. провели исследование типа «случай–контроль» с участием 708 мужчин с РПЖ и 2242 без РПЖ и пришли к заключению, что при росте уровня общего тестостерона в физиологическом диапазоне риск развития РПЖ статистически значимо снижается [6]. G. Severi и соавт. в 2006 г. обследовали 524 мужчины с РПЖ в возрасте 47–80 лет (средний период наблюдения 8,7 года) и 1859 случайно отобранных мужчин и констатировали, что высокий уровень тестостерона сопровождается сниженным риском агрессивного РПЖ [7]. Некоторые авторы отмечают негативные особенности течения РПЖ при низком уровне тестостерона: распространенность, инвазивность, недифференцированность и агрессивность [8, 9].
По мере накопления данных было опубликовано несколько обзоров и метаанализов по данной проблеме. Так, эпидемиологический анализ, проведенный J. Baillargeon и соавт. на основе сведений о 52 579 мужчинах с диагнозом РПЖ, не выявил ассоциации ЗТТ с повышенным риском РПЖ [10].
P. Boyle и соавт. оценивали связь между уровнем эндогенного и экзогенного тестостерона, простатспецифического антигена (ПСА) и риском РПЖ. Метаанализ проведен в соответствии с руководящими принципами PRISMA. Авторы сделали вывод о том, что РПЖ, по-видимому, не связан с эндогенным уровнем тестостерона, а ЗТТ не увеличивает уровень ПСА и риск развития РПЖ [11]. Однако в обзоре декларируется необходимость дальнейших исследований, что обусловливает актуальность данного.
Целью исследования является предварительная оценка возможности использования ЗТТ у мужчин с синдромом андрогенной недостаточности после радикального лечения РПЖ – брахитерапии и РПЭ.
Материалы и методы
На базах ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России под нашим наблюдением находились 12 мужчин в возрасте от 50 до 65 лет с локализованным РПЖ (Т1-2N0M0) в анамнезе и синдромом андрогенного дефицита: 5 пациентов после брахитерапии (все с Т1сN0M0G1 ) и 7 после РПЭ (1 с Т2aN0M0G1 , 6 с Т1сN0M0G1 ). Всем пациентам назначена ЗТТ в течение 15 мес. Учитывая преимущества и недостатки ЗТТ у данной категории пациентов, мы отказались от препаратов с пролонгированным действием и использовали трансдермальную форму (1 % гель), которая позволяла в любой момент прекратить терапию.
До и после ЗТТ определен уровень общего тестостерона крови, ПСА; проведены оценка эректильной дисфункции по IIEF (International Index оf Erectile Function – международный индекс эректильной функции) и андрогенного дефицита по AMS (Aging Males’ Symptoms Scale – шкала оценки симптомов старения мужчин), трансректальное ультразвуковое исследование, мультиспиральная компьютерная и магнитно-резонансная томография и остеосцинтиграфия. Статистический анализ полученных клинических данных не выполнялся из-за недостаточности количества наблюдений. Приводится фактическое среднее значение показателей. В дальнейшем планируется накопление достаточного числа случаев для статистического анализа и проверки эффективности и безопасности исследуемой терапии.
Результаты и обсуждение
До начала ЗТТ все пациенты предъявляли жалобы, характерные для возрастного андрогенного дефицита: на снижение либидо и нарушение эрекции, повышенную утомляемость, ухудшение настроения и памяти, раздражительность, беспокойство и периодическое повышение артериального давления.
Все пациенты ЗТТ переносили удовлетворительно. После ЗТТ средний уровень общего тестостерона крови повысился по сравнению с исходным у пациентов, перенесших брахитерапию, с 3,4 до 18,4 нмоль/л, у пациентов, перенесших РПЭ, – с 2,7 до 15,3 нмоль/л; содержание ПСА уменьшилось соответственно с 2,1 до 1,7 нг/мл и с 1,9 до 1,3 нг/мл (рис. 1).
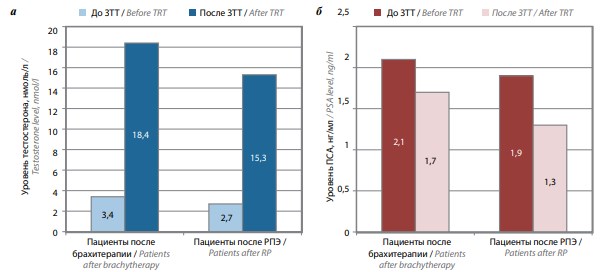
Рис. 1. Уровень общего тестостерона (а) и простатспецифического антигена (б) в крови до и после заместительной терапии тестостероном у пациентов с синдромом андрогенной недостаточности после радикального лечения рака предстательной железы. Здесь и на рис. 2: ЗТТ – заместительная терапия тестостероном, ПСА – простатспецифический антиген, РПЭ – радикальная простатэктомия
Оценка по AMS после ЗТТ снизилась по сравнению с исходной у пациентов, перенесших брахитерапию, с 43 до 20 баллов, у пациентов, перенесших РПЭ, – с 47 до 23 баллов, что свидетельствовало об изменении степени андрогенного дефицита от выраженной до слабой; оценка по IIEF повысилась соответственно с 10 до 19 баллов и с 8 до 17 баллов, что отразило изменение степени эректильной дисфункции от тяжелой до легкой (рис. 2).
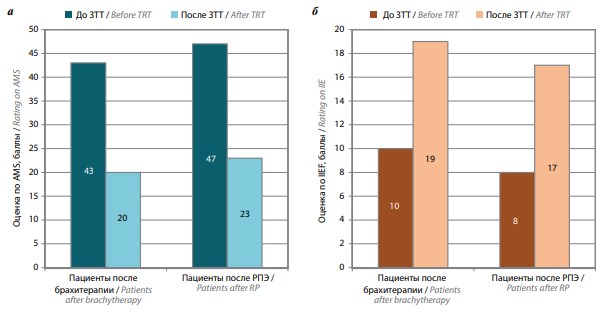
Рис. 2. Оценка по AMS (а) и по IIEF (б) до и после заместительной терапии тестостероном у пациентов с синдромом андрогенной недостаточности после радикального лечения рака предстательной железы
В период наблюдения у всех пациентов по данным контрольного трансректального ультразвукового исследования, мультиспиральной компьютерной и магнитно-резонансной томографии и остеосцинтиграфии не наблюдалось прогрессирования и рецидива опухолевого процесса. Все пациенты отмечали уменьшение жалоб, улучшение половой функции и качества жизни в целом.
Полученные нами данные хорошо согласуются с данными других исследователей. В зарубежной литературе имеются сообщения о безопасности ЗТТ у пациентов после радикального лечения РПЖ. В частности, A. Morales и соавт. еще в 2009 г. сообщили о положительных результатах применения ЗТТ в течение 14,5 мес у 5 мужчин в возрасте 51–80 лет с синдромом андрогенной недостаточности после дистанционной лучевой терапии локализованного РПЖ [1]. В этом же году M. Khera опубликовал аналогичное сообщение об эффективности ЗТТ, которая применялась в течение 36 мес у 57 мужчин в возрасте 53–83 лет после РПЭ [12]. Автор пришел к выводу, что ЗТТ повышает уровень сывороточного тестостерона без изменения уровня ПСА, и, главное, это сопровождается у всех пациентов исчезновением симптомов возрастного андрогенного дефицита.
Y. Cui и соавт. выполнили метаанализ всех опубликованных рандомизированных контролируемых исследований лечения тестостероном гипогонадизма по базам Medline, Embase и Cochrane Controlled Trials. Он показал, что независимо от метода введения тестостерона ЗТТ не способствует развитию или прогрессированию РПЖ, но эти выводы касаются краткосрочных курсов ЗТТ [13]. Систематический обзор и метаанализ, проведенные D.Y. Kang, H.J. Li на материалах Medline, Cochrane Library, Embase и Google Scholar, также позволяют с большой долей уверенности утверждать, что ЗТТ не увеличивает уровень ПСА у мужчин, получающих лечение гипогонадизма [14].
Итак, главным критерием эффективности ЗТТ является изменение уровня ПСА и тестостерона, оценки по AMS и IIEF. До ЗТТ необходимо тщательно обследовать пациентов, успешно прошедших радикальное лечение по поводу локализованного РПЖ. ЗТТ должна проводиться у пациентов с крайне низким риском рецидива онкологического процесса. Пациенты должны быть осведомлены о преимуществах и недостатках лечения.
Выводы
У пациентов с синдромом андрогенной недостаточности после радикального лечения РПЖ возможно проведение ЗТТ, поскольку она ассоциирована с улучшением эректильной функции и уменьшением андрогенного дефицита и не приводит к рецидивам опухоли.
1. Morales A., Black A.M., Emerson L.E. Testosterone administration to men with testosterone deficiency syndrome after external beam radiotherapy for localized prostate cancer: preliminary observations. BJU Int 2009;103(1):62–4. DOI: 10.1111/ j.1464-410X.2008.07882.x. PMID: 18671790.
2. Tubaro A. Testosterone and prostate cancer. Eur Urol 2007;51(2):293–5. DOI: 10.1016/j.eururo.2006.08.048. PMID: 17034931.
3. Новиков А.И., Назаров Т.Х. Заместительная андрогенная терапия после радикального лечения рака предстательной железы. В сб.: XII съезд Российского общества урологов: материалы. М., 2012. С. 341. [Novikov A.I., Nazarov T.Kh. Androgen replacement therapy after radical treatment of prostate cancer. In: XII Congress of the Russian Society of Urologists. Moscow, 2012. Pp. 341. (In Russ.)].
4. Nazarov T., Magidov S., Ahmedov M. Androgen deficiency and formation kidney stone in men. 2nd Meeting of the EAU Section of Urolithiasis. Copenhagen, 2013. Pp. 59.
5. Parsons J.K., Carter H.B., Platz E.A. et al. Serum testosterone and the risk of prostate cancer: potential implications for testosterone therapy. Cancer Epidemiol Biomarkers Prev 2005;14(9): 2257–60. DOI: 10.1158/1055-9965.EPI04-0715. PMID: 16172240.
6. Stattin P., Lumme S., Tenkanen L. et al. High levels of circulating testosterone are not associated with increased prostate cancer risk: a pooled prospective study. Int J Cancer 2004;108(3):418–24. DOI: 10.1002/ijc.11572. PMID: 14648709.
7. Severi G., Morris H.A., MacInnis R.J. et al. Circulating steroid hormones and the risk of prostate cancer. Cancer Epidemiol Biomarkers Prev 2006;15(1): 86–91. DOI: 10.1158/1055-9965.EPI-050633. PMID: 16434592.
8. Imamoto T., Suzuki H., Fukasawa S. et al. Pretreatment serum testosterone level as a predictive factor of pathological stage in localized prostate cancer patients treated with radical prostatectomy. Eur Urol 2005;47(3):308–12. DOI: 10.1016/ j.eururo.2004.11.003. PMID: 15716191.
9. Isom-Batz G., Bianco F.J., Kattan M.W. et al. Testosterone as a predictor of pathological stage in clinically localized prostate cancer. J Urol 2005;173(6): 1935–7. DOI: 10.1097/01.ju. 0000158040.33531.e7. PMID: 15879785. PMCID: PMC1855287.
10. Baillargeon J., Kuo Y.F., Fang X. et al. Long-term exposure to testosterone therapy and the risk of high grade prostate cancer. J Urol 2015;194(6):1612–6. DOI: 10.1016/j.juro.2015.05.099. PMID: 26066403.
11. Boyle P., Koechlin A., Bota M. et al. Endogenous and exogenous testosterone and the risk of prostate cancer and increased prostate-specific antigen (PSA) level: a meta-analysis. BJU Int 2016;118(5):731–41. DOI: 10.1111/bju.13417. PMID: 26779889.
12. Khera M. Androgens and erectile function: a case for early androgen use in postprostatectomy hypogonadal men. J Sex Med 2009;6(3):234–8. DOI: 10.1111/j.1743-6109.2008.01159.x. PMID: 19207279.
13. Cui Y., Zong H., Yan H. et al. The effect of testosterone replacement therapy on prostate cancer: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis 2014;17(2):132–43. DOI: 10.1038/ pcan.2013.60. PMID: 24445948.
14. Kang D.Y., Li H.J. The effect of testosterone replacement therapy on prostatespecific antigen (PSA) levels in men being treated for hypogonadism: a systematic review and meta-analysis. Medicine (Baltimore) 2015;94(3):e410. DOI: 10.1097/MD.0000000000000410. PMID: 25621688. PMCID: PMC4602637
Статья опубликована в журнале "Андрология и генитальная хирургия" выпуск №1/2018, стр. 44-48









Комментарии