В рамках IX Российского Конгресса по эндоурологии и новым технологиям, 24 октября 2024 г. состоялось пленарное заседание «Эндоурология и новые технологии. Только Highlights», где с докладом «Carcinoma in situ. Маленькая, плоская, злая» выступил стажер-исследователь отдела урологии и андрологии МГУ Кисляков Дмитрий Андреевич. Доклад был подготовлен в соавторстве с Сорокиным Н.И., Преображенским В.Ю., Севергиной Л.О.
Доклад Кисляков Д.А. начал с определения места Carcinoma in situ (CIS) в ряду стадий рака мочевого пузыря (РМП), отметив, что это начальная стадия НИРМП и она ограничена базальной мембраной (не доходит до lamina propria). Термин НИРМП объединяет Та, Т1 и CIS, которые в совокупности составляют 75% всех впервые выявляемых опухолей мочевого пузыря. Истинная распространенность CIS по данным литературы сильно варьирует, однако известно, что категория высокого и наивысшего риска, где встречается CIS, составляет около 45% всего НИРМП. CIS это плоская опухоль, но она всегда high-grade (HG), имеет высокий потенциал перехода в мышечно-инвазивный рак мочевого пузыря (МИРМП), а ее переход в инвазивный рак непредсказуем.
В серии примеров было наглядно продемонстрировано, что часто CIS выглядит как красное, бархатистое пятно (часто имитируя воспаление), но может быть неотличима от нормального уротелия при цистоскопии в «белом свете». Также известны характерные признаки CIS, что она часто имеет множественный характер поражения, но может также быть диффузной, то есть присутствовать во всех участках стенки мочевого пузыря.
Далее автор напомнил о высоком потенциале злокачественности CIS, были приведены ссылки на все действующие рекомендации (Российские, AUA, EAU, NCCN, SITC), согласно которым, обнаружение CIS вместе с любой папиллярной опухолью переводит пациента в категорию высокого риска. В то же время, согласно Российским клиническим рекомендациям и рекомендациям EAU, обнаружение CIS в простатической уретре относится к наиболее неблагоприятным факторам и переводит пациента в категорию наивысшего риска, что требует первой линией лечения предлагать радикальную цистэктомию. Таким образом, CIS представляет из себя незаметный, но вместе с тем крайне неблагоприятный фактор, заставляющий фокусировать внимание на прогрессировании заболевания больше чем на рецидивировании и выбирать наиболее агрессивные методы лечения.
Говоря о диагностике CIS, было отмечено, что эта плоская и зачастую маленькая опухоль может быть совершенно не видна при традиционных методах визуализации РМП (ультразвуковое исследование, экскреторная урография, магнитно-резонансная томография, мультиспиральная компьютерная томография), при этом одна из ключевых ролей в ее выявлении – цитологический анализ мочи. Цитология мочи, выполненная по современной Парижской системе (Paris System published in 2022) остается оператор-зависимым методом диагностики CIS, что отмечается множеством авторов, и в случае отрицательного результата не говорит об отсутствии CIS, в тоже время положительный анализ может говорить о наличии любой HG опухоли (как CIS, так и папиллярной) в любом отделе мочевой системы, начиная от чашечек и заканчивая мочеиспускательным каналом.
Среди методов диагностики CIS особое место занимает цистоскопия с использованием методик улучшенной визуализации. Согласно литературным данным использование фотодинамической диагностики (PDD) позволяет улучшить выявляемость CIS на 26–40% по сравнению с «цистоскопией в белом свете» (WLC) (рис. 1).
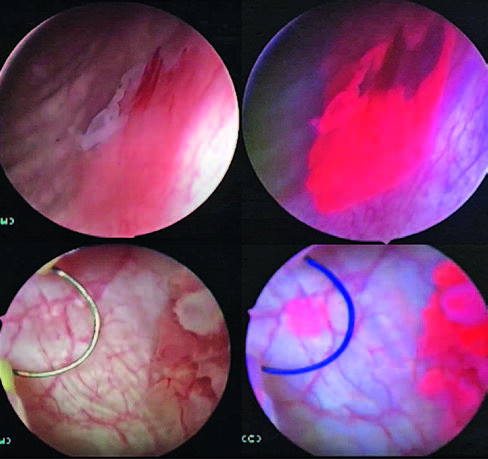
Рис. 1. CIS при цистоскопии в «белом свете» и PDD
Однако данная методика требует предварительного введения 5-аминолевулиновой кислоты (ALA) или гексаминолевулиновой кислоты (HAL), что ограничивает ее эффективность, поскольку не всегда возможно заранее определить пациентов с высоким риском, и в то же время от ее применения не выигрывают пациенты низкого и промежуточного риска, но значительно удорожают стоимость лечения. Также методика PDD лимитирована ложноположительным свечением в области треугольника Льето и простатической уретре, а также невозможностью применения в верхних мочевыводящих путях (ВМП).
Технология узкоспектровой визуализации (NBI) заключается в предпроцессорной обработке оптического сигнала за счет светового фильтра и улучшает выявляемость CIS на 28% (по сравнению с цистоскопией в «белом свете»). Технология более удобна в рутинной практике, поскольку не требует предварительного введения препаратов, а переключение между режимами WLC и NBI происходит одной кнопкой (рис. 2).
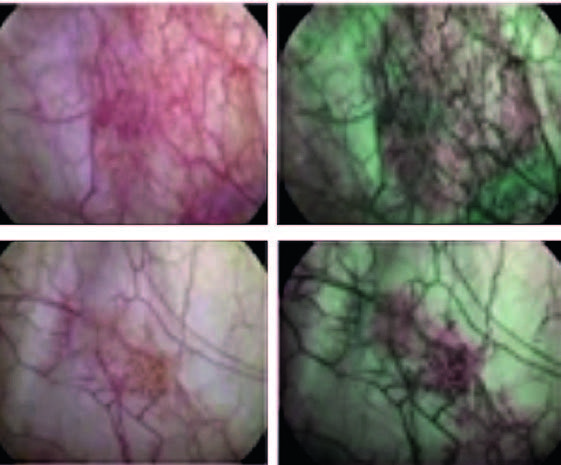
Рис. 2. CIS при цистоскопии в «белом свете» и NBI
В то же время, автором было отмечено, что если отсутствует доступность технологий улучшенной визуализации и пациент относится к группе высокого риска, положительную роль в исключении CIS играет биопсия (или ТУР-биопсия) c картированием мочевого пузыря, при которой выполняется биопсия каждой из зон мочевого пузыря. Также, для улучшения результатов трансуретральной резекции мочевого пузыря и диагностики CIS, был отмечен прием, при котором хирург к каждому пациенту с опухолью мочевого пузыря относится как к пациенту с положительным цитологическим анализом мочи. Данный прием позволяет добиться лучшего самоконтроля во время операции в каждом отдельном случае и выполнять цистоскопию более тщательно, в том числе, выполняя биопсию любого подозрительного участка стенки мочевого пузыря.
Особое внимание было сфокусировано на диагностике CIS в простатическом отделе уретры, которая, согласно литературным данным, составляет 11,7% у мужчин с Т1HG опухолями. Было отмечено, что диагностическая ценность методов улучшенной визуализации (PDD и NBI) для диагностики CIS в простатическом отделе уретры значительно меньше чем в мочевом пузыре, что обусловлено ложноположительным свечением из-за острого угла осмотра. Основным методом диагностики CIS в простатическом отделе уретре признана ТУР-биопсия с забором слизистой от шейки мочевого пузыря до прекалликулярной зоны (5–7 часов условного циферблата).
Также была продемонстрирована авторская методика выполнения энблок-биопсии простатического отдела уретры с использованием тулиевого волоконного лазера, в ходе которой выполняется резекция всей зоны уретры, рекомендованной к оценке – от прекалликулярной зоны до шейки мочевого пузыря от 5 до 7 часов условного циферблата.
Докладчик привел также данные исследования, в котором было показано, что CIS в интрамуральной порции мочеточника является независимым предиктором возникновения метахронного рака ВМП с той же стороны.
Переходя к лечению пациентов с CIS, было подчеркнуто, что хирургическое удаление не относится к методам лечения CIS, поскольку невозможно удалить то, что мы не видим. А основным методом лечения, имеющим статус «золотого стандарта» на настоящий момент, является интрапузырная иммунная терапия вакциной БЦЖ в режиме индукция + поддерживающая терапия (1 или 3 года). Косвенно была упомянута проблема БЦЖ-рефрактерного рака и современные решения этой проблемы в мире. Также отмечены две меры для лечения больных БЦЖ-рефрактерным РМП, прописанные в Российских клинических рекомендациях: системная иммунная терапия пембролизумабом, а также радикальная цистэктомия.
В заключении своего доклада Кисляков Д.А. сделал выводы о том, что CIS является серьезной малозаметной проблемой в НИРМП, а основные проблемы в диагностике CIS – малое внимание со стороны оперирующих урологов, которые далеко не всегда используют технологии улучшенной визуализации, не всегда выполняют биопсию или ТУР-биопсию мочевого пузыря у пациентов высокого риска, а также патоморфологическую составляющую – согласие морфологов в диагностике CIS не превышает 70%.









Комментарии