Scott Eggenera,*, Georg Salomonb, Peter T. Scardinoc, Jean De la Rosetted, Thomas J. Polascike, Simon Brewsterf
a Отделение урологии, Медицинский центр Чикагского университета, Чикаго, Иллинойс, США
b Клиника Мартини, Центр рака простаты, Госпиталь Гамбургского университета, Гамбург, Германия
c Отделение хирургии, Мемориальный раковый центр Слоуна Кеттеринга, Нью-Йорк, США
d Отделение урологии, Университет Амстердама, Амстердам, Голландия
e Подразделение урологии, Дурхэм, Северная Каролина, США
f Отделение урологии, госпиталь Черчилля, Оксфорд, Великобритания
Абстракт
Контекст: у значительной части пациентов с раком простаты при постановке диагноза рак представляет собой хорошо дифференцированную опухоль небольшого объема, с минимальным риском нарушения качества жизни или ее продолжительности. Выбор стратегии лечения среди множества методов имеет огромные последствия для отдельных пациентов и для системы здравоохранения в целом.
Цель: рассмотреть подоплеку, критерии отбора пациентов, диагностическую визуализацию, схемы биопсии и методы, доступные для фокальной терапии локализованного рака простаты. Мы уделили особое внимание стратегическим возможностям и ограничениям.
Получение данных: был проведен поиск в базе данных Национального центра биотехнологической информации PubMed (www.pubmed.gov) за период с 1995 по 2009 год с использованием медицинских терминов «фокальная терапия», «аблативный» и «рак простаты». На основании рекомендаций экспертной панели авторов были взяты дополнительные статьи.
Синтез данных: фокальная терапия простаты у пациентов с характеристиками рака низкого риска является развивающимся подходом к лечению, цель которого – элиминировать все известные фокусы рака с минимизацией повреждения окружающих структур, необходимых для сохранения функции мочеиспускания, кишечника и сексуальной функции. Концептуально фокальная терапия имеет потенциал минимизировать токсичность, связанную с лечением, без снижения канцер-специфических результатов. Ограничения включают невозможность точного стадирования или определения злокачественности рака, субоптимальные возможности визуализации, неопределенность в естественном течении не леченого фокуса рака, проблемы с мониторированием после лечения и отсутствие данных по качеству жизни, которые можно было бы сравнить с альтернативными подходами к лечению. Ранний клинический опыт с умеренным периодом наблюдения и оценкой различных методов интригует, однако существуют препятствия, связанные с ограничениями дизайна исследований и небольшим числом пациентов.
Выводы: Фокальная терапия рака простаты – это перспективная и развивающаяся стратегия лечения мужчин с низким риском прогрессии рака или развития метастазов. До того момента, как эта новая стратегия будет принята в клинической практике, необходимо провести оценку в официальных проспективных клинических исследованиях. Адекватные исследования должны включать соответствующие конечные точки, или отсутствие рака на биопсии, или снижение прогрессии рака, параллельно с оценкой безопасности и изменений качества жизни
1. Введение
С момента введения скрининга рака простаты, основанного на определении уровня простат-специфического антигена (ПСА), практические модели в США предлагают лучшее естественное исследование по влиянию широко распространенного скрининга. Встречаемость рака простаты возросла на 26%, пропорция пациентов с наличием отдаленных метастазов на момент постановки диагноза снизилась на 75%, а смертность упала на 30% [1]. Одновременно с этими интригующими тенденциями имеется значительное число мужчин, которым ставят диагноз, но которые не получат клинической пользы от лечения, потому что они и не узнали бы до конца жизни о наличии у них рака. Выявляемое при аутопсии число инцидентальных раков простаты (частота у мужчин в 30-40, 40-50, 50-60 и 60-70 лет 29%, 32%, 55% и 64%, соответственно [2]) значительно превышает число клинически проявляющихся раков. Также установлено, что показатели «гипердиагностики», связанной с ежегодным скринингом, составляют до 50% [3], что позволяет предположить, что для сохранения жизни одного пациента необходимо пролечить от 48 до 100 больных [4,5].
Хирургия и лучевая терапия дают прекрасные долгосрочные онкологические результаты [6]. Среди 11 000 пациентов, которым выполнили радикальную простатэктомию в 4 медицинских центрах за период с 1987 по 2005 год, 15-летняя канцер-специфическая смертность составили 4–7% [7]. У таких же пациентов, которым проводили лучевую терапию, 10-летняя канцер-специфическая смертность составила 3–6% [8,9]. Тем не менее, у значительно меньшей части пациентов оба вида лечения могут вызвать длительные нарушения мочеиспускания, сексуальной функции и функции кишечника. В современных сериях по радикальной простатэктомии показано, что средний объем опухоли составлял ~1 см3 [10–12], а риск смерти от причин, связанных с раком, у пациентов с хорошо дифференцированной опухолью, ограниченной пределами органа, практически равен нулю [7,13,14]. Например, среди 3756 пациентов с раком простаты, ограниченным пределами органа, суммой баллов по Глисону 6 и менее, которым выполнили радикальную простатэктомию, только один пациент умер от причин, связанных с раком простаты [7].
Тактика активного наблюдения – это стратегия, разработанная для минимизации показателей перелечивания и индивидуализации необходимости во вмешательстве. Пациентов с хорошо дифференцированным раком простаты можно безопасно наблюдать, а долгосрочные результаты подтверждают применимость такого подхода у отобранных пациентов. Показатели 10-летней канцер-специфической выживаемости варьируют от 92 до 100% [5,15–17]. Отсроченное вмешательство, если рассматривается его необходимость, индивидуализирует необходимость в лечении, а результаты активного наблюдения сравнимы с таковыми при лечении сразу же после постановки диагноза [18,19]. Тем не менее, наблюдательная стратегия может привести к значительной нервозности пациентов [20,21], и врачи особенно не решаются рекомендовать этот подход молодым здоровым мужчинам с большой ожидаемой продолжительностью жизни. Концептуально приемлемым вариантом для пациентов, которым не подходит наблюдательная стратегия, но которые очень обеспокоены рисками, связанными с терапией всей железы, является объединение элементов тактики активного наблюдения и терапии всей железы. Этот гибридный подход, называемый фокальной терапией, имеет цель элиминировать известные фокусы рака, которые имеют наибольшую вероятность прогрессии или метастазирования, и, в то же время, снизить коллатеральное повреждение важных структур, необходимых для поддержания нормальной функции мочеиспускания и сексуальной функции. В идеале аблация всех известных фокусов будет благоприятно влиять на естественное течение рака без нарушения домена качества жизни, связанного со здоровьем, и позволит при необходимости проводить безопасное повторное лечение с применением фокальной терапии или методов лечения всей железы. Нашей целью было рассмотреть подоплеку, критерии отбора пациентов, диагностическую визуализацию, схемы биопсии и методы, доступные для фокальной терапии локализованного рака простаты. Мы уделили особое внимание концептуальным возможностям и ограничениям.
2. Получение данных
Был произведен поиск в Национальном центре биотехнологической информации PubMed (www.pubmed.gov) за период с 1995 по 2009 год с использованием терминов «фокальная терапия», «аблативный» и «рак простаты». На основании рекомендаций экспертной панели авторов были взяты дополнительные статьи.
3. Синтез данных
3.1. Подоплека для фокальной терапии
Многие данные позволяют предположить, что за общий объем опухоли, риск развития рецидива рака и сумму баллов по Глисону преимущественно ответственен индексный фокус, определяемый как наиболее крупный очаг рака. Среди примерно 5000 оцениваемых препаратов после радикальной простатэктомии объем индексного рака позволяет прогнозировать рецидив, также как и общий объем опухоли [22], и наличие вторичного опухолевого фокуса у пациентов низкого риска не влияет неблагоприятно на показатели рецидивов [23]. Используя карты всего объема опухоли, полученные после 100 радикальных простатэктомий, только 3% индексных раков содержали основной паттерн по Глисону ниже, чем общий основной паттерн [24]. Эти подробные серии поддерживают концепцию определения индексного рака как первичной и часто единственной определяющей прогноза.
3.2. Специфика фокальной терапии
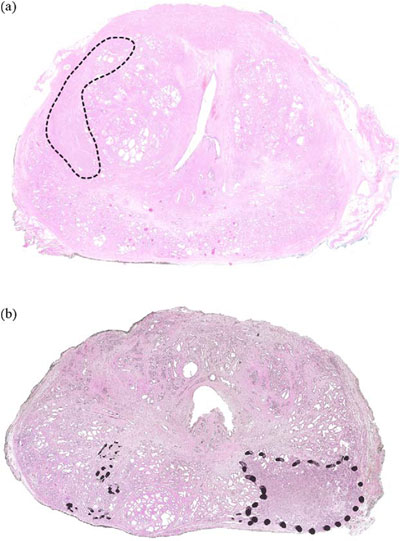
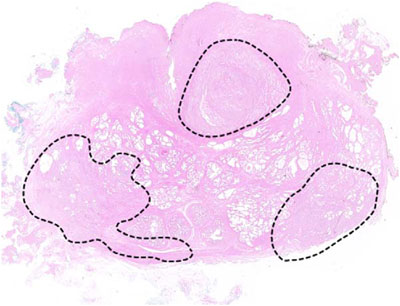
Фокальная терапия относится к любой форме субтотальной аблации простаты. Таргетные регионы могут включать рак, подтвержденный на биопсии, с соответствующими радиографическими образованиями, сектантную аблацию, гемиаблацию или аблацию трех четвертей (одну половину и часть контралатеральной). Идеальными считаются пациенты с унифокальными опухолями (рис. 1a), унилатеральным или индексным раком, сочетающимся с неиндексными образованиями с характеристиками очень низкого риска (рис. 1b). Пациенты с мультифокальными билатеральными опухолями большого размера в настоящее время не подходят для фокальной терапии (рис. 2). Было предложено много методов, которые позволяют вызвать необратимое цитотоксическое повреждение: криотерапия, высокоинтенсивный сфокусированный ультразвук (HIFU), фотодинамическая терапия и лазерная интерстициальная термотерапия.
3.2.1. Возможности
Основу потенциальных преимуществ фокальной терапии перед другими стратегиями ведения пациентов формируют три основных принципа (таблица 1). Во-первых, имеется потенциал того, что профиль побочных эффектов будет намного более привлекательным. Стратегически ограничивая степень повреждения ключевых анатомических структур, приводящую к травматичности, связанной с лечением, можно получить более низкую встречаемость или тяжесть нежелательных результатов, но желательно и то, и другое. Несмотря на это стратегически рациональное требование, тревожно мало сообщений по фокальной терапии содержали систематический отчет по результатам влияния на качество жизни или нежелательным явлениям, определенным валидированными методами [25–33].
Во-вторых, важным аспектом парадигмы ведения является сохранение возможности провести повторное лечение простаты с применением фокальной терапии или терапии всей железы, если это оправдано. Для пациентов, находящихся на наблюдении, результаты после отсроченной радикальной простатэктомии кажутся схожими с таковыми при немедленном лечении [18,19,34]. Несмотря на эти интригующие данные, применимость, безопасность и эффективность повторного лечения после фокальной терапии неизвестна.
В-третьих, пациенты, подходящие для фокальной терапии, также, вероятно, являются кандидатами и для подходов, основанных на наблюдении, которые имеют прекрасные онкологические результаты, и в современных сериях со среднесрочным [17,18,35,36] и в более старых сериях с долгосрочным наблюдением [5,16]. Чтобы фокальная терапия сосуществовала или заменила наблюдательные стратегии, необходимо установить в исследованиях показатели онкологической эффективности, вторичного лечения и нежелательных результатов.
3.2.2. Ограничения
Параллельно со значительными надеждами на фокальную терапию имеется много неопределенностей (таблица 1). Главная озабоченность – это возможность неадекватного контроля над раком, что приведет к более низким результатам, чем после лечения всей железы. При несоответствующем отборе пациентов, неточности картирования мультифокального рака, субоптимальной аблации рака, плохой комплаентности пациента или скомпрометированной безопасности или эффективности спасительной терапии, существует потенциал для потери возможности провести радикальное лечение.
Основное препятствие – это субоптимальный отбор пациентов, так как у значительно меньшей части больных клинически определяется стадия или степень злокачественности ниже, чем есть на самом деле, даже в рамках современных протоколов биопсии [37,38]. Даже среди пациентов с самым низким риском, включая тех с одним микрофокусом хорошо дифференцированного рака [39,40], частота экстракапсулярного прорастания или более высокая степень злокачественности рака на момент выполнения повторной биопсии или простатэктомии составляют 20-30% [39–41].
Во-вторых, невозможность достоверно визуализировать рак простаты ограничивает энтузиазм по поводу фокальной терапии. Значимые усовершенствования в определении локализации опухоли, фокальности, степени распространения и дифференцировании могут значительно улучшить отбор пациентов, которым фокальная терапия принесет пользу.
Рис. 1 – Весь препарат после простатэктомии при низком увеличении. (a) Унифокальный рак, ограниченный пределами органа, с суммой баллов по Глисону 6; (b) мультифокальный рак с суммой баллов по Глисону 6 с индексным раком и множеством небольших (<0,5 см3), фокусов, ограниченных пределами органа.
Рис. 2 – Весь препарат после простатэктомии при низком увеличении, на котором показан мультифокальный рак простаты – данный пациент не рассматривался для фокальной терапии.Таблица 1 – Теоретические возможности и ограничения фокальной терапии рака простаты
| Возможности | Ограничения |
Аблация фокусов рака с показателями прогрессии или метастазирования рака не выше, чем при оперативном лечении или лучевой терапии |
Неадекватная аблация рака |
Минимизация риска тяжелой травматичности, связанной с лечением |
Неполное получение характеристик опухоли из-за субоптимального клинического стадирования, картирования и визуализации |
Возможность повторного воздействия на простату фокальными методами или терапией всей железы |
Неизвестное влияние не леченых неиндексных фокусов рака |
Мониторирование онкологического статуса после лечения без валидированных определений клинического провала |
|
Дискутируемая стоимость/эффективность |
В-третьих, неизвестно влияние не леченых неиндексных фокусов [22–24,42]. Поэтому, даже если можно точно определить и лечить индексный рак, может не быть необходимости в элиминировании фокуса рака с наибольшей вероятностью метастазирования, и долгосрочное влияние не леченых неиндексных фокусов в большой степени спекулятивное. Gburek et al выявили 12 пациентов с опухолевым поражением лимфоузлов при простатэктомии, когда хромосомные аномалии в метастазах соответствовали индексному фокусу рака только у 5 из них (42%) [43]. Особое беспокойство вызывает то, что хромосомные изменения в метастазах могут быть идентичных таковым в неиндексных раках в простате [44]. Хотя маловероятно, что пациенты из этих 2 исследований могли быть кандидатами на фокальную терапию, так как у них уже имелось опухолевое поражение лимфоузлов, это отражает тот факт, что неиндексные фокусы могут иметь склонность к метастазированию даже при характеристиках рака низкого риска.
В-четвертых, существуют большие проблемы в определении того, как мониторировать пациентов после фокальной терапии. Анализ уровня ПСА, хотя и недорогой, удобный и логичный, тяжело интерпретировать в условиях частично леченой простаты, в которой, вероятно, имеются не леченые неиндексные фокусы рака и значительное число нормальной или гиперплазированной ткани железы. Кроме того, у пациентов без данных за рак простаты, уровень ПСА имеет значительные годовые или физиологические колебания [45]. Даже у пациентов с не леченым локализованным раком простаты, которые выбирают тактику активного наблюдения, ни исходный уровень ПСА, ни его кинетику нельзя достоверно использовать для прогнозирования канцер-специфических явлений [46]. Биомаркеры и изображение, вероятно, являются субоптимальными по сравнению с биопсией простаты, и по этой причине кажется оправданным ее рутинное выполнение для наблюдения после фокальной терапии. Тем не менее, даже при серийных биопсиях могут быть не определены большие по размеры фокусы и раки с высокой степенью злокачественности [41,47]. Определение провала и показания для повторного лечения не установлены, хотя наблюдательские исследования 2 фазы с различными определениями провала позволяют предположить, что пациенты имеют очень низкий риск развития метастазов [17,18,48]. Для минимизации риска безуспешного лечения необходимо использовать интенсивную долечебную схему биопсии, хотя еще необходимо будет установить ее конкретный протокол. Как минимум, послелечебное мониторирование должно состоять из (1) ранней и обширной биопсии для установления факта элиминирования рака, (2) рутинных биопсий для определения прогрессии рака или диагностики новых фокусов и (3) ранней и периодической визуализации простаты для получения характеристик лечебных эффектов и связи с исходами.
Наконец, необходимо учитывать финансовое влияние и последствия различных стратегий ведения. Было бы идеальным параллельное сравнение с тактикой активного наблюдения, оперативным лечением или лучевой терапией. Цена лечения будет сильно варьировать в зависимости от страны, системы здравоохранения, метода аблации, наблюдения пациентов и частоте и типе вторичного вмешательства.
3.3. Визуализация рака простаты
В идеале, перед лечением должны быть визуализированы все фокусы рака простаты, также как и степень распространения опухоли, и гистологическая степень злокачественности. Если это достижимо, то можно надлежаще отобрать пациентов для фокальной терапии, провести нацеливание на значимые фокусы, и подобрать четкий протокол наблюдения после лечения.
3.3.1. Магнитно-резонансная томография
Мультимодальная магнитно-резонансная томография (МРТ) позволяет оценить анатомические и метаболические характеристики простаты, и она кажется наиболее перспективным методом ее визуализации. Обычно ее выполняют с эндоректальной тазовой катушкой, анализ проводится в режиме Т2 усиления, динамического контрастирования, диффузионном режиме и МР-спектроскопии. Несмотря на многие технологические разработки, включая диагностическое программное обеспечение с компьютерным ассистированием [49], точность стадирования на МРТ остается субоптимальной (чувствительность 13–95% для экстрапростатического прорастания и 23-80% для инвазии в семенные пузырьки).
Noguiera et al оценивали конкретную роль традиционной МРТ с режиме Т2 усиления у пациентов, которые удовлетворяют критериям тактики активного наблюдения или фокальной терапии [39]. Каждый квадрант простаты оценивали по 5-балльной шкале на основании данных МРТ по наличию рака и дополнительной 5-балльной шкале относительно подозрения на наличие экстракапсулярного прорастания. При обследовании 202 пациентов у 101 (50%) патологически определили тихий рак. В зависимости от квадранта простаты чувствительность МРТ варьировала от 2% до 20%, а специфичность – от 91 до 95%. Оценка экстракапсулярного прорастания и распространения опухоли по данным МРТ (минимальное, среднее или интенсивное) добавила ценности прогнозированию агрессивных раков по сравнению со стандартными параметрами (область под кривой 0,62 и 0,53 по сравнению 0,49), хотя улучшение было умеренным. Данные этого исследования позволяют предположить, что стандартная МРТ в режиме Т2 усиления не является достоверным метод для выявления фокусов рака у пациентов низкого риска, но она может быть полезна для исключения пациентов из протокола фокальной терапии, если на изображении имеются подозрения на большой объем или экстрапростатическое прорастание. Интригующие данные из небольших серий по диффузионной МРТ и МРТ с динамическим контрастированием поддерживают продолжающуюся оценку данных методов. У 49 пациентов, которым выполняли простатэктомию после МРТ с эндоректальной катушкой на аппарате 1,5 Т, а простату разделяли на 6 зон, каждую из которых оценивали по шкале от 0 до 4 баллов («определенно нет рака» и «определенно рак», соответственно), и используемые характеристики для определения опухолей размером >4 мм с суммой баллов по Глисону ≥6 были лучше у диффузионной МРТ (чувствительность 81%, специфичность – 84%), чем у МРТ в режиме Т2 усиления (54% и 91%) [50]. Villers et al для установления шкалы для каждого квадранта простаты у 24 пациентов использовали контрастное усиление, морфологические характеристики и конкордантность между режимом Т1 и Т2 МРТ с динамическим контрастированием. Для опухолей размером >0,5 см3 чувствительность составила 90%, а специфичность 88% [51]. Наконец, у 52 пациентов, которым перед простатэктомией с полноценным патологическим исследованием выполняли МРТ с динамическим контрастированием на аппарате 3Т, максимальный индекс усиления составлял 56% в зоне рака по сравнению с нормальной тканью периферической зоны, а комбинация количественных данных динамического контрастирования имела чувствительность 89%, а специфичность – 90% [52].
3.3.2. Ультразвук
Традиционный серошкальный ультразвук в течение двух десятилетий был основой визуализации простаты и контроля биопсии. Предложенными стратегиями для улучшения характеристик путем одновременной оценки кровотока являются режимы цветного и усиленного Допплера. Дополнительно, трансректальный ультразвук с контрастным усилением основан на внутривенном введении малых инкапсулированных пузырьков газа для визуализации характера сосудистой перфузии. Трехмерное УЗИ с контрастным усилением в режиме усиленного Допплера позволяет выявить 68–79% всех опухолей размером более 5 мм [53]. Использование биопсии под контролем УЗИ с контрастным усилением позволяет получить схожие показатели выявления рака с рандомной биопсией при приблизительно половине точек забора биоптатов [54]. Сочетание таргетной и рандомной биопсии у 380 пациентов с уровнем ПСА от 4 до 10 нг/мл позволило получить частоту выявления рака 37% по сравнению с 27% при использовании какого-либо одного из этих методов [55]. Оно также может позволить определять преимущественно раки с более высокой суммой баллов по Глисону [56]. Halpern et al обследовали 60 пациентов, которым проводили сектантную биопсию, и оценивали УЗИ изображения до и после введения контраста. По сравнению с традиционным серошкальным изображением, введение контраста повышает чувствительность с 38% до 65% без значительного снижения специфичности (83–80%) [57]. Эластография – это дополнительная стратегия, предлагаемая для увеличения возможностей ультразвукового исследования путем сравнения относительных показателей изменения сигнала после компрессии/декомпрессии простаты. У230 мужчин с повышенным уровнем ПСА сравнивали биопсию из 5 точек под контролем эластографии с систематической биопсией из 10 точек [58]. Показатели определения рака были одинаковыми у двух методов, однако биопсия под контролем эластографии была более благоприятной, так как требовалось менее половины точек. У 109 мужчин, которым выполняли эластографию, а после радикальной простатэктомии проводили полноценное патологическое исследование, чувствительность и специфичность для корреляции, специфичной относительно локализации, составила 75% и 77%, соответственно [59]. Хотя эластографию используют редко, ранние данные позволяют предположить, что она может улучшить стадирование по сравнению с традиционным ультразвуковым исследованием.
Компьютерное ультразвуковое исследование простаты (HistoScanning; Advanced Medical Diagnostics, Ватерлоо, Бельгия) – это метод, который опирается на морфологические изменения посредством анализа обратного рассеяния ультразвуковых данных. В пилотном исследовании 13 пациентов, которым выполняли радикальную простатэктомию, было 12 фокусов рака размером >0,5 см3, и все они были правильно определены с помощью компьютерного УЗИ [60]. Тем не менее, в этом исследовании не была включена оценка всех пациентов, которым выполняли исследование, отсутствовала подробная информация о пациентах и оно дает только предварительные данные, поддерживающие дальнейшее изучение метода.
3.4. Стратегии биопсии
Биопсия простаты трансформировалась от стандартной сектантной [61] до более часто применяемой биопсии из 12 точек. Тем не менее, не кажется, что стандартный амбулаторный подход позволяет адекватно отбирать пациентов для фокальной терапии [37,38]. Более обширный подход, с забором более 12 биоптатов, дает больше информации относительно объема опухоли, ее локализации, фокальности, стадии и степени злокачественности [47,62–64]. Среди 180 пациентов с унилатеральными опухолями обширная трансперинеальная биопсия с картированием (среднее число точек: 50) позволила выявить 110 (61%) пациентов, у которых был диагностирован билатеральный рак, а 41 (23%) пациенту поставили более высокую сумму баллов по Глисону [63]. Менее обширные повторные трансректальные биопсии (среднее число точек: 20) у пациентов с раком низкого риска показали, что у 38% была более высокая сумма баллов по Глисону или больший объем опухоли [47]. Травматичность обширной трансперинеальной шаблонной биопсии кажется приемлемой – в 7% случаев требуется продолжительная катетеризация - и отсутствуют значимые нарушения в доменах качеству жизни по мочеиспускательной, сексуальной функции и функции кишечника [65]. Оптимальную стратегию биопсии для выявления и определения локализации фокуса рака еще необходимо будет установить, но кажется, что оптимальным способом является расширенная стратегия, превышающая 12 точек, с применением шаблона и вниманием к предпочтительному анатомическому картированию.
3.5. Отбор пациентов
Критерии включения в исследования по фокальной терапии широко варьируют [25,26,28–33,66,67]. Недавно созванная рабочая группа на 2-м Международном семинаре по фокальной терапии и изображению рака простаты разработала положения консенсуса по отбору пациентов [27]. Областями согласия был отбор пациентов после трансперинеальной биопсии с картированием, включение пациентов с характеристиками рака простаты низкого риска (например, с суммой баллов по Глисону 6, клинической стадией <T2a), установленной продолжительностью жизни >10 лет; то, что изображение, очень вероятно, будет играть в будущем важную роль, а долгосрочное влияние на функцию мочеиспускания и сексуальную функцию неизвестно.
3.6. Методы фокальной терапии
3.6.1. Высокоинтенсивный сфокусированный ультразвук
HIFU опирается на фокусированную конгломерацию ультразвуковых волн в конкретной точке простаты, что приводит к повышению температуры (60–100°С), денатурации белков и коагуляционному некрозу [33]. На УЗИ определяется отчетливая граница между леченой и не леченой зонами. В настоящее время доступны две системы: Ablatherm (Maple Leaf HIFU, Ancaster, Онтарио, Канада) и Sonablate (Focus Surgery, Индианаполис, Индиана, США), которые немного отличаются в фокусной длине, объеме аблации и положении пациента во время вмешательства. В крупномасштабные исследования, в которых проводили прицеливание на всю простату, проводимых, в основном, в Европе и Азии, было включено до 400 пациентов, и в них были показаны различные показатели инфекции мочевыводящих путей (2–24%), уретральных стриктур (4–30%), недержания мочи (2–14%), эректильной дисфункции (20–60%) и ректоуретральных свищей (1–6%) [25,33,66]. Почти все сообщения были посвящены терапии всей железы, и в них было ограничение размера простаты <40 см3. Особенно тяжело интерпретировать и сравнивать по различным сериям или напрямую с другими видами лечения онкологические результаты, так как нет стандартизированного определения эффективности или рецидива. Различной части пациентов после терапии всей железы выполняли биопсию, и в этих случаях у 13–80% определяли рак [25,33]. О результатах, основанных на уровне ПСА, сообщалось с различными определениями неэффективности (например, надир ПСА плюс 2 нг/мл, три последовательных подъема ПСА после надира >0,5 нг/мл), поэтому в настоящее время не существует корреляции между уровнем ПСА после HIFU терапии и более значимыми конечными точками, такими как необходимость во вторичном лечении, развитие метастазов или канцер-специфическая смертность.
Muto et al исследовали фокальную HIFU терапию с использованием аппарата Sonablate на 29 пациентах в возрасте >60 лет (в среднем, 72 года) с раком стадии T1c–T2a и любой суммой баллов по Глисону, ограниченным одной стороной простаты [31]. Зона лечения включала билатеральные периферические зоны и ипсилатеральную переходную зону; 7 пациентов (24%) получали неоадъювантную андрогенную депривацию. Биопсию выполняли через 6 и 12 месяцев после лечения; резидуальный рак обнаружили в 11% и 24%, соответственно. Не было приведено никаких данных по локализации резидуального рака, по методу его лечения и окончательным результатам. Функция мочеиспускания в основном не нарушалась, в 4% случаев развилась стриктура уретры, и, также, в 4% - инфекция мочевыводящих путей. Не было представлено никаких данных по эректильной функции. HIFU как метод фокальной терапии также оценивают в продолжающихся регистрируемых исследованиях (www. clinicaltrials.gov; идентификатор: NCT00770822, NCT00561314).
3.6.2. Криотерапия
Гибель клеток простаты после криотерапии, проводимой с помощью трансперинеальных зондов, возникает из-за разрыва клеточной мембраны и микрососудистого тромбоза, с эффективностью, зависящей от надира температуры, продолжительности воздействия, числа циклов замораживания/оттаивания и скорости оттаивания [68]. Изначально метод имел высокие показатели больших осложнений, однако с появлением криозондов 3 поколения, мониторирования в режиме реального времени и УЗИ контроля результаты улучшились. Криотерапию применяли в течение десятилетий в качестве терапии всей железы как первичную или спасительную терапию, однако в последних сериях исследовали потенциальную роль криоаблации как метода фокальной терапии, или в виде гемиаблации или более таргетной фокальной аблации. Серии по фокальной терапии включали до 100 пациентов с периодом наблюдения от 2 до 6 лет [26,29,32,67]. Частота недержания мочи после лечения низкая (0–2%), а эректильная функция сохраняется в 71%-90% случаев [26,29,32,67]. Дизайн исследований отличался, включали пациентов со значительным риском развития рецидива, пациентов, получавших неоадъювантную комбинированную гормональную аблацию, и пациентов с плохой комплаентностью относительно выполнения биопсии после лечения. Клинические опыт постоянно растет, продолжаются зарегистрированные клинические исследования
3.6.3. Лазерная интерстициальная термотерапия
Лазерная интерстициальная термотерапия – это фототермальный метод аблации. Lindner et al оценивали фототермальную терапию под контролем изображения у 12 пациентов с уровнем ПСА < 10 нг/мл, клинической стадией T1c–T2a, суммой баллов по Глисону ≤6, <30% положительных биоптатов и протяженностью рака в биоптатах <50% [30]. Положительные биопсии были ограничены одним сектором простаты и соответствовали видимым изменениям на МРТ. Изображения МРТ совмещали с трехмерными ультразвуковыми изображениями. Пациентам осуществляли трансперинеальное расположение лазеров под УЗИ контролем для аблации всех фокусов рака. Для мониторирования лечебного эффекта в режиме реального времени также использовали внутривенные микропузырьки (Definity; Bristol-Myers Squibb
Medical Imaging, Биллерика, Массачусетс, США). Осложнения были легкой степени и купировались самостоятельно. Функция мочеиспускания и сексуальная функция не нарушались, что определяли по Международному индексу эректильной функции (IIEF-5) и по Международной шкале оценки простатических симптомов (IPSS). Через 7 дней после лечения на МРТ определяли образования с пониженным кровоснабжением со средним объемом 2,2 см3. Среди 12 пациентов, которым выполняли биопсию после лечения (3–6 месяцев), включая две таргетные биопсии зоны аблации, у 6 (50%) не было данных за опухоль, у 2 (17%) диагностировали новый фокус рака на контралатеральной стороне, а у 4 (33%) были положительные биопсии из зоны аблации. У одного пациента, которому выполнили радикальную простатэктомию, было выявлено ранее не диагностированное экстрапростатическое прорастание.
3.7. Рекомендации по дизайну исследований
Фокальная терапия, и концептуально, и практически, находится на пороге своего развития. Без доступных достоверных долгосрочных результатов фокальную терапию следует рассматривать как исследовательскую, и изучать ее в соответствии с протоколами, одобренными институциональными советами по рассмотрению с соответствующим информированным согласием пациентов. Для получения данных, необходимых для обоснованной оценки, все программы по фокальной терапии должны установить систематическое обследование до и после лечения, а также иметь хорошо определенные конечные точки и строгие критерии включения. Результаты должны включать качество жизни, измеренное валидированными опросниками, также как и осложнения, связанные с вмешательством, с регулярным обзором совета по мониторингу данных и безопасности. Для оценки концепции и технологии в исследованиях 1 фазы будет установлена безопасность метода, исследования 2 фазы дадут первоначальные данные по эффективности, а исследования 3 фазы позволят окончательно установить значимую безопасность и эффективность. Особой проблемой при разработке исследований является оценка клинической пользы. Кажутся обоснованными два различных подхода. Первый – подтвердить, что фокальная аблация снижает возможность прогрессии до клинически значимого рака с течением времени (биопсия – аблация – отсутствие прогрессии). Основным препятствием является достижение соглашения по определению значимого рака и ограничения в его выявлении. В альтернативной модели будет проводиться тщательное определение характеристик и локализации всех раков, их аблация и повторная биопсия после лечения для подтверждения отсутствия рака (биопсия – аблация – биопсия). Современные возможности для оценки онкологических результатов ограничены, потому что практически все исследования имеют средний период наблюдения <5 лет [26,28,30–32].
4. Заключение
Фокальная терапия локализованного рака простаты низкого риска зависит от элиминирования известных фокусов рака, которые, как кажется, имеют наибольший потенциал к прогрессии, и в то же время с сохранением здоровых тканей для минимизации токсичности, связанной с лечением. С появлением интенсивных схем картирования простаты и продолжающимся развитием методов визуализации ожидается, что появится больше пациентов, у которых можно будет картировать и, предпочтительней, визуализировать рак. Значительным препятствием остается оптимизация отбора пациентов, прицельное воздействие на индексный фокус и установление эффективности. Ранний клинический опыт с умеренным периодом наблюдения и оценкой различных методов лечения, интригует, однако препятствием являются ограничения дизайна исследований и небольшое число пациентов. Необходимо поощрять дальнейшую оценку в официальных проспективных клинических исследованиях, которые будут иметь четкие критерии включения, полную документацию техники лечения и побочных эффектов, параллельную оценку качества жизни и хорошо определенные конечные точки. До того, как можно будет принять фокальную терапию в клинической практике, необходимо будет убедить медицинское сообщество в безопасности и эффективности аблативных технологий для элиминирования таргетного фокуса рака, снижения частоты прогрессии до клинически значимого рака по сравнению с другими подходами, такими как тактика активного наблюдения, и наличии возможности безопасного повторного лечения при наличии показаний с применением фокальной аблации или радикальной терапии.
Список литературы
[1] Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin 2009;59:225–49.
[2] Sakr WA, Grignon DJ, Crissman JD, et al. High-grade prostatic intraepithelial neoplasia (HGPIN) and prostatic adenocarcinoma between the ages of 20-69: an autopsy study of 249 cases. In Vivo 1994;8:439–43.
[3] Draisma G, Boer R, Otto SJ, et al. Lead times and overdetection due to prostate-specific antigen screening: estimates from the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst 2003;95:868–78.
[4] Schroder FH, Hugosson J, Roobol MJ, et al. Screening and prostatecancer mortality in a randomized European study. N Engl J Med 2009;360:1320–8.
[5] Bill-Axelson A, Holmberg L, Filen F, et al. Radical prostatectomy versus watchful waiting in localized prostate cancer: the Scandinavian prostate cancer group-4 randomized trial. J Natl Cancer Inst 2008;100:1144–54.
[6] Heidenreich A, Aus G, Bolla M, et al. EAU guidelines on prostate cancer. Eur Urol 2008;53:68–80.
[7] Stephenson A, Klein E, Kattan M, Han M, Partin A. Predicting the long-term risk of prostate cancer-specific mortality after radical prostatectomy. J Clin Oncol 2009;27:15s. Abstract 5007.
[8] Tewari A, Johnson CC, Divine G, et al. Long-term survival probability in men with clinically localized prostate cancer: a case-control, propensity modeling study stratified by race, age, treatment and comorbidities. J Urol 2004;171:1513–9.
[9] Bittner N, Merrick GS, Galbreath RW, et al. Primary causes of death after permanent prostate brachytherapy. Int J Radiat Oncol Biol Phys 2008;72:433–40.
[10] Iczkowski KA, Hossain D, Torkko KC, et al. Preoperative prediction of unifocal, unilateral, margin-negative, and small volume prostate cancer. Urology 2008;71:1166–71.
[11] Kassouf W, Nakanishi H, Ochiai A, Babaian KN, Troncoso P, Babaian RJ. Effect of prostate volume on tumor grade in patients undergoing radical prostatectomy in the era of extended prostatic biopsies. J Urol 2007;178:111–4.
[12] Kikuchi E, Scardino PT, Wheeler TM, Slawin KM, Ohori M. Is tumor volume an independent prognostic factor in clinically localized prostate cancer? J Urol 2004;172:508–11.
[13] Stark JR, Perner S, Stampfer MJ, et al. Gleason score and lethal prostate cancer: does 3 + 4 = 4 + 3? J Clin Oncol 2009;27:3459–64.
[14] Hernandez DJ, Nielsen ME, Han M, et al. Natural history of pathologically organ-confined (pT2),Gleason score 6 or less, prostate cancer after radical prostatectomy. Urology 2008;72:172–6.
[15] Klotz L. Active surveillance for prostate cancer: for whom? J Clin Oncol 2005;23:8165–9.
[16] Lu-Yao GL, Albertsen PC, Moore DF, et al. Outcomes of localized prostate cancer following conservative management. JAMA 2009;302:1202–9.
[17] Dall’Era MA, Cooperberg MR, Chan JM, et al. Active surveillance for early-stage prostate cancer: review of the current literature. Cancer 2008;112:1650–9.
[18] Eggener SE, Mueller A, Berglund RK, et al. A multi-institutional evaluation of active surveillance for low risk prostate cancer. J Urol 2009;181:1635–41; discussion 1641.
[19] Warlick C, Trock BJ, Landis P, Epstein JI, Carter HB. Delayed versus immediate surgical intervention and prostate cancer outcome. J Natl Cancer Inst 2006;98:355–7.
[20] Latini DM, Hart SL, Knight SJ, et al. The relationship between anxiety and time to treatment for patients with prostate cancer on surveillance. J Urol 2007;178:826–31; discussion 831–2.
[21] van den Bergh RC, Essink-Bot ML, Roobol MJ, et al. Anxiety and distress during active surveillance for early prostate cancer. Cancer 2009;115:3868–78.
[22] Wise AM, Stamey TA, McNeal JE, Clayton JL. Morphologic and clinical significance of multifocal prostate cancers in radical prostatectomy specimens. Urology 2002;60:264–9.
[23] Noguchi M, Stamey TA, McNeal JE, Nolley R. Prognostic factors for multifocal prostate cancer in radical prostatectomy specimens: lack of significance of secondary cancers. J Urol 2003;170:459–63.
[24] Arora R, Koch MO, Eble JN, Ulbright TM, Li L, Cheng L. Heterogeneity of Gleason grade in multifocal adenocarcinoma of the prostate. Cancer 2004;100:2362–6.
[25] Challacombe BJ, Murphy DG, Zakri R, Cahill DJ. High-intensity focused ultrasound for localized prostate cancer: initial experience with a 2-year follow-up. BJU Int 2009;104:200–4.
[26] Crawford ED, Barqawi A. Targeted focal therapy: a minimally invasive ablation technique for early prostate cancer. Oncology (Williston Park) 2007;21:27–32; discussion 33–4, 39.
[27] De la Rosette J, Ahmed H, Barentsz J, et al. Focal therapy in prostate cancer—report from a consensus panel. J Endourol. In press.
[28] Eggener SE, Scardino PT, Carroll PR, et al. Focal therapy for localized prostate cancer: a critical appraisal of rationale and modalities. J Urol 2007;178:2260–7.
[29] Lambert EH, Bolte K, Masson P, Katz AE. Focal cryosurgery: encouraging health outcomes for unifocal prostate cancer. Urology 2007;69:1117–20.
[30] Lindner U,WeersinkRA,HaiderMA,et al. Imageguidedphotothermal focal therapy for localized prostate cancer: phase I trial. J Urol 2009;182:1371–7.
[31] Muto S, Yoshii T, Saito K, Kamiyama Y, Ide H, Horie S. Focal therapy with high-intensity-focused ultrasound in the treatment of localized prostate cancer. Jpn J Clin Oncol 2008;38:192–9.
[32] Onik G, Vaughan D, Lotenfoe R, Dineen M, Brady J. The ‘‘male lumpectomy’’: focal therapy for prostate cancer using cryoablation results in 48 patients with at least 2-year follow-up. Urol Oncol 2008;26:500–5.
[33] Tsakiris P, Thuroff S, de la Rosette J, Chaussy C. Transrectal highintensity focused ultrasound devices: a critical appraisal of the available evidence. J Endourol 2008;22:221–9.
[34] Shappley WV III, Kenfield SA, Kasperzyk JL, et al. Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 2009;27:4980–5.
[35] Klotz L. Active surveillance with selective delayed intervention for favorable risk prostate cancer. Urol Oncol 2006;24:46–50.
[36] Carter HB, Kettermann A,Warlick C, et al. Expectantmanagement of prostate cancer with curative intent: an update of the Johns Hopkins experience. J Urol 2007;178:2359–64; discussion 2364–5.
[37] Mayes JM, Mouraviev V, Sun L, Tsivian M, Madden JF, Polascik TJ. Can the conventional sextant prostate biopsy accurately predict unilateral prostate cancer in low-risk, localized, prostate cancer? Urol Oncol. In press. doi:10.1016/j.urolonc.2009.03.011.
[38] Tsivian M, Kimura M, Sun L, Mouraviev V, Mayes JM, Polascik TJ. Predicting unilateral prostate cancer on routine diagnostic biopsy: sextant vs extended. BJU Int. In press.
[39] Nogueira L, Wang L, Fine SW, et al. Focal treatment or observation of prostate cancer: pretreatment accuracy of transrectal ultrasound biopsy and T2-weighted MRI. Urology 2010;75:472–7.
[40] Thong AE, Shikanov S, Katz MH, et al. A single microfocus (5% or less) of Gleason 6 prostate cancer at biopsy—can we predict adverse pathological outcomes? J Urol 2008;180:2436–40.
[41] Berglund RK, Masterson TA, Vora KC, Eggener SE, Eastham JA, Guillonneau BD. Pathological upgrading and up staging with immediate repeat biopsy in patients eligible for active surveillance. J Urol 2008;180:1964–7; discussion 1967–8.
[42] Ohori M, Eastham J, Koh H, Kuroiwa K, Slawin K, Wheeler T. Is focal therapy reasonable in patients with early stage prostate cancer (CaP)—an analysis of radical prostatectomy (RP) specimens. J Urol 2006;175(Suppl):507. Abstract 1574.
[43] Gburek BM, Kollmorgen TA, Qian J, D’Souza-Gburek SM, Lieber MM, Jenkins RB. Chromosomal anomalies in stage D1 prostate adenocarcinoma primary tumors and lymph node metastases detected by fluorescence in situ hybridization. J Urol 1997;157:223–7.
[44] Qian J, Bostwick DG, Takahashi S, et al. Chromosomal anomalies in prostatic intraepithelial neoplasia and carcinoma detected by fluorescence in situ hybridization. Cancer Res 1995;55:5408–14.
[45] Eastham JA, Riedel E, Scardino PT, et al. Variation of serum prostatespecific antigen levels: an evaluation of year-to-year fluctuations. JAMA 2003;289:2695–700.
[46] Fall K, Garmo H, Andren O, et al. Prostate-specific antigen levels as a predictor of lethal prostate cancer. J Natl Cancer Inst 2007;99: 526–32.
[47] Abouassaly R, Lane BR, Jones JS. Staging saturation biopsy in patients with prostate cancer on active surveillance protocol. Urology 2008;71:573–7.
[48] Klotz L, Zhang L, Lam A, Nam R, Mamedov A, Loblaw A. Clinical results of long-term follow-up of a large, active surveillance cohort with localized prostate cancer. J Clin Oncol 2010;28:126–31.
[49] Vos PC, Hambrock T, Hulsbergen-van de Kaa CA, Futterer JJ, Barentsz JO, Huisman HJ. Computerized analysis of prostate lesions in the peripheral zone using dynamic contrast enhanced MRI. Med Phys 2008;35:888–99.
[50] Haider MA, van der Kwast TH, Tanguay J, et al. Combined T2-weighted and diffusion-weighted MRI for localization of prostate cancer. AJR Am J Roentgenol 2007;189:323–8.
[51] VillersA,PuechP,MoutonD,LeroyX,BallereauC, Lemaitre L.Dynamic contrast enhanced, pelvic phased array magnetic resonance imaging of localized prostate cancer for predicting tumor volume: correlation with radical prostatectomy findings. J Urol 2006;176:2432–7.
[52] Zelhof B, Lowry M, Rodrigues G, Kraus S, Turnbull L. Description of magnetic resonance imaging-derived enhancement variables in pathologically confirmed prostate cancer and normal peripheral zone regions. BJU Int 2009;104:621–7.
[53] Wink M, Frauscher F, Cosgrove D, et al. Contrast-enhanced ultrasound and prostate cancer; a multicentre European research coordination project. Eur Urol 2008;54:982–93.
[54] Frauscher F, Klauser A, Volgger H, et al. Comparison of contrast enhanced color Doppler targeted biopsy with conventional systematic biopsy: impact on prostate cancer detection. J Urol 2002;167:1648–52.
[55] Pelzer A, Bektic J, Berger AP, et al. Prostate cancer detection in men with prostate specific antigen 4 to 10 ng/ml using a combined approach of contrast enhanced color Doppler targeted and systematic biopsy. J Urol 2005;173:1926–9.
[56] Mitterberger M, Pinggera GM, Horninger W, et al. Comparison of contrast enhanced color Doppler targeted biopsy to conventional systematic biopsy: impact on Gleason score. J Urol 2007;178: 464–8; discussion 468.
[57] Halpern EJ, Rosenberg M, Gomella LG. Prostate cancer: contrastenhanced us for detection. Radiology 2001;219:219–25.
[58] Pallwein L, Mitterberger M, Struve P, et al. Comparison of sonoelastography guided biopsy with systematic biopsy: impact on prostate cancer detection. Eur Radiol 2007;17:2278–85.
[59] Salomon G, KoЁllerman J, Thederan I, et al. Evaluation of prostate cancer detection with ultrasound real-time elastography: a comparison with step section pathological analysis after radical prostatectomy. Eur Urol 2008;54:1354–62.
[60] Braeckman J, Autier P, Soviany C, et al. The accuracy of transrectal ultrasonography supplemented with computer-aided ultrasonography for detecting small prostate cancers. BJU Int 2008;102: 1560–5.
[61] Hodge KK, McNeal JE, Terris MK, Stamey TA. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol 1989;142:71–4; discussion 74–5.
[62] King CR, McNeal JE, Gill H, Presti JC Jr. Extended prostate biopsy scheme improves reliability of Gleason grading: implications for radiotherapy patients. Int J Radiat Oncol Biol Phys 2004;59:386–91.
[63] Onik G, Miessau M, Bostwick DG. Three-dimensional prostate mapping biopsy has a potentially significant impact on prostate cancer management. J Clin Oncol 2009;27:4321–6.
[64] San Francisco IF, DeWolf WC, Rosen S, Upton M, Olumi AF. Extended prostate needle biopsy improves concordance of Gleason grading between prostate needle biopsy and radical prostatectomy. J Urol 2003;169:136–40.
[65] Merrick GS, Taubenslag W, Andreini H, et al. The morbidity of transperineal template-guided prostate mapping biopsy. BJU Int 2008;101:1524–9.
[66] Ahmed HU, Zacharakis E, Dudderidge T, et al. High-intensityfocused ultrasound in the treatment of primary prostate cancer: the first UK series. Br J Cancer 2009;101:19–26.
[67] Bahn DK, Silverman P, Lee F Sr, Badalament R, Bahn ED, Rewcastle JC. Focal prostate cryoablation: initial results show cancer control and potency preservation. J Endourol 2006;20:688–92.
[68] Babaian RJ, Donnelly B, Bahn D, et al. Best practice statement on cryosurgery for the treatment of localized prostate cancer. J Urol 2008;180:1993–2004.







Комментарии