Gary J. Kelloff1, Peter Choyke2, and Donald S. Coffey3 for The Prostate Cancer Imaging
Working Group
1 Подразделение лечения и диагностики рака, Программа визуализации рака, Национальный институт здоровья, Национальный институт рака, 6130 Executive Blvd., EPN Rm. 6058, Bethesda, MD 20852
2 Программа молекулярного изображения, Национальный институт здоровья, Национальный институт рака, Бетезда, MD
3 Отделение урологии, университет Джона Хопкинса, Балтимор, MDОдной из основных проблем при раке простаты является дифференциация летальной и нелетальной опухоли. Новые технологии и новое применение уже испытанных методов делают изображение эффективным и для оценки, и для лечении рака простаты.
Ключевые слова
Диффузионная МРТ; МРТ с динамическим контрастированием; ФДГ ПЭТ изображение; функциональное изображение; МРТ; изображение рака простаты; SPECT.
Рак простаты является второй по частоте причиной смертности от рака среди американских мужчин, но он не всегда бывает летальным. Рак простаты может протекать как бессимптомно, так и с клиническими проявлениями, при этом быстро прогрессировать в системный процесс. Встречаемость рака простаты так высока, что он может рассматриваться как феномен, связанный с возрастом. Американское общество рака установило, что в 2008 году было диагностировано 186320 новых случаев рака простаты, и приблизительно 28660 мужчин в США умрут от него (1). Недавно показатели смертности от рака простаты снизились, а 5-летние показатели выживаемости показали значительное увеличение (сейчас 99% при учете всех стадий). Это произошло благодаря скринингу, раннему выявлению и изменениям в образе жизни (2). Эта тенденция также отражает некоторый прогресс в лечении рака простаты.
Тем не менее, для ведения и понимания этого заболевания нужно сделать намного больше. С этой целью Национальный институт рака (NCI), Программа визуализации рака (CIP) провели 2-дневный семинар по раку простаты и методам визуализации, охватывающий исследовательские тенденции и пути для улучшения применения изображения в клиническом спектре болезни. Мультидисциплинарная группа из 55 человек (Приложение 1) и их аудитория были собраны для обсуждения следующих вопросов - как анатомические, функциональные и молекулярные изображения могут принести большую точность в описании характеристик рака при изначальной биопсии; как более качественное стадирование или оценка раннего ответа на лечение позволит лучше вести пациентов, повышая эффективность лечения или позволяя избегать его при отсутствии необходимости в нем; как и какой метод изображения можно использовать наилучшим образом, чтобы информировать клинические исследования по раку простаты относительно дизайна и облегчить оценку потенциально новых достижений в лечении. Семинар был организован по 4 клиническим проблемам в ведении рака простаты от ранних до поздних стадий, в которых изображение может внести вклад в стратегию лечения:
- диагностическая точность – снижение ложно-позитивных и ложно-негативных результатов биопсии и повышение репрезентабельности рака при биопсии;
- стратификация риска, первоначальное стадирование, тактика активного наблюдения и фокальная терапия – ведение локализованного рака, отличие рака высокого и низкого риска, точное стадирование и использование изображения для мониторирования прогрессии рака и оценки эффективности фокальной терапии;
- D0 заболевание (рецидив уровня ПСА после лучевой терапии или радикальной простатэктомии) – ведение рецидивного рака с применением изображения для различения локального от отдаленного рецидива и оценка роли изображения в наведении лучевой терапии при локальном рецидиве;
- оценка ответа на лечение при распространенном раке – использование изображения в разработке препаратов для лечения рака простаты и в ведении распространенного рака.
В пленарной сессии участники семинара рассмотрели общее состояние науки по раку простаты и использование методов визуализации при его диагностике и лечении, а затем в подробностях были рассмотрены вышеперечисленные 4 клинические проблемы и возможные пути их решения с помощью методов визуализации.
Наконец, была сформирована «группа прорыва» для обсуждения стратегии по решению 4х проблем и для разработки специфических рекомендаций, особенно для клинических исследований. В этой статье суммированы обсуждения по роли визуализации при всем спектре стадий рака простаты и в дифференцировании летального от нелетального рака. После этого представлено обсуждение 4х клинических проблем по ведению рака и связанные с ними клинические вопросы и роль визуализации.
Роль визуализации при различных стадиях рака простаты
Основной целью визуализации рака простаты является более точное описание характеристик рака путем синтеза анатомической, функциональной и молекулярной информации. Другие важные цели включают оценку ответа на терапию, необходимую для того, чтобы обеспечить раннее прекращение неэффективной терапии, более короткую продолжительность фазы 2 клинических исследований новых препаратов и ускорить одобрение в исследованиях 3 фазы. К настоящему моменту не достигнуто консенсуса относительно использования методов визуализации при оценке первичного рака простаты, хотя признано, что выбор метода визуализации должен зависеть от тех вопросов, на которые нужно ответить в соответствии с клинической ситуацией. Каждый метод имеет преимущества, недостатки и специфические показания (таблица 1).
Современные стандартные методы визуализации, таких как ультразвук, МРТ, КТ и сцинтиграфия, не позволяют выявлять ранние раки и дают ограниченную информацию относительно стадии процесса (3-8).
Тем не менее, развиваются и исследуются несколько многообещающих технологий, как в чистом виде, так и в сочетании со стандартными методами. Трансректальный ультразвук (ТРУЗИ) - стандартный метод визуализации рака простаты - применяется в основном для выполнения биопсии и имплантации зерен для брахитерапии. Однако с его помощью невозможно дифференцировать нормальную ткань железы от рака, что приводит к тому, что при биопсии игла не направляется непосредственно в области, которые наиболее вероятно являются злокачественными. Несколько новых технологий, применяемых в сочетании с ТРУЗИ, включают в себя допплеровское изображение с контрастированием, интермиттирующее гармоническое изображение и контрастная эхография с методом flash-replenishment (9). Особенно привлекательным методом является УЗИ с контрастным усилением, так как он имеет преимущество в дифференцировании микрососудистого русла между фокусом рака и доброкачественной тканью простаты. УЗ-спектроскопия основана на применении радиочастостного эхо-сигнала, который выражается в виде спектральных параметров для того, чтобы охарактеризовать микроархитектонику ткани и отличить злокачественную ткань простаты от доброкачественной (10).
Традиционная МРТ простаты для определения степени распространения рака основывается на морфологических изменениях в простате (11). В настоящее время МРТ простаты выполняют с применением эндоректальной катушки (МРТ-ЭК) в сочетании с 4-мя внешними катушками (тазово-фазная последовательность). МРТ-ЭК обеспечивает более высокое пространственное и контрастное разрешение при визуализации зональной анатомии простаты, чем ТРУЗИ или КТ (12, 13). Показано, что МРТ с Т2 усилением имеет высокую чувствительность в определении локализации рака простаты (97%), хотя этот показатель варьирует в зависимости от исследуемой популяции пациентов (14). Этот метод также не чувствителен при определении рака с локализацией не в периферической зоне простаты (12). Функциональные методы МРТ, такие как МР-спектроскопия, диффузионная МРТ и МРТ с динамическим контрастированием, исследовались для возможного дополнения режима Т2 усиления для того, чтобы улучшить определение локализации рака простаты. Функциональные методы визуализации, ПЭТ и SPECT, позволяют определить патологический процесс с помощью специфических молекулярных датчиков, помеченных радионуклидами. К настоящему моменту, большинство онкологических клинических исследований для ПЭТ применяют 18F-ФДГ. Тем не менее, результаты ФДГ ПЭТ в выявлении рака простаты неоднозначные (15-18). Для улучшения пользы ПЭТ и SPECT в выявлении рака простаты, разрабатываются и валидируются молекулярные датчики с более высокой чувствительностью и специфичностью. В качестве альтернативы ФДГ ПЭТ исследуются новые трейсеры, такие как 11С-ацетат, 11С-холин и 18F-холин (19).
Важные вопросы относительно роли визуализации в стратификации риска, первоначальном стадировании, тактике активного наблюдения и фокальной терапии рака простаты - это выявление рака низкого риска, для которого не требуется агрессивное лечение; соединение образцов ткани с маркерами изображения; определение пациентов, которым изображение лимфоузлов и их стадирование даст преимущество; определение того, влияет ли прогностическая ценность точных методов визуализации на выбор тактики лечения и определение наилучшего способа наблюдения пациентов после терапии.
КТ и МРТ – это основные методы визуализации, которые в настоящее время применяются для стадирования опухолевого поражения лимфоузлов. ПЭТ и ФДГ ПЭТ/КТ, которые успешно применялись для визуальной оценки большого числа опухолевых типов, также оценивались и для стадирования рака простаты, но они широко не применяются, так как рак простаты имеет различное накопление ФДГ и сильные помехи из-за экскреции его в мочевой пузырь (16). МРТ с усилением лимфотропными наночастицами – подающий надежды метод для оценки опухолевого поражения лимфоузлов. Он очень точен в стадировании лимфоузлов у пациентов с различными типами первичных раков (20). Он позволяет оценить функцию нодальных макрофагов и при определении опухолевого поражения не опирается на размер лимфоузла (21,22). Местный рецидив может быть выявлен при пальцевом ректальном исследовании, на сектантной биопсии под ТРУЗИ контролем, с помощью различных методов МРТ (традиционная МРТ в режиме Т1 и Т2 усиления, МРТ с динамическим контрастированием и МР-спектроскопия) и сцинтиграфии (ФДГ ПЭТ и 11С и 18F холин и ацетат ПЭТ/КТ). К настоящему времени, повсеместно доступно только ТРУЗИ, и оно применяется в основном для наведения иглы при биопсии. Также доступны традиционная МРТ и ФДГ ПЭТ, в то время как другие методы по-прежнему являются экспериментальными (МРТ с динамическим контрастированием, ТРУЗИ с контрастированием микропузырьками, МР-спектроскопия и 11С и 18F холин и ацетат ПЭТ/КТ) (23).
Недавним стандартом для остеосцинтиграфии был 99mTc-метилен дифосфонат (99mTc-MDP); тем не менее, ПЭТ с 18F натрия фторид (18F-NaF) получила повышенный интерес в связи с большей чувствительностью и специфичностью. В дополнение к его использованию для выявления рака, этот метод может быть более полезен, как и ФДГ ПЭТ, для измерения изменений, вызванных лечением.
Изображение (визуализация) – это мощный инструмент, т. к. большинство методов визуализации либо неинвазивные, либо малоинвазивные; они не деструктивны, вызывают минимальные расстройства в организме и могут предоставить динамические данные в режиме реального времени, а также повторные измерения и интегративные результаты (системные данные). Тем не менее, для оценки значения этих измерений в отношении специфических клинических исходов крайне необходимы стандартизированные параметры изображений, полученных при различных методах. Прогресс в визуализации рака простаты начинает передаваться в более качественный выбор лечения и более точное наведение терапии, включая хирургию и лучевую терапию. В дополнение, необходимость в раннем определении местного и отдаленного рецидивирования приводит к более точной оценке пациентов с повышенным уровнем ПСА после лечения. Нужно надеяться, что эти достижения в визуализации, включая молекулярные изображения, внесут свой вклад в долгосрочное повышение качества жизни и снижение травматичности, связанной с раком простаты, и ускорит снижение смертности от рака простаты, которые мы сейчас только начинаем наблюдать (21).
Отличие летального от нелетального рака: главная проблема в клиническом ведении рака простаты
Раннее выявление рака простаты в эру ПСА принесло новые трудности для клинической оценки и подбора лечения. Задача осложнялась вариабельностью естественного течения заболевания. Сегодня выявляются раки меньшего размера, с более низкой стадией и низкой степенью злокачественности, чем 20 лет назад, но по-прежнему остается большой разброс в агрессивности рака (21, 24). Предполагается, что применение данных из диагностических параметров, основанных на доказательствах, таких как гистопатологическая степень злокачественности; система стадирования опухоли, лимфоузлы и метастазы (TNM); новые молекулярные биомаркеры помогут практикующим врачам избежать дилеммы гипердиагностики и перелечивания либо гиподиагностики рака простаты с летальным биологическим потенциалом. Тем не менее, наилучшие доступные методы оценки дают не самый точный прогноз. Считают, что дополнение знаний информацией, полученной из функциональных, а также анатомических изображений к различным клиническим номограммам добавит им точности в прогнозировании исходов и в определении тактики лечения (Таблица 2).
У многих мужчин, у которых развивается рак простаты, никогда не появятся симптомы, и им не будет проведено лечение, и они умрут по другим причинам. Естественное течение рака простаты очень гетерогенно и оно по-прежнему остается не полностью понятым. Аутопсия и ранние наблюдательские исследования показали, что приблизительно у трети мужчин в возрасте 50 лет и старше имеются гистологические признаки рака простаты; большинство этих опухолей небольшие по размерам и, возможно, клинически незначимые, а другие – крайне агрессивные и потенциально летальные (25). Проблема состоит в дифференцировании этих двух видов. В настоящее время рак простаты классифицируется по группам риска (низкий, промежуточный и высокий) на основании уровня ПСА, суммы баллов по Глисону по данным биопсии и клинической стадии. Эти группы риска используются при выборе тактики лечения. Тем не менее, три группы риска являются широкими категориями с различными патологическими характеристиками и клиническим поведением. Например, рак простаты низкого риска (по определению National Comprehensive Cancer Network – опухоль, которая или не пальпируется, или, если пальпируется, то занимает половину одной доли и менее, с суммой баллов по Глисону 2-6 и уровнем ПСА <10 нг/мл) может, в свою очередь, быть клинически значимым или незначимым (24).
ПСА
Широко распространенное применение скрининга ПСА привело не только к более раннему выявлению и к резкому снижению стадии рака простаты при постановке диагноза, но и к гипердиагностике и перелечиванию клинически незначимого рака.
ПСА является наиболее часто используемым биохимическим маркером рака простаты и в настоящее время единственным для него широко принятым скрининговым методом (помимо пальцевого ректального исследования). Он представляет собой протеазу, синтезируемую секреторным эпителием и дренируемую в систему протоков, где он обеспечивает жидкую среду секрету семенных пузырьков после эякуляции. Уровень ПСА в крови в норме менее 4 нг/мл, но он варьирует в зависимости от возраста и расовой принадлежности. Многие урологи сегодня в качестве показания к выполнению биопсии применяют порог ПСА, равный 2,5 нг/мл, что приводит к повышенному выявлению рака простаты, однако также и значительному числу дополнительных, возможно ненужных, биопсий (26). В настоящее время установлено, что показатели гипердиагностики составляют от 27% до 56% (25). ПСА специфичен для простаты, но не специфичен для рака. Любой процесс, который нарушает нормальную архитектонику простаты, может привести к диффузии ПСА в строму и микрососудистое русло (например, повышенный уровень ПСА наблюдается при простатите, инфаркте, гиперплазии, а также транзиторно после биопсии). Хотя уровень ПСА положительно коррелирует с клинической стадией, объемом опухоли, гистологической степенью злокачественности, и наличием капсулярной перфорации и инвазией семенных пузырьков, он имеет ограниченную ценность в прогнозировании стадии у отдельного пациента (27).
Однако, несмотря на свои ограничения, ПСА остается единственным общепринятым биомаркером рака простаты. Чтобы улучшить традиционный анализ ПСА, были разработаны и продолжают разрабатываться другие тесты на его основе (дериваты ПСА) – например, плотность ПСА, скорость нарастания и возраст-специфические показатели – и изоформы ПСА – например, различные молекулярные формы свободного ПСА, проПСА и BPSA (доброкачественный ПСА) (26, 28).
Во многих исследованиях показана мощная прогностическая ценность в дифференцировании доброкачественной гиперплазии простаты и рака плотности ПСА, т.е. отношения его уровня к объему простаты, измеренному на ТРУЗИ, хотя другие исследования такой связи не показали. Больше всего для выявления рака простаты применяли скорость нарастания ПСА и изменение его уровня за определенный интервал времени. Скорость нарастания ПСА показывает сильную корреляцию с диагнозом рака простаты и с риском развития рецидива или канцер-специфической смерти после лечения. Возраст-специфические показатели ПСА были предложены с целью повышения чувствительности выявления рака у молодых мужчин и повышения специфичности у пожилых; тем не менее, эти показатели критиковались, в основном по причине пропуска клинически значимых раков у мужчин пожилого возраста и они не стали общепринятыми. Изоформы ПСА, или протеины, связанные с ПСА, оценивались на возможность прогнозирования рака простаты. Большая часть ПСА в крови находится в стабильной ковалентной связи с ингибитором протеаз. Установлена клиническая применимость несвязанных форм, известных как свободный ПСА, для повышения специфичности анализа, особенно после отрицательного результата биопсии простаты, хотя значение этого эффекта варьирует в различных исследованиях. ПроПСА – это белок-предшественник ПСА. В нескольких статьях авторы предположили, что проПСА может помочь в дифференцировании рака простаты от доброкачественного увеличения. Повышенный уровень проПСА ассоциирован с раком простаты, а в сочетании с общим и свободным ПСА эти показатели повышают специфичность определения рака. BPSA, продукт деградации ПСА, связан с объемом простаты и поэтому может также применяться для дифференциальной диагностики. Все эти формы ПСА заслуживают дальнейших исследований для того, чтобы определить, могут ли они повысить точность выявления клинически значимого рака простаты, особенно в комбинации в панели маркеров.
Сумма баллов по Глисону
К настоящему времени рак простаты диагностируется на основании гистопатологического или гистологического исследования нескольких биоптатов простаты, полученных при систематической трансректальной биопсии. Данные биопсии аденокарциномы оцениваются с помощью суммы баллов по Глисону, которая в настоящее время является наилучшим прогностическим фактором и наиболее часто используемой системой для определения злокачественности рака простаты. Патологи исследуют микроскопический вид и гистопатологические особенности опухолевого роста и устанавливают степень злокачественности (варьирует от 1 до 5; 5 – наиболее агрессивный рак) наиболее распространенной опухоли и степень злокачественности опухоли, которая является второй по распространенности. Эти два показателя суммируются для расчета баллов по Глисону (варьирует от 2 до 10; 10 – имеет наихудший прогноз). Более низкие суммы связаны с небольшими, хорошо дифференцированными, тесно расположенными клетками; с возрастанием степени клетки отдаляются, теряется их железистая структура и они становятся плохо дифференцированными. Рак простаты с суммой баллов по Глисону 6 или ниже рассматриваются как хорошо дифференцированные, и они связаны с хорошим прогнозом. Рак простаты с суммой баллов 8-10 имеет наихудший прогноз и самый высокий риск развития рецидива. Опухоли с суммой баллов 7 имеют различный прогноз и промежуточный риск развития рецидива (2). Тем не менее, имеется несколько недостатков этого метода: могут возникать различия в интерпретации данных разными патологами, степень злокачественности при биопсии может не коррелировать с таковой при исследовании препарата после простатэктомии, что связано с проблемами с забором биоптатов; также два морфологически идентичных рака простаты могут иметь различное биологическое поведение (30).
Стадирование
TNM классификация является эталонным стандартом стадирования рака простаты – первичной целью является определение анатомического распространения рака для отличия пациентов с опухолью, ограниченной пределами органа, от пациентов с локально инвазивным или метастатическим раком. Субкатегории в стадиях Т1-Т4 основываются на комбинации данных, полученных и при клиническом обследовании (пальпируемость), и после оценки удаленной ткани железы (процент поражения одной доли, множественное поражение доли, прорастание за пределы простаты и так далее). Гистопатологические данные, полученные после лимфодиссекции, или данные визуализации дают дополнительную информацию, используемую для определения стадии.
Номограммы
Такие математические модели, как номограммы, могут дать не просто стадирование, а более точное определение прогноза или терапевтический ответ. Показано, что модели, сочетающие в себе пальцевое ректальное исследование, уровень ПСА и сумму баллов по Глисону (такие как номограммы D'Amico, Partin, или Kattan (2)), по сравнению с однопараметровыми моделями имеют более высокую точность прогнозирования риска неэффективности лечения.
Более того, показано, что введение в номограммы данных МРТ или МР-спектроскопии улучшает прогнозирование незначимого рака (21, 31). Тем не менее, эти модели дают общую вероятность, а не специфический риск для индивидуального пациента.
Как отмечалось, по только что описанным параметрам, которые широко применяются при принятии клинического решения, пациенты могут быть стратифицированы на подгруппы в зависимости от исходов после операции.
Тем не менее, в связи с выявлением рака, основанным на ПСА, пациенты все чаще поступают с узким диапазоном значений этих параметров, которые из-за этого теряют силу своей селективности. Фактически, среди всех пациентов, которым выполняется простатэктомия по поводу рака, ограниченного пределами органа, более, чем в трети случаев развивается рецидив, что является свидетельством прорастания опухоли за пределы органа (32, 33). С другой стороны, мы знаем, что только 12-15% диагностируемых раков простаты являются летальными (34).
Молекулярные методы
Среди методов, необходимых для решения этой проблемы, должны быть использованы новые биомаркеры, которые дают возможность установить тяжесть рака простаты и прогнозировать ответ на лечение.
Для этого были сделаны попытки углубить знания генетики рака простаты и выявить новые прогностически значимые биомаркеры в сывороточных и тканевых анализах. Некоторые из этих биомаркеров станут мишенями для методов визуализации. У пациентов с раком простаты выявлены частые генетические аномалии, включая CpG гиперметилирование GSPTислияние гена TMPRSS2–ERG. Определение в моче и крови биомаркеров РНК (например, PCA3) и протеинов ткани рака простаты с помощью антител (например, EPCA) оценивается в настоящее время как метод выявления рака и определения его прогноза (24, 26).
Таким образом, возможность прогнозировать биологическую агрессивность рака простаты остается ограниченной, а способность отличить агрессивные формы рака является критичной, исходя из его встречаемости, легкой диагностики и старения популяции. Необходимость и возможность визуализации для решения этих задач суммированы в таблицах 1 и 3.
Стратегии и клинические исследования методов визуализации, необходимых для решения проблем клинического ведения рака простаты
Далее представлены обсуждения и рекомендации по исследованиям, посвященным решению 4х проблем в ведении рака простаты, которым был посвящен семинар. По каждой проблеме проведен краткий обзор нынешнего состояния, отмечены потенциально полезные методы визуализации и представлены рекомендации для исследований.
Проблема 1: диагностическая точность (снижение количества ложноположительных и ложноотрицательных биопсий)
Клинические вопросы – как было отмечено выше, рак простаты диагностируется при патологическом исследовании образцов ткани, полученных при игольчатой биопсии, часто в сочетании с изменениями при пальцевом ректальном исследовании и повышенным уровнем ПСА. Хотя уровень ПСА коррелирует с риском наличия рака простаты и его агрессивностью, на большей части биопсий, проведенных при повышенном ПСА, обнаруживают рак, ограниченный пределами органа, в то время как рак высокой степени злокачественности также может быть обнаружен у пациентов с уровнем ПСА менее 0,5 нг/мл (35). В дополнение, в связи с врожденной гетерогенностью рака простаты (приблизительно 85% по своей природе мультифокальные), современные методы систематической биопсии (из 6-12 распределенных в пространстве точек под ТРУЗИ контролем) могут не давать точную информацию о локализации, размере, экстракапсулярном распространении и степени злокачественности. Даже систематический забор под ТРУЗИ контролем часто приводит к недооценке степени прорастания рака простаты. Фактически, при тонкоигольной биопсии гистологическая степень злокачественности почти всегда недооценивается (37). Таким образом, с применением нынешних диагностических схем в популяции, имеющей риск развития опухоли простаты, возникает и гипердиагностика клинически незначимого рака, и гиподиагностика потенциально летального рака.
Для преодоления ограничений нынешнего скрининга ПСА и техники биопсии в выявлении рака простаты, срочно необходимо вводить комплексный подход. Например, необходимо разрабатывать новые сывороточные и тканевые биомаркеры с большей чувствительностью и специфичностью. В дополнение, необходимо исследовать новые методы визуализации в плане оценки их потенциала в выявлении раннего рака, наведения биопсии и планировании лечения. Более точное описание характеристик локальной опухоли по сывороточным и тканевым маркерам, методикам биопсии, изображению и номограммам критично для улучшения оценки риска, и это может передаваться в дифференцированное ведение в клинических условиях рака низкого и высокого риска. Являясь неинвазивным методом, изображение играет интегральную роль в ведении рака простаты. Как первый шаг, до биопсии, необходимо исследовать и интегрировать в диагностическую схему методы визуализации, с помощью которых можно охарактеризовать локализацию фокусов рака, так как эта информация может применяться для наведения биопсии.
Роль ультразвука – ТРУЗИ преимущественно используется для наведения биопсийной иглы в определенную анатомическую область, но оно не помогает в дифференцировании нормальной ткани железы от опухолевой. В результате этого биопсия производится не из специфической зоны, которая наиболее вероятно является злокачественной.
С целью повышения чувствительности биопсии и снижения числа биоптатов для определения клинически значимого рака простаты исследуются несколько новых технологий в комбинации со стандартным ТРУЗИ, включая допплеровское исследование с контрастом, интермиттирующие гармонические изображения и контрастную эхографию со стратегией flash replenishment imaging (9). Одной из наиболее интересных стратегий является ультразвук с контрастным усилением, который имеет преимущество в дифференцировании микрососудистого русла между фокусом рака простаты и доброкачественной тканью.
В раке имеется повышенная микрососудистая плотность; эти микрососуды не визуализируются на традиционном ультразвуке в связи с более низким разрешением, но могут быть визуализированы при использовании в качестве контрастного агента микропузырьков. После внутривенного введения микропузырьки (1-10 нм в диаметре) могут диффундировать в микрососуды, селективно усиливая сигнал в областях с повышенным кровоснабжением. При таргетной биопсии под контролем УЗИ с контрастированием было выявлено намного больше раков и забрано в два раза больше опухолевой ткани, по сравнению с традиционной систематической биопсией. Большинство раков были высокой степени злокачественности (сумма баллов по Глисону >6). Тем не менее, способность этого метода дифференцировать доброкачественную ткань от злокачественной низкая (38). Для его применения в качестве наведения биопсии необходима валидация в крупных исследованиях. Другим фактором, который может препятствовать его применению в онкологии, является то, что микропузырьки, одобренные FDA для эхокардиографии, имеют побочные эффекты, требующие тщательного мониторирования пациентов с высоким риском во избежание потенциально опасных кардиопульмонарных реакций (www.fda.gov/cder/drug/Info-Sheets/HCP/microbubbleHCP.htm). Ультразвуковая спектроскопия основана на радиочастотном эхо-сигнале, выраженном в виде спектрального параметра с целью получения характеристик микроархитектоники ткани, которые позволяют отличить доброкачественные образования от злокачественных. Во время спектрального анализа вокруг подозрительной области рисуется зона интереса, и спектр радиочастотных сигналов сравнивается с эталоном в неизмененном месте (10). Способность ультразвуковой спектроскопии определять рак простаты была показана в клиническом исследовании, проведенном в Sloan-Kettering Cancer Center и охватывающем 300 пациентов; исследование включало 64 пациентов в медицинском центре в Вашингтоне, штате Даллас и независимую группу в Германии (39). Тем не менее, для валидации и потенциального применения этого метода необходимо провести большее количество исследований.
Роль МРТ – как обсуждалось ранее, традиционная МРТ с применением эндоректальной катушки в сочетании с фазовыми поверхностными катушками позволяет определить наличие и распространение рака (11); она обладает более высоким пространственным и контрастным разрешением, чем ТРУЗИ или КТ, но имеет низкую специфичность (14). Рак простаты на МРТ-ЭК в режиме Т2 усиления показывает снижение интенсивности сигнала относительно нормальной периферической зоны, но этот метод менее чувствителен в выявлении рака в других зонах железы. Также, низкая интенсивность сигнала не является специфичной для рака простаты, потому что такие доброкачественные состояния, как простатит, кровоизлияния и побочные эффекты терапевтического лечения имеют на МРТ такое же проявление (12, 13).
Для улучшения определения локализации рака провели исследования потенциала функциональных методов МРТ, таких как МР-спектроскопия, диффузионная МРТ и МРТ с динамическим контрастированием в дополнение к морфологическим снимкам в режиме Т2 усиления. МР-спектроскопия – это одобренный FDA метод для неинвазивного измерения метаболической активности в ткани на основании относительных концентраций метаболитов. В простате раковые клетки имеют сниженную концентрацию цитратов, но повышенное содержание холина по сравнению с нормальной тканью. Было показано, что сочетание метаболической информации, полученной при МР-спектроскопии, и морфологической информации, полученной в режиме Т2 усиления, улучшает как определение локализации рака, так и прогнозирование его агрессивности (11, 40). Но результаты были неоднозначными. В недавно завершившемся мультицентровом исследовании был сделан вывод о том, что комбинация МРТ/МР-спектроскопии не имеет явного преимущества, при сравнении с одной МРТ (41). Более того, технология сложна и требует физической поддержки для обеспечения надлежащего качества получения данных. Раковые клетки в основном имеют повышенную гликолитическую активность. Измеряя относительное превращение пирувата в лактат или аланин можно рассчитать гликолитическую активность клетки. После введения гиперполяризованного пирувата, меченного 13С, можно через короткий промежуток времени количественного измерить его метаболические продукты лактат и аланин, применяя метод динамической ядерной поляризации (42, 43). В трансгенной мышиной модели рака простаты после инъекции 13С-пирувата на МР-спектроскопии в нем показано значительно большее содержание лактата относительно нормальных тканей. Возможности этой технологической разработки в выявлении рака простаты исследуются в клинических исследованиях. Исследование 1 фазы по эскалации дозы гиперполяризированного 13С-пирувата у пациентов с раком простаты планировалось на 2009 год (44).
Диффузионная МРТ основана на свойствах диффузии воды в тканях. Область рака простаты имеет повышенную клеточную плотность и снижение диффузионного коэффициента относительно нормальной ткани железы (45). Диффузионная МРТ имеет более высокую точность определения рака по сравнению с МРТ или МР-спектроскопией (46, 47). Тем не менее, биологическая значимость диффузии не ясна. Хотя технология имеет высокую разрешающую способность, необходима ее валидация в крупных клинических исследованиях. МРТ с динамическим контрастированием основана на измерении сосудистого рисунка опухоли. После введения контрастного агента хелата гадолиния зоны с повышенным кровоснабжением, например, рак простаты, показывают быстрое усиление и раннее снижение интенсивности сигнала. Тем не менее, некоторые раки простаты данным методом не выявляются, что связано с невыраженной васкуляризацией ткани. Комбинирование МРТ с динамическим контрастированием и МРТ с режиме Т2 усиления улучшает выявление рака простаты и точность стадирования (48, 49). Результаты МРТ с динамическим контрастированием, полученные в различных исследованиях, оказались сравнимыми, однако необходимо развитие стандартизированной методики и алгоритмов анализа. Наиболее привлекающим аспектом этих методов МРТ является возможность проводить одно комплексное мультимодальное МРТ исследование, при котором станет возможным интеграция всех полученных данных, которые важны для постановки диагноза, стадирования и описания характеристик рака. При этом ожидается улучшение общей диагностической ценности МРТ.
Роль ПЭТ и SPECT – как отмечалось ранее, результаты ФДГ ПЭТ в выявлении рака простаты неоднозначные. В одном сообщении с помощью этого метода был выявлен только один рак из 24-х, ограниченных пределами органа у пациентов, не получавших лечение (15). Не показана способность ФДГ ПЭТ дифференцировать рак простаты от доброкачественной гиперплазии (16) или выявлять метастатическое поражение тазовых лимфоузлов (50); в других исследованиях же сообщалось о хорошей точности в определении первичного или локального рецидива рака простаты (17, 18). Как отмечалось, способность ПЭТ и SPECT определять рак простаты, ограниченный пределами органа, будет улучшена при введении молекулярных датчиков с более высокой чувствительностью и специфичностью. Ранние результаты обнадеживают, также повышается интерес к использованию 18F-холина (23).
Другие исследуемые методы визуализации –Спектроскопия Raman – это оптический метод изображения для измерения свойств молекул в ткани. Технология была тестирована только на образцах ткани in vitro; таким образом, ее клиническая применимость пока не ясна. Другим исследуемым методом визуализации является оптическая спектроскопия рассеяния с острыми иглами (smart-needle) для введения в зону интереса в режиме реального времени с целью выявления рака. Если этот метод будет валидирован, он потенциально может привести к уменьшению числа биопсий, выполняемых для постановки диагноза рака простаты. Он может применяться в комбинации с другими метода для наведения биопсии. Недостатком его является инвазивность.
Проблема 2: стратификация риска, первоначальное стадирование, тактика активного наблюдения и фокальная терапия
Клинические проблемы – изображение как способ прогнозирования исхода заболевания у пациента можно успешно оценить путем сравнительных моделей, в которые вводят результаты методов визуализации с моделями, не определяющими возрастание прогностической ценности. Система стадирования TNM описывает распространение первичной опухоли, поражение соседних лимфоузлов и желез и наличие либо отсутствие отдаленных метастазов. В США при первоначальном стадировании рака простаты делается акцент на стадии Т и N, потому что отдаленные метастазы имеют относительное небольшое число пациентов. Тем не менее, определение экстракапсулярного прорастания и определение локализации интрапростатического распространения рака – важные вопросы в его ведении.
Встречаемость экстракапсулярного распространения, особенно раннего микроскопического экстракапсулярного распространения, неизвестно. Статистически, пациенты с прорастанием капсулы при патологическом исследовании имеют тенденцию к более низкой 10-летней выживаемости без заболевания, чем пациенты с раком, ограниченным пределами органа; значимость экстракапсулярного распространения требует исследований. Хотя в недавних исследованиях было обнаружено, что встречаемость опухолевого поражения лимфоузлов упала менее, чем до 10%, эти цифры не отражают истинные показатели (51), так как пациенты, получающие неоадъювантную гормональную или лучевую терапию, у которых имеется рак простаты высокого риска, а также пациенты с позитивными лимфоузлами, которым была выполнена расширенная лимфодиссекция, исключаются из этого числа. Поэтому, хотя процент пациентов с позитивными лимфоузлами снижается, абсолютное число пациентов с опухолевым поражением лимфоузлов значительное (около 39% в группе высокого риска). Знание статуса лимфоузлов позволяет принимать информированное решение о терапии, прогнозировать рецидивирование и оценивать прогноз. Методы визуализации не достоверны в выявлении поражения лимфоузлов; до недавнего времени их размер был единственным широко используемым параметром для подтверждения опухолевого поражения. Тем не менее, критерии размера ограничены в точности, потому что имеется значительное различие между размером нормальных и пораженных лимфоузлов.
Основным препятствием к улучшению технологий стадирования является необходимость улучшения патологических маркеров. Эти маркеры служат эталонными стандартами для поиска методов визуализации, с помощью которых можно прогнозировать исходы заболевания и выбирать стратегию лечения. Остаются и другие важные проблемы, включая определение когорты пациентов, которым изображение и стадирование лимфоузлов принесет пользу, а также изучение того, как прогностическая ценность точных методов влияет на выбор тактики лечения. Традиционно, тактика активного наблюдения при раке простаты (ранее называвшаяся выжидательной тактикой) рассматривалась для пожилых мужчин и мужчин со значительными сопутствующими заболеваниями. Она принималась специально с ограниченным успехом. Пациенту после трансуретральной резекции диагностировали стадию А1 рака простаты, далее проводилось нестандартизированное наблюдение. Современная тактика активного наблюдения применяется у пациентов с раком низкого риска, небольшого объема, при низком уровне ПСА и сумме баллов по Глисону. Наблюдение стандартизировано, пациенты хорошо информированы и им периодически выполняются повторные биопсии простаты. Хотя рак простаты преимущественно мультифокальное заболевание, около 15-30% имеют унифокальный или унилатеральный рак. Локализованный, унифокальный, клинически значимый рак обычно рассматривается как предпосылка к фокальной терапии. Тем не менее, унилатеральный (мультифокальный, но с поражением одной стороны) рак может облегчить проведение фокальной терапии. Возможно, что при мультифокальном раке прогрессию определяет доминантный фокус; таким образом, рак может рассматриваться как биологически унифокальное заболевание. Фокальная аблация опухоли осуществляется с низкой травматичностью. Проблема заключается в определении локализации подходящих опухолей и мониторировании аблации тканей. В дополнение к выявлению пациентов, являющихся кандидатами на фокальную терапию, визуализация может помочь в определении таргетного образования. Другой клинической проблемой фокальной терапии является резидуальный уровень ПСА, который затрудняет послеоперационное наблюдение. Также проблемами являются биологический потенциал нелеченых вторичных фокусов и роль адъювантной терапии. Представляет интерес комбинирование тактики активного наблюдения с другими вмешательствами (тактика активного наблюдения плюс), такими как агрессивное изменение рациона питания и образа жизни, применение ингибиторов 5α-редуктазы, дополнительных альтернативных препаратов, пероральных антиандрогенов и т.д.. Однако тактика активного наблюдения остается дискутабельной в связи с отсутствием современных рандомизированных исследований надлежащего качества, также как и надежных методов визуализации. Имеются четкие социальные и экономические факторы, которые влияют на применение тактики активного наблюдения. Основной проблемой в нынешних протоколах остается ограниченная способность близко и неинвазивно мониторировать прогрессию опухоли в простате. Методы визуализации хорошо подходят для этой цели, и их интеграция может повысить общее признание активного наблюдения в ведении рака низкого риска. Исходы фокальной терапии, вне зависимости от того, проводилась ли она до или после активного наблюдения, будут улучшаться с интеграцией визуализации в качестве контроля. Стандартные варианты лечения включают радикальную простатэктомию, высокодозную наружную лучевую терапию и брахитерапию, которые применяются как в виде монотерапии, так и в комбинации. В качестве первого шага, для того, чтобы рекомендовать наиболее подходящий вариант, необходимо точно стадировать и определить прогноз заболевания. В конце концов, целью местной терапии является контроль над раком с минимальным повреждением окружающих структур, тем самым оптимизируя и онкологические результаты, и уменьшая осложнения. В связи с исторически сложившейся неспособностью точно визуализировать степень местного распространения опухоли, все локальные методы лечения просто направлялись на простату как на суррогат рака. Эта парадигма неизменно приводила к перелечиванию незначимого и недолечиванию местно-распространенного рака. Таким образом, визуализация локализации и степени распространения рака делает более надлежащим как хирургическое лечение, так и наведение лучевой терапии. Визуализация рака, который прорастает за пределы железы, может снизить частоту неполных резекций и улучшить качество лучевой терапии, с включением экстрапростатического компонента. Также, простатические очаги рака могут быть отобраны для интенсификации дозы облучения, что позволит улучшить онкологический контроль и снизить ненужное облучение прилежащих органов, снижая риск повреждения с последующим развитием токсичности. Важно понимать, что доза облучения, требуемая для контроля над микроскопическим раком намного ниже той, которая требуется для контроля макроскопического (плотного) рака, поэтому, еще только предстоит полностью исследовать модуляцию дозы по интенсивности на основе пространственного распределения опухоли.
Фокальные аблативные методы не направляют энергию на области, содержащие микроскопический рак в простате и вокруг нее, что может влиять на онкологический контроль. Для решения этой задачи можно рассматривать применение адъювантной терапии в дополнение к фокальной аблации. Фактически, недавно было показано, что немедленная лучевая терапия предполагаемого микроскопического рака после простатэктомии повышает общую выживаемость у пациентов с локализованным раком простаты. Методы визуализации, которые могут позволить мониторировать прогрессию микроскопического рака, могут вообще устранить необходимость в адъювантной терапии, ограничивая ее применение в качестве терапии спасения в случае прогрессии микроскопического рака.
Роль визуализации – возрастающая точность изображения представляет собой огромный интерес при раке простаты. Тем не менее, до того, как они будут определенными, технологии изображения должны стать более зрелыми, стабильными и стандартизированными. МРТ – полезный метод для выявления рака простаты, основывающийся на сниженной интенсивности Т2 сигнала, повышении холина и снижении цитрата и спермина (52). Интрапростатическое молекулярное изображение может выявить зону высокого опухолевого груза с помощью таких методов, как SPECT, МР-спектроскопия и ПЭТ с холином. Улучшенное выявление локализации опухоли и стадирование лимфоузлов может достигаться путем комбинирования молекулярных изображений с регистрацией и анатомических снимков, полученных при КТ и МРТ (21). В дополнение, показана применимость валидированных интрапростатических биологических таргетных масс с использованием фидуциальных маркеров (53). Скоррелированные данные гистопатологического исследования и протокола системы расположения маркеров показывают однозначную корреляцию с данными патологического исследования и дискретной интенсификацией дозы, направляя ее на опухоль, и в то же время без воздействия на нормальные радиочувствительные ткани (уретра, прямая кишка и сосудисто-нервный пучок). Была показана клиническая применимость скоррелированных данных гистопатологического исследования и протокола системы расположения маркеров как метода валидации молекулярных методов изображения, таких как SPECT-КТ.
В настоящее время разрабатываются и тестируются технологии для прямой интеграции изображений для оффлайн и онлайн наведения локальной терапии. Они включают технологии для выведения, регистрации, навигации и онлайн адаптации изображения к движениям и деформациям, возникающим во время терапевтической процедуры (54, 55).
МРТ с динамическим контрастированием – это мощный метод для визуализации сосудистого русла солидных опухолей. Изображение простаты, полученное при этом методе, также дает полезную информацию для выявления и стадирования рака простаты (56). При диффузионной МРТ применяется диффузионный контраст для картирования интрапростатического распространения рака. Данные интегрируются в модель для прогнозирования его локализации (57).
КТ и МРТ – это основные методы визуализации, которые в настоящее время применяются для стадирования опухолевого поражения лимфоузлов. ПЭТ и ФДГ ПЭТ/КТ также оценивались для стадирования рака простаты, но, так как он имеет различное накопление ФДГ, эти методы не получили широкого распространения. Тем не менее, ФДГ ПЭТ получает применение при повторном стадировании (58). МРТ с усилением лимфотропными наночастицами – подающий надежды метод для оценки опухолевого поражения лимфоузлов, он очень точен в их стадировании у пациентов с различными типами первичных раков (59). Он позволяет оценить функцию нодальных макрофагов и при определении опухолевого поражения не опирается на размер лимфоузла.
Модуль с программным обеспечением MRProstateCare (Центр терапии простаты под наведением изображения - Image Guided Prostate Therapy Core) был создан для использования с Slicer (программное обеспечение с открытым источником), компьютизированной хирургической навигационной платформой, которая помогает планировать, контролировать и направлять биопсию простаты (54, 55). MrBot (URobotics), робот, созданный для обеспечения доступа к простате под контролем изображения (60). Робот настраивается для трансперинеального ввода иглы и разработан в совместимости с МРТ. Он может вмещать различные драйвера для иглы с целью различных перкутанных вмешательств - биопсия, термальная аблация или брахитерапия.
Радиочастотная аблация под контролем ТРУЗИ представляет собой ультразвуковое мониторирование термоаблативного метода. Радиочастотная аблация простаты имеет несколько проблем. Распределение энергии склонно к вариациям, так как тепло разносится по сосудистому руслу и диффундирует на широкую область, что делает затруднительным контроль температуры прилегающих органов; нагревание происходит медленно, что часто приводит к недостаточному пику аблации. Также имеется плохая геометрическая корреляция между таргетным образованием и входом энергии. В дополнение, эту процедуру тяжело мониторировать интраоперационно. Эти проблемы снижают шансы применения радиочастотной аблации в качестве метода, подходящего окончательного лечения рака простаты; тем не менее, при поздних стадиях заболевания, когда таргетность и мониторирование не так критичны, радиочастотная аблация может быть полезным методом паллиативного лечения. Высокоинтенсивный сфокусированный ультразвук (HIFU) подводит тепловую энергию в виде сфокусированных ультразвуковых пульсирующих волн.
Одним из преимуществ HIFU является осуществление фокальной аблации простаты без прямой инвазии в ткани с сопутствующим повреждением окружающих структур (61). Другим преимуществом является очень быстрое нагревание тканей, что вызывает немедленную коагуляцию и некроз. Полная аблация простаты с помощью HIFU – относительно простая методика. Применение фокальной HIFU находится на ранней стадии; было показано, что этот метод приводит к низкой травматичности. HIFU аблация под контролем визуализации позволяет мониторировать процесс с помощью ультразвука для определения образования. HIFU под контролем МРТ позволяет использовать МР-термометрию в режиме реального времени для эффективного оптимизирования распределения тепла. Тем не менее, существуют сложности с измерением эффективности, связанные с персистированием повышенного уровня ПСА после лечения; также лечение затрудняют различия в размере и локализации рака.
Проблема 3. D0 заболевание: роль визуализации в ведении рака
Клинические вопросы – после радикальной простатэктомии или лучевой терапии первым признаком рецидива рака обычно является подъем уровня ПСА, также известный как биохимический рецидив. Он возникает у 20-40% пациентов в течение 10 лет после окончательной терапии рака простаты (62-64), часто на годы опережая клинически выявляемый рецидив (62). Тем не менее, прогрессия рака в группе пациентов с подъемом ПСА гетерогенна; только у 30% он в конце концов прогрессирует до клинических проявлений (65, 66).
Биохимический рецидив после радикальной простатэктомии – после радикальной простатэктомии уровень ПСА в течение 3-4 недель падает до неопределяемого (<0,1 нг/мл), что измеряется стандартным иммунным анализом. Тем не менее, определение биохимического рецидива в литературе варьирует от пограничного значения в 0,2-0,5 нг/мл для одного измерения или двух последовательных измерений с уровнем, превышающим 0,2 или 0,4 нг/мл (66-68). Уровень ПСА, равный 0,4 нг/ил и выше наиболее сильно связан с прогрессией ПСА или прогрессией рака, и он рассматривается как наиболее значимый для определения биохимического рецидива (68, 69), который может возникать спустя годы после радикальной простатэктомии. Например, около 20% рецидивов ПСА наступили через 5 или более лет после операции, что предполагает необходимость в пролонгированном наблюдении за уровнем ПСА. В нынешней клинической практике уровень ПСА мониторируют каждые 3 месяца в течение 1 года, каждые 6 месяцев в течение 2-5 лет и далее ежегодно (70). Время от биохимического рецидива до развития метастазов зависит от дооперационной патологической стадии, суммы баллов по Глисону и послеоперационного времени удвоения ПСА (65, 66). Короткое время удвоения ПСА (<10 месяцев) – наиболее мощный прогностический фактор прогрессии заболевания (65, 66). В редких случаях, у пациентов могут развиваться отдаленные метастазы после радикальной простатэктомии без повышенного уровня ПСА (71).
Биохимический рецидив после лучевой терапии – после лучевой терапии уровень ПСА снижается медленно и может никогда не достигнуть неопределяемого уровня. Время достижения надира после лучевой терапии может занимать месяцы и даже годы, в зависимости от различных факторов, таких как доза облучения, размер простаты и долечебный уровень ПСА (72). Определение биохимического рецидива после лучевой терапии более сложное. Американское общество терапевтической радиологии и онкологии (ASTRO) в 1997 году рекомендовало определение биохимического рецидива в случае трех последовательных повышений уровня ПСА после достижения надира, а время рецидива определяется как средняя точка между временем надира и первых из трех последовательных измерений. Этот определение критиковалось в связи со сдвигом, вызванным установлением времени рецидива в прошлом. В 2006 году определение было пересмотрено и разработано новое, известное как определение Phoenix ((Группа лучевой терапии и онкологии) RTOG-ASTRO). По нему биохимический рецидив определялся как абсолютное повышение на 2 нг/мл и более выше надира, без установления его времени в прошлом. Это определение имеет большую чувствительность и специфичность в прогнозировании клинической неэффективности после наружной лучевой терапии и брахитерапии, по сравнению с изначальным определением ASTRO (73). Тем не менее, как и с радикальной простатэктомией, клиническая неэффективность лучевой терапии может быть лучше спрогнозирована по времени удвоения ПСА, чем по его абсолютному уровню (74).
Роль изображения – когда у пациентов после радикальной простатэктомии или лучевой терапии наблюдается рост уровня ПСА, следующим шагом является определение того, является ли рецидив местным или же имеются отдаленные метастазы. Точное определение локализации и распространения рака критичны в подборе соответствующего лечения, то есть, спасительной местной или системной терапии. Первичной целью визуализации в этих условиях является помощь в поиске отличий местного рецидива и отдаленных метастазов.
ПЭТ и SPECT – как отмечалось, рак простаты растет медленно и редко поглощает ФДГ. Вследствие этого, ФДГ не является оптимальным трейсером для ПЭТ при оценке рецидива, хотя ФДГ ПЭТ позволило определить системный или местный процесс в 31% из 91 пациента с рецидивом ПСА, направленного на диагностику (75). Тем не менее, недавние исследования позволяют предположить высокую чувствительность 11С-ацетат и 11С-холин ПЭТ в выявлении местного рецидива и опухолевого поражения регионарных лимфоузлов после радикальной простатэктомии и лучевой терапии (5, 6, 8, 76). Очень короткий период полувыведения 11С (20 минут) делает его менее практичным, чем 18F в качестве радиометки ПЭТ в связи с логистическими вопросами. Недавно у 6 пациентов с рецидивирующим раком простаты оценивали новый трейсер для ПЭТ, анти-1-амино-3-18F-фторциклобутан-1-карбоксиловая кислоту (18F-FACBC), синтетический аналог L-лейцина. Наблюдалась очень низкая экскреция анти-18F-FACBC через почки; он показал интенсивное накопление в метастазах в лимфоузлах и ложе рецидивного рака простаты; было определено, что он превосходит ProstaScint (111Инкарпомаб пендетид, Cytogen) SPECT в выявлении поражения лимфоузлов (77).
В ProstaScint SPECTприменяется муриновые моноклональные антитела против простат-специфического мембранного антигена (ПСМА), которые показывает гиперэкспрессию в клетках рака простаты, по сравнению с нормальной тканью. ProstaScint SPECT применяется для определения метастазов в лимфоузлах и рецидива рака простаты после радикальной простатэктомии или лучевой терапии. Тем не менее, его чувствительность и специфичность в определении рецидивного рака являются субоптимальными (78). Другие новые трейсеры SPECT, проходящие в настоящее время доклиническую и раннюю клиническую разработку, включают низкомолекулярные ингибиторы ПСМА (79-81). Эти молекулы селективно накапливаются в ПСМА-позитивном человеческом ксенографте рака простаты. Также, в исследованиях на людях было показано, что ингибитор ПСМА, MIP-1095 (Molecular Insight Pharmaceuticals) накапливается в метастатическом раке простаты (82); его применение требует дальнейшей проверки в более крупных клинических исследованиях. Кости – это самая частая локализация метастазов рака простаты. Остеосцинтиграфия – чувствительный метод для оценки костных метастазов. В настоящее время, 99mTc-МДФ пларная остеосцинтиграфия – это стандартный метод визуализации костной системы. Тем не менее, точность определения костных метастазов может быть повышена при использовании SPECT с ротационным 3D захватом (83). Результаты исследований также позволяют предположить, что 18F-NaF ПЭТ имеет преимущество перед планарной сцинтиграфией с 99mTc-МДФ или SPECT в определении костных метастазов рака простаты (84); 18F-NaF ПЭТ позволяет выявить больше образований и показывает больший контраст между злокачественными очагами и нормальной костью. В отличие от сканирования с 99mTc-МДФ, которое имеет низкие показатели выявления образований в позвоночнике и тазовых костях, эффективность определения 18F-NaF ПЭТ не зависит от анатомической локализации метастазов (85). Очень высокое разрешение и контрастирование мишень-фон 18F-NaF ПЭТ может потенциально снизить его специфичность; тем не менее, корреляция между данными ПЭТ и
КТ оказывает значительную помощь в дифференцировании злокачественных и доброкачественных образований (84).
МРТ и КТ – хотя МРТ широко применяется для оценки местного рецидива после простатэктомии и/или лучевой терапии, интерпретация может быть затруднена из-за изменений в тканях (железистая атрофия и фиброз), вызванных лучевой терапией, присутствия зерен для брахитерапии, а также рубцевания и наличия хирургических клипс. Из-за сообщений, что МРТ и КТ определение рецидивного поражения лимфоузлов ограничено низкой чувствительностью (~36%) и плохим пространственным разрешением (~8 мм) МРТ, некоторые центры рассматривают их ценность только для пациентов с раком высокого риска и уровнем ПСА >20 нг/мл. Вследствие этого исследуются улучшенные функциональные или усиленные контрастом методы, такие как МР-спектроскопия, диффузионная МРТ и МРТ с динамическим контрастированием. В недавнем исследовании была показана более высокая точность МРТ с суперпарамагнетическими наночастицами (монокристаллы окиси железа, Combidex, Advanced Magnetics), чем у традиционной МРТ при определении опухолевого поражения лимфоузлов. С помощью этого метода определялись метастазы в лимфоузлах размером всего лишь 2 мм (88).
Резюме
Основной целью этого семинара было объединение мультидисциплинарных ученых для рассмотрения новых и улучшенных стратегий изображения, которые могут помочь решить четыре основных проблемы в лечении и ведении рака простаты – диагностическую точность, стратификацию риска, особенно для применения тактики активного наблюдения и фокальной терапии, болезнь D0 и оценку ответа на лечение – также как и способы оценки этих стратегий в клинических условиях. Обсуждению этих четырех проблем предшествовало резюме по встречаемости и смертности при раке простаты; современной роли методов визуализации по всему спектру рака простаты – от ранних стадий до метастатического; и основная проблема рака простаты – как отличить летальные опухоли от нелетальных. Затем обсуждение было сфокусировано на специфических клинических вопросах и роли изображения в решении четырех определенных проблем в клиническом ведении рака. Эти дискуссии и сопровождающие их рекомендации кратко представлены в тексте и таблицах 1-4.
Приложение 1: Члены рабочей группы по визуализации рака простаты
Gary J. Kelloff, Программа визуализации рака, Национальный институт здоровья, Национальный институт рака DCTD, Бетезда, MD
Peter Choyke, Программа молекулярного изображения, Национальный институт здоровья, Национальный институт рака DCTD, Бетезда, MD
Donald S. Coffey, отделение урологии, Университет Джона Хопкинса, Балтимор, MD
Howard I. Scher, Служба урогенитальной онкологии, мемориальный центр Слоуна-Кеттеринга,
Нью-йорк, NY
Thomas M. Wheeler, Отделение патологии, Бэйлорский колледж медицины, Хьюстон, TX
Leigh Anderson, Главный управляющий, Институт протеома плазмы, Роквилл, MD
James Tatum, Программа визуализации рака, Национальный институт здоровья, Национальный институт рака DCTD, Бетезда, MD
Peter T. Scardino, Отделение хирургии, мемориальный центр Слоуна-Кеттеринга, Нью-йорк, NY
Mukesh Harisinghani, Отделение абдоминального изображения и интервенционной радиологии, Массачусеттский госпиталь общего профиля, Бостон, MA
William J. Catalona, подразделение онкологии, школа медицины северо-западного университета Фейнберг, Чикаго, IL
Mario A. Eisenberger, Отделение онкологии и урологии, Университет Джона Хопкинса,
Балтимор, MD
Maha Hadi Hussain, Отделение медицины, Университет Мичикана, Ann Arbor, MI
Steven M. Larson, Отделение ядерной медицины, мемориальный центр Слоуна-Кеттеринга, Нью-йорк, NY
Michael Marberger, Отделение урологии, Венский медицинский университет, Вена, Австрия
Judd W. Moul, Отделение хирургии, Медицинский центр университета Дьюка, Дурхэм, NC
Anwar Padhani, Отделение радиологии, Раковый центр Маунт Вимон, Лондон, Великобритания
Mitchell D. Schnall, Отделение радиологии, Медицинский центр университета Пенсильвании, Филадельфия, PA
Daniel C. Sullivan, Отделение радиологии, Раковый центр, университета Дьюка, Дурхэм, NC
Richard L. Wahl, подразделение ядерной медицины, школа медицины при университете Джона Хопкинса, Балтимор, MD
Cynthia Menard, Отделение лучевой онкологии, Госпиталь принцессы Маргариты, Торонто, ON, Канада
Laurence Clarke, Национальный институт здоровья, Роквилл, MD
Jeffrey K. Cohen, Подразделение урологии, группа урологии Триангл, Питтсбург, PA
William L. Dahut, Медицинская онкологическая ветвь, Национальный институт здоровья, Национальный институт рака DCTD, Бетезда, MD
Adam P. Dicker, Отделение лучевой онкологии, Медицинский колледж Джефферсона медицинского университета Томаса Джефферсона, Филадельфия, PA
Rodney J. Ellis, Отделение радиологии, медицинский колледж университета Охио, Рутстаун, OH, Отделение лучевой терапии, Госпиталь Олтман, Кэнтон, OH
Ernest J. Feleppa, Исследовательский директор, Исследовательский институт Риверсида, Нью-йорк, NY
Keyvan Farahani, Национальный институт здоровья, Роквилл, MD
Victor Frenkel, лаборатория исследований по диагностической радиологии, Отделение радиологии,
Национальный институт здоровья, Бетезда, MD
Robert H. Getzenberg, Университет Джона Хопкинса, Балтимор, MD
Brenda Gumbs-Petty, Отделение медицинской науки, Ассоциация CCS, Маунтэйн Вью, CA
Ethan J. Halpern, Отделение радиологии и урологии, университета Томаса Джефферсона, Фильдельфия, PA
Howard R. Higley, Отделение научных вопросов, Ассоциация CCS, Маунтэйн Вью, CA
Andrew M. Hruszkewycz, Национальный институт здоровья, Роквилл, MD
Paula Jacobs, Regulatory Affairs, Программа визуализации рака, Национальный институт здоровья,
Национальный институт рака DCTD, Бетезда, MD
John M. Jessup, Ветвь диагностической оценки, Национальный институт здоровья, Национальный институт рака DCTD, Бетезда, MD
Michael W. Kattan, Исследовательский институт Лемера, клиника Кливлэнда, OH
Aaron E. Katz, Отделение урологии, Колумбийский университет, Нью-йорк, NY
Michael O. Koch, Отделение урологии, университет Индианы, Индаинаполис, IN
Jason A. Koutcher, Физическая служба изображения и спектроскопии, мемориальный центр Слоуна-Кеттеринга, Нью-йорк, NY
Karen A. Kurdziel, Национальный институт здоровья, Национальный институт рака DCTD, Бетезда,
MD
John Kurhanewicz, Отделение радиологии, Университет Калифорнии, Сан-Франциско, CA
M. Scott Lucia, Отделение патологии, Исследовательский центр здоровья университета, Aurora, CO
Howard L. Parnes, Исследовательская группа рака простаты и раков урогенитальной системы, подразделение профилактики рака, Национальный институт здоровья, Национальный институт рака DCTD, Бетезда, MD
Nick Petrick, подразделение изображения и применения математики, Управление по контролю за качеством пищевых продуктов,
Silver Spring, MD
Martin G. Pomper, подразделение нейрорадиологии, Отделение радиологии, Фармакология и онкология, школа медицина университета Джона Хопкинса, Балтимор, MD
Gregory Ravizzini, Национальный институт здоровья, Национальный институт рака, Бетезда, MD
Lalitha K. Shankar, Программа визуализации рака, Национальный институт здоровья, National Cancer
Institute DCTD, Бетезда, MD
Anat Sheinfeld, Отделение медицинской науки, Ассоциация CCS, Маунтэйн Вью, CA
Caroline C. Sigman, President, CEO, Ассоциация CCS, Маунтэйн Вью, CA
Matthew R. Smith, Массачусеттский раковый центр при госпитале общего профиля, Бостон, MA
Joycelyn L. Speight, Отделение лучевой онкологии, Калифорнийский университет, Сан Франциско, CA
Vernon Steele, Национальный институт здоровья, Национальный институт рака, Бетезда, MD
Ying Tang, Отделение медицинской науки, Ассоциация CCS, Вена, VA
Clare Tempany, Отделение радиологии, Женский госпиталь Бригхэма, Гарвардская школа медицины, Бостон, MA
Richard K. Valicenti, Отделение лучевой онкологии, Калифорнийский университет, Дэвис, Сакраменто, CA
Список литературы
1. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008. CA Cancer J Clin 2008;58:71–96. [PubMed: 18287387]
2. Kundra V, Silverman PM, Matin SF, Choi H. Imaging in oncology from the University of Texas M. D. Anderson Cancer Center: diagnosis, staging, and surveillance of prostate cancer. AJR 2007;189:830–844. [PubMed: 17885053]
3. DeGrado TR, Coleman RE, Wang S, et al. Synthesis and evaluation of 18F-labeled choline as an oncologic tracer for positron emission tomography: initial findings in prostate cancer. Cancer Res 2001;61:110–117. [PubMed: 11196147]
4. Price DT, Coleman RE, Liao RP, Robertson CN, Polascik TJ, DeGrado TR. Comparison of [18F] fluorocholine and [18F]fluorodeoxyglucose for positron emission tomography of androgen dependent and androgen independent prostate cancer. J Urol 2002;168:273–280. [PubMed: 12050555]
5. Oyama N, Miller TR, Dehdashti F, et al. 11C-acetate PET imaging of prostate cancer: detection of recurrent disease at PSA relapse. J Nucl Med 2003;44:549–555. [PubMed: 12679398]
6. Picchio M, Messa C, Landoni C, et al. Value of [11C]choline-positron emission tomography for restaging prostate cancer: a comparison with [18F]fluorodeoxyglucose-positron emission tomography. J Urol 2003;169:1337–1340. [PubMed: 12629355]
7. Kwee SA, Wei H, Sesterhenn I, Yun D, Coel MN. Localization of primary prostate cancer with dualphase 18F-fluorocholine PET. J Nucl Med 2006;47:262–269. [PubMed: 16455632]
8. Albrecht S, Buchegger F, Soloviev D, et al. (11) C-acetate PET in the early evaluation of prostate cancer recurrence. Eur J Nucl Med Mol Imaging 2007;34:185–196. [PubMed: 16832632]
9. Linden RA, Halpern EJ. Advances in transrectal ultrasound imaging of the prostate. Semin Ultrasound CT MR 2007;28:249–257. [PubMed: 17874649]
10. Feleppa EJ, Alam SK, Deng CX. Emerging ultrasound technologies for early markers of disease. Dis Markers 2002;18:249–268. [PubMed: 14646040]
11. Scheidler J, Hricak H, Vigneron DB, et al. Prostate cancer: localization with three-dimensional proton MR spectroscopic imaging—clinicopathologic study. Radiology 1999;213:473–480. [PubMed: 10551229]
12. Yu YP, Landsittel D, Jing L, et al. Gene expression alterations in prostate cancer predicting tumor aggression and preceding development of malignancy. J Clin Oncol 2004;22:2790–2799. [PubMed: 15254046]
13. Kurhanewicz J, Swanson MG, Nelson SJ, Vigneron DB. Combined magnetic resonance imaging and spectroscopic imaging approach to molecular imaging of prostate cancer. J Magn Reson Imaging 2002;16:451–463. [PubMed: 12353259] 14. Hricak H, White S, Vigneron D, et al. Carcinoma of the prostate gland: MR imaging with pelvic phased-array coils versus integrated endorectal–pelvic phased-array coils. Radiology 1994;193:703– 709. [PubMed: 7972810]
15. Liu IJ, Zafar MB, Lai YH, Segall GM, Terris MK. Fluorodeoxyglucose positron emission tomography studies in diagnosis and staging of clinically organ-confined prostate cancer. Urology 2001;57:108– 111. [PubMed: 11164153] Kelloff et al. Page 19 AJR Am J Roentgenol. Author manuscript; available in PMC 2010 June 28.
16. Hofer C, Laubenbacher C, Block T, Breul J, Hartung R, Schwaiger M. Fluorine-18- fluorodeoxyglucose positron emission tomography is useless for the detection of local recurrence after radical prostatectomy. Eur Urol 1999;36:31–35. [PubMed: 10364652]
17. Turlakow A, Larson SM, Coakley F, et al. Local detection of prostate cancer by positron emission tomography with 2-fluorodeoxyglucose: comparison of filtered back projection and iterative reconstruction with segmented attenuation correction. Q J Nucl Med 2001;45:235–244. [PubMed: 11788816]
18. Oyama N, Akino H, Suzuki Y, et al. Prognostic value of 2-deoxy-2-[F-18]fluoro-D-glucose positron emission tomography imaging for patients with prostate cancer. Mol Imaging Biol 2002;4:99–104. [PubMed: 14538053]
19. Akin O, Hricak H. Imaging of prostate cancer. Radiol Clin North Am 2007;45:207–222. [PubMed: 17157630]
20. Saokar A, Braschi M, Harisinghani M. Lymphotrophic nanoparticle enhanced MR imaging (LNMRI) for lymph node imaging. Abdom Imaging 2006;31:660–667. [PubMed: 16680506]
21. Hricak H, Choyke PL, Eberhardt SC, Leibel SA, Scardino PT. Imaging prostate cancer: a multidisciplinary perspective. Radiology 2007;243:28–53. [PubMed: 17392247]
22. Fuchsjäger M, Shukla-Dave A, Akin O, Barentsz J, Hricak H. Prostate cancer imaging. Acta Radiol 2008;49:107–120. [PubMed: 18210320]
23. Pucar D, Sella T, Schoder H. The role of imaging in the detection of prostate cancer local recurrence after radiation therapy and surgery. Curr Opin Urol 2008;18:87–97. [PubMed: 18090496]
24. Shukla-Dave A, Hricak H, Scardino PT. Imaging low-risk prostate cancer. Curr Opin Urol 2008;18:78–86. [PubMed: 18090495]
25. Dall'Era MA, Cooperberg MR, Chan JM, et al. Active surveillance for early-stage prostate cancer: review of the current literature. Cancer 2008;112:1650–1659. [PubMed: 18306379]
26. Wright JL, Lange PH. Newer potential biomarkers in prostate cancer. Rev Urol 2007;9:207–213. [PubMed: 18231617]
27. Bostwick DG. Prostate-specific antigen: current role in diagnostic pathology of prostate cancer. Am J Clin Pathol 1994;102(4 suppl 1):S31–37. [PubMed: 7524305]
28. Gretzer MB, Partin AW. PSA markers in prostate cancer detection. Urol Clin North Am 2003;30:677– 686. [PubMed: 14680307]
29. Lilja H, Ulmert D, Vickers AJ. Prostate-specific antigen and prostate cancer: prediction, detection and monitoring. Nat Rev Cancer 2008;8:268–278. [PubMed: 18337732]
30. Hughes C, Murphy A, Martin C, Sheils O, O'Leary J. Molecular pathology of prostate cancer. J Clin Pathol 2005;58:673–684. [PubMed: 15976331]
31. Shukla-Dave A, Hricak H, Kattan MW, et al. The utility of magnetic resonance imaging and spectroscopy for predicting insignificant prostate cancer: an initial analysis. BJU Int 2007;99:786– 793. [PubMed: 17223922]
32. Han M, Partin AW, Zahurak M, Piantadosi S, Epstein JI, Walsh PC. Biochemical (prostate specific antigen) recurrence probability following radical prostatectomy for clinically localized prostate cancer. J Urol 2003;169:517–523. [PubMed: 12544300]
33. Rubin, MA.; Loda, M. Prostate cancer: molecular pathology and biologic determinants. In: Vogelzang, NJ.; Scardino, PT.; Shipley, WU.; Debruyne, FM., editors. Comprehensive textbook of genitourinary oncology. Philadelphia, PA: Lippincott Williams & Wilkins; 2005.
34. Hegarty NJ, Fitzpatrick JM, Richie JP, et al. Future prospects in prostate cancer. Prostate 1999;40:261–268. [PubMed: 10420155]
35. Shariat SF, Scardino PT, Lilja H. Screening for prostate cancer: an update. Can J Urol 2008;15:4363– 4374. [PubMed: 19046489]
36. Eichelberger LE, Cheng L. Does pT2b prostate carcinoma exist? Critical appraisal of the 2002 TNM classification of prostate carcinoma. Cancer 2004;100:2573–2576. [PubMed: 15197798]
37. Rajinikanth A, Manoharan M, Soloway CT, Civantos FJ, Soloway MS. Trends in Gleason score: concordance between biopsy and prostatectomy over 15 years. Urology 2008;72:177–182. [PubMed: 18279938] Kelloff et al. Page 20 AJR Am J Roentgenol. Author manuscript; available in PMC 2010 June 28.
38. Halpern EJ, Ramey JR, Strup SE, Frauscher F, McCue P, Gomella LG. Detection of prostate carcinoma with contrast-enhanced sonography using intermittent harmonic imaging. Cancer 2005;104:2373–2383. [PubMed: 16240450]
39. Balaji KC, Fair WR, Feleppa EJ, et al. Role of advanced 2 and 3-dimensional ultrasound for detecting prostate cancer. J Urol 2002;168:2422–2425. [PubMed: 12441931]
40. Zakian KL, Sircar K, Hricak H, et al. Correlation of proton MR spectroscopic imaging with Gleason score based on step-section pathologic analysis after radical prostatectomy. Radiology 2005;234:804–814. [PubMed: 15734935]
41. Weinreb, J. ACRIN 6659: MRI and MRSI of prostate cancer prior to radical prostatectomy—a prospective multi-institutional clinicopathological study. (abstr. No. SSJ05–06) Proceedings of the Radiological Society of North America (RSNA) 92nd annual scientific assembly and annual meeting; Chicago, IL. 2006.
42. Golman K, Zandt RI, Lerche M, Pehrson R, Ardenkjaer-Larsen JH. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res 2006;66:10855–10860. [PubMed: 17108122]
43. Chen AP, Albers MJ, Cunningham CH, et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T: initial experience. Magn Reson Med 2007;58:1099–1106. [PubMed: 17969006]
44. Coakley FV, Teh HS, Qayyum A, et al. Endorectal MR imaging and MR spectroscopic imaging for locally recurrent prostate cancer after external beam radiation therapy: preliminary experience. Radiology 2004;233:441–448. [PubMed: 15375223]
45. Hosseinzadeh K, Schwarz SD. Endorectal diffusion-weighted imaging in prostate cancer to differentiate malignant and benign peripheral zone tissue. J Magn Reson Imaging 2004;20:654–661. [PubMed: 15390142]
46. Shimofusa R, Fujimoto H, Akamata H, et al. Diffusion-weighted imaging of prostate cancer. J Comput Assist Tomogr 2005;29:149–153. [PubMed: 15772529]
47. Mazaheri Y, Shukla-Dave A, Hricak H, et al. Prostate cancer: identification with combined diffusionweighted MR imaging and 3D 1H MR spectroscopic imaging—correlation with pathologic findings. Radiology 2008;246:480–488. [PubMed: 18227542]
48. Kim CK, Park BK, Kim B. Localization of prostate cancer using 3T MRI: comparison of T2-weighted and dynamic contrast-enhanced imaging. J Comput Assist Tomogr 2006;30:7–11. [PubMed: 16365565]
49. Bloch BN, Furman-Haran E, Helbich TH, et al. Prostate cancer: accurate determination of extracapsular extension with high-spatial-resolution dynamic contrast-enhanced and T2-weighted MR imaging—initial results. Radiology 2007;245:176–185. [PubMed: 17717328]
50. Shreve PD, Grossman HB, Gross MD, Wahl RL. Metastatic prostate cancer: initial findings of PET with 2-deoxy-2-[F-18]fluoro-D-glucose. Radiology 1996;199:751–756. [PubMed: 8638000]
51. Swanson GP, Thompson IM, Basler J. Current status of lymph node-positive prostate cancer: incidence and predictors of outcome. Cancer 2006;107:439–450. [PubMed: 16795064]
52. Kurhanewicz J, Vigneron D, Carroll P, Coakley F. Multiparametric magnetic resonance imaging in prostate cancer: present and future. Curr Opin Urol 2008;18:71–77. [PubMed: 18090494]
53. Zhou, H.; Resnick, MI. Molecular image validation utilizing the correlation of histopathology and marker placement system (CHAMPS) protocol. (abstr) Proceedings of the American Society for Therapeutic Radiology and Oncology (ASTRO) 48th annual meeting; Philadelphia, PA. 2006. p. A2269
54. Tokuda J, Fischer GS, Csoma C, et al. Software strategy for robotic transperineal prostate therapy in closed-bore MRI. Med Image Comput Comput Assist Interv Int Conf Med Image Comput Comput Assist Interv 2008;11(Pt 2):701–709.
55. Barnes AS, Haker SJ, Mulkern RV, So M, D'Amico AV, Tempany CM. Magnetic resonance spectroscopy-guided transperineal prostate biopsy and brachytherapy for recurrent prostate cancer. Urology 2005;66:1319. [PubMed: 16360468]
56. Alonzi R, Padhani AR, Allen C. Dynamic contrast enhanced MRI in prostate cancer. Eur J Radiol 2007;63:335–350. [PubMed: 17689907] Kelloff et al. Page 21 AJR Am J Roentgenol. Author manuscript; available in PMC 2010 June 28.
57. Mulkern RV, Barnes AS, Haker SJ, et al. Biexponential characterization of prostate tissue water diffusion decay curves over an extended b-factor range. Magn Reson Imaging 2006;24:563–568. [PubMed: 16735177]
58. Larson SM, Schoder H. Advances in positron emission tomography applications for urologic cancers. Curr Opin Urol 2008;18:65–70. [PubMed: 18090493]
59. Saksena MA, Saokar A, Harisinghani MG. Lymphotropic nanoparticle enhanced MR imaging (LNMRI) technique for lymph node imaging. Eur J Radiol 2006;58:367–374. [PubMed: 16472955]
60. Muntener M, Patriciu A, Petrisor D, et al. Transperineal prostate intervention: robot for fully automated MR imaging—system description and proof of principle in a canine model. Radiology 2008;247:543–549. [PubMed: 18430882]
61. Barqawi AB, Crawford ED. Emerging role of HIFU as a noninvasive ablative method to treat localized prostate cancer. Oncology (Williston Park) 2008;22:123–129. [PubMed: 18409659]
62. Partin AW, Pound CR, Clemens JQ, Epstein JI, Walsh PC. Serum PSA after anatomic radical prostatectomy: the Johns Hopkins experience after 10 years. Urol Clin North Am 1993;20:713–725. [PubMed: 7505980]
63. Khan MA, Han M, Partin AW, Epstein JI, Walsh PC. Long-term cancer control of radical prostatectomy in men younger than 50 years of age: update 2003. Urology 2003;62:86–91. [PubMed: 12837428]
64. Djavan B, Moul JW, Zlotta A, Remzi M, Ravery V. PSA progression following radical prostatectomy and radiation therapy: new standards in the new millennium. Eur Urol 2003;43:12–27. [PubMed: 12507539]
65. Ward JF, Blute ML, Slezak J, Bergstralh EJ, Zincke H. The long-term clinical impact of biochemical recurrence of prostate cancer 5 or more years after radical prostatectomy. J Urol 2003;170:1872– 1876. [PubMed: 14532796]
66. Pound CR, Partin AW, Eisenberger MA, Chan DW, Pearson JD, Walsh PC. Natural history of progression after PSA elevation following radical prostatectomy. JAMA 1999;281:1591–1597. [PubMed: 10235151]
67. Kattan MW, Wheeler TM, Scardino PT. Postoperative nomogram for disease recurrence after radical prostatectomy for prostate cancer. J Clin Oncol 1999;17:1499–1507. [PubMed: 10334537]
68. Amling CL, Bergstralh EJ, Blute ML, Slezak JM, Zincke H. Defining prostate specific antigen progression after radical prostatectomy: what is the most appropriate cut point? J Urol 2001;165:1146–1151. [PubMed: 11257657]
69. Stephenson AJ, Scardino PT, Eastham JA, et al. Preoperative nomogram predicting the 10-year probability of prostate cancer recurrence after radical prostatectomy. J Natl Cancer Inst 2006;98:715– 717. [PubMed: 16705126]
70. Oh J, Colberg JW, Ornstein DK, et al. Current followup strategies after radical prostatectomy: a survey of American Urological Association urologists. J Urol 1999;161:520–523. [PubMed: 9915439]
71. Leibman BD, Dillioglugil O, Wheeler TM, Scardino PT. Distant metastasis after radical prostatectomy in patients without an elevated serum prostate-specific antigen level. Cancer 1995;76:2530–2534. [PubMed: 8625081]
72. Hanlon AL, Moore DF, Hanks GE. Modeling postradiation prostate specific antigen level kinetics: predictors of rising postnadir slope suggest cure in men who remain biochemically free of prostate carcinoma. Cancer 1998;83:130–134. [PubMed: 9655302]
73. Horwitz EM, Thames HD, Kuban DA, et al. Definitions of biochemical failure that best predict clinical failure in patients with prostate cancer treated with external beam radiation alone: a multi-institutional pooled analysis. J Urol 2005;173:797–802. [PubMed: 15711272]
74. D'Amico AV, Moul JW, Carroll PR, Sun L, Lubeck D, Chen MH. Surrogate end point for prostate cancer-specific mortality after radical prostatectomy or radiation therapy. J Natl Cancer Inst 2003;95:1376–1383. [PubMed: 13130113]
75. Schoder H, Herrmann K, Gonen M, et al. 2-[18F] fluoro-2-deoxyglucose positron emission tomography for the detection of disease in patients with prostate-specific antigen relapse after radical prostatectomy. Clin Cancer Res 2005;11:4761–4769. [PubMed: 16000572] Kelloff et al. Page 22 AJR Am J Roentgenol. Author manuscript; available in PMC 2010 June 28.
76. Wachter S, Tomek S, Kurtaran A, et al. 11C-acetate positron emission tomography imaging and image fusion with computed tomography and magnetic resonance imaging in patients with recurrent prostate cancer. J Clin Oncol 2006;24:2513–2519. [PubMed: 16636343]
77. Schuster DM, Votaw JR, Nieh PT, et al. Initial experience with the radiotracer anti-1-amino-3-18Ffluorocyclobutane- 1-carboxylic acid with PET/CT in prostate carcinoma. J Nucl Med 2007;48:56– 63. [PubMed: 17204699]
78. Thomas CT, Bradshaw PT, Pollock BH, et al. Indium-111-capromab pendetide radioimmunoscintigraphy and prognosis for durable biochemical response to salvage radiation therapy in men after failed prostatectomy. J Clin Oncol 2003;21:1715–1721. [PubMed: 12721246]
79. Mease RC, Dusich CL, Foss CA, et al. N-[N-[(S)-1,3-dicarboxypropyl]carbamoyl]-4-[18F] fluorobenzyl-L-cysteine, [18F]DCFBC: a new imaging probe for prostate cancer. Clin Cancer Res 2008;14:3036–3043. [PubMed: 18483369]
80. Banerjee SR, Foss CA, Castanares M, et al. Synthesis and evaluation of technetium-99m- and rhenium-labeled inhibitors of the prostate-specific membrane antigen (PSMA). J Med Chem 2008;51:4504–4517. [PubMed: 18637669]
81. Chen Y, Foss CA, Byun Y, et al. Radiohalogenated prostate-specific membrane antigen (PSMA)- based ureas as imaging agents for prostate cancer. J Med Chem 2008;51:7933–7943. [PubMed: 19053825]
82. Molecular Insight Pharmaceuticals Website. Molecular Insight presents three studies on Trofex program for prostate cancer diagnosis and staging. [June 18, 2008]. www.molecularinsight.com/pressreleases/20080618_2.aspx
83. Lee Z, Sodee DB, Resnick M, Maclennan GT. Multimodal and three-dimensional imaging of prostate cancer. Comput Med Imaging Graph 2005;29:477–486. [PubMed: 15893911]
84. Even-Sapir E, Metser U, Mishani E, Lievshitz G, Lerman H, Leibovitch I. The detection of bone metastases in patients with high-risk prostate cancer: 99mTc-MDP planar bone scintigraphy, singleand multi-field-of-view SPECT, 18F-fluoride PET, and 18F-fluoride PET/CT. J Nucl Med 2006;47:287–297. [PubMed: 16455635]
85. Schirrmeister H, Guhlmann A, Elsner K, et al. Sensitivity in detecting osseous lesions depends on anatomic localization: planar bone scintigraphy versus 18F PET. J Nucl Med 1999;40:1623–1629. [PubMed: 10520701]
86. Westphalen AC, McKenna DA, Kurhanewicz J, Coakley F. Role of magnetic resonance imaging and magnetic resonance spectroscopic imaging before and after radiotherapy for prostate cancer. J Endourol 2008;22:789–794. [PubMed: 18366322]
87. Haider MA, Chung P, Sweet J, et al. Dynamic contrast-enhanced magnetic resonance imaging for localization of recurrent prostate cancer after external beam radiotherapy. Int J Radiat Oncol Biol Phys 2008;70:425–430. [PubMed: 17881141]
88. Harisinghani MG, Barentsz J, Hahn PF, et al. Noninvasive detection of clinically occult lymph-node metastases in prostate cancer. N Engl J Med 2003;348:2491–2499. [PubMed: 12815134]
89. Freedland SJ, Moul JW. Prostate-specific antigen recurrence after definitive therapy. J Urol 2007;177:1985–1991. [PubMed: 17509277]
90. Loberg RD, Fielhauer JR, Pienta BA, et al. Prostate-specific antigen doubling time and survival in patients with advanced metastatic prostate cancer. Urology 2003;62(suppl 1):128–133. [PubMed: 14747050]
91. D'Amico A. Global update on defining and treating high-risk localized prostate cancer with leuprorelin: a USA perspective—identifying men at diagnosis who are at high risk of prostate cancer death after surgery or radiation therapy. BJU Int 2007;99(suppl 1):13–16. discussion 17–18. [PubMed: 17229162]
92. Ye XC, Choueiri M, Tu SM, Lin SH. Biology and clinical management of prostate cancer bone metastasis. Front Biosci 2007;12:3273–3286. [PubMed: 17485298]
93. Dehdashti F, Picus J, Michalski JM, et al. Positron tomographic assessment of androgen receptors in prostatic carcinoma. Eur J Nucl Med Mol Imaging 2005;32:344–350. [PubMed: 15726353]
94. Oyama N, Akino H, Suzuki Y, et al. FDG PET for evaluating the change of glucose metabolism in prostate cancer after androgen ablation. Nucl Med Commun 2001;22:963–969. [PubMed: 11505204] Kelloff et al. Page 23 AJR Am J Roentgenol. Author manuscript; available in PMC 2010 June 28.
95. Oyama N, Kim J, Jones LA, et al. MicroPET assessment of androgenic control of glucose and acetate uptake in the rat prostate and a prostate cancer tumor model. Nucl Med Biol 2002;29:783–790. [PubMed: 12453586]
96. Schoder H, Larson SM. Positron emission tomography for prostate, bladder, and renal cancer. Semin Nucl Med 2004;34:274–292. [PubMed: 15493005]
97. Valicenti RK, Sweet JW, Hauck WW, et al. Variation of clinical target volume definition in threedimensional conformal radiation therapy for prostate cancer. Int J Radiat Oncol Biol Phys 1999;44:931–935. [PubMed: 10386652]
98. Lee KC, Sud S, Meyer CR, et al. An imaging biomarker of early treatment response in prostate cancer that has metastasized to the bone. Cancer Res 2007;67:3524–3528. [PubMed: 17440058]
99. Lee KC, Bradley DA, Hussain M, et al. A feasibility study evaluating the functional diffusion map as a predictive imaging biomarker for detection of treatment response in a patient with metastatic prostate cancer to the bone. Neoplasia 2007;9:1003–1011. [PubMed: 18084607]
100. Toegel S, Hoffmann O, Wadsak W, et al. Uptake of bone-seekers is solely associated with mineralization: a study with 99mTc-MDP, 153Sm-EDT-MP and 18F-fluoride on osteoblasts. Eur J Nucl Med Mol Imaging 2006;33:491–494. [PubMed: 16416330]
101. Cooperberg MR, Grossfeld GD, Lubeck DP, Carroll PR. National practice patterns and time trends in androgen ablation for localized prostate cancer. J Natl Cancer Inst 2003;95:981–989. [PubMed: 12837834]
102. Cooperberg MR, Lubeck DP, Grossfeld GD, Mehta SS, Carroll PR. Contemporary trends in imaging test utilization for prostate cancer staging: data from the cancer of the prostate strategic urologic research endeavor. J Urol 2002;168:491–495. [PubMed: 12131295]
Примечание —1 HIFU – высокоинтенсивный сфокусированнй ультразвук
КТ – компьютерная томография
МДФ – метилен дифосфонат
МРТ – магнитно-резонансная томография
ПЭТ – позитронно-эмисионная томография
УЗ-спектроскопия – ультразвуковая спектроскопия
ФДГТ – 18F-фтордигидротестостерон
Анти-18F-ФАЦБК – анти- 1-амино-3-18-F-фторциклобутан-1-карбоксиловая кислота), FLT – 18F-3-фтор-3-деокси-L-тимидин 8F-NAF = 18F фторид натрия
МДФ = метилена дифосфонат
Ktrans = константа перехода объема
ФДГ ПЭТ = 18фтор-2-деоксиглюкоза ПЭТ
FLT = 18F-3′-фтор-3′-деокси-L-тимидин
ФДГД - 18Fфтордигидротестостерон






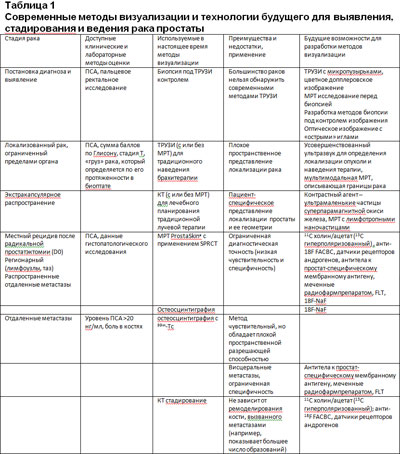
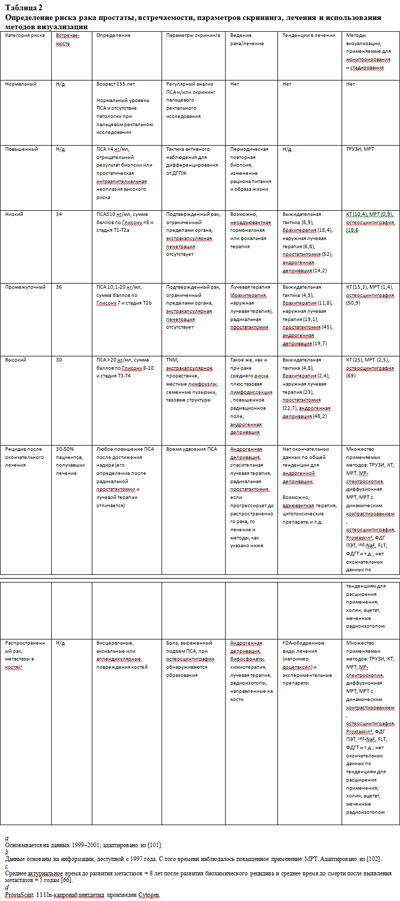
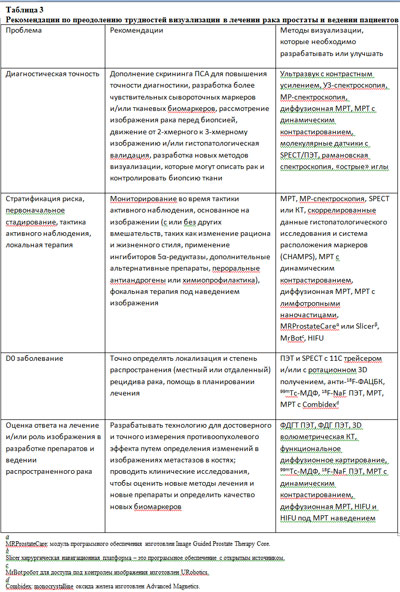
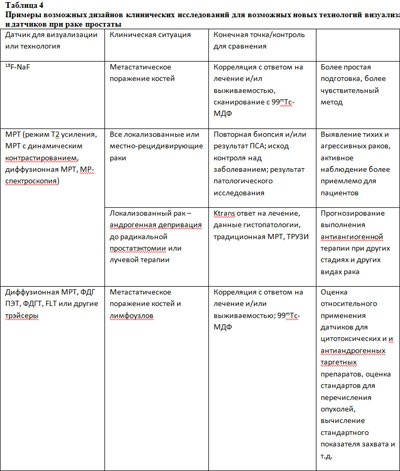

Комментарии