Jaspreet Singh
Edouard J Trabulsi
Leonard G Gomella
Department of Urology Kimmel Cancer Center Thomas Jefferson University Philadelphia, PA, USA
Correspondence: Leonard Gomella
Department of Urology, Thomas Jefferson University, Philadelphia, PA 1025 Walnut Street, Suite 1112 Philadelphia, PA 19107, USA
Тезис: широко распространенный скрининг простат-специфического антигена (ПСА) привел к значительному повышению выявления клинически локализованного рака простаты на ранней стадии. В этой обзорной статье обсуждаются различные подходы к его ведению, включая тактику активного наблюдения, радикальную простатэктомию, лучевую терапию и криотерапию. Отсутствие большого количества данных с высоким уровнем доказательности вызывает значительные противоречия при выборе оптимального типа вмешательства, как у лечащего врача, так и у пациента. Это еще больше осложняется длительным временем до событий после лечения рака простаты, в сочетании с продолжающимся усовершенствованием подходов.
В связи с отсутствием рандомизированных исследований, в которых бы сравнивались различные варианты лечения, в данной статье предпринимается попытка суммировать различные подходы к ведению рака и связанные с ними побочные эффекты, включая влияние на качество жизни, связанное со здоровьем, с учетом опубликованных в настоящее время данных.
Введение
Одной из главных проблем при ведении пациента с новодиагностированным раком простаты является решение в пользу одного из многих доступных вариантов лечения. Часто пациенты с выявленным раком простаты ищут помощь в принятии решения у своего лечащего врача. Фактически, кроме поощрения участия в клинических исследованиях, тяжело определить оптимальный путь лечения локализованного рака простаты. В настоящее время подходы к нему противоречивы. Эти противоречия освещены в недавнем опросе специалистов по «оптимальному» подходу к ведению гипотетического пациента с локализованным раком простаты: приблизительно 29% склоняются к выжидательной тактике и тактике активного наблюдения, 33% - к лучевой терапии и 39% выбирают радикальную простатэктомию (1). Отсутствие консенсуса среди экспертов подчеркивает, как важно для мужчины с диагностированным раком простаты принять информированное решение по лечению путем объективной дискуссии о рисках и пользе каждого из подходов. Наиболее часто на урологе, который поставил диагноз, при планировании лечения лежит задача обсудить с пациентом как выбор вмешательства, так и проблемы, касающиеся качества жизни и ее продолжительности. Каждый подход к лечению имеет уникальный профиль побочных эффектов, а также различные показатели онкологического контроля. Длительное развитие исходов после лечения рака простаты в сочетании с продолжающимися усовершенствованиями в методах лечения еще более усложняют эту задачу.В этой статье будут обсуждаться хирургические и нехирургические варианты лечения, применяемые при новодиагностированном раке простаты, а также будут освещены усовершенствования в каждой из областей. Для пациентов с раком низкого объема и низкой степени злокачественности, то есть характеристиками, обычно связанными с минимальным риском прогрессии, существуют значительные противоречия относительно метода лечения, включая вопрос – а нужно ли вообще лечить? Поиск правильного ответа в вопросах лечения рака простаты высокого риска также затруднителен. Тем не менее, хотя одномодальное лечение с применением радикальной простатэктомии или наружная лучевая терапия для некоторых пациентов может быть подходящим, имеются данные рандомизированных исследований, предполагающие применение мульмодального подхода при лечении более агрессивного рака высокого риска.
Стратификация риска
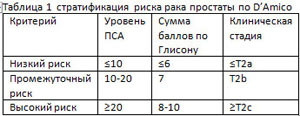
D’Amico and colleagues разработали концепцию стратификации риска, которая позволяет с помощью комбинации клинических данных (уровень простат-специфического антигена, сумма баллов по Глисону и клиническая стадия (см. Таблицу 1) (2) классифицировать мужчин в долечебные группы в соответствии с риском – низкий, промежуточный и высокий. Изначально классификация была разработана для установления риска биохимической прогрессии после лечения локализованного рака простаты, и она стала важным компонентом в рекомендациях по лечению.
Другие методы, такие как таблицы Partin или номограммы Kattan могут помочь определиться с терапией, так как они позволяют определить вероятность того, ограничен ли рак пределами органа или он прорастает за пределы простаты (3). В современную эру мульмодальной терапии эти данные могут помочь в выборе лечения, а также создают реальную картину относительно вероятности успешности монотерапии или же того, что необходим комбинированный подход. В определении агрессивности рака простаты и в рекомендации по наилучшему методу лечения могут помочь и дополнительные специфические данные пациента. Например, подъем уровня ПСА на 2,0 нг/мл в год до проведения радикальной простатэктомии был прогностическим фактором показателя 7-летней смертности от рака простаты, равного 15%. Ни один из пациентов с подъемом уровня ПСА на 2,0 нг/мл/год не умер от рака простаты до операции. Этот подъем позволяет выявить пациентов с агрессивным и потенциально жизнеугрожающим раком простаты (6). Плотность ПСА 0,15 нг/ил/см3 была прогностическим фактором того, что после тактики активного наблюдения понадобится активное лечение (5). Эти исследования позволяют предположить, что клинические данные, включая кинетику уровня ПСА, могут выявить пациентов, имеющих повышенный риск прогрессии заболевания и могут играть потенциальную роль в консультировании пациентов относительно специфического вида лечения.
Выжидательная тактика и тактика активного наблюдения
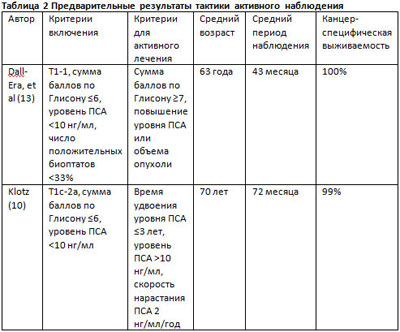
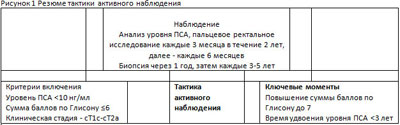
В ведении локализованного, бессимптомного рака простаты растет популярность подходов, не связанных с лечением: выжидательная тактика и тактика активного наблюдения. Хотя у них есть сходства, они во многом отличаются. В настоящее время при выжидательной тактике лечение пациента начинается либо при развитии метастазов, либо при симптоматическом прогрессировании. Данный подход обычно ограничивается бессимптомными пациентами с невысокой ожидаемой продолжительностью жизни, часто с раком высокой степени злокачественности. Цель современных протоколов тактики активного наблюдения – радикальное лечение тех раков простаты, которые агрессивно развиваются во время периода наблюдения, но в то же время могут быть излечены при проведении операции или лучевой терапии. Хотя в настоящее время не достигнут консенсуса, тактика активного наблюдения в основном включает в себя периодическое клиническое обследование, анализ уровня ПСА и повторную биопсию. Сторонники данного подхода в США ссылаются на перелечивание рака простаты. Существует выраженное несоответствие между числом пациентов, у которых диагностирован рак простаты и числом мужчин, которые умирают от него. Пожизненный риск диагностики рака простаты равен 16%, но только 3% равен риск смерти от него (6). Данные аутопсии показывают, что, несмотря на присутствие рака простаты у одной трети мужчин в возрасте старше 60 лет и до 50% мужчин в возрасте свыше 70 лет, мужчины в США чаще умирают от сопутствующих заболеваний (7). Также улучшаются и знания биологического поведения рака простаты низкого риска. Parker, et al установил, что 15-летняя смертность, связанная с раком простаты при консервативном лечении опухоли, выявленной при скрининге, составляет 0-2% при сумме баллов по Глисону, равной 7 (8). Данные недавно завершившегося Европейского рандомизированного исследования по скринингу рака простаты показывают, что время до конечной точки, связанное со скринингом ПСА, составило 10,3 лет, а показатель гипердиагностики – 54% (9). Эти исследования показали необходимость в выявлении более четких факторов для дифференцирования клинически незначимого рака от рака, способного прогрессировать и привести к летальному исходу. Одной из проблем протокола тактики активного наблюдения является проблема недостаточного забора ткани и неадекватное картирование объема имеющегося рака. Исследование тактики активного наблюдения в MD Anderson Cancer Center показало очень низкое перестадирование после выполнения простатэктомии, а также то, что во всех образцах рак был ограничен пределами органа. Переходная зона была поражена в 29% унифокальных и 71% мультифокальных опухолей (10). Поэтому при включении пациента в данный протокол обычно рекомендуется выполнение повторной биопсии. Несмотря на эти данные, van den Bergh et al показали, что отсрочка вмешательства на срок до 2 лет не приводит к ухудшению патологических характеристик опухоли по сравнению с пациентами, которым сразу была выполнена радикальная простатэктомия (11). Только у малого процента пациентов, включенных в протокол активного наблюдения, появляются признаки прогрессии рака, с установленным риском развития метастазов 0,1% в течение 2-8 лет наблюдения (11, 12, 13). Также, пациенты с характеристиками рака низкого риска (уровень ПСА <10 нг/мл, клиническая стадия Т1-Т2а, сумма баллов по Глисону ≤6), которые выбирают тактику активного наблюдения, имеют установленную 8-летнюю канцер-специфическую смертность, равную 1% (14) (см. Таблицу 2)
При подтверждении прогрессии во время активного наблюдения может быть предложено раннее вмешательство. Как отмечалось, кажется, что отсроченное вмешательство незначительно ухудшает исход лечения по сравнению с ранним. Несколько других исследований также показали, что у пациентов с раком простаты низкого риска, у которых простатэктомия была отсрочена в среднем на 6 и 22 месяца, не повышаются показатели неблагоприятных патологических характеристик, также как и не снижается возможность радикального излечения (15, 16).
Пациентам необходимо рассказывать о том, что тактика активного наблюдения, как указано в названии, - это активный подход к ведению рака и заверить их, что при выявлении во время наблюдения каких-либо признаков биохимической или патологической прогрессии опухоли, можно сразу же безопасно приступить к активному лечению с минимальным увеличением риска. Тактика активного наблюдения позволяет осуществлять близкое наблюдение за раком и проводить радикальное вмешательство при первых признаках прогрессии.
Epstein and associates были предложены допустимые критерии подходящих кандидатов для тактики активного наблюдения. На основании опыта радикальной простатэктомии в Хопкинсе оценивались дооперационные параметры, которые были прогностическими факторами наличия рака низкого риска, с благоприятными характеристиками.
Плотность ПСА, 0,15 нг/мл, клиническая стадия Т2а и ниже и отсутствие степени злокачественности по Глисону 4 или 5 имеют при благоприятном раке прогностическую точность, равную 73% (17). Стратегия тактики активного наблюдения подходит для пациентов с ожидаемой продолжительностью жизни менее 10 лет и для здоровых мужчин возрастом 65 лет и старше с раком небольшого объема и низкой степени злокачественности, как было отмечено Epstein (18). Это подход позволяет избежать потенциальных осложнений, связанных с радикальным лечением. С точки зрения качества жизни, возможные неблагоприятные эффекты тактики активного наблюдения включают повышенную нервозность и комплаентность пациента, связанную с повторными биопсиями простаты. Хотя и редко среди правильно отобранных пациентов, но все же остается проблемой клиническая прогрессия и потеря возможности проведения радикального излечения. Включение пациентов в протокол тактики активного наблюдения, последующее наблюдение и показания для активного лечения суммированы в Рисунке 1.
Радикальная простатэктомия
Одним из очевидных преимуществ радикальной простатэктомии над другими видами лечения является точное патологическое стадирование. Как отмечалось, игольчатая биопсия простаты не всегда точна и поэтому решение о нехирургических методах лечения часто основывается на номограммах Partin и Kattan. Иногда эти номограммы могут недостадировать распространение рака простаты. Например, экстракапсулярное прорастание обнаруживается у 15% пациентов, у которых рак простаты рассматривался как ограниченный пределами органа. В дополнение, примерно у трети пациентов, которым выполняется простатэктомия, при патологическом исследовании будет повышена сумма баллов по Глисону (повышение Глисона 3 при постановке диагноза до Глисона 4 или 5) (19). После радикальной простатэктомии уролог имея четкие данные патологического исследования, может определить, был ли резецированный рак локальным или нет. Также врач может заверить пациента, что его 10-летняя канцер-специфическая выживаемость составляет более 90% (20).
Что касается вопросов качества жизни, то радикальная простатэктомия дает дополнительное преимущество в недвусмысленной интерпретации послеоперационного уровня ПСА, так что, полагаясь на неопределяемый уровень ПСА (стандартный показатель ПСА 0,2 нг/мл), пациента часто можно обоснованно заверить, что рак был удален полностью. Если при патологическом исследовании после радикальной простатэктомии стадия рака повышается до Т3 или Т4, пациента со временем можно консультировать относительно адъювантной лучевой терапии, которая, как показано, снижает риск метастазирования и повышает общую выживаемость (21, 22). В дополнение, при не достижении неопределяемого уровня ПСА или рецидиве ПСА после радикальной простатэктомии возможно проведение спасительной или адъювантной лучевой терапии.
Boorjian et al показали, что адъювантная лучевая терапия была связана со значительным улучшением 10-летней выживаемости, свободной от биохимического рецидива, и со снижением необходимости в поздней гормональной терапии (23). Также, у пациентов, которые получали спасительную лучевую терапию, был снижен риск местного рецидивирования, была отсрочена системная прогрессия и время начала гормональной терапии. Опять же, есть недостаток клинических исследований, сравнивающих радикальное и другие виды лечения. Группа онкохирургов Американского колледжа пыталась провести исследование, в котором мужичин с раком простаты низкого риска рандомизировали в группу брахитерапии и радикальной простатэктомии. Но в связи с очень плохой обработкой исследование не было завершено (24). Одно проспективное рандомизированное исследование показало отчетливое преимущество в выживаемости радикальной простатэктомии над выжидательной тактикой. Через 12 лет, 12,5% пациентов в группе хирургии и 17,9% в группе наблюдения умерли от рака простаты, а у 19,3% мужчин в 1 группе и 26% во второй группе были диагностированы отдаленные метастазы (25). В ретроспективном анализе когорты сравнивали показатели онкологического излечения после радикальной простатэктомии, наружной лучевой терапии и брахитерапии при раке простаты низкого риска. Наблюдение сроком до 8 лет после лечения показало значительное преимущество в выживаемости без биохимической прогрессии радикальной простатэктомии над наружной лучевой терапией (88% и 78%). Тем не менее, исследование критиковалось, потому что пациенты в группе лучевой терапией получали среднюю дозу облучения, равную 70 Гр, которая в настоящее время считается низкой, так как показано, что эскалация дозы выше этого уровня улучшает выживаемость, свободную от биохимической прогрессии (26). Вне зависимости от этого, долгосрочные результаты после радикальной простатэктомии рассматриваются большинством как золотой стандарт лечения локализованного рака простаты. Недавнее мультицентровое показало, что 15-летняя канцер-специфическая смертность при раке простаты после радикальной простатэктомии составила 12% (27). Результаты этого исследования помогли построить номограмму, которая прогнозирует, что только 4% пациентов в современную эру ПСА имеют прогнозируемую канцер-специфическую смертность более 5%. Авторы сделали заключение, что немногие пациенты умрут от рака простаты в течение 15 лет после радикальной простатэктомии, даже при неблагоприятных клинических характеристиках (28).
О прекрасных исходах после радикальной простатэктомии сообщалось также и у пожилых пациентов. У пациентов >70 лет, показатели 10-летней канцер-специфической выживаемость при раке простаты низкого, промежуточного и высокого риска составили 99,5%, 97,5% и 94%, соответственно (28). Послеоперационные осложнения у мужчин в возрасте 70-74 лет по частоте возникновения были сравнимы с таковыми у молодой когорты мужчин 65-69 лет. Частота осложнений была лишь немного выше у пациентов 75 лет и старше. Исходы радикальной простатэктомии намного сильнее связаны с сопутствующими заболеваниями до операции, чем с одним только возрастом (29). Ожидаемая продолжительность жизни является наиболее часто используемой отметкой для выполнения простатэктомии как метода окончательного лечения пациентов с локализованным раком простаты (30). После введения более 10 лет назад лапароскопической радикальной простатэктомии она бросила вызов стандартным позадилонным и промежностным операциям. Лапароскопический доступ критикуется в связи с длинной кривой обучения и большим временем операции, из-за чего эту технически сложную операцию хорошо выполняют только в ограниченном числе центров. Робот-ассистированные технологии позволили перейти от лапароскопического доступа к роботической радикальной простатэктомии (31). Прошло 9 лет с момента ее одобрения FDA, и 63% больниц Tier I имеют собственного робота да Винчи и в прошлом году робот-аасистированные операции составили 81% всех простатэктомий в США (32). Имеется несколько потенциальных преимуществ этого подхода. Они связаны с меньшим объемом кровопотери и более коротким сроком госпитализации. Также, срок восстановления при роботической операции короче, чем при лапароскопической, в то же время при них достигаются одинаковые онкологические результаты (33). Хотя пока не доступны долгосрочные онкологические данные для роботических операций, опубликованы многочисленные серии, оценивающие частоту положительных хирургических краев, как независимый прогностический фактор биохимического рецидива. В обзоре сравнения методом matched-pair анализа открытой и роботической простатэктомии не было выявлено достоверных различий по этому показателю, и промежуточная выживаемость, свободная от биохимической прогрессии, также достоверно не отличалась (34). В противоположность этим результатам в кумулятивном анализе шести сравнительных исследований, в которых сообщались данные по краям, Ficarra et al показали статистически значимое различие в пользу робот-ассистированного подхода при сравнении с открытой операцией (20). В недавнем мультицентровом анализе, опубликованном в JAMA, проводили обзор около 2000 мужчин, которым проводились малоинвазивные операции за период с 2003 по 2007 год (35). Эти результаты сравнивали с данными приблизительно 6900 мужчин, которым проводилась стандартная открытая радикальная простатэктомия. В минимально инвазивной группе выявили более короткий срок госпитализации и меньшее число осложнений в раннем послеоперационном периоде. Тем не менее, через 18 месяцев после операции, в этой группе отмечали большую частоту недержания мочи и эректильной дисфункции по сравнению с группой открытых операций. При коррекции характеристик пациентов и опухоли, мужчинам в обеих группах в схожем проценте случаев требовалась адъювантная терапия. Для валидации улучшения результатов минимально инвазивной хирургии рака простаты понадобятся дополнительные долгосрочные исследования.
Kaouk et al также описали применение однопортовой лапароскопической хирургии для выполнения радикальной простатэктомии. Эта техника выполняется через один пупочный разрез, а все используемые инструменты проводят через один порт. Это пример недавнего сдвига в хирургии до еще более мало инвазивных подходов (36). Наконец, следует обратить внимание вопросу об изменении ведения лимфопозитивного рака простаты, диагноз которого устанавливается до радикальной простатэктомии. Хотя классическое учение гласит, что операцию не следует выполнять при наличии опухолевого поражения лимфоузлов, недавние данные, включающие проспективные клинические исследования и ретроспективные анализы, позволяют предположить, что это больше не может рассматриваться как правильная тактика (37, 38). Фактически, общая выживаемость может быть улучшена путем удаления и простаты, и лимфатических узлов, с последующим началом срочной гормональной терапии (38). Данные Messing et al также позволяют предположить, что субпопуляция мужчин с позитивными лимфоузлами может иметь долгосрочную выживаемость без заболевания и без применения дополнительной гормональной терапии (37).
В заключение, для того, чтобы полноценно проконсультировать больного относительно выбора метода хирургического лечения с учетом осложнений, онкологических и функциональных исходов, требуется проведение крупных рандомизированных контролируемых исследований, сравнивающих открытую/лапароскопическую/роботическую простатэктомию, однако в настоящее время такие исследования не планируются. Одним из факторов, который, как было показано, улучшает и контроль рака, и функциональные результаты после радикальной простатэктомии, вне зависимости от техники, является опыт хирурга (39).
Лучевая терапия
Область лучевой онкологии в лечении локализованного рака простаты постоянно переоценивается с целью оптимизации подведения облучения и контроля над опухолью, а также и для минимизации повреждения окружающих нормальных тканей. Разработка новых видов таргетной лучевой терапии в форме трехмерной конформальной и модулированной по интенсивности лучевой терапии, а также использование техник под наведением изображения, таких как фидуциальные маркеры, теоретически снижают частоту побочных эффектов наружной лучевой терапии (40). В то же время, другие нововведения в этой области позволяют применять более высокие дозы облучения для рака, ограниченного пределами органа, и использовать андрогенную депривацию совместно с лучевой терапией для рака более высокого риска.
Данные ретроспективного анализа позволяют предположить, что отмеченные технические усовершенствования отразятся снижением показателей местного рецидива и развития отдаленных метастазов, также как и увеличением общей выживаемости. Примером этих данных может быть анализ 1465 мужчин, участвовавших в 4 рандомизированных исследованиях, проводимых Radiation Therapy Oncology Group (RTOG). Доза облучения > 66 Гр была связана со снижением относительного риска смерти от рака простаты на 29%, по сравнению с более низкими дозами (41). Ясно, что для лечения и адекватного контроля рака простаты промежуточного и высокого риска необходимы более высокие дозы лучевой терапии. В рандомизированных исследованиях сравнивали низкие дозы с высокими, и преимущество в биохимическом контроле, выраженном в виде контроля ПСА, было выявлено в группах с высокими дозами (42, 43). Множественные исследования показывают, что для окончательной терапии рака простаты необходимы дозы 78-80 Гр, т.е. наблюдается сильное повышение дозы с 70-74 Гр, которая раньше была стандартной (43, 44). С разработкой методов более точного подведения лучевой терапии рассматриваются даже большие дозы облучения. RTOG 0126, крупное рандомизированное исследование экскалации дозы, в котором изучали дозу облучения, превышающую 81 Гр, недавно было полностью обработано (45). Так как показано, что повышение дозы лучевой терапии дает преимущество в выживаемости, имеются надежды, что дальнейшая эскалация может помочь пациентам с локализованным раком высокого риска. Хотя с помощью современных методов допустимо назначать дозы, превышающие 81 Гр, дает ли дополнительную пользу мужчинам с раком простаты низкого риска дозы свыше 78 Гр, остается противоречивым.
Использование лучевой терапии в сочетании с андрогенной депривацией у пациентов с раком простаты хорошо поддерживается множественными рандомизированными исследованиями (46, 47). Тем не менее, несколько вопросов остаются без ответа, включая оптимальную последовательность и продолжительность андрогенной депривации. В RTOG 8610 471 пациент был рандомизирован в группу одной лучевой терапии и группу комбинации с золадексом в сочетании с флутамидом. Андрогенную депривацию назначали за 2 месяца до и на 2 месяца во время лучевой терапии. При среднем периоде наблюдения 12,5 лет андрогенная депривация приводила к значительному снижению показателей канцер-специфической смертности, развития отдаленных метастазов и биохимического рецидива (23% и 36%, 35% и 47% и 65% и 80% с и без андрогенной депривации, соответственно), и, в то же время, к повышению канцер-специфической выживаемости (11% и 3%) (48). D’Amico et al сообщали о преимуществе в выживаемости при неоадъювантной андрогенной депривации в течение 6 месяцев у пациентов с раком простаты промежуточного риска (47). Основной конечной точкой исследования была общая выживаемость и время до уровня ПСА >1,0 нг/мл и повышения его на 0,2 нг/мл во время двух последовательных измерений. Пациенты, которые были рандомизированы на получение неоадъювантной лучевой терапии, имели значительное увеличение общей выживаемости, канцер-специфической выживаемости и выживаемости без необходимости в спасительной андрогенной депривации. Одним из недостатков этих исследований было то, что подводимая доза лучевой терапии по современным стандартом рассматривается, как субоптимальная, и поэтому неизвестно, даст ли преимущество андрогенная депривация у нынешних пациентов, получающих более высокие дозы облучения? Именно поэтому некоторые исследователи высказывают мнение, что при адекватной локальной дозе лучевой терапии последующая андрогенная депривация не требуется (49).
Другой области разработок является применение простатических маркеров для точного направления лучевой терапии. Наш опыт из Kimmel Cancer Center показал, что золотые фидуциальные маркеры можно легко установить в амбулаторных условиях, а также, что более важно, что эти маркеры позволяют точно подвести дозу облучения, тем самым ограничивая острую токсичность (40). Исследователи в университете Калифорнии в Сан-Франциско показали, что маркеры простаты обеспечивают точное наведение, поэтому облучение можно подводить в пределах 2 мм без риска миграции зерен (50). Эти разработки позволяют развиваться области лучевой терапией под наведением и 4-мерной конформальной лучевой терапии. Под «четвертым измерением» в этом контексте подразумевается влияние времени на положение и/или формы таргетного объема, что позволяет установить более точные края вокруг облучаемой зоны. Монотерапию радиоактивными зернами предпочтительно сохранять для пациентов с раком низкого риска; многие группы для пациентов с раком промежуточного - высокого риска комбинируют брахитерапию с наружной лучевой терапией. Целью этого подхода является подведение большей дозы и лучшее покрытие таргетного объема из-за предполагаемого распространения раковых клеток за пределы простаты. Преимущество мультимодальной лучевой терапии наблюдается также и при комбинации высокодозной брахитерапии с модулированной по интенсивности лучевой терапией, по сравнению с только модулированной лучевой терапией. 3-летние показатели выживаемости, свободной от биохимической прогрессии, у пациентов с раком высокого риска¸ которым проводили только модулированную по интенсивности лучевую терапию, составили 67%, по сравнению с 93% в группе, где ее комбинировали с высокодозной брахитерапией (51). Такое же преимущество также было получено у пациентов с раком промежуточного и высокого риска, которые получали 3-мерную конформальную лучевую терапию с имплантацией одного зерна для высокодозной брахитерапии над одной 3-мерной конформальной лучевой терапией. Показатели 5- и 7-летнего биохимического контроля для рака промежуточного риска в группе комбинированного лечения составили 82,5% и 80,3%, а в группе одной 3-мерной конформальной лучевой терапии - 81,3% и 71%, соответственно. В дополнение, у пациентов с неблагоприятными характеристиками рака простаты, которым проводили комбинированную терапию, наблюдалась минимальная токсичность (52).
Стереотаксическая лучевая терапия быстро внедряется в лечение локализованного рака простаты. Таргетный объект обычно локализуется в пространстве с помощью внешней стандартной конструкции, которая может относиться к лечебной машине. Стереотаксическое позиционирование может быть прецизионным, в результате чего стереотаксическая лучевая терапия часто позволяет подводить за одну фракцию большие дозы с меньшим число самих фракций (гипофракционированная), по сравнению с традиционной лучевой терапией. Стереотаксическая лучевая терапия обычно состоит из полного курса и охватывает 5 или менее сеансов лечения. Многие доступные коммерческие системы, применяемые в настоящее время, обычно включают какой-либо тип изображения для наведения; большинство аппаратов имеют устройство для иммобилизации пациентов (например, CyberKnife® Роботическая система для лучевой хирургии, Accuray, Inc., Sunnyvale, CA и многие другие). Целесообразность использования гипофракционированной терапии в лечения рака простаты еще не установлена, ожидаются результаты продолжающихся рандомизированных исследований, которые могут подтвердить преимущество гипофракционированной над рутинной (нормофракционированной) лучевой терапией (53).
Протонная лучевая терапия или терапия заряженными частицами при раке простаты впервые была проведена в больнице общего профиля Массачусеттса в 1970-х, однако повышенное внимание в литературе при раке простаты она получила недавно. Теоретически, протонные частицы проникают глубже, чем при традиционной фотонной или электронной лучевой терапии и поэтому должны подводить большую часть своей энергии к месту локализации опухоли, а не на уровне кожи. В дополнение, очень малая часть подведенной дозы проходит за опухоль, в то время как фотоны продолжают передавать энергию тканям за опухолью. Этот феномен известен как пик Брэгга, при котором график подведенной энергии имеет резкое снижение после назначенного места воздействия (54). В исследовании II фазы, в котором сравнивали дозиметрические характеристики протонов и лучевой терапии, модулированной по интенсивности, Vargas et al показали снижение на 59% и 35% дозы, полученной прямой кишкой и мочевым пузырем, соответственно (54). Ожидается, что протонная терапия позволит более точно подвести биологически эквивалентную дозу с меньшей травматичностью, связанной с радиацией, чем традиционная фотонная лучевая терапия. Неясно, является ли полезной заявленная высокая точность подведения дозы и необходимость ее применения для лечения локализованного рака простаты, вместо современных методов лучевой терапии.
Криотерапия
Криотерапия применяется в хирургии, начиная с 1850-х годов, когда была впервые введена Dr James Arnot (55). Американская ассоциация урологов (ААУ) впервые одобрила применение криотерапии для лечения рака простаты в 1996 году. Однако только недавно ААУ признала ее как метод первичного лечения локализованного рака простаты, опубликовав Best Practice Statement on Cryosurgery for the Treatment of Localized Prostate Cancer (56).
В настоящее время криотерапия показана у пациентов с раком простаты низкого риска, как альтернатива радикальной простатэктомии или лучевой терапии; у пациентов с высоким хирургическим риском как первичное лечение; у пациентов, не дающих ответ на лучевую терапию – как процедура спасения.
Исторически криохирургия была связана с относительно высоким риском, таким как слущивание слизистой уретры, повреждение прямой кишки и развитие мочеполовых свищей. В прошедшие 15 лет произошли значительные изменения в методике ее проведения. Большим достижение было введение датчика для криотерапии, который работает на аргоне, а не на жидком азоте. Аргон быстро охлаждает конец датчика до -187°C (-304,6°F) и может быть быстро заменен на гелий при температуре 67°C (152,6°F) во время фазы активного оттаивания, что приводит к более быстрому ответу на действия хирурга и значительно ускоряет лечение, состоящее из 2-х циклов (57). Более того, датчик на основе аргона имеет намного меньший диаметр, тем самым обеспечивая прямое, острое трансперинеальное введение, обеспечивая более комфортное проведение манипуляции. Важным фактором является объем железы: в большой простате могут возникнуть сложности в достижении одинаковой низкой температуры во всей простате. Для таких пациентов можно рассматривать применение неоадъювантной терапии для уменьшения размера железы, хотя на настоящий момент по этому вопросу нет опубликованных исследований. С введением нового поколения игл для криодатчика, уретральных и ректальных катетеров для нагревания, а также мониторирования температуры в режиме реального времени радикально изменилась частота осложнений. В обзоре текущей литературы сообщалось о показателях недержания мочи, уретральных свищей и отслойки слизистой уретры, равных 2-7%, 0-2% и 2-6%, соответственно (58-60). Han et al сообщали о хороших результатах в серии из 106 пациентов с развитием стрессового недержания мочи, потребовавшим применения прокладок, только у 3% пациентов, императивного недержания, не требовавшего применения прокладок, у 5%, транзиторную задержку мочи у 3,3% и ректальную боль у 2,6% (59). Это показывает относительно низкий профиль осложнений криотерапии. Исходя из данных исследований по минимальной инвазивности, профиль побочных эффектов криоаблации сравним с таковым у наружной лучевой терапии и брахитерапии. Более того, в исследовании, проведенном Hubosky et al со сроком наблюдения 18 месяцев, у пациентов группе криохирургии отмечали лучшее функционирование мочевой системы, по сравнению с пациентами группы брахитерапии, и этот показатель сохранялся и через 24 месяца (58). Robinson et al представили данные по качеству жизни из рандомизированного исследования, проведенного в одном институте, в котором сравнивали наружную лучевую терапию и криотерапию в лечении локализованного рака простаты. В группе криоаблации сообщалось о более низких показателях функции нижних мочевых путей (69,4 и 90,7), одинаковой функции кишечника и более низких показателях сексуальной функции (7,2 и 32,9). Через 36 месяцев пациенты в группе наружной лучевой терапии имели немного более низкие показатели функции нижних мочевых путей, однако в функции кишечника не отмечалось никаких различий. Сексуальная функция через 36 месяцев была ниже у пациентов в группе криоаблации (16 и 36,7) (61). Основным ее недостатком является высокий риск развития эректильной дисфункции. Она возникает в основном из-за эффективной «зоны уничтожения», которая позволяет достичь адекватного покрытия всей железы с распространением на перипростатическую ткань, которая включает и сосудисто-нервный пучок, необходимый для возникновения эрекции.
Hubosky et al сообщал, что только 20% из всей когорты смогли вернуться к исходным показателям сексуальной функции через 12 месяцев наблюдения (58). Это совпадает с опубликованными данными других исследований, в которых сообщается о показателях эректильной дисфункции при криохирургии всей железы, составляющих 90% после 1 года наблюдения (59, 60). Поэтому вероятно, что пациенты, для которых сохранение эректильной функции является высоким приоритетом, не будут идеальными кандидатами. Одним из недостатков криотерапии, также как и лучевой терапии, является то, что мониторирование рецидива рака или неэффективности лечения могут быть затруднительными. Наиболее часто, также как и после лучевой терапии, наблюдают за уровнем ПСА, однако нет универсально принятого определения биохимического рецидива. В литературе по криотерапии применяются два определения, описанные в данных по лучевой терапии – критерии ASTRO и критерии Phoenix. Другие используют определенный порог уровня ПСА. Тем не менее, остается неизвестным порог надира ПСА, который означает отсутствие рака.
В долгосрочных ретроспектиных Cohen et al сообщалось о 10-летней выживаемости без биохимических признаков рака, составляющей 56,01% в соответствии с критериями ASTRO и 62,36% при использовании критериев Phoenix (надир плюс 2 нг/мл). При стратификации по группам риска (низкий, промежуточный и высокий) выживаемость без биохимических признаков рака по критериям Phoenix составила 80.56%, 74,16%, и 45,54%, соответственно (62).
Jones et al недавно опубликовали данные по самой большой серии пациентов, которым в качестве первичного лечения проводили криотерапию всей железы; все пациенты были включены в регистр базы данных Cryo On-Line Database (COLD) – самую большую опубликованную когорту по криотерапии всей железы при локализованном раке простаты. Средний долечебный уровень ПСА составлял 6,8 нг/мл (в среднем, 9,6 ± 8,6 нг/мл). Были представлены пациенты с различной суммой баллов по Глисону (в среднем, 7). Средний период наблюдения составил 24,4 ± 25,9 месяцев. При применении критериев Phoenix для мужчин, собранных в этом регистре, показатели биохимического рецидива для мужчин с раком низкого, промежуточного и высокого риска составили 91%, 78% и 62%, соответственно (63). Регистр COLD – это мультицентровая база, которую разрабатывали и вводили данные 4 академических медицинских центра и 34 уролога из сообщества, так что контроль применяемых поколений криосистем и протоколов лечения варьировал среди различных центров. Это привело к ослаблению данных, так как отсутствовала стандартизация в методике проведения лечения. Более важно, что 49,5% из этих мужчин до криоаблации получали гормональную терапию, что, возможно, привело к ложному неопределяемому уровню ПСА (63). Вне зависимости от этого, в опубликованных данных регистра COLF сообщалось о 5-летней выживаемости без биохимических признаков рака, равной 77,1% при использовании критериев ASTRO и 72,9% при использовании критериев Phoenix. Применяя стратификацию риска, 5-летняя выживаемость без биохимических признаков рака составила 84,7%, 73,4% и 75,3% (ASTRO) и 91,1%, 78,5%, 62,2% (Phoenix) для рака низкого, промежуточного и высокого риска, соответственно (63).
Как обсуждалось ранее, показатели эректильной дисфункции высоки у пациентов, которым проводится терапия всей железы. Хотя фокальная криоаблация по-прежнему находится в экспериментальной стадии, или, как часто говорят «мужская лампэктомия» простаты, она развивается как потенциальный вариант лечения пациентов с унилатеральным раком низкого риска. Целью фокальной терапии является адекватная аблация опухоли с сохранением сосудисто-нервного пучка. Onik et al сообщали о своих результатах по лечению 45 пациентов со средним периодом наблюдения 4,5 года, с применением фокальной криоаблации. У 45 пациентов из 48 (94%) был стабильный уровень ПСА по критериям ASTRO, без признаков рака. У 24 пациентов, которым выполнили рутинную биопсию, не было данных за опухоль (64). Поэтому фокальная криоаблация может играть потенциальную роль в лечении пациентов с унилатеральным раком простаты низкого риска, выявленным при биопсии, для которых сохранение эректильной функции не является важным. В исследовании, проведенном Ward et al, проводили обзор препаратов простаты при выявлении унилатерального рака на биопсии для описания характеристик локализации, объема и степени злокачественности каждого фокуса, с целью определить, может ли с помощью фокальной терапии добиться излечения. Несмотря на то, что только 17% пациентов имели один фокус рака, шаблон для гемиаблации, применяемый при фокальной терапии, позволяет успешно у 81% пациентов воздействовать на все клинически значимые фокусы рака. Большинство раков вне поля действия были клинически незначимыми и не выявлялись на биопсии (небольшой объем, 0,5 см3 и низкая степень злокачественности, сумма баллов по Глисону ≤6) (65). Современные результаты фокальной криотерапии показывают высокие показатели сохранения эректильной функции, приблизительно 90% (64, 66).
Другие методы лечения
Высокоинтенсивный сфокусированнй ультразвук (HIFU) одобрен в ЕС и Канаде, но не доступен коммерчески в США.
При высокодозной радиации применяют временную имплантацию в простату, которая требует непродолжительной госпитализации. Метод обычно проводится в сочетании с наружной лучевой терапией. В настоящее время данные по нему ограничены, также как и число клиник в США, в которых проводится высокодозное облучение. Многие пожилые мужчины с локализованным раком простаты получают только гормональную терапию. Тем не менее, преимущество гормональной монотерапии (монотерапия аналогами релизинг-фактора лютеинизирующего гормона, комбинация их с антиандрогенами или монотерапия андрогенами) при локализованном раке простаты не установлено и у некоторых пациентов она может быть связана с тяжелой токсичностью (67). В руководствах по лечению не рекомендовано ее использование в качестве терапии первой линии при ранних стадиях заболевания. Несмотря на ограниченные к настоящему моменту данные по влиянию на клинические результаты, применение гормональной монотерапии у пациентов с локализованным и распространенным раком простаты повышается во многих странах, особенно сильно в Японии (68). Гормональная терапия, и в виде монотерапии аналогами релизинг-фактора лютеинизирующего гормона, или в их сочетании с антиандрогенами при локализованном раке простаты в настоящее время противоречива в виде монолечения и не должна рутинно применяться до тех пор, пока не будут доступны дополнительные данные.
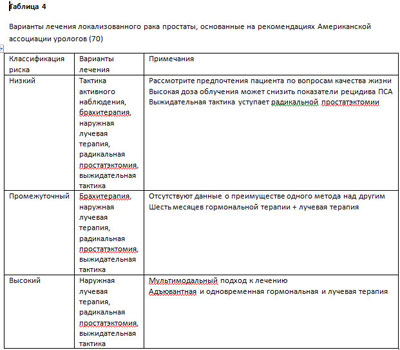
Выводы
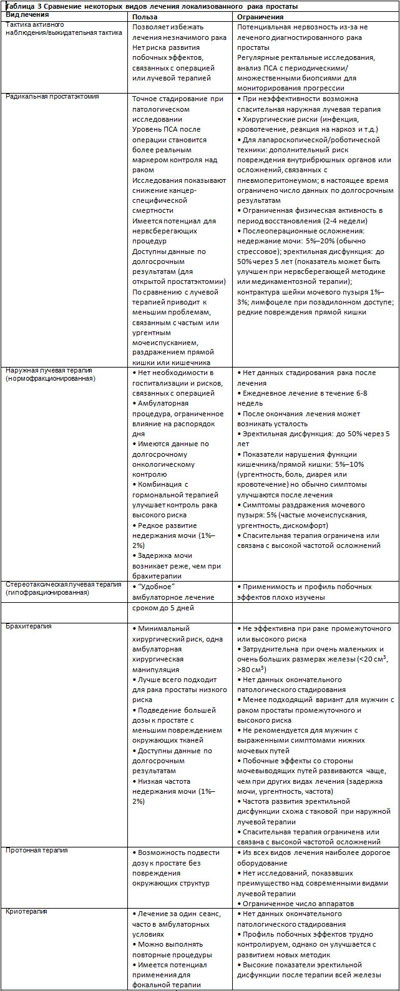
Как показано в этой статье, в ведении локализованного рака простаты существуют многочисленные подходы. В настоящее время нет одного правильного или «лучшего» подхода для всех мужчин. Ограниченная доступность прямых сравнительных рандомизированных исследований делает более трудным выбор правильной тактики. Тенденции пациентов искать мультидисциплинарные клинические консультации часто способствуют раковые центры, в которых все усилия направлены на помощь больному (69). Как отмечалось ААУ, при принятии коллективного решения по ведению мужчины с клинически локализованным раком простаты необходимо учитывать различные факторы (70). Самым высоким приоритетом обладает включение пациента в рандомизированные клинические исследования, так как мы продвигаемся к улучшению оказания помощи нашим пациентам. Сравнение риска и пользы различных видов лечения локализованного рака простаты и рекомендации ААУ суммированы в таблицах 3 и 4. Факторы качества жизни, такие как эректильная функция, расстройства мочеиспускания или функции прямой кишки должны играть важную роль в принятии решения о лечении пациента; подробное обсуждение этих специфических вопросов не включено в данную статью. В недавней публикации Sanda, et al предствалены прекрасные объективные данные по основным потенциальным эффектам на качество жизни при первичном лечении рака простаты (71). Результаты терапии мужчин с раком низкого риска, которым проводится лучевая терапия или радикальная простатэктомия, показывают, что онкологическая эффективность в течение, по крайней мере, 10-15 лет, схожа. Возможно, у более молодых пациентов с ожидаемой продолжительностью жизни более 10 лет радикальная простатэктомия дает преимущество, обеспечивая точное стадирование и неопределяемый уровень ПСА. Назначение адъювантной лучевой терапии при раке высокого риска как части мультимодального лечебного плана после радикальной простатэктомии может улучшить показатели биохимического рецидива и, возможно, общую выживаемость. Лучевая терапия в комбинации с гормональной терапией рассматривается как стандарт ведения больных с раком простаты, имеющим характеристики высокого риска, которые выбирают наружную лучевую терапию. Пациентам, заинтересованным в одном минимально инвазивном вмешательстве, может подойти брахитерапия или криотерапия. Наконец, пациенты, подходящие для тактики активного наблюдения, могут выбирать этот путь для мониторирования рака простаты. В заключение, лечение рака простаты должно быть индивидуализированным для каждого пациента, с взвешиванием современной информации о доступных методах, с учетом ожиданий каждого пациента, общего состояния здоровья и качества жизни.
Список литературы
1. Schwartz R. Management of Prostate Cancer – Polling Results. N Engl J Med. 2009 Jan;15;360(3):e4.
2. Hernandez DJ, Nielsen ME, Han M, et al. Contemporary evaluation of the D‘amico risk classification of prostate cancer. Urology. 2007 Nov;70(5):931–935.
3. Shariat SF, Karakiewicz PI, Roehrborn, et al. An updated catalog of prostate cancer predictive tools. Cancer. 2008 Dec;113(11):3075–3099.
4. D’Amico AV, Chen MH, Roehl KA, et al. Preoperative PSA velocity and the risk of death from prostate cancer after radical prostatectomy. N Engl J Med. 2004 Jul:351(2):125–135.
5. Dall’Era MA, Konety BR, Cowan JE, et al. Active surveillance for the management of prostate cancer in a contemporary cohort. Cancer. 2008 Jun;112(12):2664–2670.
6. Yin M, Bastacky S, Chandran U, et al. Prevalence of incidental prostate cancer in the general population: A study of healthy organ donors. J Urol. 2008 Mar;179(3):892–895.
7. Ries LA, Melbert D, Krapcho M, et al editors. SEER Cancer Statistics Review, 1975–2005. Based on 2007 Nov SEER data bmission, posted to the SEER website, 2008. Bethesda, Md, National Cancer Institute. Available at http://seer.cancer.gov/csr/1975_2005.
8. Parker C, Muston D, Melia J, et al. A model of the natural history ofscreen-detected prostate cancer, and the effect of radical treatment on overall survival. Br J Cancer. 2006 May;94(10):1361–1368.
9. Schroder FH. Screening for prostate cancer (PC)-an update on recent findings of the European Randomized Study of Screening for Prostate Cancer (ERSPC). Urol Oncol. 2008 Sep–Oct;26(5):533–541.
10. Davis JW, Kim J, Ward JF, et al. Radical prostatectomy findings in patients predicted to have low-volume/low-grade prostate cancer diagnosed by extended-core biopsies: an analysis of volume and zonal distribution of tumour foci. BJU Int. Article in Press.
11. van den Bergh RC, Roemeling S, Roobol MJ, et al. Outcomes of men with screen-detected prostate cancer eligible for active surveillance who were managed expectantly. Eur Urol. 2009 Jan;55(1):1–8.
12. Eggener SE, Mueller A, Berglund RK, et al. A multi-institutional evaluation of active surveillance for low risk prostate cancer. J Urol. 2009 Apr;181(4):1635–1641.
13. Dall-Era MA, Konety BR, Cowan JE, et al. Active surveillance for the management of prostate cancer in a contemporary cohort. Cancer. 2008 Jun;112(12):2664–2670.
14. Klotz L. Active surveillance for favorable risk prostate cancer: What are the results, and how safe is it? Semin in Rad Oncol. 2008 Jan;18(1): 2–6.
15. Freedland SJ, Kane CJ, Amling WJ, et al. Delay of radical prostatectomy and the risk of biochemical progression in men with low risk prostate
cancer. J Urol. 2006 Apr;175(4):1298–1302.
16. Warlick C, Trock BJ, Landis P, et al. Delayed versus immediate surgical intervention and prostate cancer outcome. J Natl Cancer Inst. 2006
Mar;98(5):355–357.
17. Bastian PJ, Carter BH, Bjartell A, et al. Insignificant prostate cancer and active surveillance: From definition to clinical implications. Eur Urol. 2009 Jun;55(6):1321–1330.
18. Walsh PC, DeWeese TL, Eisenberger MA. Clinical practice. Localized prostate cancer. N Engl J Med. 2007 Dec;357(26):2696–2705.
19. Grossfeld GD, Chang JJ, Broering JM, et al. Under staging and under grading in a contemporary series of patients undergoing radical prostatectomy: Results from the Cancer of the Prostate Strategic Urologic Research Endeavor database. J Urol. 2001 Mar;165(3):851–856.
20. Ficarra V, Novara G, Artibani W, et al. Retropubic, laparoscopic, and robot assisted radical prostatectomy. A systematic review and cumulative analysis of comparative studies. Eur Urol. 2009 May;55(5):1037–1063.
21. Thompson IM, Tangen CM, Paradelo J, et al. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: Long-term followup of a randomized clinical trial. J Urol. 2009 Mar;181(3):956–962.
22. Trabulsi EJ, Valicenti RK, Hanlon AL, et al. A multi-institutional matched-control analysis of adjuvant and salvage postoperative radiation therapy for pT3-4N0 prostate cancer. Urology. 2008 Dec; 72(6):1298–1302.
23. Boorjian SA, Karnes RJ, Crispen PL, et al. Radiation Therapy After Radical Prostatectomy: Impact on Metastasis and Survival. J Urol. 2009 Dec;182(6):2708–2714.
24. Wallace K, Fleshner, Jewett M, et al. Impact of a multi-disciplinary patient education session on accrual to a difficult clinical trial: the Toronto
experience with the surgical prostatectomy versus interstitial radiation intervention trial. J Clin Oncol. 2006 Sep;24(25):4158–4162.
25. Bill-Axelson A, Holmberg L, Filen F, et al. Radical prostatectomy versus watchful waiting in localized prostate cancer: The Scandinavian prostate cancer group-4 randomized trial. J Natl Cancer Inst. 2008 Aug;100(16):1144–1154.
26. D’Amico AV, Whittington R, Malkowicz SB, et al. Biochemical outcome after radical prostatectomy or external beam radiation therapy for patients with clinically localized prostate carcinoma in the prostate specific antigen era. Cancer. 2002 Jul;95(2):281–286.
27. Stephenson AJ, Kattan MW, Eastham JM, et al. Prostate cancer-specific mortality after radical prostatectomy for patients treated in the prostatespecific
antigen era. J Clin Oncol. 2009 Sep;27(26):4300–4305.
28. Siddiqui SA, Sengupta S, Slezak JM, et al. Impact of patient age at treatment on outcome following radical retropubic prostatectomy for prostate cancer. J Urol. 2006 Mar;175(3):952–957.
29. Begg CB, Riedel ER, Bach PB, et al. Variations in morbidity after radical prostatectomy. N Engl J Med. 2002 Apr;346(15):1138–1144.
30. Walz J, Gallina A, Saa F, et al. A Nomogram Predicting 10-Year Life Expectancy in Candidates for Radical Prostatectomy or Radiotherapy for Prostate Cancer. J Clin Oncol. 2007 Aug;25(24):3576–3581.
31. Trabulsi EJ, Zola JC, Gomella LG, et al. Transition from pure laparoscopic to robotic-assisted radical prostatectomy: A single surgeon institutional evolution. Urol Oncol. 2010 Jan–Feb;28(1):81–85.
32. CNBC.com http://www.cnbc.com/id/31112735 Published 2009 June, accessed Nov 2009.
33. Frota R, Turna B, Barros R, et al. Comparison of radical prostatectomy techniques: open, laparoscopic and robotic assisted. Int Braz J Urol.
2008 May–Jun;34(3):259–268.
34. Coelho RF, Chauhan S, Palmer KJ, et al. Robotic-assisted radical prostatectomy: a review of current outcomes. BJU Int. 2009 Nov; 104(10):1428–1435.
35. Ficarra V, Novara G, Artibani W, et al. Retropubic, laparoscopic, and robot assisted radical prostatectomy. A systematic review and cumulative analysis of comparative studies. Eur Urol. 2009 May;55(5):1037–1063.
35. Hu JC, Gu X, Lipsitz SR, et al. Comparitive Effectiveness of Minimally Invasive vs Open Radical Prostatectomy. JAMA. 2009 Oct; 302(14):1557–1564.
36. Kaouk JH, Goel RK, Haber GP, et al. Single-port laparoscopic radical prostatectomy. Urology. 2008 Dec;72(6): 1190–1193.
Clinical Interventions in Aging Publish your work in this journal Submit your manuscript here: http://www.dovepress.com/clinical-interventions-in-aging-journal
Clinical Interventions in Aging is an international, peer-reviewed journal focusing on evidence-based reports on the value or lack thereof of treatments intended to prevent or delay the onset of maladaptive correlates of aging in human beings. This journal is indexed on PubMed
Central, MedLine, the American Chemical Society’s ‘Chemical Abstracts Service’ (CAS), Scopus and the Elsevier Bibliographic databases. The manuscript management system is completely online and includes a very quick and fair peer-review system, which is all easy to use. Visit http://www.dovepress.com/testimonials.php to read real quotes from published authors.
Clinical Interventions in Aging 2010:5 submit your manuscript | www.dovepress.com
Optimal management for localized prostate cancer
37. Messing EM, Manola J, Yao J, et al. Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol. 2006 Jun;7(6):472–479.
38. Engel J, Bastian PJ, Baur H, et al. Survival Benefit of Radical Prostatectomy in Lymph Node – Positive Patients with Prostate Cancer. Eur Urol. Article in Press.
39. Eastham JA. Do high-volume hospitals and surgeons provide better care in urologic oncology? Urol Oncol. 2009 Jul–Aug;27(4):417–421.
40. Linden RA, Weiner PR, Gomella LG, et al. Technique of outpatient placement of intraprostatic fiducial markers before external beam radiotherapy. Urology. 2009 Apr;73(4):881–886.
41. Valicenti R, Lu J, Pilepich M, et al; Survival advantage from higherdose radiation therapy for clinically localized prostate cancer treated on the Radiation Therapy Oncology Group trials. J Clin Oncol. 2000 Jul; 18(14):2740–2274.
42. Peeters ST, Heemsbergen WD, Koper PC, et al. Dose – response in radiotherapy for localized prostate cancer: results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy. J Clin Oncol. 2006 May;24(13):1990–1996.
43. Zietman AL, DeSilvio, Slater JD, et al. Comparison of conventionaldose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial. JAMA. 2005 Sep;294(10):1233–1239.
44. Pollack A, Zagars GK, Starkschall G, et al. Prostate cancer radiation dose response: Results of the Anderson MD phase III randomized trial. Int J Radiat Oncol Biol Phys. 2002 Aug;53(5):1097–1105.
45. http://clinicaltrials.gov/ct2/show/NCT00033631 Accessed Nov 2009.
46. Pilepich MV, Winter K, John MJ, et al. Phase III Radiation Therapy Oncology Group (RTOG) trial 86–10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys. 2001 Aug;50(5):1243–1252.
47. Roach M 3rd. Dose escalated external beam radiotherapy versus neoadjuvant androgen deprivation therapy and conventional dose external beam radiotherapy for clinically localized prostate cancer: do we need both? Strahlenther Onkol. 2007 Dec;183 Spec No 2:26–28.
48. Roach M 3rd, Bae K, Speight J, et al. Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: Long-term results of RTOG 8610. J Clin Oncol. 2008 Feb;26(4):585–591.
49. Jacob R, Hanlon AL, Horwitz EM, et al. Role of prostate dose escalation in patients with greater than 15% risk of pelvic lymph node involvement. Int J Radiat Oncol Biol Phys. 2005 Mar;61(3):695–701.
50. Pouliot J, Aubin M, Langen KM, et al. (Non)-migration of radiopaque markers used for on-line localization of the prostate with an electronic portal imaging device. Int J Radiat Oncol Biol Phys. 2003 Jul;56(3):862–866.
51. Wilder RB, Barme GA, Gilbert RF, et al. Preliminary results in prostate cancer patients treated with high-dose-rate brachytherapy and intensity modulated radiation therapy (IMRT) vs IMRT alone. Brachytherapy. Article in Press. Accessed Nov 2009.
52. Zwahlen DR, Andrianopoulos N, Matheson B, et al. High-dose-rate brachytherapy in combination with conformal external beam radiotherapy in the treatment of prostate cancer. Brachytherapy. Article in Press. Accessed Nov 2009.
53. Macнas V, Biete A. Hypofractionated radiotherapy for localized prostate cancer. Review of clinical trials. Clin Transl Oncol. 2009 Jul; 11(7):437–445.
54. Vargas C, Fryer A, Mahajan C, et al. Dose-volume comparison of proton therapy and intensity-modulated radiotherapy for prostate cancer. Int J Radiat Oncol Biol Phys. 2008 Mar;70(3):744–751.
55. Gage AA. History of cryosurgery. Semin Surg Oncol. 1998 Mar; 14(2):99–109.
56. Babaian RJ, Donnelly B, Bahn D, et al. Best practice statement on cryosurgery for the treatment of localized prostate. J Urol. 2008 Nov; 180(5):1993–2004.
57. Cytron S, Greene D, Witzsch, et al. Cyroablation of the Prostate: Technical Recommendations. Prostate Cancer Prostatic Dis. 2009 Dec; 129(4):339–346.
58. Hubosky SG, Fabrizio MD, Schellhammer PF, et al. Single center experience with third generation cryosurgery for management of organ-confined prostate cancer: critical evaluation of short-term outcomes, complications and patient quality of life. J Endourol. 2007 Dec; 21(12):1521–1531.
59. Han KR, Cohen JK, Miller RJ, et al. Treatment of organ confined prostate cancer with third generation cryosurgery: preliminary multicenter experience. J Urol. 2003 Oct;170(4 Pt 1):1126–1130.
60. Polascik T, Nosnick I, Mayes J, et al. Short-term cancer control after primary cryosurgical ablation for clinically localized prostate cancer using third generation cryotechnology. Urology. 2007 Jul;70(1):117–121.
61. Robinson JW, Donnelly BJ, Siever JE, et al. A randomized trial of external beam radiotherapy versus cryoablation in patients with localized prostate cancer: quality of life outcomes. Cancer. 2009 Oct;115(20):4695–4704.
62. Cohen JK, Miller RJ, Ahmed S, et al. Ten-year biochemical disease control for patients with prostate cancer treated with cryosurgery as primary therapy. Urology. 2008 Mar;71(3):515–518.
63. Jones JS, Rewcastle JC, Donnelly B, et al. Whole gland primary prostate cryoablation: initial results from the cryo on-line data registry. J Urol. 2008 Aug;180(2):554–558.
64. Onik G, Vaughan D, Lotenfoe R, et al. The “male lumpectomy”: focal therapy for prostate cancer using cryoablation results in 48 patients with at least 2-year follow-up. Urol Oncol. 2008 Sep–Oct;26(5):500–505.
65. Ward JF, Nakanishi H, Pisters L, et al. Cancer ablation with regional templates applied to prostatectomy specimens from men who were eligible for focal therapy. BJU Int. 2009 Aug;104(4):490–497.
66. Bahn DK, Silverman P, Lee FSr, et al. Focal prostate cryoablation: initial results show cancer control and potency preservation. J Endourol. 2006 Sep;20(9):688–692.
67. Heinzer H, Steuber T. Prostate cancer in the elderly. Urol Oncol. 2009 Nov;27(6):668–672.
68. Akaza H. Future Prospects for Luteinizing Hormone-Releasing Hormone Analogues in Prostate Cancer Treatment. Pharmacology. 2010 Feb; 85(2):110–120.
69. Valicenti RK, Gomella LG, El-Gabry EA, et al. The multidisciplinary clinic approach to prostate cancer counseling and treatment. Semin Urol Oncol. 2000 Aug;18(3):188–191.
70. Thompson I, Thrasher JB, Aus G, et al. Guideline for the management of clinically localized prostate cancer: 2007 update. J Urol. 2007 Jun; 177(6):2106–2131.
71. Sanda MG, Dunn RL, Michalski J, et al. Quality of life and satisfaction with outcome among prostate-cancer survivors. N Engl J Med. 2008 Mar;358:1250–1261.







Комментарии