Термин «цистит медового месяца» (англ. «honeymoon cystitis») возник в англоязычной медицинской и научно-популярной литературе XX века и отражал распространенный факт: появление симптомов цистита у женщин вскоре после начала половой жизни, чаще всего – после первой брачной ночи или в первые недели брака. Само название стало метафорой сочетания романтики и физиологического дискомфорта. Ранее, до широкого распространения контрацепции и сексуального просвещения, вступление в половую жизнь действительно часто происходило после брака, и «медовый месяц» стал клише для описания не только периода близости, но и связанных с ним медицинских проблем у женщин.
 О.Ю. Нестерова, к.м.н., врач-уролог, старший научный сотрудник отдела урологии и андрологии Университетской клиники МНОИ МГУ им. М.В. Ломоносова, старший преподаватель кафедры урологии и андрологии МНОИ МГУ им. М.В. Ломоносова, Москва
О.Ю. Нестерова, к.м.н., врач-уролог, старший научный сотрудник отдела урологии и андрологии Университетской клиники МНОИ МГУ им. М.В. Ломоносова, старший преподаватель кафедры урологии и андрологии МНОИ МГУ им. М.В. Ломоносова, Москва
В первой половине XX века в ряде стран сексуальное просвещение было ограничено, а открытое обсуждение интимных тем считалось запретным. У женщин, только начавших половую жизнь, часто не было достаточной информации о гигиене половых органов, о риске инфекции и необходимости опорожнения мочевого пузыря после полового акта. Это способствовало частому развитию инфекционно-воспалительных заболеваний мочевыводящих путей на фоне механического раздражения уретры и миграции кишечной микрофлоры (в частности, E. coli, как наиболее частого возбудителя острого цистита) из прямой кишки в область преддверия влагалища к уретре и мочевому пузырю.
Сложившийся на тот момент общественный уклад дополнялся отсутствием широкодоступной антибиотикотерапии: до 1940-х годов лечение инфекционно-воспалительных заболеваний урогенитального тракта ограничивалось спринцеваниями, настоями трав, диетой и рекомендациями воздержания от половой жизни. Женщины, страдающие рецидивирующими циститами после полового акта, зачастую не получали должного лечения, а их состояние интерпретировалось как следствие «женской слабости» или «нервного истощения».
Уже в середине XX века врачи-гинекологи и урологи начали ассоциировать посткоитальный цистит с сексуальной активностью. В 1960–70-х годах появились первые статьи, описывающие посткоитальный цистит как специфическую клиническую форму, требующую определенного лечения. В 1980–1990-х годах в литературе стали появляться работы, описывающие анатомо-функциональные особенности женщин, предрасполагающие к посткоитальному циститу: короткая и гипермобильная уретра, наличие уретрогеминальных спаек, частое анатомическое прилегание уретры и влагалища, изменения влагалищной микрофлоры. Одновременно, термин «honeymoon cystitis» постепенно вытеснялся более корректным и нейтральным «postcoital urinary tract infection» и «postcoital cystitis» – посткоитальная инфекция мочевыводящих путей и посткоитальный цистит соответственно, что соответствовало стремлению современной медицины к правильной терминологии и научной точности.
Несмотря на длительную историю изучения посткоитального цистита на сегодняшний день четкого общепризнанного определения данного состояния нет. В большинстве исследований конца XX-начала XXI века посткоитальный цистит описывается как рецидивирующий цистит (то есть цистит, который возникает не менее 2 раз за последние 6 месяцев или не менее 3 раз за последние 12 месяцев), симптомы которого появляются через 24-72 часа после полового акта. Крупнейшее эпидемиологическое исследование, посвященное посткоитальному циститу, было выполнено еще в 2005 году C. Stamatiou и др. В ходе обследования почти 3 тысяч женщин с симптомами инфекционно-воспалтельных заболеваний нижних мочевыводящих путей у 8% пациентов определялся рецидивирующий цистит, у 4,3% пациенток общей выборки цистит возникал после половых актов. Тем самым, посткоитальный цистит составлял 60% от всех случаев рецидивирующих циститов [1].
Факторы риска
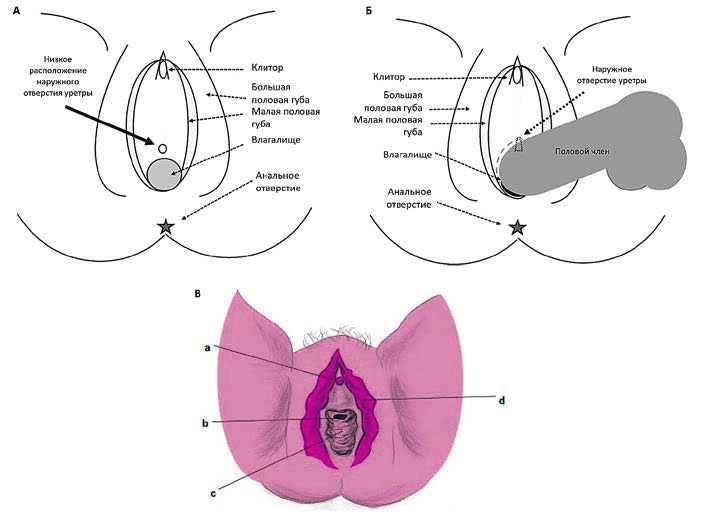
Рис. 1. Низкое расположение уретры (А) и смещение уретры во время фрикций во влагалище, то есть гипермобильность уретры (Б), адаптировано из [2];
дистопия уретры во влагалище (В): а – клитор, b – дистопированное наружное
отверстие уретры, c – влагалище, d – малая половая губа, адаптировано из [4]
В качестве факторов риска посткоитального цистита длительное время рассматривались анатомические факторы, в частности, гипермобильность и дистопия уретры. Под гипермобильностью уретры понимают низкое расположение уретры, смещаемой на переднюю стенку влагалища во время фрикций (рисунок 1А) [2]. Под дистопией понимают расположение наружного отверстия уретры на передней стенки влагалища непосредственно перед его преддверием (рисунок 1Б , В). Предположение относительно повышения риска бактериальной инвазии при половом акте в случае низкого расположения уретры было высказано О’Доннелом в 1959 году [3]. Впоследствии в рутинную практику для диагностики гипермобильности наружного отверстия уретры вошла проба О’Доннел-Хиршхорна, когда при введении указательного и среднего пальца руки во влагалище наружное отверстие уретры начинает зиять и смещается во влагалище.
Помимо этого, в качестве одного из анатомических факторов риска посткоитального цистита рассматриваются уретрогеминальные спайки, представляющие собой соединительнотканные сращения между уретрой и остатками девственной плевы (гимена), формирующиеся в области преддверия влагалища в виде тонких перемычек или тяжей. Предполагалось, что уретрогеминальные спайки могут быть причиной механического трения уретры во время полового акта, способствовать затруднению гигиены и предрасположенности к посткоитальному циститу.
Постепенное накопление знаний и развитие микробиологии привело к смещению парадигмы от анатомических факторов к бактериальным. Как оказалось, важнейшим фактором риска посткоитального цистита является нарушение микробиоценоза влагалища. Влагалищная микрофлора, представленная преимущественно лактобактериями, метаболизирует гликоген в молочную кислоту, продуцирует лизоцим, стимулирует нейтрофилы и макрофаги, образование интерферонов и секреторных Ig. Тем самым Lactobacillus spp. обладают мощнейшим защитным потенциалом, защищающим не только влагалище, но и область преддверия влагалища с уретрой от проникновения кишечных бактерий, основных возбудителей инфекций мочевыводящих путей [5]. В связи с этим нарушения микробиоценоза влагалища с формированием дисбактериоза (или бактериального вагиноза) является важнейшим фактором риска посткоитального цистита [6].
Следует отметить, что основным предрасполагающим фактором к возникновению бактериального вагиноза является прием системной антибактериальной терапии, которую, к сожалению, крайне часто назначают при остром цистите. Антибактериальные препараты широкого спектра действия, уничтожая патогенные бактериальные агенты, одновременно влияют и на микрофлору влагалища, снижая концентрацию лактобактерий и смещая микробиологическое равновесие в сторону дисбиоза с размножением факультативных и облигатных анаэробов и дрожжеподобных грибов. Тем самым, снижается защитный потенциал влагалища и кишечные и кожные бактерии колонизируют влагалище, преддверие влагалища, уретру, а затем и мочевой пузырь, способствуя развитию цистита после полового акта. Последние на фоне бактериального вагиноза зачастую болезненные и дискомфортные, что создает очаги микротравматизации влагалища, преддверия влагалища и уретры, еще более способствуя проникновению в мочевой пузырь уропатогенных бактерий. Таким образом, при неправильно подобранном лечении формируется порочный круг рецидивирования посткоитального цистита: на фоне системной антибактериальной терапии уничтожаются лактобактерии, снижается защитный потенциал влагалища, развивается бактериальный вагиноз с колонизацией кишечными бактериями уретры и мочевого пузыря, создаются входные ворота для инфекции и повторно после полового акта возникает цистит (рисунок 2).
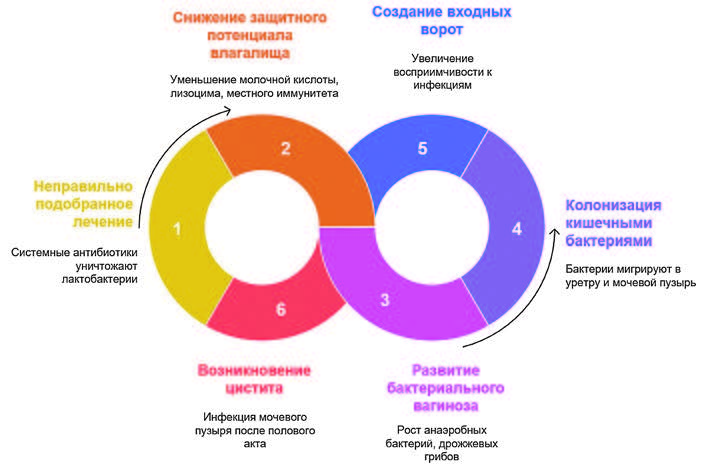
Рис. 2. Схема порочного круга рецидивирования посткоитального цистита
При попадании пациентки в представленный порочный круг посткоитального цистита и регулярном остром воспалении слизистой оболочки мочевого пузыря последняя истончается, происходит постепенное уменьшение важнейшего защитного барьера мочевого пузыря, гликозаминогликанового слоя. Постоянные обострения препятствуют восстановлению уротелия, который в условиях воспаления не способен обеспечить адекватный синтез компонентов гликозаминогликанового слоя и является крайне восприимчивым к различным бактериальным агентам и химически активным веществам.
Для разрыва порочного круга посткоитального цистита требуется правильная и адекватно подобранная терапия для лечения пациенток с обострением цистита и профилактики рецидивов.
Диагностика и лечение
Действующие клинические рекомендации, как было сказано выше, не дают четкого определения посткоитального цистита, обобщая данное состояние с рецидивирующим циститом. Действительно, посткоитальный цистит требует ряда специфических мероприятий для диагностики и правильного лечения. Важнейшим этапом обследования пациенток с посткоитальным циститом, помимо тщательного осмотра на кресле с оценкой состояния слизистых оболочек, расположения уретры и мышц тазового дна, является исследование микробиоценоза влагалища с целью определения влагалищного дисбиоза. В рутинной клинической практике для этих целей чаще всего используется Фемофлор-16.
Как и в случае рецидивирующего цистита, лечение посткоитального цистита направлено на улучшение качества жизни и профилактику рецидивов.
Консервативное лечение и профилактика
Лечение обострения посткоитального цистита следует проводить как обычного острого цистита антибактериальными препаратами из группы нитрофуранов или фосфомицином. Особенность данных групп препаратов заключается в преимущественном влиянии на мочевой пузырь без эрадикации влагалищной или кишечной нормофлоры.
Для профилактики рецидивов используется ряд немедикаментозных и медикаментозных методов. К немедикаментозным методам относится поведенческая терапия, которая заключается в нормализации водно-питьевого режима (примерный объем употребляемой ежедневно жидкости 2 литра), формировании режима мочеиспусканий (опорожнение мочевого пузыря каждые 3–4 часа, мочеиспускание перед половым актом и после полового акта без натуживания передней брюшной стенки), отказ от ежедневного применения прокладок, спермицидов, антисептиков для орошения влагалища и преддверия влагалища, ношение удобного нижнего белья, гигиена промежности, минимизация травматизации промежности на фоне достаточного количества лубрикантов, длительной стимуляции промежности и расслабления мышц тазового дна до пенетрации [7, 8].
Медикаментозная профилактика делится на стратегии неантибактериальной и антибактериальной профилактики. Неантибактериальная профилактика включает в себя коррекцию бактериального вагиноза и восстановление нормальной микрофлоры влагалища и восстановление нормального состояния поврежденного уротелия. Коррекция бактериального вагиноза у пациенток с посткоитальным циститом осуществляется, чаще всего путем назначения интравигинальных свечей с антибактериальными препаратами (в зависимости от результатов исследования микробиоценоза влагалища) с последующим восстановлением ниши лактобактерий путем назначения интравагинальных свечей с лактобактериями. Восстановление нормального состояния уротелия требует комплексного подхода с назначением препаратов клюквы, Д-маннозы (как конкурентного ингибитора бактериальной адгезии), иммунопрофилактики, фитотерапии и в некоторых случаях – внутрипузырных инстилляций протектора вязкоэластичного стерильного для слизистой мочевого пузыря, содержащего гиалуроновую кислоту [7,9,10]. К вариантам антибактериальной профилактики посткоитального цистита относится назначение минимальной дозы препарата из группы нитрофуранов до или после полового акта (нитрофурантоин 50 мг или нифурател 200 мг) [7, 11, 12].
К сожалению, крайне часто пациентки с длительно текущим посткоитальным циститом имеют ряд других нарушений, в частности – гипертонус или гиперчувствительность мышц тазового дна, присоединение синдрома хронической тазовой боли, выраженную тревожность и сниженное качество жизни [13, 14], что, конечно, требует более комплексного и расширенного подхода к проблеме и обсуждается в каждом конкретном случае.
Оперативное лечение
Поскольку в конце XX-начале XXI века, когда основным фактором риска посткоитального цистита считался анатомический факторы (дистопия уретры, гипермобильность уретры или уретрогеминальные спайки) для устранения этих причин активно использовались оперативные вмешательства. Одним из наиболее часто используемых вмешательств было рассечение уретрогеминальных спаек [3, 15–17], которое и на сегодняшний день в некоторых случаях у хорошо отобранных категорий пациентов после неэффективного консервативного лечения может эффективно применяться у пациенток спосткоитальным циститаом [18–20].
В 1968 году Р. О’Доннел разработал хирургическую технику по перемещению наружного отверстия мочеиспускательного канала при его эктопии из влагалища в параклиторальную область – транспозицию уретры [18,21], которая в последующем была неоднократно модифицирована [22]. В нашей стране чаще всего применяется транспозиция уретры по Б.К. Комякову [23].
В зарубежных странах от повсеместного выполнения транспозицици уретры отказались в связи с невысокой эффективностью, отдав предпочтение консервативному лечению. Последние зарубежные публикации, посвященные транспозиции уретры, датируются концом XX и первым десятилетием XXI века [4, 24]. В связи с этим, следует помнить, что правильно выполненная операция может быть эффективна, однако у строго подобранной категории пациентов, прошедших все этапы правильного комплексного консервативного лечения [25].
Клиническое наблюдение – классический посткоитальный цистит
Пациентка Х, 23 года, обратилась в августе 2023 с года с жалобами на частые обострения цистита, пиелонефрита после половых актов.
Анамнез: в 16 лет впервые на фоне переохлаждения – острый пиелонефрит. С 18 лет с началом половой жизни начались обострения цистита через 12–24 часа после полового акта, принимала монурал с эффектом. Обострения цистита после половых актов возникали 1–2 раза в год. С апреля 2023 года эпизоды возникновения острого цистита после половых актов участились и стали регулярно осложняться восходящим необструктивным пиелонефритом с повышением температуры до 39°С. Принимала левофлоксацин, амоксициллин/клавуланат, цефалоспорины, амикацин, периодически госпитализировалась для стационарного лечения. Последний бактериологический анализ мочи от августа 2023 года – E. Coli 108 КОЕ/мл (резистентность к амоксициллину/клавуланату, к остальным чувствительность, в том числе к монуралу, нитрофурантоину).
В анамнезе оперативных вмешательств не было. Постоянный прием препаратов отрицает. Гинекологический анамнез: беременностей – 1 (аборт 2019), менструации регулярные, безболезненные.
При осмотре на кресле слизистая преддверия влагалища розовая, болезненности при касании нет. Уретра расположена низко. Мышцы влагалища в нормотонусе, безболезненные с двух сторон, триггерных точек не определяется. Шейка мочевого пузыря при пальпации безболезненная.
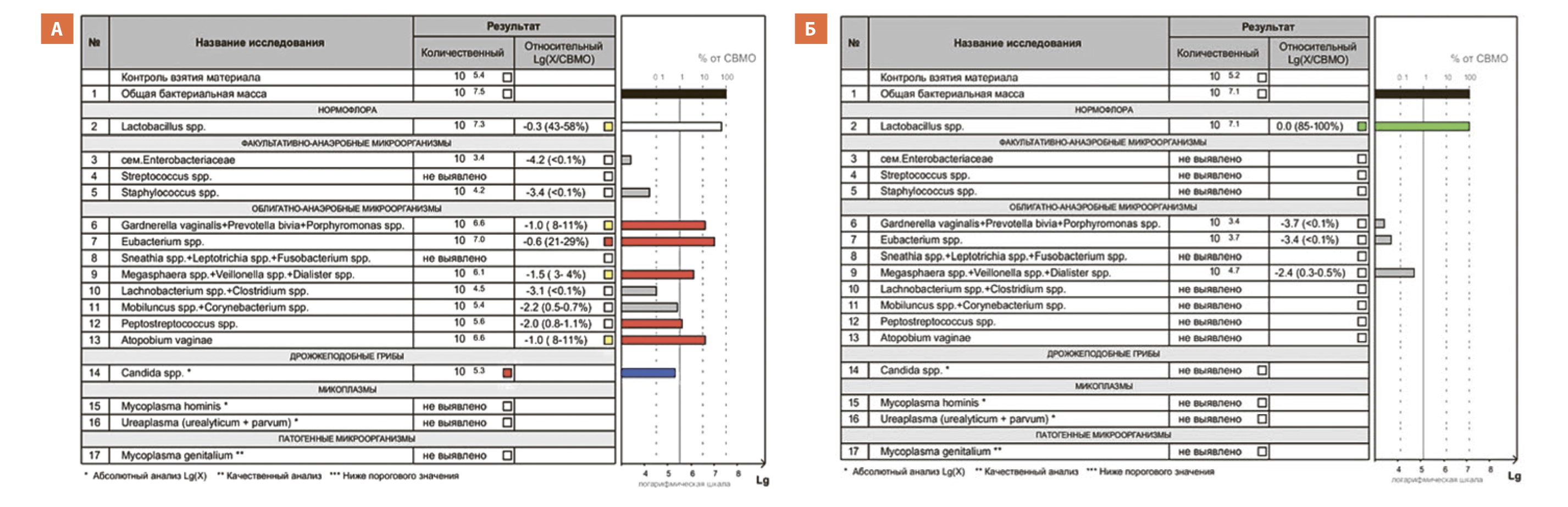
Рис. 3. Результаты Фемофлор-16 у пациентки Х. 23 лет: А – до лечения, Б – через 1 месяц после лечения.
Пациентке рекомендовано: исследование микробиоценоза влагалища (Фемофлор-16) с последующей повторной консультацией. Результаты Фемофлора-16 до лечения представлены на рисунке 3А. Как видно из представленного рисунка у пациентки отмечается выраженный анаэробный дисбиоз с уменьшением доли лактобактерий в общей бактериальной массе. На основании жалоб, анамнеза, результатов осмотра и лабораторных методов обследования, пациентке был назначен комплекс лечебных мероприятий для восстановления микробиоценоза влагалища и слизистой оболочки мочевого пузыря:
- Поведенческая терапия (описана выше).
- Д-манноза 2000 мг в сутки на 3 месяца.
- Иммунопрофилактика (Уроваксом) на 3 месяца.
- Поскоитальная профилактика нитрофурантоин 100 мг после каждого полового акта 3 месяца.
- Капсулы с нифурателом интравагинально 1 раз в сутки на ночь – 8 дней, затем свечи с лактобактериями 1 раз в сутки на ночь 14 дней, через 1 неделю после окончания интравагинальной терапии – контрольный Фемофлор-16.
- Повторная консультация через 3 месяца.
От выполнения внутрипузырных инстилляций препаратами гиалуроновой кислоты было решено воздержаться в связи с отсутствием болезненности шейки мочевого пузыря при вагинальном осмотре.
Через 3 месяца приема назначенной терапии пациентка пришла на контрольную консультацию. По результатам Фемофлора-16 (рисунок 3Б) – абсолютный нормоценоз. За указанный период обострений циститов после половых актов не отмечалось. Пациентке рекомендовано продолжить терапию Д-маннозой и иммунопрофилактику (по бустерной схеме 10 дней каждого месяца), а также снизить дозу посткоитальной антибиотикопрофилактики нитрофурантоином до 50 мг в сутки на 3 месяца.
При контрольном визите еще через 3 месяца (через 6 месяцев после первичного приема) у пациентки за прошедший период не было обострений цистита после полового акта. Рекомендовано отменить посткоитальную профилактику и оставить Д-маннозу и иммунопрофилактику по бустерной схеме до 12 месяцев. На сегодняшний день прошло 2 года с первичного визита пациентки. Пациентка не принимает никакой поддерживающей терапии (за исключением поведенческих мероприятий по нормализации водно-питьевого режима и гигиены), за прошедшие 2 года обострений цистита после половых актов не было.
Таким образом, данный классический вариант посткоитального цистита, несмотря на низкое расположение уретры у пациентки не потребовал оперативного вмешательства для нормализации ее качества жизни. Это еще раз подтверждает, что лечение пациенток с посткоитальным циститом базируется на двух основных принципах: нормализация микробиоценоза влагалища и восстановление функции уротелия. При этом следует помнить, что в более тяжелых случаях может отмечаться присоединение миофасциального компонента с вовлечением тазовых нервов и формированием синдрома хронической тазовой боли. Такие более тяжелые случаи мы разберем в следующих частях нашей рубрики «Доктор, кажется у меня цистит…»
Список литературы
- Stamatiou C., Bovis C., Panagopoulos P., et al. Sex-induced cystitis--patient burden and other epidemiological features. // Clinical and experimental obstetrics & gynecology. Singapore, 2005. Vol. 32, № 3. P. 180–182.
- Gyftopoulos K. The aberrant urethral meatus as a possible aetiological factor of recurrent post-coital urinary infections in young women. // Medical hypotheses. United States, 2018. Vol. 113. P. 6–8.
- Blackledge D. A simple operation for postcoital urethrotrigonitis in women. // The Australian & New Zealand journal of obstetrics & gynaecology. Australia, 1979. Vol. 19, № 2. P. 123–125.
- Ronzoni G., De Giovanni L., Weir J.M., et al. Transposing the urethral meatus in the treatment of recurrent and postcoital cystitis in women with hypospadias. // BJU international. England, 2001. Vol. 87, № 9. P. 894–896.
- Graziottin A., Gambini D. Anatomy and physiology of genital organs - women. // Handbook of clinical neurology. Netherlands, 2015. Vol. 130. P. 39–60.
- Комяков Б.К., Тарасова В.А., Очеленко В.А., et al. Патогенез и лечение посткоитального цистита: верны ли наши представления об этом? // Урология. 2022. № 2. P. 27–32.
- Клинические рекомендации. Острый цистит. Министерство здравоохранения Российской Федерации.2024.
- Lyon R.P., Marshall S. Postcoital water flush in the prevention of urinary tract infection. // JAMA. United States, 1971. Vol. 218, № 12. P. 1828.
- Bergamin P.A., Kiosoglous A.J. Non-surgical management of recurrent urinary tract infections in women. // Translational andrology and urology. China, 2017. Vol. 6, № Suppl 2. P. S142–S152.
- Kwok M., McGeorge S., Mayer-Coverdale J., et al. Guideline of guidelines: management of recurrent urinary tract infections in women. // BJU international. England, 2022. Vol. 130 Suppl 3, № Suppl 3. P. 11–22.
- Sen A. Recurrent cystitis in non-pregnant women. // BMJ clinical evidence. England, 2008. Vol. 2008.
- Jent P., Berger J., Kuhn A., et al. Antibiotics for Preventing Recurrent Urinary Tract Infection: Systematic Review and Meta-analysis. // Open forum infectious diseases. United States, 2022. Vol. 9, № 7. P. ofac327.
- Komyakov B.K., Shevnin M. V, Ochelenko V.A., et al. [Assessment of sexual function and quality of life in women with postcoital cystitis]. // Urologiia (Moscow, Russia : 1999). Russia (Federation), 2023. № 2. P. 20–25.
- Ricucci N., Colonnello E., Limoncin E., et al. Psychosexological correlates of 372 women with vulvodynia, overactive pelvic floor, postcoital cystitis, and interstitial cystitis. // The journal of sexual medicine. Netherlands, 2024. Vol. 21, № 5. P. 471–478.
- Barr S.J. Urethral-hymenal fusion: a cause of postcoital cystitis. // American journal of obstetrics and gynecology. United States, 1969. Vol. 104, № 4. P. 595–597.
- Alexander A.R., Morrisseau P.M., Leadbetter G.W.J. Urethral-hymenal adhesions and recurrent post-coital cystitis: treatment by hymenoplasty. // The Journal of urology. United States, 1972. Vol. 107, № 4. P. 597–598.
- Reziciner S. [Prevention of recurrent post-coital cystitis using hymenoplasty]. // Annales d’urologie. France, 1988. Vol. 22, № 6. P. 446–451.
- Снурницына О.В., Иноятов Ж.Ш., Лобанов М.В., et al. Малоинвазивное хирургическое лечение женской гипоспадии и гипермобильности уретры, осложненных посткоитальной дизурией // Вестник урологии. 2021. Vol. 9, № 1. P. 72–79.
- Глыбочко П.В., Рапопорт Л.М., Иноятов Ж.Ш., et al. Новый подход к лечению посткоитального цистита // Вопросы урологии и андрологии. 2019. Vol. 7, № 1. P. 59–63.
- Descazeaud C., Cuvelier G., Descazeaud A., et al. Evaluation of hymenal adhesions resection in the treatment of recurrent post-coital cystitis. // Progres en urologie : journal de l’Association francaise d’urologie et de la Societe francaise d’urologie. France, 2022. Vol. 32, № 17. P. 1490–1497.
- O’DONNELL R.P. Relative hypospadias potentiated by inadequate rupture of the hymen: a cause of chronic inflammation of the lower part of the female urinary tract. // The Journal of the International College of Surgeons. United States, 1959. Vol. 32. P. 374–388.
- Репкина А.С., Сулейманов З.К. Путь развития хирургического лечения посткоитального цистита // Международный журнал гуманитарных и естественных наук. 2025. № 1-3(100). P. 73–78.
- Комяков Б.К. Экстравагинальная транспозиция уретры в лечении посткоитального цистита // Урология. 2013. № 5. P. 12–14.
- Smith P.J., Roberts J.B., Ball A.J. “Honeymoon” cystitis: a simple surgical cure. // British journal of urology. England, 1982. Vol. 54, № 6. P. 708–710.
- Комяков Б.К. Посткоитальный цистит: взгляд на проблему, техника и результаты экстравагинальной транспозиции уретры // Урология. 2025. № 2. P. 135–140.









Комментарии