Д. Кузьмин1,2, Е.А. Щуплова1
- 1Институт клеточного и внутриклеточного симбиоза УрО РАН, Оренбург, Россия
- 2Оренбургская областная клиническая больница, Оренбург, Россия
Пиелонефрит является самым частым заболеванием почек во всех возрастных группах, причем в 25–30% случаев течение острого пиелонефрита осложняется развитием гнойно-деструктивных форм (апостематозный пиелонефрит, карбункул и абсцесс почки). Частота нефрэктомий при гнойном пиелонефрите составляет 8,2–44,6% [1]. Послеоперационная летальность при этом достигает 28,4–48,5% [1, 2].
На фоне отмечающейся тенденции к увеличению заболеваемости пиелонефритом и его септических проявлений в виде гнойно-деструктивных форм проблема адекватной диагностики поражений почек остается весьма актуальной [3]. Несмотря на наличие современного диагностического оборудования, мощных антибактериальных средств и широких оперативных возможностей, число больных гнойными заболеваниями почек продолжает неуклонно возрастать [4].
С целью упрощения дифференциальной диагностики серозной и гнойной стадий острого пиелонефрита Л.А. Синяковой были разработаны критерии, включающие клинические симптомы, результаты лабораторных исследований мочи и крови, рентгенологического и ультразвукового исследований [5]. В настоящее время широкое применение находят современные высокотехнологичные методы исследования, которые позволяют оценивать структурно-функциональное состояние почечной паренхимы на принципиально ином, максимально приближенном к морфологическому уровне диагностики. К ним относят УЗ-доплерографию, магнитно- резонансную томографию (МРТ), мультиспиральную компьютерную томографию (МСКТ) [6]. Однако, к сожалению, не всегда с полной уверенностью на основании результатов объективного осмотра и анализа лабораторно-инструментальных данных можно дифференцировать серозную и гнойную стадии острого пиелонефрита. В связи с этим нами были разработаны дополнительные микробиологические критерии для диагностики стадий острого пиелонефрита, в частности перехода серозной в гнойную стадию.
Материалы и методы
В наших исследованиях были обследованы 35 пациентов (26 женщин, 9 мужчин) с острым пиелонефритом в возрасте от 19 до 85 лет (средний возраст 52 года). Обследование включало сбор анамнеза, выявление клинических симптомов, в т.ч. болезненности в области почек, общие анализы крови и мочи, а также рентгенологическое и ультразвуковое исследования. Наряду с этим у всех пациентов брали кровь из локтевой вены стерильным одноразовым шприцем и переливали ее в пробирку с антикоагулянтом. Изучение образцов крови проводили с помощью классического бактериологического метода и молекулярно-генетической флуоресцентной in situ гибридизации (FISH). При бактериологическом методе для идентификации гемокультур использовали тест-системы: Enterotest-24, Staphytest («Lachema», Чехия). При FISH использовали ДНК-зонды, комплементарные видоспецифическим участкам гена 16S рРНК микроорганизмов Oligo 1 (Enterobacteriaceaе), Oligo 3 (Staphylococcus aureus), Oligo 5 (Staphylococcus epidermidis) Oligo 6 (Staphylococcus spp.)). Данные зонды синтезировали в ООО «ДНК- синтез» (Москва) и на 5'-конце пометили флуоресцеинаизотиоцианатом (FITC). Кровь больных обрабатывали по методу, описанному в работе Е.А. Щупловой и соавт. [7]. Далее с помощью конфокального лазерного сканирующего микроскопа (КЛСМ) определяли число адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий.
Статистический анализ полученных результатов проводили с помощью программы Statistica 6.0. Для оценки различий (р) использовали критерий (t) Стьюдента, различия считали значимыми (достоверными) при р<0,05.
Результаты и обсуждение
У всех 35 обследованных пациентов наблюдали гипертермию. Результаты УЗИ выявили у всех пациентов признаки острого пиелонефрита. В клиническом анализе крови отмечали лейкоцитоз (12,4±3,8×109/л) со сдвигом лейкоцитарной формулы влево, в анализе мочи – лейкоцитурию, бактериурию. Полученные клинические и лабораторно-инструментальные результаты явились показанием к микробиологическому исследованию крови. Бактериологический метод позволил выделить гемокультуру (монокультуру) только у 1 (2,9%) пациента, которую с помощью биохимических тестов идентифицировали как Escherichia coli. К сожалению, недостатком бактериологического метода является длительность культивирования посевов мочи на питательные среды до 5–7 сут., длительное время для идентификации чистой культуры с помощью различных биохимических тестов, кроме того, известно, что эффективность бактериологического метода даже при уросепсисе составляет около 45% [6]. Однако бактериологический метод необходим при выявлении резистентности гемокультур к антибактериальным препаратам.
В связи с этим в наших исследованиях параллельно был использован современный молекулярно-генетический метод флуоресцентной in situ гибридизации (FISH) для обнаружения микроорганизмов в образцах крови обследуемых больных Чувствительность данного метода составляет 95% [8], время для исследований сокращается до 8–12 часов, не требуется выделения гемокультуры, можно сразу использовать образец крови. Метод FISH позволяет одновременно проводить идентификацию микроорганизмов, т.к. ДНК и рРНК бактерий гибридизуется с ДНК-зондами, комплементарными таксонспецифическим участкам гена 16S рРНК [8].
В исследуемых образцах крови, используя метод FISH и люминесцентную микроскопию, подсчитывали число адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий. Параллельно эти же образцы крови изучали с помощью бактериологического метода для выделения гемокультур (табл. 1).
Как видно из табл. 1, метод FISH оказался более чувствительным, чем бактериологи ческий метод. С помощью бактериологического метода удалось выявить наличие гемокультуры только у 6,6±1,2% обследуемых больных, в то время как метод FISH показал наличие гемокультур у 30±5,8% больных острым пиелонефритом.
Таблица 1. Сравнение возможности обнаружения гемокультур у больных острым пиелонефритом бактериологическим методом и методом FISH
|
Обследуемые больные |
Бактериологический метод (%) |
Метод FISH(%) |
|---|---|---|
|
Больные острым пиелонефритом (n= 35) |
6,6±1,2 |
30±5,8 |
В дальнейшем для диагностики стадий острого пиелонефрита и определения вероятности развития гнойных осложнений острого пиелонефрита с помощью метода FISH определили долю (в %) бактериальных клеток, адгезированных на поверхности эритроцитов, и внутриэритроцитарно расположенных бактерий с использованием данных ДНК-зондов. Полученные результаты сопоставили с клиническим анамнезом больных острым пиелонефритом. Результаты представлены в табл. 2.
Из представленной табл. 2 видно, что в образцах крови обследуемых больных острым пиелонефритом наблюдали свечение как адгезированных бактерий на поверхности эритроцитов, так и внутриэритроцитарное расположение, но в разном долевом соотношении.
Таблица 2. Число обнаруженных бактерий в образцах крови больных острым пиелонефритом
|
Стадии острого пиелонефрита, число обследуемых больных (n=35) |
Адгезия (%) |
Внутриэритроцитарное проникновение (%) |
||||||||
|
Oligo 1 |
Oligo |
Oligo |
Oligo 5 |
Oligo 6 |
Oligo |
Oligo |
Oligo |
Oligo |
Oligo |
|
|
1 |
2 |
3 |
5 |
6 |
||||||
|
Серозная стадия (n =25) |
1,8±0,7 |
0 |
0,6±0,2 |
0 |
0,6±0,2 |
1,2±0,6 |
0 |
1,1±0,6 |
0 |
0 |
|
Переходная стадия (n =5) |
8,9±3,8 |
1,8±0,7 |
2,4±4,1 |
0 |
1,8±0,7 |
9,3±3,8 |
4,7±2 |
2,3±1,2 |
0 |
1,2±0,6 |
|
Гнойная стадия (n =5) |
47±5,9 |
10,7±3,9 |
20,8±4,1 |
3,6±1,9 |
0 |
42±5,3 |
10,4±3,9 |
22±4,6 |
5,8±2,1 |
0 |
Результаты наших исследований показали, что при адгезии бактерий к поверхности эритроцитов (рис. 1) в 26 раз чаще наблюдали свечение с ДНК-зондом (Oligo 1), характерного для представителей семейства Enterobacteriaceaе в группе пациентов с гнойной стадией острого пиелонефрита, чем в группе с серозной стадией и в 5,3 раза чаще, чем в группе с переходной стадией, что составляло 47±5,9% против 1,8±0,7 и 8,9±3,8% соответственно (при р<0,05). Среди ДНК-зондов, характерных для стафилококков, в 34,6 раза чаще наблюдали свечение бактерий S. aureus (Oligo 3) в группе пациентов с гнойной стадией, чем в группе с серозной и в 8,6 раза чаще, чем у пациентов с переходной стадией острого пиелонефрита, что составляло 20,8±4,1% против 2,4±4,1 и 0,6±0,2% соответственно (при р<0,05).
Необходимо отметить, что свечение бактерий с Oligo 5 – комплементарные таксон-специфическим участкам гена S. epidermidis наблюдали в образцах крови только у пациентов с гнойной стадией пиелонефрита.
Аналогичные результаты оказались и при внутриэритроцитарном проникновении бактерий в образцах крови обследуемых больных (рис. 2).

Рис. 1. Адгезия S. aureus к мембране эритроцита в образце крови пациента с гнойно-деструктивной формой острого пиелонефрита
Метод флуоресцентной in situ гибридизации (FISH). Конфокальная лазерная сканирующая микроскопия. Ув. 1000×
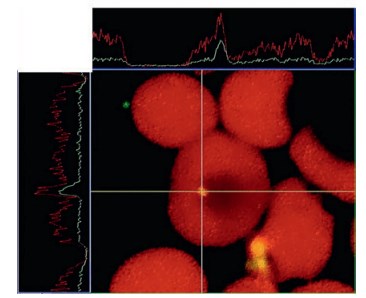
Рис. 2. Внутриэритроцитарное проникновение бактерий в образце крови пациента с гнойно-деструктивной формой острого пиелонефрита Обработка исследуемого материала методом FISH. Конфокальная лазерная сканирующая микроскопия. Графики флуоресцентных сигналов: зеленый флуоресцеинизотиоцианад – бактерии. Красный сигнал – эритроциты. Ув. 1000×
Необходимо отметить, что при изучении образцов крови обследуемых пациентов с серозной и переходной стадиями пиелонфрита (n=30) свечение от бактерий наблюдали, но гораздо реже. Было выдвинуто предположение, что бактерии появляются в серозной стадии острого пиелонефрита задолго до деструкции (образование гнойничковых очагов в паренхиме почки) и увеличивается их число в переходной стадии. Данные бактерии могут быть «предвестниками» перехода из серозной стадии в гнойную при остром пиело- нефрите.
Далее провели статистический анализ полученных данных, результаты которого позволили получить регрессионную модель, описывающую связь между числом адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий и развитием стадий острого пиелонефрита.
Регрессионная модель представляет собой интегральный показатель (ИП), значения которого позволили получить диапазоны соответствующих стадий при развитии острого пиелонефрита.
ИП рассчитывается по формуле: ИП=1,28-0,37×X1+1,35×X2,
где X1 – общее число всех адгезированных бактерий на поверхности эритроцитов в образце крови больного, обработанных зондами: Oligo 1, Oligo 2, Oligo 3, Oligo 5, Oligo 6, X2 – общее число всех внутриэритроцитарно расположенных бактерий в образце крови больного, обработанных зондами: Oligo 1, Oligo 2, Oligo 3, Oligo 5, Oligo 6.
По результатам значений иИП и клинически подтвержденных диагнозов получили диапазоны значений для дифференциаций стадий острого пиелонефрита, которые представлены в табл. 3.
Как видно из табл. 3, чем больше значения ИП (число адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий), тем больше вероятность развития гнойной стадии острого пиелонефрита и, соответственно, тяжелее состояние больного.
Таблица 3. Диапазоны значений для дифференциации стадий острого пиелонефрита
|
№п/п |
Стадии острого пиелонефрита |
Значение ИП |
|---|---|---|
|
1 |
Серозная |
Меньше 3 |
|
2 |
Переходная |
3–6 |
|
3 |
Гнойная |
Больше 6 |
Таким образом, дифференциальная диагностика серозной и гнойной стадий острого пиелонефрита достаточна сложна. Несмотря на существующие диагностические критерии, далеко не всегда врач может вовремя поставить точный диагноз. По мнению З.С. Вайнберга, каждый пациент с подозрением на наличие гнойного процесса в почках «в известной степени есть кроссворд, и от умения врача находить единственно правильные ответы и решения зависит жизнь пациента» [9].
Результаты данной работы показали, что при диагностике острого пиелонефрита имеется необходимость применения дополнительных методов для выявления микроорганизмов в кровотоке обследуемых больных, причем для обнаружения гемокультуры более точный и быстрый по времени оказался современный молекулярно-генетический метод FISH. По этиологической значимости первостепенное место занимали представители семейства Enterobacteriaceaе, на втором месте оказался S. aureus. Полученные результаты нашли подтверждение в литературе [9], где отмечается, что при гнойном пиелонефрите основными возбудителями являются грамотрицательные условно-патогенные микроорганизмы (76,9%).
Таким образом, использование современного молекулярно-генетического метода флуоресцентной in situ гибридизации в диагностике острого пиелонефрита можно рекомендовать как дополнительный критерий для дифференциации серозной и гнойной стадий заболевания.
Нами был получен патент на изобретение №2716713 «Способ диагностики острого пиелонефрита» (см. рис. 3).

Заключение
Одной из важных проблем в урологии считаются своевременная диагностика гнойно-деструктивного пиелонефрита и его осложнения в виде уросепсиса. Все известные методы исследований выявляют уже сформированный гнойный процесс, что объясняет поиск новых высокоспецифичных и чувствительных маркеров их развития [4]. Результаты нашей работы показали возможность создания дополнительного диагностического критерия для дифференциаций пациентов с серозной и гнойной формами острого пиелонефрита. Данный способ заключается в определении числа адгезированных на поверхности эритроцитов и внутриэритроцитарно расположенных бактерий, обнаруженных с помощью современного молекулярно-генетического метода флуоресцентной in situ гибридизации. Метод FISH позволяет обнаружить и одновременно провести идентификацию микроорганизмов, т.к. ДНК и рРНК бактерий гибридизуется с ДНК-зондами, комплементарными таксонспецифическим участкам гена 16S рРНК микроорганизмов. Другим преимуществом FISH является возможность проведения дифференциальной диагностики серозной и гнойной стадий острого пиелонефрита по образцам крови обследуемых больных без выделения гемокультуры.
ЛИТЕРАТУРА
- Лоран О.Б., Синякова Л.А., Берников Е.В. Функциональное состояние почек у больных, перенесших гнойный пиелонефрит. Урология. 2008; 5:3–7.
- Плеханов В.Н. О трудностях диагностики гнойно-деструктивных форм острого пиелонефрита у мужчин молодого возраста. Вестник РУДН, серия Медицина. 2010;1:172–7.
- Mahmood T., Puckrin R., Sugar L., Naimark D. Staphylococcus-associated glomerulonephritis mimicking henoch-schönlein purpura and cryoglobulinemic vasculitis in a patient with an epidural abscess: a case report and brief review of the literature. Canadian J. Kidney Health Dis. 2018;5:1–6.
- Чернова Ю.Г., Неймарк А.И., Момот А.П. Роль пресепсина в оценке тяжести и эффективности лечения гнойного пиелонефрита. Урология. 2018; 5:22–6.
- Синякова Л.А. Рецидивирующие инфекции нижних мочевых путей: сложности упрощенной диагностики. Урология сегодня. 2013;1:18–21.
- Аляев Ю.Г., Газимиев М.А., Еникеев Д. Современные аспекты диагностики острого пиелонефрита. Врач. 2009; 6:76–8.
- Щуплова Е.А., Черкасов С.В., Плотников А.О. Применение метода FISH для выявления бактерий, локализованных на поверхности и внутри эритроцитов. Клиническая лабораторная диагностика. 2017;62(7): 431–5.
- Гаврилов С.Н., Скачкова Т.С., Шипулина О.Ю., Савочкина Ю.А., Шипулин Г.А., Малеев В.В. Современные молекулярно-генетические методы, используемые для этиологической диагностики сепсиса. Журнал микробиологии, эпидемиологии и иммунобиологии. 2016; 2:91–9.
- Белый Л.Е. Неотложная урология: Руководство для врачей. М., 2011. 472 с.









Комментарии