В.К. Карпов 1,3, С.А. Капранов 3, Б М. Шапаров 1,2
- 1Кафедра урологии и андрологии факультета фундаментальной медицины МГУ им. М.В. Ломоносова, Москва, Россия
- 2МНОЦ МГУ им. М.В. Ломоносова, Москва, Россия 3ГБУЗ «ГКБ №31 ДЗМ», Москва, Россия
Продолжает работу наша рубрика, посвященная рентгенэндоваскулярным методам диагностики и лечения в урологии. Сегодняшняя тема является одной из наиболее актуальных в малоинвазивном лечении больных гиперплазией простаты – эмболизация простатических артерий (ЭПА).
Введение Доброкачественная гиперплазия предстательной железы (ДГПЖ) – заболевание, чрезвычайно распространенное среди мужчин старше 40 лет. Морфологически оно представляет собой пролиферацию гладкомышечных волокон и эпителиальных клеток в транзиторной зоне предстательной железы (ПЖ), вследствие чего формируется механическое препятствие для оттока мочи, а также стимулируются адренорецепторы шейки мочевого пузыря. Частота встречаемости ДГПЖ увеличивается с возрастом: среди мужчин старше 60 лет она встречается в 50% случаев, а старше 85 лет – почти в 90% [1].
Основным методом лечения больных гиперплазией ПЖ является консервативная терапия, однако в случаях, когда лекарственное лечение оказывается неэффективным, пациенту показано выполнение оперативного лечения. Оперативное лечение зачастую оказывается невозможным ввиду отягощенного соматического статуса пациента, поэтому особую актуальность в последнее десятилетие приобрели малоинвазивные оперативные методы лечения пациентов с ДГПЖ. Они позволяют сократить объем анестезиологического пособия, длительность оперативного лечения и снизить вероятность развития послеоперационных осложнений и их тяжесть.
Среди множества минимально инвазивных оперативных методов лечения ДГПЖ обращает на себя внимание суперселективная эмболизация артерий ПЖ (ЭПА – эмболизация простатических артерий), главным преимуществом которой является то, что данная методика выполняется под местной анестезией и может быть выполнена пациентам пожилого возраста с наличием тяжелых сопутствующих заболеваний.
Суперселективная ЭПА ЭПА ПЖ – современный минимально-инвазивный оперативный метод лечения больных гиперплазией ПЖ. Данная техника была разработана с целью улучшения результатов лечения пациентов с гиперплазией ПЖ и отягощенным соматическим статусом, которым невозможно выполнить традиционное эндоскопическое или открытое оперативное лечение, а консервативная терапия неэффективна. К основным преимуществам данного метода относится отсутствие необходимости в применении анестезиологического пособия, быстрая активизация пациента, меньшая вероятность развития осложнений. ЭПА выполняется под рентгеноскопическим контролем с применением современных эндоваскулярных микрокатетеров, позволяющих суперселективно катетеризировать простатические артерии и осуществить таргетную доставку эмболизирующего агента в сосудистое русло a. prostatica до достижения стаза рентгенконтрастного препарата, что свидетельствует о полной окклюзии ветвей простатической артерии (рис. 1).
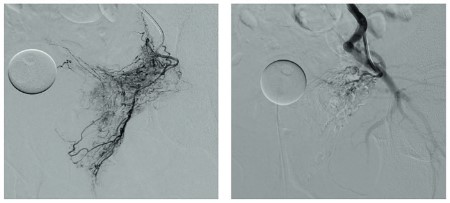
Рис. 1. Ангиограммы до и после ЭПА
Лечебный эффект достигается за счет развития в паренхиме ПЖ ишемического некроза, что приводит к склерозу, уменьшению объема железы и снижению активности адренергических рецепторов в простатическом отделе уретры (рис. 2).
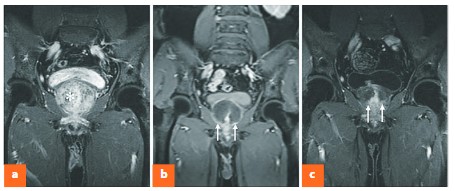
Рис. 2.DCE-MRI во фронтальной плоскости до и после ЭПА
a – изображение, полученное до ЭПА: демонстрирует ДГПЖ большого объема (92,3 см3),b – изображение, полученное через 1 неделю после ЭПА: демонстрирует 90% зонуишемии ПЖ (стрелки), c – изображение, полученное через 15 месяцев после ЭПА:демонстрирует уменьшение объема ПЖ на 57,5% (стрелки)
Несмотря на свою относительную новизну ЭПА широко внедрена в клиническую практику во всем мире. С 2016 г. ЭПА была одобрена FDA (Food and Drug Administration) к применению на территории США. С 2018 г. ЭПА входит в перечень методов, рекомендованных NICE (National Institute for Health and Care Excellence) для лечения больных гиперплазией ПЖ в Великобритании. В России ЭПА выполняется с 2004 г., а с 2019 г. включена в клинические рекомендации Минздрава РФ по лечению больных ДГПЖ в качестве метода, рекомендуемого для пациентов с отягощенным соматическим статусом.
История вопроса Исходно ЭПА использовалась исключительно для гемостаза при некупируемой макрогематурии. В 2000 г. J.S. De Meritt et al. [2] сообщили о пациенте с кровотечением и острой задержкой мочеиспускания на фоне ДГПЖ, которому выполнили ЭПА вследствие невозможности стандартного оперативного лечения из-за сопутствующих заболеваний. После успешного купирования кровотечения наблюдалось неожиданное облегчение симптомов нарушения функции нижних мочевыводящих путей (СНМП) без каких-либо осложнений и сексуальной дисфункции, а через 12 месяцев после ЭПА уменьшился и объем ПЖ на 40%.
Результаты первого клинического исследования применения ЭПА для лечения больных ДГПЖ были опубликованы А.И. Неймарком и соавт. [3] в 2009 г. ЭПА была успешно выполнена 38 пациентам с тяжелыми сопутствующими заболеваниями, для которых стандартное оперативное лечение оказалось невозможным. Объем ПЖ в среднем уменьшился на 45%, во всех наблюдениях после операции уменьшилась выраженность СНМП по шкале IPSS, 4 пациентам стало возможным убрать цистостомический дренаж.
По данным исследования J.M. Pisco et al. [4], опубликованным в 2011 г., ЭПА оказалась технически успешна у 14 из 15 пациентов. У большинства пациентов сумма баллов по шкале IPSS снизились, QoL улучшилось, Qmax увеличилась, а объем ПЖ уменьшился. У 28,6% пациентов ЭПА не привела к уменьшению СНМП. Среди серьезных осложнений имела место только ишемия мочевого пузыря у 1 пациента, потребовавшая открытой резекции. Те же авторы в аналогичном исследовании с участием большего числа пациентов (104 человека), выявили, что через 1 месяц после ЭПА средний суммарный балл по шкале IPSS уменьшился на 10, средний балл QoL уменьшился на 2, средняя Qmax повысилась на 38%, средний объем ПЖ уменьшился на 20%, средний объем остаточной мочи снизился на 30 мл, а средний балл по опроснику IIEF повысился на 0,5 [5].
В 2014 г. F.C. Carnevale et al. [6] представили усовершенствованную технику ЭПА – PErFecTED- эмболизацию, которая через 12 месяцев наблюдения продемонстрировала следующие показатели по сравнению с ТУРП по критерию послеоперационной суммы баллов по шкале IPSS: 3,6±2,9 в группе PErFecTED-эмболизации против 6,1±8,6 у пациентов после ТУРП. У пациентов после классической ЭПА и PerFecTED-эмболизации не встречались осложнения, которые были при ТУРП, и включали в себя неудержание мочи, разрыв простатической капсулы, ретроградную эякуляцию, а также повторную госпитализацию в связи с гематурией.
Одно из наиболее крупных исследований на сегодняшний день было опубликовано в 2020 г. А.А. Камаловым и соавт. [7], которые представили результаты многоцентрового исследования с включением 1015 пациентов с ДГПЖ. Двусторонняя эмболизация была успешно выполнена в 931 (91,7%) случае, 49 (4,8%) пациентам из-за технических трудностей потребовалась пункция контралатеральной бедренной артерии. Односторонняя ЭПА была выполнена в 69 (6,8%) случаях в связи с анатомическими особенностями сосудистого русла. В течение 24-месячного наблюдения сумма баллов по шкале IPSS снизилась с 22±2,4 до 10±2,9, Qmax увеличилась с 7,6±1,2 до 15,7±4,9 мл/сек, объем остаточной мочи уменьшился с 132±19,4 до 72±15,1 мл, объем ПЖ сократился с 96±24,7 до 62±11,6 см3, уровень простатического специфического антигена (ПСА) снизился с 5,56±2,7 до 2,8±0,5 нг/мл. В данном исследовании было также проведено сравнение эффективности классической ЭПА и методики PErFecTED. Сравнительный анализ выявил большую эффективность методики PErFecTED, превышающую таковую в группе классической ЭПА примерно в 3 раза.
Применение ЭПА в клинической практике
ЭПА в качестве альтернативного метода используется для лечения больных ДГПЖ уже более 10 лет, и многие обзорные исследования и мета-анализы подтверждают ее безопасность и эффективность. Кроме того, проведено множество исследований, сравнивающих безопасность и эффективность применения ЭПА со стандартным оперативным лечением. В этих сравнительных клинических испытаниях успех достигался как после ЭПА, так и после стандартного оперативного лечения. Эффективность ЭПА оказалась сопоставимой с ТУРП и открытой аденомэктомией (ОА) во всех шести исследованиях (см. таблицу).
Таблица. Результаты исследований, сравнивающих безопасность и эффективность ЭПА со стандартным оперативным лечением
|
Исследования |
Y. Gao, et al. [8] |
G.I. Russo,et al. [9] |
F.C. Carneval, et al. [10] |
Z. Qiu, et al.[11] | A.F. Ray, et al. [12] | D. Abt, et al. [13] | ||||||
| Параметры | ЭПА | ТУРП | ЭПА | ОА | ЭПА | ТУРП | ЭПА | ТУРП | ЭПА | ТУРП | ЭПА | ТУРП |
|
Сумма баллов по шкале IPSS |
-15,6 | -16,3 | -13,58 | -19,4 | -12,8 | -21,5 | -10,8 | -14,3 | -10,9 | -15,2 | -9,23 | -10,77 |
| QoL | -3,2 | -3,2 | – | – | -2,5 | -3,7 | -2 | -2,4 | -2,6 | -3,4 | -2,33 | -2,69 |
| Qmax (мл/с) | +13,7 | +14,8 | +15,97 | +9,63 | +3,1 | +17,4 | +12,3 | +14,9 | +4,4 | +8,6 | +5,19 | +15,34 |
|
Объем ПЖ, см3 |
-107,5 |
-100,2 | -43,87 | -58,8 | -64,7 | -70 | – | – | -40,4 | -78,1 |
-86,36 |
-199,98 |
|
Изменение объема ПЖ, % |
-46,06 | -58,11 | – | – |
-19,21 |
-43,46 |
-34,98 |
-52,11 |
-28,26 |
– |
-23,05 |
-53,58 |
| ПСА, нг/мл | -1,6 | -1,9 | -1,48 | -2,88 | -1,2 | -1,6 | – | – | – | – | -2 | -3,11 |
| IIEF-5 | – | – | +0.68 | -4,22 | -1,7 | +3,6 | – | – | +1 | -0,2 | -0,98 | -1,84 |
В крупном рандомизированном контролируемом исследовании, опубликованном Y. Gao et al. [8], ЭПА сравнивается с ТУРП на выборке из 114 пациентов с наблюдением в течение 24 месяцев. Пациенты обеих групп достигли значительного клинического улучшения, снижения объема ПЖ и уровня ПСА по сравнению с дооперационным периодом. Сравнение между группами показало, что пациенты перенесли ТУРП с более значительным улучшением показателей IPSS, QoL, Qmax, объема остаточной мочи, объема ПЖ и уровня ПСА, чем пациенты, перенесшие ЭПА.
В рандомизированном плацебо-неконтролируемом исследовании с участием 103 больных и периодом наблюдения 12 недель D. Abt et al. [13] продемонстрировали, что среднее снижение суммы баллов по шкале IPSS через 12 недель составило 9,23 и 10,77 после ЭПА и ТУРП соответственно. Кроме того, изменения Qmax, объема остаточной мочи и объема ПЖ были лучше после ТУРП, чем после ЭПА.
Частота рецидивов – ключевой критерий оценки любого метода лечения пациентов с ДГПЖ. Имеющиеся данные свидетельствуют о том, что ЭПА менее эффективна в долгосрочной перспективе, чем ТУРП. Y. Gao et al. [8] сообщают, что необходимость в последующей ТУРП возникла у 9,4 и 3,8% пациентов, получавших ЭПА и ТУРП соответственно. A.F. Ray et al. сообщают, что необходимость в последующей ТУРП в течение 12–24 месяцев после ЭПА возникла у 19,9% пациентов, в то время как частота повторных операций после ТУРП составила только 5,6%.
ЭПА ассоциирована с меньшей кровопотерей, меньшим числом гемотрансфузий, менее длительной госпитализацией, меньшим числом и менее тяжелыми побочными эффектами, чем ТУРП. В отличие от стандартных операций на ПЖ ЭПА можно выполнить под местной анестезией. Следовательно, нарушения свертываемости крови, анемия и антикоагулянтная терапия не являются противопоказаниями к эмболизации.
Сохранение эякуляторной функции является важным критерием выбора для многих пациентов. В литературе сообщается, что после ЭПА только в 2 из более чем 1000 случаев имело место нарушение эякуляции, в то время как после ТУРП ретроградная эякуляция встречается в 60–65% случаев.
Несмотря на то, что в вышеуказанных исследованиях ЭПА не продемонстрировала лучших результатов по сравнению с ТУРП и открытой аденомэктомией, этот метод может быть достойной альтернативой для лечения больных ДГПЖ, благодаря таким преимуществам, как минимальная инвазивность, сохранение сексуальной функции, более короткой срок госпитализации. Особенно актуальна ЭПА для тех пациентов, которым противопоказано стандартное оперативное лечение, либо для тех пациентов, которые сами отказываются от него.
Перспективным направлением является использование ЭПА в качестве первого этапа лечения больных ДГПЖ с большим объемом ПЖ. В результате ЭПА объем ПЖ уменьшается до допустимых значений, и вторым этапом выполняется эндоскопическое гисторедуктивное лечение. P. Li et al. [14] в 2017 г. опубликовали результаты такого двухэтапного лечения: ЭПА c последующей HoLEP. Успех был достигнут у всех 24 пациентов.
Заключение
Исходя из имеющихся на сегодняшний день данных, ЭПА является эффективной и безопасной минимально инвазивной методикой лечения ДГПЖ. Преимущества ЭПА заключаются в том, что это требует только местной анестезии или умеренной седации. Несмотря на имеющиеся данные, ЭПА еще предстоит найти свое место среди методов лечения больных ДГПЖ. Требуются дальнейшие долгосрочные многоцентровые контрольные исследования, помогающие оценить эффективность и безопасность, а также уточнить четкие показания и противопоказания к выполнению данного вида оперативного лечения.
ЛИТЕРАТУРА
- Berry S.J., Coffey D.S., Walsh P.C., Ewing L.L. The development of human benign prostatic hyperplasia with age. J. Urol. 1984;132(3):474–9. doi: 10.1016/s0022-5347(17)49698-4. PMID: 6206240
- DeMeritt J.S., Elmasri F.F., Esposito M.P. et al. Relief of benign prostatic hyperplasia-related bladder outlet obstruction after transarterial polyvinyl alcohol prostate embolization. J. Vasc. Interv. Radiol. 2000;11:767–70
- Неймарк А.И., Яковец Е.А., Яковец Я.В. и др. Оценка эффектитвности рентгенэндоваскулярной эмболизации артерий при ДГПЖ с помощью ультразвуковой трансректальной допплерографии. Андрология и генитальная хирургия. Материалы международного конгресса по андрологии. 2009;2:117 с.
- Pisco J.M., Pinheiro L.C., Bilhim T. et al. Prostatic arterial embolization to treat benign prostatic hyperplasia. J. Vasc. Interv. Radiol. JVIR. 2011;22(1):11–9; quiz 20 https://doi.org/10.1016/j.jvir.2010.09.030.
- Pisco J.M., Campos Pinheiro L., Bilhim T., et al. Prostatic arterial embolization for benign prostatic hyperplasia: short- and intermediate-term results. Radiol. 2013;266(2):668–77. https://doi.org/10.1148/radiol.12111601.
- Carnevale F.C., Moreira A.M., Antunes A.A. The ‘‘PErFecTED technique’’: proximal embolization first, then embolize distal for benign prostatic hyperplasia. J. Cardiovasc. Interv. Radiol. 2014; 37(6):1602–5.
- Kamalov A., Kapranov S., Neymark A. et al. Prostatic Artery Embolization for Benign Prostatic Hyperplasia Treatment: A Russian Multicenter Study in More Than 1,000 Treated Patients. Am. J. Mens. Health. 2020;14(3):1557988320923910. doi: 10.1177/1557988320923910. [PMID: 32486959; PMCID: PMC7273342].
- Gao Y., Huang Y., Zhang, R. et al. Benign prostatic hyperplasia: prostatic arterial embolization versus transurethral resection of the prostate--a prospective, randomized, and controlled clinical trial. Radiol. 2014;270(3):920–8. https://doi.org/10.1148/radiol.13122803.
- Russo G. I., Kurbatov D., Sansalone S. et al. Prostatic Arterial Embolization vs Open Prostatectomy: A 1-Year Matched-pair Analysis of Functional Outcomes and Morbidities. Urol. 2015;86(2):343–8. https://doi.org/10.1016/j.urology.2015.04.037.
- Carnevale F.C., Iscaife A., Yoshinaga E.M. et al. Transurethral Resection of the Prostate (TURP) Versus Original and PErFecTED Prostate Artery Embolization (PAE) Due to Benign Prostatic Hyperplasia (BPH): Preliminary Results of a Single Center, Prospective, Urodynamic- Controlled Analysis. Cardiovasc. Interv. Radiol. 2016;39(1):44–52. https://doi.org/10.1007/s00270-015-1202-4.
- Qiu Z., Zhang C., Wang X. et al. Clinical evaluation of embolization of the superior vesical prostatic artery for treatment of benign prostatic hyperplasia: a single-center retrospective study. Wideochirurgia i Inne Techniki Maloinwazyjne=Videosurg. Other Miniinvas. Techniq. 2017;12(4):409–16. https://doi.org/10.5114/wiitm.2017.72324.
- Ray A.F., Powell J., Speakman M.J. et al. Efficacy and safety of prostate artery embolization for benign prostatic hyperplasia: an observational study and propensity-matched comparison with transurethral resection of the prostate (the UK-ROPE study). BJU International. 2018;122(2):270–82. https://doi.org/10.1111/bju.14249.
- Abt D., Hechelhammer L., Müllhaupt G. et al. Comparison of prostatic artery embolisation (PAE) versus transurethral resection of the prostate (TURP) for benign prostatic hyperplasia: randomised, open label, non-inferiority trial. BMJ. (Clin. Res. Ed.), 2018;361:k2338. https://doi.org/10.1136/bmj.k2338.
- Li P., Wang C., Cao Q. et al. Prostatic Arterial Embolization Followed by Holmium Laser Enucleation of the Prostate as a Planned Combined Approach for Extremely Enlarged Benign Prostate Hyperplasia. Urol. Intern. 2017;99(4):422–8. https://doi.org/10.1159/000478788.









Комментарии