24–26 октября 2024 г. состоялся IX Российский Конгресс по эндоурологии и новым технологиям. 24.10.2024 г. в рамках первого пленарного заседания было представлено сообщение академика РАН Камалова Армаиса Альбертовича «Фундаментальная наука в практической эндоурологии», где было подробно рассказано о новейшей разработке, созданной на базе Московского университета командой врачей под руководством Армаиса Альбертовича и физиков под руководством Ширшина Евгения Александровича.
 Говоря о современных технологиях в медицине, академик РАН А.А. Камалов рассказал про факультет фундаментальной медицины, воссозданный в стенах Московского университета в 1992 г. по инициативе академика РАН, ректора МГУ имени М.В. Ломоносова Виктора Антоновича Садовничего. Для реализации медицинской, образовательной и научной деятельности в 2013 г. был построен и введён в эксплуатацию уникальный и первый в современной России Медицинский научно-образовательный центр МГУ имени М.В. Ломоносова.
Говоря о современных технологиях в медицине, академик РАН А.А. Камалов рассказал про факультет фундаментальной медицины, воссозданный в стенах Московского университета в 1992 г. по инициативе академика РАН, ректора МГУ имени М.В. Ломоносова Виктора Антоновича Садовничего. Для реализации медицинской, образовательной и научной деятельности в 2013 г. был построен и введён в эксплуатацию уникальный и первый в современной России Медицинский научно-образовательный центр МГУ имени М.В. Ломоносова.
Таким образом, был полностью сформирован биомедицинский кластер МГУ, которому под силу решать самые серьезные биомедицинские и фармацевтические задачи. Биомедицинский кластер ведёт активную медицинскую и исследовательскую деятельность совместно с рядом других подразделений, таких как биологический, химический, физический факультеты и многие другие. Помимо этого, ежегодно к работе привлекаются и внешние партнёры, в том числе фармацевтические компании, а также крупные производители медицинского оборудования. Тем самым, процесс преобразования научного продукта в производство в рамках замкнутого линейного цикла уже сейчас осуществляется на базе биомедицинского кластера МГУ. Так, научный продукт, полученный на основании фундаментальных исследований, превращается в медицинский при проведении клинических испытаний его эффективности и безопасности.
 По инициативе В.А. Садовничего в структуре МГУ были созданы научно-образовательные школы, каждая из которых позволяет объединить учебный процесс и научный потенциал, необходимые для развития перспективных междисциплинарных направлений современной науки и достижения прорывных научных результатов (рис. 1). Активную научную деятельность Университетская клиника ведёт совместно со школой по фотонным и квантовым технологиям, в рамках которой осуществляется ряд научных проектов. Руководителем школы по фотонным и квантовым технологиям является Ширшин Евгений Александрович.
По инициативе В.А. Садовничего в структуре МГУ были созданы научно-образовательные школы, каждая из которых позволяет объединить учебный процесс и научный потенциал, необходимые для развития перспективных междисциплинарных направлений современной науки и достижения прорывных научных результатов (рис. 1). Активную научную деятельность Университетская клиника ведёт совместно со школой по фотонным и квантовым технологиям, в рамках которой осуществляется ряд научных проектов. Руководителем школы по фотонным и квантовым технологиям является Ширшин Евгений Александрович.

Рис. 1. Научно-образовательные школы МГУ лазера
Биофотоника – область науки, занимающаяся исследованием живых систем с помощью света (рис. 2). Принцип работы биофотоники основан на особенностях взаимодействия молекул с оптическим излучением. Например, все молекулы поглощают излучение в инфракрасном диапазоне – следовательно, с помощью инфракрасного света можно сделать обогреватель. А если использовать в качестве источника инфракрасного света лазер, позволяющий концентрировать большую мощность излучения в импульсе, можно создать устройство для силового воздействия на объект. Именно так работают хирургические лазеры, позволившие вывести эффективность и безопасность урологических операций на новый уровень. В то же время, с помощью света можно не только воздействовать на систему, но и проводить ее диагностику – и этот подход также нашел применение в урологии.
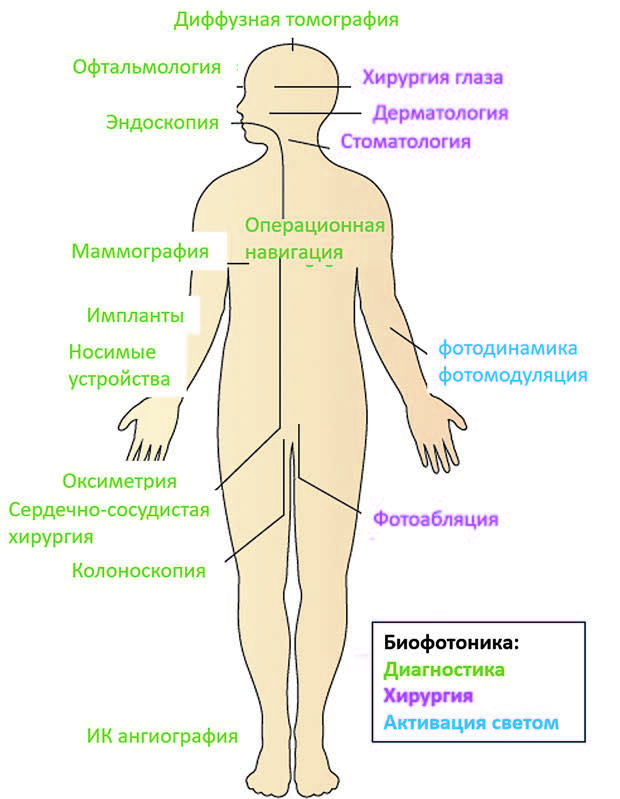
Рис. 2. Области применения биофотоники в медицине: диагностика (зеленый),
хирургия (фиолетовый), фотовоздействие (синий). Рисунок адаптирован из работы
(Nature biomedical engineering, (2017), 1(1), 0008)
Использование методик оптической спектроскопии в практической эндоурологии позволило создать систему умного лазера, основанную на технологии искусственного интеллекта и используемую уже сегодня в клинической практике. В качестве индустриального партнёра с 2020 г. выступает НТО «ИРЭ Полюс». Умный лазер прошел все стадии от идеи, тестирования на модельных объектах, валидации в операционной до реализации в конечном продукте. Полный цикл разработки занял два года и является примером трансляции фундаментальных исследований в практическое здравоохранение.
Идея создания умного лазера была связана с необходимостью минимизации интраоперационных осложнений лазерной литотрипсии, таких как повреждения мочеточника различной степени. Так, например, в условиях ограниченной видимости на фоне кровоточивости ткани повышается вероятность перфорации мочеточника, которые сами по себе увеличивают риск послеоперационных стриктур более чем в 7 раз.
В результате была разработана система, которая позволяет через одно и то же волокно зондировать ткань, анализировать сигнал и регулировать подачу излучения в зависимости от типа ткани перед волокном, то есть получается смарт-система с обратной связью, которая позволяет в доли секунды остановить лазерное излучение в случае попадания на слизистую. Для анализа параметров ткани и камня использовался мультимодальный подход – то есть, совмещались воедино несколько методик оптической спектроскопии. Все методы реализованы через одно волокно, и из каждой точки измеряется несколько оптических сигналов, несущих информацию о характеристике тканей. Принцип работы системы умного лазера представлен на рис. 3.
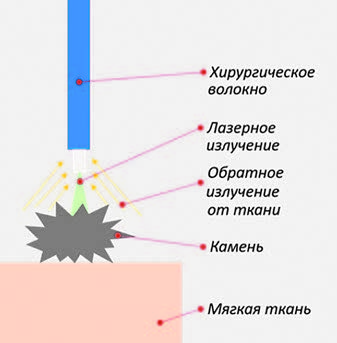
Рис. 3. Принцип работы системы умного
лазера
Разработка умного лазера проходила в 3 этапа от тестирования метода in vitro до внедрения инновационного продукта в клиническую практику. На первом этапе анализировались оптические свойства различных камней и мягких тканей in vitro. В экспериментах было показано, что точность определения типа объекта достигала 95%, в результате чего была доказана принципиальная возможность реализации метода распознавания конкрементов от мягких тканей. На втором этапе интраоперационно разработанный сенсор тестировали с использованием различных алгоритмов анализа ткани. Сначала сенсор подключался к лазеру отдельно, получал и анализировал информацию об объекте перед волокном. Таким образом, набиралась статистика сигналов во время операций и тестировались алгоритмы. По результатам работы на втором этапе было показано, что точность классификации объектов составила более 90%. На финальном этапе разработки была создана плата, встроенная непосредственно в саму лазерную установку, осуществляющую обратную связь, после чего была проведена клиническая валидация созданной системы умного лазера.
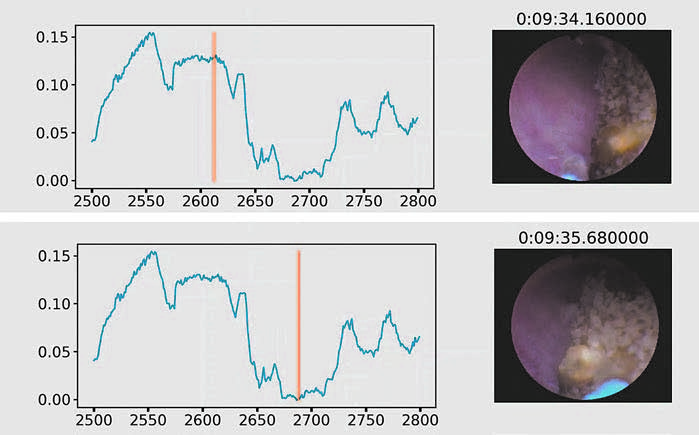
Рис. 4. Различие оптических свойств мягкой ткани (А) и камня (Б)
На рис. 4 представлено различие оптических свойств мягкой ткани (А) и камня (Б). При наведении на разные типы тканей меняются оптические свойства объекта. На основании этой разницы и удалось создать систему автоматического распознавания ткани и моментального отключения лазерной энергии в случае контакта со слизистой в доли секунды.
Тем самым впервые в мировой практике в нашей стране создана система автоматического контроля за работой самого лазера. В результате выполненной нами работы был получен патент «способ распознавания объекта при лазерной литотрипсии с использованием алгоритма цифровой обработки отраженного от него света».
Ещё одна задача, встроенная в систему умного лазера – это определение состава камней. Принцип распознавания типа камня основан на анализе молекулярных компонентов методом флуоресцентной спектроскопии. На сегодняшний день точность такого определения превышает 92%, тем самым уже на этапе операции можно судить о том, какой перед нами камень и автоматически подбирать режим дробления в зависимости от его параметров и без последующего спектрального анализа камня назначать соответствующую терапию для профилактики рецидива камнеобразования.
Система умного лазера позволяет также определять температуру нагрева жидкости в мочевыводящих путях, тем самым предотвращая термическое повреждение слизистой мочеточника или лоханки. При повышении температуры ирригационной жидкости лазер автоматически отключается.
Таким образом, разработанная система умного лазера позволяет решать сразу несколько задач. Во-первых, предотвращение травмы слизистой за счёт мгновенного отключения энергии при попадании на слизистую, особенно в ограниченном пространстве. Во-вторых, распознавание состава камня. В-третьих – возможность осуществления температурного контроля. Не меньшим преимуществом являются этапы освоения лазерной литотрипсии начинающими урологами, а также предотвращение поломки оборудования в случае активации системы внутри инструмента.
Как отметил академик Камалов А.А., система умного лазера тестируется и в аспекте интраоперационной диагностики рака мочевого пузыря. Подчеркивая актуальность данного заболевания, Армаис Альбертович отметил, что прирост заболеваемости раком мочевого пузыря за последние 10 лет составил 28,3%. Рак мочевого пузыря отличается чрезвычайно высокой частотой рецидивирования, которая достигает 70%, в то время как у 30% пациентов отмечается прогрессирование заболевания, что подчеркивает важность полного удаления опухолевой ткани в ходе трансуретральной резекции мочевого пузыря.
Для оперирующего уролога очень важно иметь четкое представление о границах опухоли мочевого пузыря и здоровых тканей. В настоящее время для этих целей используются современные эндоскопические системы, такие как NBI, фотодинамическая диагностика и различные варианты цифрового анализа изображений, каждый из этих методов связан с необходимостью приобретения дорогостоящего оборудования и расходных материалов. Важно отметить, что, хотя системы типа NBI и позволяют хирургу лучше рассмотреть сосудистую сеть, они не решают проблему визуализации границы опухоли и не дают врачу рекомендации по оптимальной границе резекции мочевого пузыря. Урологу не всегда очевидно, где заканчивается опухоль и начинается нормальная ткань, и создание систем интраоперационной диагностики представляет собой одну их центральных задач не только урологии, но и медицины в целом.
В связи с этим перед умным лазером была поставлена ещё одна амбициозная задача – с помощью метода оптической спектроскопии осуществить детекцию тканей с распознаванием опухолевой и здоровой.
Интересно, что ключевым элементом при реализации детекции здоровой и опухолевой тканей, является гемоглобин. Цвет тела человека во многом определяется гемоглобином – молекулой, переносящей в организме кислород. Гемоглобин имеет красный цвет, поскольку и синий и зеленый свет он поглощает, а красный пропускает и отражает. Розоватый цвет кожи, ее покраснение при воспалении и побеление на холоде определяются изменением содержания гемоглобина за счет кровенаполнения сосудов. Именно так работает измерение пульса в носимых устройствах, умных часах и фитнес-трекерах: сердце прокачивает кровь, и наполнение кровью сосудов изменяется синхронно с работой сердца. Можно увидеть, что носимые устройства мигают зеленым – так как зеленый свет гемоглобином поглощается, а отражение его от кожи промодулировано изменением содержанием крови в коже в такт работе сердца, и во временной форме отраженного сигнала проявляется пульсовая волна.
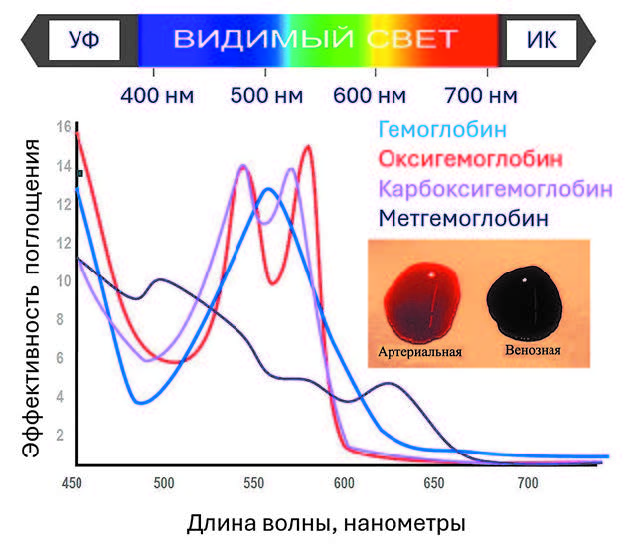
Рис. 5. Спектр поглощения гемоглобинов, определяющий цвет артериальной
и венозной крови: синий – дезоксигемоглобин, красный – оксигемоглобин. Сверху
схематически изображены оптические диапазоны: видимый свет (400 нанометров
(нм) – синий, 500 нм – зеленый, 600 нм – оранжевый, 700 нм – красный), ультрафиоле-
товый (УФ) и инфракрасный (ИК) диапазоны
Хорошо известно также, что цвет артериальной и венозной крови несколько отличаются – венозная кровь синее. Почему так получается, если в обоих случаях цвет определяется гемоглобином? Дело в том, что цвет самого гемоглобина зависит от связывания им кислорода: при образовании комплекса между железом гемоглобина и кислородом немного меняется стриктура молекулы (гема), в результате чего цвет становится более красным (рис. 5). Данная оптическая особенность гемоглобина очень полезна, она нашла применение в различных приборах, анализирующих оксигенацию (насыщение кислородом) органов и тканей в организме человека. Наиболее известный прибор такого типа – пульс-оксиметр, представляющий собой прищепку, размещаемую на пальце. Если для измерения пульса достаточно одного светодиода (например, зеленого), то для определения оксигенации их нужно уже два, чтобы поглощение их излучения отличалось для окси- и дезоксигемоглобина. По разнице этого поглощения можно установить степень оксигенации, например, обнаружить ишемию тканей во время операции.
В рамках усовершенствования диагностики рака мочевого пузыря возникла идея оценивать количественно васкуляризацию (кровенаполнение) по параметрам поглощения гемоглобина, то есть, «оцифровать» данные о распределении сосудов. Далее логичным шагом стало измерение оксигенации тканей – известно, что в раковых опухолях часто повышено содержание гемоглобина за счет большего числа сосудов, но при этом концентрация кислорода меньше, поскольку он поглощается активно делящимися опухолевыми клетками. На оценке васкуляризации и оксигенации работает диагностика рака молочной (грудной) железы с помощью оптоакустической томографии, также являющейся одним из методов биофотоники. Затем, при измерении сигнала от тканей, связанного с гемоглобином, в качестве бонуса детектируется сигнал рассеяния света, который несет в себе информацию о неоднородностях облучаемого объекта – соответственно, если различие морфологии нормальной и опухолевой ткани влияет на параметры распространения оптического излучения в них, это тоже можно задетектировать в эксперименте. Расширением набора используемых методов стало также детектирование сигнала флуоресценции – то есть, свечения молекул в ответ на их возбуждение в оптическом диапазоне.
Рис. 6. Измерения в операционной – анализ оптических свойств раковой ткани
во время удаления опухоли мочевого пузыря
Исследования возможности определения типа ткани (опухоль/нормальная ткань) проводили во время операций (рис. 6). При этом урологом выполнялись стандартные манипуляции, а к лазеру подключалась специально разработанная система, позволяющая собирать информацию об оптических свойствах объекта перед волокном. В результате на 30 операциях были накоплены спектральные данные о параметрах опухолей и нормальной ткани, в частности, об обсуждавшихся выше содержании гемоглобина (васкуляризации), оксигенации, рассеянии света (определяемом морфологией ткани), интенсивности флуоресценции (определяемой метаболическим состоянием клеток слизистой). Оказалось, что, используя указанные параметры, удается весьма точно определить тип ткани – действительно, опухолевые участки характеризуются повышенной васкуляризацией и рассеянием, а также пониженной оксигенацией и флуоресценцией (рис. 7).
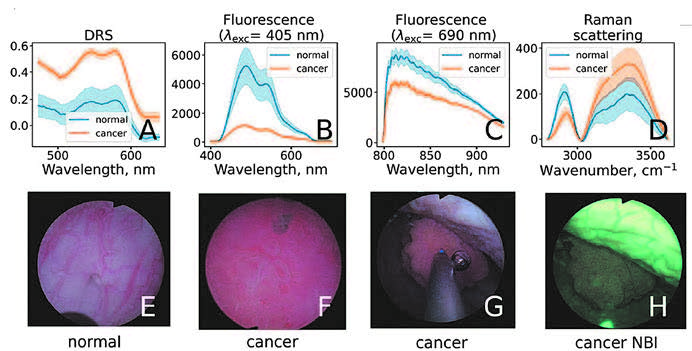
Рис. 7. Различие оптических свойств нормальной (normal) и опухолевой (cancer)
тканей мочевого пузыря из статьи (Zlobina N.V. et al., Las. Surg. Med., 2024)
А – различие спектров отражения, B – различие спектров флуоресценции в видимом
диапазоне, C – различие спектров флуоресценции в ИК диапазоне, D – различие спектров
комбинационного рассеяния света, E-G – эндоскопические изображения нормальной
и опухолевой ткани, H – эндоскопическое изображения опухолевой ткани в режиме
узкоспектральной эндоскопии (narrow band imaging NBI)
Предсказательная модель, работающая на основе данных оптического зондирования, обладает специфичностью определения рака 91%. Результаты исследования были опубликованы в журнале Lasers in Surgery&Medicine, издаваемом Американским сообществом лазерной медицины и хирургии (ASLMS, American Society for Laser Medicine&Surgery), а статья была отмечена редакцией как избранная (featured paper). Задачей ближайшего времени является испытание методики в клинике и сопоставление профилей локализации опухолей, получаемых оптическим методом, с данными гистологии для дальнейшей интеграции с хирургическим лазером.
Постановлением Бюро РАН отмечается высокий уровень фундаментальной и прикладной значимости интеллектуальных лазерных систем, что ещё раз подтверждает актуальность и востребованность проводимых исследований. Тем самым, уникальность разработки умного лазера открывает новую эру использования возможностей биомедицинской фотоники при заболеваниях различных органов и систем, создавая тем самым большие перспективы научных исследований с применением интеллектуальных лазерных систем в медицине, в том числе в эндоурологии.









Комментарии