Хубларов О.Ю.
Латгальский Урологический Центр, Латвия Адрес: LV5401, Латвия, г.Даугавпилс, ул.Ригас 54а, тел. +3(712)9164333 Эл.почта: oleg.hublarov@urocenter.lv
Введение
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является частым возрастным заболеванием у мужчин. Существующая уже десятки лет и признанная как «золотой стандарт» трансуретральная резекция предстательной железы (ТУРП), а также открытая трансвезикальная простатэктомия, являются классическими методами лечения ДГПЖ. Несмотря на это 15-20% пациентов, которым выполняется ТУРП, имеют осложнения и даже летальные исходы, регистрируемые от 0,2 % до 2,5% случаев [1-4].
В течение последнего десятилетия разработаны и предложены многочисленные малоинвазивные методики, направленные на снижение риска, улучшение состояния пациентов в раннем и позднем послеоперационных периодах, результаты которых не только сопоставимы, но и превосходят как ТУРП, так и открытую трансвезикальную простатэктомию.
Особенное развитие и применение получили «лазерные технологии».
Лазерная абляция простаты с помощью гольмиевого лазера на алюминиево-иттриевом гранате (Ho:YAG) с длиной волны 2140 нм была впервые представлена в 1995 году [5]. Однако ввиду сильного поглощения молекулами воды глубина проникновения Ho:YAG лазера в ткани очень мала, 0,5 мм. Гиперплазированные ткани могут быть удалены только при непосредственном контакте с лазером. Ограниченное применение Ho:YAG лазера объясняется низкой скоростью абляции, что обусловливает его использование только в случае небольших простат, до 40 см3 [6].
Модификация методики для прямой резекции аденоматозной ткани с пульсирующим потоком пузырьков на кончике оптического волокна привела к появлению нового метода – гольмиевой лазерной резекции простаты (HoLRP), которая с разработкой и внедрением механического морцеллятора ткани преобразовалась в новую методику – гольмиевую лазерную энуклеацию предстательной железы (HoLEP) [7].
Результатами многочисленных исследований показано, что клиническая эффективность HoLEP сопоставима с ТУРП или открытой трансвезикальной простатэктомией, в то же время безопасность HoLEP более высока, снижен период необходимой катетеризации мочевого пузыря, существенно короче время пребывания пациента в стационаре, менее длителен период реабилитации. HoLEP имеет также сопоставимые или превосходящие преимущества в соотношении затрат и результатов в долгосрочном периоде после операции. Тем не менее, несмотря на эти преимущества, HoLEP в настоящее время не используется повсеместно в урологической практике. Основной причиной является техническая сложность манипуляции и длительный период обучения [6]. Специалисты утверждают, что для достижения плато кривой обучения необходимо выполнить как минимум от 20 до 30 оперативных вмешательств [89], а по некоторым данным необходимо не менее 50 операций. Пройденный нами в нашем Центре путь изучения и внедрения HoLEP подтверждает, что необходимое количество операций для достижения минимального опыта колеблется между 30 и 50 процедурами.
В урологической среде не хватает практических курсов и учебных программ по изучению и применению HoLEP, практически отсутствуют HoLEP-тренеры, не развиты и не организованы менторские программы. Все это послужило основанием к написанию этой статьи для подробного изложения технических аспектов HoLEP на основе собственного опыта и данных имеющейся литературы.
Отбор пациентов и предоперационная подготовка
В отличие от традиционных методов (ТУРП, открытая трансвезикальная простатэктомия) HoLEP может быть предложена любому пациенту с диагнозом ДГПЖ, имеющему явления инфравезикальной обструкции [6]. Все же основным субъективным фактором отбора является шкала интенсивности простатических симптомов (I-PSS). Объективная клиническая картина формируется на основе анализа рутинных урологических обследований, таких как уровень ПСА, урофлоуметрия, УЗИ-объем остаточной мочи, трансректальное УЗИ простаты (ТрУЗИ), биохимические и общий анализы крови, ЭКГ, рентгенография легких.
У пациентов с осложненной ДГПЖ, особенно после катетеризаций мочевого пузыря или при наличии цистостомы полезным будет микробиологическая оценка мочи с определением количественного фактора флоры и чувствительности ее к антибиотикам.
Уретроцистоскопия не рассматривается как обязательное обследование, но в определенных случаях для уточнения степени обструкции и исключения стриктуры может быть использована. Приоритетом является использование гибкого эндоскопа.
У пациентов с острой задержкой мочи мы отдаем предпочтение перкутанной цистостоме вместо постоянного уретрального катетера как более щадящего способа в отношении травматизации уретры и ее воспаления. ПСА как маркер немаловажен в предоперационной дифференциальной диагностике для решения вопроса о необходимости проведения мультифокальной биопсии простаты. При получении негативного результата биопсии мы планируем HoLEP не ранее чем через 68 недель после биопсии. В течение этого времени травмированные при биопсии участки заживают, воспалительные явления в окружающих тканях стихают, что немаловажно в обеспечении безопасности метода.
Урофлоуметрию используем для скрининга обструкции. Определение эффективного объема мочевого пузыря является важным моментом в процессе операции HoLEP. Так, если мочевой пузырь имеет небольшую емкость, то во время механической морцеляции тканей возрастает степень его возможной травматизации, что обязывает хирурга к максимальной внимательности.
ТрУЗИ является очень информативным и, по нашему мнению, обязательным методом предоперационного обследования, дающего возможность воссоздания трехмерной конфигурации простаты используя фронтальные и сагиттальные срезы, что особенно важно для специалистов, начинающих овладевать HoLEP. Метод позволяет оценить конфигурацию и структуру простаты, расположение гипертрофированных узлов, и, что самое главное, оценить реальный размер простаты и отдельно взятых узлов. На наш взгляд, ТрУЗИ является необходимым диагностическим тестом, которым должен владеть уролог и проводить его самостоятельно. Мы рекомендуем овладеть этим исследовательским инструментом.
В то же время нельзя забывать о том, что при трансабдоминальном УЗИ мочевого пузыря возможно выявить конкременты мочевого пузыря, не редки случаи находок бессимптомных опухолей.
Предоперационное определение групп крови является факультативным исследованием, т.к. процент гемотрансфузий при HoLEP чрезвычайно низкий и колеблется от 0% до 1,9% [10-11].
В вопросе прекращения приема пациентами антикоагулянтных препаратов у разных авторов есть разные мнения. Часть клиник требуют полное прекращение приема антикоагулянтов, часть переводят пациентов на низкомолекулярный гепарин. В нашей клинике общий протокол подготовки пациентов предусматривает отмену антикоагулянтов за 5 дней до операции и перевод пациентов высокого риска на низкомолекулярный гепарин. 3 пациентам выполнялись операции с отменой антикоагулянтов за 2 дня до операции, что не вызвало значительных проблем в процессе операции и осложнений в послеоперационном периоде. Многие работы показывают, что HoLEP снижает риск кровотечения у пациентов, принимающих антикоагулянты, но конкретных рекомендаций и установленных принципов ведения таких больных нет [12].
Оборудование для HoLEP
HoLEP, как и другие трансуретральные операции, выполняется операционной бригадой, состоящей из хирурга, операционной медицинской сестры, помощника операционной сестры, врача анестезиолога и анестезиологической сестры. Присутствие помощника операционной сестры в операционном зале категорически необходимо в течение всей операции. Операционный зал стандартный с возможностью проведения спинальной анестезии, общего наркоза и с возможностью полноценного мониторинга пациента. Операционный стол должен предполагать возможность укладки пациента в литотомическое положение. Оборудование для HoLEP включает в себя лазер, видеосистему, трансуретральные инструменты и оптики, морцеллятор.
Для выполнения HoLEP мы используем многофункциональный гольмиевый лазер VersaPulse® PowerSuite™ фирмы Lumenis (рисунок 1) с установками мощности от 1.5 до 1.9 Дж и частотой 25-53 Гц в зависимости от необходимого воздействия на ткани: рассечение ткани, коагуляция, щадящий режим на определенных этапах операции.
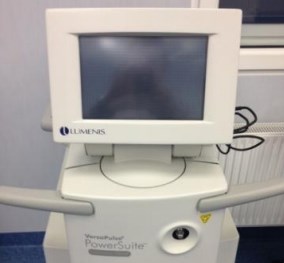
Рис. 1. Гольмиевый лазер VersaPulse® PowerSuite™
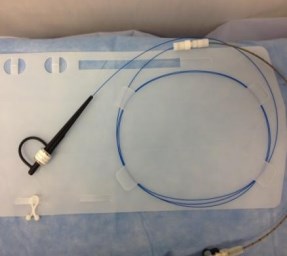
Рис. 2. Lumenis SlimLine 550 микрон
Используемая мощность колеблется в пределах 37,5-100,7 Ватт. Здесь надо оговориться, что есть разница между лазерами, поставляемыми в Европу и в Америку. Европейские лазеры не позволяют использовать рабочие установки, часто описываемые в рекомендациях как основной рабочий режим 2.0 Дж и 50 Гц и соответственную мощность 100 W. Соответствующая мощность достигается установками 1.9 Дж и 53 Гц, что дает мощность 100,7 W.
Для HoLEP мы применяем лазерное волокно с концевым источником, Lumenis SlimLine 550 микрон, код синий, многоразового применения, длинной 3 метра (рисунок 2). Применение более тонкого волокна не оправдано изза высокого риска его повреждения при работе с большой мощностью.
В нашей клинике применяется цифровая видеосистема Olympus Visera Pro, поддерживающая HDTV-технологию и состоящая из видеопроцессора со специализированной урологической видеоголовкой, монитора и источника света. Полезным является оснащение видеосистемы специальным видеорекодером или отдельным компьютером, позволяющим вести запись эндоскопических операций для документирования, оценки и контроля качества работы, а также пересмотра проделанных операций (рисунок 3).
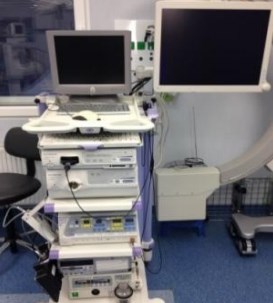
Рис. 3. Видеосистема Olympus Visera Pro
Инструменты для энуклеации различаются в зависимости от приоритетов хирурга и клиники. Чаще всего используются тубусы для трансуретральных резекций 26-28 Fr со стандартным обтуратором. Мы применяем видеообтуратор. В процессе введения тубуса в мочевой пузырь при значительных размерах простаты можно повредить слизистую в простатическом отделе уретры, что вызывает нежелательное кровотечение и ухудшает визуализацию. Наличие видеообтуратора помогает избежать повреждений и обеспечивает хорошую картинку. Лазерные вставки и рабочие элементы также различны и зависят от навыков хирурга.
В своей практике мы используем инструменты компании Olympus (рисунок 4) и Karl Storz с рабочим элементом и специальным каналом для лазерного волокна так и без него (рисунок 5).
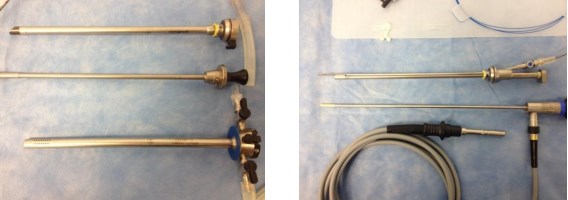
Рис. 4. Инструменты для HoLEP. Производитель – компания Olympus
Преимущество инструментов с рабочим элементом и встроенной вставкой для лазерного волокна в отсутствии необходимости применения стабилизационного катетера, внутренний конец которого в процессе операции под действием лазерной энергии может несколько деформироваться, что снижает подвижность лазерного волокна и несколько затрудняет визуализацию. Это требует его извлечения и обрезания кончика. Также стабилизационный катетер является дополнительным расходным материалом.
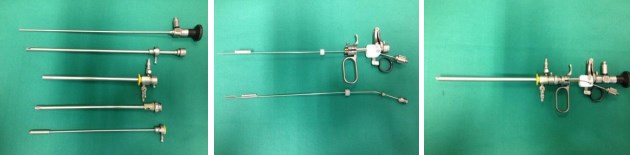
Рис. 5. Инструменты для HoLEP. Производитель – компания Karl Storz
С другой стороны рабочий элемент делает инструмент более громоздким и менее мобильным. По нашему личному мнению предпочтение отдается инструментам без рабочего элемента с рабочим каналом до 1,6 мм. Простота соединения тубуса и лазерной вставки посредством «клика» инструмента Olympus делает комплект более удобным в использовании. Отсутствие необходимости специальной обработки замков и кранов, на наш взгляд, также является преимуществом.
Мы применяем стабилизационные катетеры 6 Fr с открытым концом. Для фиксации волокна внутри катетера после использования многих вариантов отдаем предпочтение Tuohy-Borst адаптеру фирмы COOK MEDICAL (рисунок 6), как наиболее, на наш взгляд, удобной простой и стабильной системе фиксации.
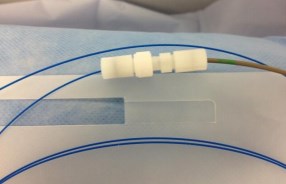
Рис. 6. Tuohy-Borst адаптер для фиксации лазерного волокна. Производитель – компания COOK MEDICAL
Для морцеляции энуклеированной ткани чаще всего применяются механические морцелляторы VersaCut (Lumenis) и Piranha Morcellator (Richard Wolf). Недавно фирма Karl Stor также выпустила свой морцеллятор. Литература не описывает каких либо значительных преимуществ одного морцеллятора перед другим. В своей практике мы используем морцеллятор VersaCut (рисунок 7). У нас нет опыта работы с морцелляторами других производителей, поэтому оценить и высказать свое мнение мы не можем.
Визуализация во время морцеляции осуществляется при помощи нефроскопа 25 Fr с внутренним каналом не менее 5 мм для свободного введения рабочей части морцеллятора. Важным является направление подачи ирригационной жидкости и необходимость применения дополнительных адаптеров.

Рис. 7. Морцеллятор VersaCut. Производитель – компания Lumenis
Визуализация во время морцеляции осуществляется при помощи нефроскопа 25 Fr с внутренним каналом не менее 5 мм для свободного введения рабочей части морцеллятора. Важным является направление подачи ирригационной жидкости и необходимость применения дополнительных адаптеров.
В комплекте Olympus (рисунок 8) замена перед морцеляцией лазерной вставки на оптику специального эндоскопа не требует дополнительного адаптера и направление подачи жидкости осуществляется под углом в отличие от комплекта Karl Storz (рисунок 8), когда требуется дополнительный адаптер.

Рис. 8. Эндоскоп компании Olympus (слева), эндоскоп компании Karl Storz (справа)
Жидкость в данном случае подается по типу «end fire», то есть строго вперед. С практической точки зрения это может создавать некоторые неудобства в конце морцеляции, когда поток подаваемой жидкости оттесняет оставшиеся небольшие части удаленной ткани и затрудняет их присасывание к рабочему каналу морцеллятора.
В качестве ирригационной жидкости используют физиологический раствор. Мы также придерживаемся этой практики.
Положение пациента, обзор, ориентиры
Под общей или спинальной анестезией пациента укладывают на операционный стол в литотомическое положение. В процессе укладки надо иметь в виду, что диапазон движения рук хирурга при HoLEP во время энуклеации боковых долей больше, чем во время ТУРП [13]. Поэтому для обеспечения свободы и безопасности манипуляции бедра пациента необходимо отводить в стороны более широко.
После обработки операционного поля производится его обкладка при помощи стерильного набора. Мы используем одноразовые наборы для проведения трансуретральных вмешательств. В мочеиспускательный канал вводим Инстиллагель без лидокаина. При необходимости, перед введением тубуса резектоскопа с обтуратором, производим расширение наружного отверстия канала прямым бужом до 30 Fr. Под контролем зрения (видеообтуратор) проводим тубус резектоскопа, осуществляя ревизию мочеиспускательного канала, в мочевой пузырь. Если введение резектоскопа осуществляется без видеообтуратора, рекомендуем вводить его до бульбарной уретры во избежание повреждения уретры. Минимальное сопротивление при введении инструмента в канал должно быть показанием к детальной визуализации для исключения стриктуры, не диагностированной на дооперационном этапе.
Учитывая сложности в ориентации во время HoLEP из-за ограниченного пространства и близкого фокуса, перед началом энуклеации необходимо четко определить ориентиры. Всегда надо представлять трехмерную структуру простаты, оцененную на дооперационном этапе во время ТрУЗИ. Главными ориентирами являются: наружный сфинктер, семенной бугорок, устья мочеточников, расстояние от наружного сфинктера до семенного бугорка, высоту шейки мочевого пузыря. Обязателен осмотр мочевого пузыря на наличие камней и образований, оценку степени трабекулярности детрузора и его емкости. Никогда нельзя начинать энуклеацию без четкой визуализации ориентиров [6].
Важным моментом ориентации является стабильное положение головки камеры. Использование маятниковой видеоголовки значительно облегчает работу хирурга. В противном случае головку камеры необходимо постоянно удерживать в одном и том же положении свободной рукой.
Энуклеация
Под энуклеацией подразумевается удаление гиперпластических узлов простаты в пределах капсулы железы. Наиболее распространенными методиками принято считать трехи двухдолевую энуклеации. Двухдолевая энуклеация чаще применяется при небольших размерах аденомы, однако при отсутствии выраженной средней доли методика может быть применима и к гиперплазиям больших размеров. Техника двухдолевой энуклеации предусматривает начальную инцизию на 5 или 7 часах условного циферблата в направлении от шейки мочевого пузыря к семенному пузырьку, удалении одним блоком средней доли вместе с одной из боковых долей и дальнейшим удалением оставшейся доли [6].
Классическая энуклеация представляет собой раздельное удаление трех долей. Сначала средней, затем отдельно боковых долей. Мы применяем обе модификации в зависимости от конкретного случая. При трехдолевой технике энуклеация боковых долей становится легче за счет образования дополнительного рабочего пространства после удаления средней доли, позволяющего увеличить обзор и улучшить ориентацию. Двухдолевая энуклеация технически более сложна, но занимает меньше времени, чаще применяется при небольших размерах простаты.
Начальный разрез
Одним из важнейших этапов операции является первая инцизия. При классической HoLEP она производится по направлению от шейки мочевого пузыря до семенного бугорка на 5 и 7 часах условного циферблата. Разрез должен быть выполнен на всю глубину аденоматозной ткани до простатической капсулы. Важность состоит в том, что по уровню произведенных инцизий в дальнейшем будет выполняться остальная часть операции, также они служат ориентиром «правильного» слоя энуклеации [9]. Капсула простаты распознается по появлению поперечных белесоватых волокон, отличающихся от желтоватой аденоматозной ткани. В процессе продвижения от шейки мочевого пузыря к семенному бугорку разрез может быть расширен путем поперечных движений. Важным является проведение разреза максимально прямо до уровня семенного бугорка и максимально глубоко до достижения уровня простатической капсулы [13]. Боковая область семенного бугорка является наилучшим местом для определения правильного слоя дальнейшей энуклеации. В определенных случаях для лучшей ориентации и определения дистальной протяженности первых разрезов можно воспользоваться тактикой первичного поперечного разреза проксимально от семенного бугорка, тем самым дополнительно сразу определив «правильную» глубину следующих разрезов и «правильный» слой энуклеации [13].
Поперечный разрез для энуклеации средней доли
Поперечный разрез производится проксимальнее семенного бугорка и соединяет ранее произведенные разрезы на 5 и 7 часах условного циферблата. Глубина его должна соответствовать глубине продольных разрезов, сделанных ранее, и доходить до простатической капсулы. После идентификации капсулы разрез продолжается поперечно и проксимальнее по направлению к шейке мочевого пузыря. В данном маневре тубус инструмента является помощником, подталкивая отделяемую среднюю долю вперед и несколько вверх. Лазерное волокно находится как бы под долей. Острым и тупым путем ретроградно производится энуклеация. На данном этапе надо постоянно контролировать направление движения тубуса, особенно в зоне близкой к шейке для предотвращения продвижения в подслизистый слой мочевого пузыря, особенно при наличии средней доли уходящей вглубь. При больших средних долях также надо иметь в виду, что доля может пролабировать в просвет мочевого пузыря и располагаться очень близко к устьям мочеточников. Крайне важно держать устья под визуальным контролем во избежание их повреждения. Энуклеация большой средней доли может привести к созданию глубокой полости, дно которой значительно ниже уровня шейки мочевого пузыря, что надо иметь в виду в дальнейшем при установке уретрального катетера [14]. Для правильной установки катетера мы рекомендуем использовать проводник.
Энуклеация боковых долей
Боковые доли удаляются раздельно. После энуклеации средней доли перед началом удаления боковых очень важно вновь обозначить ориентиры. Тубус эндоскопа выдвигается в дистальном направлении для полной визуализации семенного бугорка и наружного сфинктера. Рекомендуется снижение мощности лазера при работе в зоне наружного сфинктера для предотвращения его термического поражения [13, 14].
Производится так называемый «клюшкообразный» разрез латерально от срединной линии на глубину капсулы простаты. Постепенно огибая долю простаты, он продолжается вертикально максимально вверх. Как правило, разрез удается произвести до уровня 23 часов по условному циферблату. Следующим этапом выполняется разрез на 12 часах ретроградно до шейки мочевого пузыря во избежание повреждения сфинктера. Ориентиром начала разреза служит спроецированный на 12 часов условного циферблата семенной бугорок. Разрез не должен быть очень глубоким. Необходимо иметь в виду, что область передней спайки очень тонкая и в основном состоит из фиброзномышечной ткани [6].
Двухсторонние горизонтальные разрезы от 12 часов в шейке мочевого пузыря расширяются вниз, пока не идентифицируется капсула боковой доли. Рассечение продолжается до 3 (слева) и 9 (справа) часов условного циферблата. Последним этапом энуклеации боковых долей является соединение верхнего и нижнего разрезов. Нужно иметь в виду ожидаемую воображаемую линию соединения двух разрезов. В большинстве случаев соединение выполняется в положении 2 часа или 10 часов, в зависимости от стороны. Во избежание повреждения наружного сфинктера разрез должен выполняться ближе к аденоме, то есть немного проксимальнее. Этот завершающий момент является очень важным этапом и может быть очень сложным для начинающих [6].
HOLEP у пациентов с небольшими простатами
HoLEP в случае небольшой железы технически сложнее, поскольку хирургическая капсула зачастую трудно различима. Сглаженность контуров аденомы делает ориентацию менее четкой, особенно в зоне перехода слизистой простатического отдела канала в зону наружного сфинктера. Тем не менее, рандомизированное контролируемое исследование показало, что HoLEP снимает препятствие лучше, чем это делает ТУРП у пациентов с небольшими простатами. В определенных случаях, когда пациент имеет только среднюю долю и явные обструктивные симптомы, HoLEP может быть предпочтительным вариантом хирургии [15].
HOLEP у больных с большой простатой
HoLEP является размер-независимой процедурой. Результаты превосходны в случаях с большими простатами, более чем 100 см3 [16, 17]. Некоторые центры сообщили об опыте HoLEP у пациентов с простатой больше 350 см3 [18]. В нашей практике максимальный размер простаты, оперированной путем HoLEP, составил 240 см3 .
HoLEP при больших железах, как правило, не рекомендуется начинающим хирургам [19], т.к. эти железы имеют развитую сосудистую сеть от субкапсулярных ветвей, что обусловливает большую вероятность развития интраоперационного кровотечения. Кроме того, эти гиперплазированная ткань этих желез может иметь многоузловую структуру, что затрудняет определение слоя энуклеации. Возникают также трудности в манипулировании резектоскопом и достижении шейки мочевого пузыря вследствие сравнительно малой длины эндоскопа. Аденома, выступающая в мочевой пузырь, образует слепой угол, который создает трудности в визуализации мочеточниковых отверстий и треугольника мочевого пузыря. После энуклеации энуклеированные доли заполняют мочевой пузырь, в результате чего недостаточно места для морцелляции.
Техника гемостаза
Гольмиевый лазер коагулирует ткани на глубине до 5 мм. Кровоостанавливающее свойство гольмиевого лазера значительно снижает кровопотерю во время операции. Тем не менее, иногда может иметь место кровотечение из крупных артерий [14].
Кровотечение из мелких сосудов во время процедуры нужно тщательно контролировать для обеспечения хорошей визуализации при последующей морцеляции. Гемостаз достигается путем расфокусирования лазерного луча с расстояния 2-3 мм. Более близкое расположение лазерного луча к поверхности может привести к перфорации капсулы. Наиболее эффективный гемостаз достигается при снижении мощности лазера до 45 Ватт (1,5 Дж при частоте 35 Гц ) [13], но возможно еще большее снижение мощности, до 25 Ватт (0,5 Дж при частоте 50 Гц). Такие установки дают возможность проводить гемостаз в прямой бесконтактной проекции с минимальной вероятностью перфорации простатической капсулы.
Как правило, наибольшую угрозу для возникновения кровотечения представляют участки расположенные на 3 и 9 часах условного циферблата [13], а также в зоне семенного бугорка. Во время манипулирования в этих участках надо быть максимально внимательным и производить своевременную коагуляцию сосудов.
Морцелляция
Под морцелляцией подразумевается одновременное размельчение ранее удаленных аденоматозных узлов и удаление размельченной ткани из просвета мочевого пузыря. Морцеллятор был впервые введен для извлечения ткани предстательной железы в 1998 году [20]. Начало применения морцелляции внесло революционный вклад в процедуру гольмиевой резекции гипертрофированных тканей простаты и дало начало гольмиевой энуклеации. Она является относительно несложным этапом операции даже для начинающих хирургов [6]. Тем не менее, есть некоторые моменты, требующие внимания. Так, повреждение слизистой мочевого пузыря во время морцелляции является интраоперационным осложнением, частота которого по данным разных авторов достигает 18% [14, 21]. Тщательный гемостаз после энуклеации позволяет получить четкую эндоскопическую картинку, которая является обязательным условием безопасности морцелляции.
Также важным в этом отношении является хорошее наполнение мочевого пузыря ирригационным раствором. Мы используем для этого систему двойной подачи воды, когда ирригация жидкости осуществляется во входное и в выходное отверстия тубуса резектоскопа. Отток происходит только через отсос морцеллятора.
Кроме того, рабочая часть морцеллятора должна быть под постоянным визуальным контролем. Ни в коем случае нельзя активировать педаль морцеллятора при недостаточной визуализации. Если видимость затруднена, что бывает чаще всего на фоне недостаточного гемостаза, необходимо вернуться на этап назад и провести тщательный гемостаз. При соблюдении такого правила процедура морцеляции проходит достаточно быстро и безопасно. Бывают случаи, когда ткань энуклеированной аденомы очень плотная и морцеллятору не удается захватить кусочки. Чаще это случается когда остаются небольшие круглые, гладкие фрагменты, превышающие в своем размере диаметр уретры. Их насильственное удаление при помощи щипцов может нанести серьезную травму. В таких случаях рекомендуется использовать электрорезекцию оставшейся ткани [9]. Необходимо помнить, что отсутствие в клинике биполярного инструмента для выполнения ТУР требует полной замены ирригационного раствора.
Иногда происходит обструкция рабочего элемента морцеллятора мелкими кусочками ткани, что требует извлечения инструмента из канала эндоскопа, отсоединения от системы и дальнейшего промывания.
Выход из строя рабочего элемента крайне редкая проблема, возникающая как правило при чрезмерно долгом использовании одного и того же комплекта, а также после многочисленных процедур заточки ножей. Производитель рекомендует производить замену каждые 8-10 операций. Это ведет к значительным дополнительным расходам. Мы используем 2 комплекта морцелляторов. Периодическая заточка ножей позволила нам выполнить более 100 операций. Мы настоятельно рекомендуем всегда иметь под запас комплект рабочего элемента морцеллятора во избежание повышения хирургической агрессии для удаления энуклеированной ткани.
Ранний послеоперационный уход После проведения морцеляции, проверив просвет мочевого пузыря на отсутствие неудаленных фрагментов ткани, производим промывание мочевого пузыря шприцом Жане и дренирование посредством уретрального катетера Foley. Мы применяем 3-х ходовый катетер Foley 20 Fr с емкостью баллона 30-50 мл. При введении катетера могут возникнуть ранее описанные трудности, поэтому для постановки дренажа мы всегда используем проводник (рисунок 9).


Рис. 9. Шприц Жане, 3-х ходовый катетер Foley (20 Fr), металлический проводник для проведения катетера
Ирригационную систему после операции мы обычно не используем, однако в исключительных случаях необходимость в ней может возникнуть. Как и большинство хирургов, уретральный катетер удаляем через 24 часа, в редких случаях через 48 часов после вмешательства [22].
Рекомендации для начинающих
Для более быстрого освоения методики есть несколько советов начинающим:
- Необходимо критически неоднократно пересмотреть неотредактированные видео опытных операторов. Даже после начала успешного произведения HoLEP постоянный пересмотр может быть очень полезным в плане оценки ошибок и принятия новых, неизвестных ранее, моментов HoLEP.
- Отбор пациентов на начальном этапе очень важен. Не следует выбирать пациентов с объемом простаты более 60 см 3 [6]. Также следует избегать простат с объемом до 40 см 3 . В этом случае высок шанс проведения операции в условиях неясных, и тем самым, сложных границ тканей. На наш взгляд, определенная уверенность должна появиться после произведения примерно 50 случаев HoLEP.
- Очень полезна запись собственных операций на видео и объективный многократный просмотр их по окончании вмешательства [23].
ВЫВОДЫ
HoLEP является эффективной и безопасной процедурой для лечения ДГПЖ с положительным результатом в раннем и долгосрочном периоде наблюдения в сравнении с традиционной хирургией ДГПЖ.
Долгий период овладения оперативной техникой является основным препятствием для широкого использования HoLEP. Описанные технические аспекты, возможно, помогут урологам, начинающим осваивать метод, быстрее овладеть методологией и обрести уверенность в выполнении процедуры HoLEP.
Литература
1. Mebust, W.K. Transurethral prostatectomy: immediate and postoperative complications: a cooperative study of 13 participating institutions evaluating 3,885 patients / W.K. Mebust, H.L. Holtgrewe, A.T. Cockett, P.C. Peters // J Urol. – 1989. – Vol.141 – P.243-247.
2. Mortality and reoperation after open and transurethral resection of the prostate for benign prostatic hyperplasia / N.P. Roos, J.E. Wennberg, D.J. Malenka et al. // N Engl J Med – 1989. – Vol.320 – P.1120-1124.
3. Adverse events after prostatectomy in Victorian public hospitals / M.Z. Ansari, A.J. Costello, D.J. Jolley et al. // Aust N Z J Surg – 1998. – Vol.68. – P.830-836.
4. Holtgrewe, H.L. Factors influencing the mortality and morbidity of transurethral prostatectomy: a study of 2,015 cases. / H.L. Holtgrewe, W.L. Valk // J Urol – 1962. – Vol.87. – P.450-459.
5. Combination holmium and Nd: YAG laser ablation of the prostate: initial clinical experience. / P.J. Gilling, C.B. Cass, A.R. Malcolm, M.R. Fraundorfer // J Endourol – 1995. – Vol.9. – P.151-153.
6. Technical Aspects of Holmium Laser Enucleation of the Prostate for Benign Prostatic Hyperplasia / M. Kim, H. Lee, S. Oh // Korean J Urol. – 2013. – Sep., Vol.54, №9. –P.570-579.
7. Holmium laser resection of the prostate: preliminary results of a new method for the treatment of benign prostatic hyperplasia / P.J. Gilling, C.B. Cass, M.D. Cresswell, M.R. Fraundorfer // Urology – 1996. – Vol.47. – P.48-51.
8. Moody, J.A. Holmium laser enucleation for prostate adenoma greater than 100 gm: comparison to open prostatectomy / J.A. Moody, J.E. Lingeman // J Urol – 2001. – Vol.165. – P.459-462.
9. Tan, A.H. Holmium laser prostatectomy: current techniques / A.H. Tan, P.J. Gilling // Urology. – 2002. – Vol.60 – P.152-156.
10. Complications of laser prostatectomy: a review of recent data / M. Rieken, N. Ebinger Mundorff, G. Bonkat et al. // World J Urol – 2010. – Vol.28. – P.5362.
11. Elzayat, E.A. Holmium laser enucleation of the prostate (HoLEP): longterm results, reoperation rate, and possible impact of the learning curve / E.A. Elzayat, M.M. Elhilali // Eur Urol – 2007. – Vol.52. – P.1465-1471.
12. Laser treatment of benign prostatic hyperplasia in patients on oral anticoagulant therapy: a review / A. Descazeaud, G. Robert, A.R. Azzousi AR et al.// BJU Int – 2009. – Vol.103 – P.1162-1165.
13. Holmium laser enucleation of the prostate (HoLEP): a technical update / R.L. Kuo, R.F. Paterson, S.C. Kim et al. // World J Surg Oncol. – 2003. – Vol.1. – P.6.
14. Peri-operative complications of holmium laser enucleation of the prostate: experience in the first 280 patients, and a review of literature / H.N. Frah, A.P. Mahajan, S.S. Hegde, M.B. Bansal // BJU Int. – 2007. – Vol.100. – P.94-101.
15. Holmium laser bladder neck incision versus holmium enucleation of the prostate as outpatient procedures for prostates less than 40 grams: a randomized trial / T.F. Aho, P.J. Gilling, K.M. Kennett et al. // J Urol. – 2005. – Vol.174.– P.210-214.
16. Gilling, P.J. Holmium laser enucleation of the prostate for glands larger than 100 g: an endourologic alternative to open prostatectomy / P.J. Gilling, K.M. Kennett, M.R. Fraundorfer // J Endourol – 2000. – Vol.14. – P.529-531.
17. Elzayat, E.A. Holmium laser enucleation of the prostate: a size-independent new «gold standard» / E.A. Elzayat, E.I. Habib, M.M. Elhilali // Urology – 2005. – Vol.66, 5 Suppl. – P.108-113.
18. A randomised trial comparing holmium laser enucleation versus transurethral resection in the treatment of prostates larger than 40 grams: results at 2 years / L.C. Wilson, P.J. Gilling, A. Williams et al. // Eur Urol. – 2006. – Vol.50. – P.569-573.
19. Prospective evaluation of the learning curve for holmium laser enucleation of the prostate / H.N. Frah, A.P. Mahajan, H.S. Sodha et al. // J Urol. – 2007. – Vol.177. – P.1468-1474.
20. Fraundorfer, M.R. Holmium:YAG laser enucleation of the prostate combined with mechanical morcellation: preliminary results / M.R. Fraundorfer, P.J. Gilling // Eur Urol – 1998. – Vol.33. – P.69-72.
21. Holmium laser enucleation versus transurethral resection of the prostate: results from a 2-center prospective randomized trial in patients with obstructive benign prostatic hyperplasia / F. Montorsi, R. Naspro, A. Salonia et al. // J Urol – 2008. –Vol.179, 5 Suppl. – P.87-90.
22. Holmium laser enucleation of the prostate combined with electrocautery resection: the muFrroom technique / W.W. Hochreiter, G.N. Thalmann, F.C. Burkhard, U.E. Studer // J Urol. – 2002. – Vol.168(4 Pt 1). – P.1470-1474.
23. El-Hakim, A. Holmium laser enucleation of the prostate can be taught: the first learning experience / A. El-Hakim, M.M. Elhilali // BJU Int – 2002. – Vol.90. – P.863-869.
Статья опубликована в журнале "Вестник урологии". Номер №2/2014 стр. 24-40









Комментарии