 |
В.А. Божедомов, д.м.н., профессор кафедры урологии и андрологии факультета фундаментальной медицины ГБОУ ВПО Московский государственный университет им. М.В. Ломоносова, ведущий научный сотрудник ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. В.И. Кулакова МЗ РФ, научный руководитель по андрологии и репродукции ФБГУ Поликлиника №3 УДП РФ |
Аутоиммунные реакции против сперматозоидов, сопровождающиеся образованием антиспермальных антител (АСАТ), снижают фертильность даже при нормозооспермии. В то же время АСАТ не всегда приводят к бесплодию. Эффект АСАТ зависит от доли АСАТ-позитивных сперматозоидов, их числа и локализации на клетке, класса/субкласса и аффинности АСАТ, сопутствующих нарушений спермограммы. Проявлениями аутоиммунных реакций против сперматозоидов могут быть:
- нарушение сперматогенеза вследствие аутоиммунного орхита;
- снижение подвижности сперматозоидов (в т.ч. связанное с их агглютинацией);
- отсутствие проникновения сперматозоидов в цервикальную слизь вследствие появления АСАТ у женщин;
- нарушения акросомной реакции и капацитации, затрудняющих оплодотворение яйцеклетки in vivo и in vitro;
- апоптоз сперматозоидов, сопровождающийся повышенной фрагментацией ДНК, что может приводить к низкому качеству эмбрионов даже после экстракорпорального оплодотворения методом интраплазматической инъекции сперматозоидов.
Образование АСАТ можно рассматривать,с одной стороны, как непосредственную причину снижения фертильности, с другой – как маркер сниженного качества спермы. Клинически значимыми являются прямые методы определения АСАТ на поверхности прогрессивно подвижных сперматозоидов: MAR-(mixed agglutination reaction) и IBT (immunobead assays )-тесты. АСАТ класса иммуноглобулинов-А (IgA) всегда присутствуют в сочетании IgG, а АСАТ-IgG могут быть диагностированы и в отсутствие IgA. Именно поэтому первым этапом диагностики иммунного мужского бесплодия является определение доли подвижных IgG-позитивных сперматозоидов методами MAR или IBT. Тесты на АСАТ должны выполняться во всех случаях бесплодного брака и невынашивания беременности на ранних сроках. Патогенетически значимыми следует считать величину MAR IgG более 12% при планировании естественного зачатия и 50% –при выполнении экстракорпорального оплодотворения и переноса эмбриона (ЭКО и ПЭ).
Причинами появления АСАТ служат непроходимость семявыносящего тракта, повреждения гемато-тестикулярного барьера, перекрестные иммунные реакции с антигена ми микроорганизмов, повышенная реактивность иммунной системы в ответ на экзогенные (в т.ч. инфекционные) стимулы. В патогенезе иммунного бесплодия важную роль играет внутриклеточный оксидативный стресс (ОС).
Лечение иммунного бесплодия можно разделить на этиотропное, патогенетическое и симптоматическое. Этиотропное лечение основано на устранении факторов риска: непроходимости семявыносящего тракта, перегревания, инфекций; во многих случаях этиотропное лечение невозможно. Патогенетическое лечение включает ферменты и антиоксиданты, клеточные продукты фетоплацентарного происхождения. Симптоматическими методами являются вспомогательные репродуктивные технологии (ВРТ): в виде специальной обработки (отмывки) сперматозоидов от АСАТ in vitro и внутриматочной инсеминации или ЭКО с интраплазматической инъекцией сперматозоидов (ИКСИ) в самых сложных случаях. Требуется продолжение исследований в данном направлении с целью уточнения антигенов, антитела против которых приводят к бесплодию, и создании на этой основе антиген-специфической терапии.
Эпидемиология
По данным различных публикаций, АСАТ могут быть диагностированы у 4–21% мужчин из бесплодных пар. По нашим данным, среди мужчин, обращающихся за помощью по поводу бесплодного брака (более 3500 обследованных), АСАТ в различных количествах диагностируются в 18% случаев, в т.ч. у 8% мужчин антитела покрывают более половины подвижных сперматозоидов.
Влияние на фертильность
В присутствии АСАТ показатели спермограммы существенно хуже, чем у фертильных мужчин, однако корреляции между наличием АСАТ и отдельными показателями спермограммы слабые. Достаточно часто, больше чем в четверти случаев, по нашим данным, у пациентов с иммунным бесплодием показатели спермограммы соответствуют «нормозооспермии». Но и в этом случае реальная фертильность снижается: между длительностью вынужденного бесплодия и долей прогрессивно-подвижных сперматозоидов, покрытых АСАТ, существует высоко значимая положительная корреляция. Снижение фертильности при нормозооспермии в присутствии АСАТ вызвано различными нарушениями функциональных способностей сперматозоидов: акросомальной реакции, капацитации, рецепторного взаимодействия с яйцеклеткой, повышенного апоптоза гамет.
Многие авторы обращали внимание, что у АСАТ-положительных пациентов эмбрионы при ЭКО и ПЭ были более низкого качества. Причину этого нам удалось установить недавно. Оказалось, что у пациентов со значительными уровнями АСАТ чаще наблюдается фрагментация ДНК сперматозоидов: доля сперматозоидов с фрагментацией ДНК у АСАТ-положительных пациентов был в 1,3 раза выше, чем у бесплодных мужчин без АСАТ и в 1,6 раза выше, чем у фертильных мужчин; существуют различия в размере «хало», который характеризует степень фрагментации ДНК. Установить это удалось, когда сравнили группы пациентов с нормозооспермией, отличающиеся только по наличию или отсутствию АСАТ. Эти изменения в структуре хроматина, связанные с AСАТ, могут быть фактором, влияющим на процессы размножения как во время, так и после оплодотворения яйцеклетки.
Этиология
Более десяти факторов могут становиться причинами развития антиспермального иммунитета: травма яичек с орхитом или без него, вазорезекция, врожденная обструкция семявыносящих путей, инфекции репродуктивного тракта (ИРТ), травма спинного мозга, приводящая к анэякуляции, пассивный гомосексуализм, психогенная анэякуляция, варикоцеле, крипторхизм, перекрут яичка, злокачественные опухоли яичка.
Оценка абсолютного риска развития антиспермального иммунитета в наших исследованиях показала, что наиболее часто АСАТ появляются после перенесенных орхитов и эпидидимитов (67%), тупых травм мошонки без клинического орхита (66%), после клинически выраженного и ранее прооперированного варикоцеле (39–43%). Учет комплекса и возможного взаимодействия нескольких патогенетически значимых факторов показывает, что нарушения качества спермы и риск появления АСАТ в группах с орхитом зависят от наличия варикоцеле. В группе мужчин, у которых в результате травмы мошонки развился орхит, в 87% случаев присутствовало сопутствующее варикоцеле (11% в группе с атравматическим и 35% с субклиническим орхитом). Если травма мошонки имела место у мужчин с варикоцеле, АСАТ появляются в 1,2–1,4 раза, а орхит развивается в 3,4–4,1 раза чаще, чем при травме мошонки без варикоцеле.
Оценка роли ИРТ (Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis и др.) показывает, что риск развития аутоиммунных реакций против сперматозоидов зависит от особенностей возбудителя: C. trachomatis чаще приводит к орхиту, M. hominis вызывает перекрестные иммунные реакции. В среднем, АСАТ можно обнаружить примерно у 30% пациентов с ИРТ.
Патогенез
Патогенез иммунного мужского бесплодия можно представить следующим образом. После нарушения целостности гемато-тестикулярного барьера, образования спермогранулем при непроходимости семявыносящего тракта и/или в случае, когда к поверхности сперматозоидов прикрепляются микроорганизмы, фагоцитоз сперматозоидов макрофагами в репродуктивном тракте приводит к презентации спермальных антигенов в комплексе с HLA классов I и II Т-клеткам. Происходит экспансия специфичных к спермальным антигенам Т-лимфоцитов и высвобождение цитокинов, которые стимулируют дифференцировку специфичных к спермальным антигенам В-лимфоцитов и продукцию АСАТ. Наличие наследственно обусловленной гиперактивности Т- и В-клеток, возможно связанной с особенностями HLA-системы, усугубляют этот процесс. В дальнейшем иммунный ответ развивается по гуморальному типу с преобладанием продукции АСАТ и уменьшением числа T-клеток. Иммунологическими механизмами, приводящими к снижению фертильности на фоне АСАТ, являются гиперпродукция реакционноспособных метаболитов кислорода (АФК – активные формы кислорода), лизосомальных ферментов, интерферонов (ИФН) и повышенный фагоцитоз в органах репродуктивного тракта.
По нашему мнению, ключевым фактором развития иммунного мужского бесплодия является ОС – следствие гиперпродукции АФК: пероксида водорода, озона и др. По нашим данным, у мужчин с иммунным бесплодием даже в отсутствие инфекционного процесса продукция АФК повышена более чем в 3 раза; между АФК и АСАТ имеется прямая зависимость, причем продукция АФК больше зависит от количества антител на сперматозоидах (по данным проточной цитометрии), чем от процента подвижных АСАТ-позитивных гамет (MAR-тест). Одновременно существует положительная связь между уровнем АФК и фрагментацией ДНК сперматозоидов.
Конкретные антигены сперматозоидов, которые стимулируют иммунную систему, и механизмы первоначальных реакций, приводящих к нарушению фертильности, все еще остаются неизвестными. Можно предположить, что аутоиммунный процесс инициируют не какие-то «особые» аутоантигены, поиск которых безуспешно идет несколько десятилетий, а любые антигены сперматозоидов при соблюдении следующих условий:
- антигены отличаются от продуктов органоспецифических генов, экспрессированных в медуллярных эпителиальных клетках тимуса и презентированных Т-клеткам при их развитии в тимусе, т.е. ставших дефектными в период онтогенеза на стадиях после деления сперматогоний типа А;
- спермальные антигены отсутствуют в необходимом количестве в семенной плазме в растворенном виде, что необходимо для поддержания толерантности;
- структура макромолекул трансформирована (например, под действием АФК) и приобрела антигенные свойства.
Обнаруженная нами связь между АСАТ, ОС и фрагментацией ДНК (данные опубликованы в международных журналах Andrology и Journal of Reproductive Immunology) снова поднимает вопрос о месте ВРТ в лечении пациентов с мужским иммунным бесплодием –постулированное в мета-анализе А. Zini и соавт. (2011) положение о том, что АСАТ не снижают доли наступивших беременностей после ЭКО и ИКСИ, не означает отсутствия влияния на исходы беременности и здоровье детей.
Диагностика
Коммерчески используемые тест-системы непосредственно определяют или наличие антител на поверхности сперматозоидов, или содержание АСАТ в растворе (сперма, кровь, цервикальная слизь или фолликулярная жидкость). Методы диагностики АСАТ включают тест с полиакриламидными шариками, покрытыми АСАТ (IBD – immunobead assays), смешанную реакцию агглютинации – MAR-тест, иммуноферментный анализ (ELISA), метод трей-агглютинации (tray agglutination test), метод спермоиммобилизации (sperm immobilization assay tests), метод проточной цитометрии (ПЦМ/flow cytometry) и метод с радиочувствительным агглютинином (radiolabeled agglutinin assays). Однако ни один из методов не удовлетворяет всем требованиям клиницистов – определять присутствие АСАТ, их локализацию, изотип, быть высокочувствительным и специфичным, отсутствуют общепринятые представления о клинической значимости различных тестов. Наиболее удобными для клинического применения и поэтому рекомендованными Всемирной организацией здравоохранения (ВОЗ, 2010) в качестве стандартных являются MAR- и IBT-тесты. MAR-тест выполняется и используется преимущественно в странах Европы, IBT-тест – в странах Америки. Данные методы позволяют определять наличие, классы и локализацию АСАТ. MAR-тест основан на связывании латексных шариков, покрытых человеческими IgG со сперматозоидами, покрытыми АСАТ, после добавления бивалентной антисыворотки к Fc-фрагменту IgG человека (рис. 1).
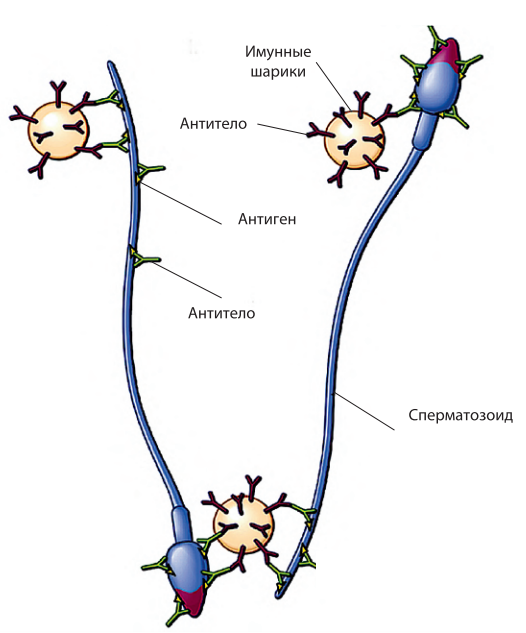
Рис. 1. Принцип реализации прямых методов обнаружения АСАТ на сперматозоидах (по CCF, 2009)
С помощью фазово-контрастного микроскопа при 400-кратном увеличении производят подсчет доли подвижных сперматозоидов, связанных с шариками и локализацию прикрепления шариков. Полученный результат выражают в MAR% для IgG или IgA соответственно. Однако с помощью данных методов невозможно оценить количество АСАТ, связанных с поверхностью сперматозоида. Кроме того, они не могут быть использованы при отсутствии активно-подвижных сперматозоидов. В этом случае приходится применять непрямой метод с инкубированием в семенной плазме донорских сперматозоидов.
По нашему мнению, рекомендованные в настоящее время руководством ВОЗ (2010) допустимые уровни MAR-IgG менее 50% слишком либеральны и не соответствуют реальной клинической практике. С целью уточнения допустимых количеств АСАТ на сперматозоидах мы оценили результаты MAR-теста у фертильных мужчин с нормозооспермией и показали, что MAR-IgG более 10% имел место в 13% наблюдений, MAR-IgG более 50% – в 2% и MAR-IgG 100% – в 1%. Распределение тестовых значений MAR-теста в этой группе заметно отличалось от нормального: медиана – 0% (среднее значение – 5,4±13,8); 50% значений (25–75% процентили) находились в диапазоне 0–3%, 95% процентиль составил 32%. График Box-and-whisker показывает, что «выпадающими значениями» (значения, далекие от медианы и не типичные для этого набора исследований) были MAR-IgG более 12% (рис. 2). Следовательно, референсные значения для фертильных мужчин находятся в диапазоне MAR-IgG 12–32%.
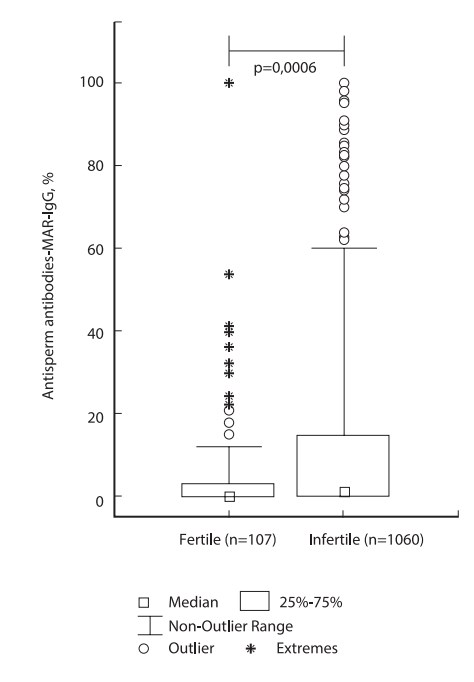
Рис. 2. Результаты прямой идентификации АСАТ класса IgG на поверхности подвижных сперматозоидов у фертильных и бесплодных пациентов с нормозооспермией (по V.A. Bozhedomov и соавт. J. Reproduct. Immunol. 2015;112:95–101)
Поскольку показатели спермограммы ни изолированно, ни в комплексе не обладают предсказательной способностью относительно наличия или отсутствия аутоиммунных реакций против сперматозоидов, исследования на АСАТ должны проводиться во всех случаях бесплодного брака и при замерших на ранних сроках беременностях.
Лечение
Лечение пациентов иммунным бесплодием представляет собой сложную проблему. Используются несколько стратегий:
- методы снижения продукции АСАТ у мужчины;
- методы предотвращения иммунных реакций против сперматозоидов со стороны женщины;
- методы удаления АСАТ, уже связанных со сперматозоидами, in vivo и in vitro;
- ВРТ, такие как ЭКО и ПЭ, включая ИКСИ.
Каждый из этих методов в некоторой степени снижает повреждающее действие «мужских» и «женских» АСАТ на половые клетки, что приводит к улучшению функции гамет и способствует восстановлению фертильности. Однако все эти методы неспецифичны, поскольку антигены спермы, которые стимулируют иммунную систему и приводят к иммунологическому бесплодию, остаются неизвестными.
Этиотропное лечение. Первым этапом терапии мужчин с иммунным бесплодием является устранение всех возможных этиологических факторов развития аутоиммунного процесса в их половой системе: обструкции семявыносящего тракта, урогенитальных инфекций, варикоцеле, перегревания и др.
Вопрос о возможности «возвращения» фертильности после микрохирургического восстановления проходимости семявыносящего тракта остается до настоящего времени неясным: сперматозоиды в эякуляте после подобной операции появляются у 65–80% пациентов, но у 40–60% имеются нарушения в спермограмме и стойкое сохранение АСАТ в 33–60% случаев. Прогнозы на беременность после реконструктивной операции в решающей степени зависят от продолжительности обструкции и исходного уровня АСАТ.
Оперативное лечение варикоцеле, осложненного АСАТ, имеет менее оптимистичный прогноз. Наши исследования показывают, что у пациентов с АСАТ после микрохирургической варикоцелэктомии реже происходит увеличение концентрации, подвижности и доли морфологически нормальных форм; доля АСАТ-позитивных сперматозоидов в среднем не снижается; реже наступают беременности. Результаты операции менее оптимистичны, когда имеют место небольшая степень варикоцеле и значительное количество АСАТ.
Наш опыт подтверждает важность профилактики и своевременного лечения острых и подострых воспалительных процессов в репродуктивном тракте. При MAR-IgG от 10 до 49% излечение от C. trachomatis приводит через 2–4 недели к уменьшению доли MAR-позитивных сперматозоидов у 85% больных в среднем по группе на 13% в абсолютных значениях. При MAR-IgG более 50%, несмотря на отсутствие C. trachomatis в мазках у всех пациентов в первый месяц после терапии и этиологического излечения, почти в 70% случаев через 2 месяца, доля IgG-позитивных сперматозоидов в этой группе мужчин не претерпела существенных изменений. Только у 20% мужчин наблюдалась позитивная динамика АСАТ.
В целом есть основания считать, что в большинстве случаев нормализация кровообращения, отсутствие ИРТ, восстановление проходимости (когда это удается сделать), устранение производственных вредностей не обеспечивают исчезновения АСАТ, когда их продукция началась. Данные факторы часто играют роль триггера, запуская при наличии генетической и иммунологической предрасположенности каскад аутоиммунных реакций. Поэтому на втором этапе обычно требуется применение дополнительных лечебных мероприятий: фармакотерапии, специальных отмывок с последующим внутриматочным введением или ЭКО и ПЭ.
Патогенетическое лечение. Классической терапией больных заболеваниями, в патогенезе которых предполагается иммунологический механизм развития, по-прежнему остается использование глюкокортикостероидов (ГКС). За четыре десятилетия применения этих препаратов примерно равное число авторов сообщали о случаях успеха и неудач при применении различных препаратов ГКС. По нашему мнению, ГКС могут быть показаны только пациентам с хроническим простатитом 3А и АСАТ: пиоспермией без каких-либо диагностированных инфекций.
Поскольку повреждение сперматозоидов в присутствии АСАТ связано с ОС сперматозоидов, можно использовать для лечения мужчин с иммунным бесплодием антиоксиданты. 3-Окси-6-метил-2-этил-пиридина гидрохлорид, рекомендуемый для лечения пациентов с воспалительными и дегенеративно-дистрофическиими процессами в офтальмологии, оказался полезным при мужском иммунном бесплодии (наш патент на изобретение №2421220).
Обнадеживающие результаты получены нами при использовании ферментов. Было показано, что почти у всех больных, получающих комплекс протеолитических ферментов (панкреатин, трипсин, химотрипсин, бромелайн, папаин) в суммарной суточной дозе 35–90 мг/кг уменьшалась вязкость спермы, у 3/4 мужчин улучшалась подвижность сперматозоидов, у 2/3 возросла их концентрация. Снижение числа АСАТ-позитивных сперматозоидов произошло у 80% мужчин в среднем на 20–30% (Патент РФ №2149021). Коллеги недавно предложили использовать для этих целей конъюгат протеолитического фермента гиалуронидазы с высокомолекулярным носителем группы производных N-оксида поли-1,4-этиленпиперазина: по их данным, это также способствует уменьшению числа АСАТ-позитивных сперматозоидов. Протеолитические ферменты можно сочетать с антиоксидантами, рибоксином и другими препаратами, что повышает эффективность лечения.
Другим направлением в консервативном лечении мужчин с иммунным бесплодием следует считать применение продуктов фетоплацентарного происхождения. Известно, что ряд белков, в значительном количестве вырабатываемых плодом и плацентой в период беременности, таких как Fas-лиганд (CD95), α-фетопротеин, α2-микроглобулин фертильности и др., обеспечивают иммуносупрессию, необходимую для сохранения и нормального протекания беременности. Применение фетоплацентарных комплексов у мужчин с иммунным бесплодием позволило на 27–95% снизить уровни АСАТ, включая IgA, который не реагирует на лекарственную терапию, улучшить качество спермы, в каждом четвертом случае у их жен наступала беременность (Патент на изобретение №2155596).
Симптоматическое лечение. Симптоматическим методом следует считать применение ВРТ в форме ИКСИ. Данный метод позволяет доставлять сперматозоиды, часто неспособные самостоятельно оплодотворять, непосредственно в яйцеклетку. По данным мета-анализа А. Zini и соавт. (2011), доля наступивших после ИКСИ беременностей от пациентов с иммунным бесплодием статистически не отличается от таковой у пациентов с аналогичной спермограммой без АСАТ, но данные по родам не приводятся.
Следует помнить, что различные способы лечения не исключают друг друга. Лекарственную терапию следует сочетать с внутриматочной инсеминацией, эффективность которой может быть повышена с помощью новых методов подготовки спермы. В наиболее сложных случаях, когда имеется посттравматическая атрофия яичек, концентрация сперматозоидов меньше 5 млн/мл, уровни гонадотропинов в 1,5 раза выше нормы или когда присутствуют дополнительные факторы бесплодия, следует рассматривать возможности ЭКО и ПЭ (ИКСИ) с самого начала.













Комментарии