О.С. Стрельцова, В.Н. Крупин
ГБОУ ВПО «Нижегородская государственная медицинская академия», кафедра урологии им. Е.В. Шахова
Введение.
Рост хронических воспалительных заболеваний нижних мочевых путей у пациенток старших возрастных групп связан в первую очередь с увеличением чувствительности клеток к окислительному стрессу. Эти проблемы зависят не только от изменений гормонального фона, но и от развития атеросклеротических изменений сосудов [1,2]. Определено, что возрастные изменения фонового метаболизма способны ослабить индукцию острого воспалительного ответа, содействуя выживанию инфекционных агентов в тканях [1].
У здоровых женщин мочевой пузырь обладает значительной резистентностью, которая обусловлена наличием ряда антибактериальных механизмов, постоянно и эффективно действующих - гормонально зависимая выработка защитных мукоидов слизистой оболочкой (гликозаминогликановый слой; секреторный IgA, вырабатываемый лимфоидной тканью подслизистых структур). Кроме того, моча может содержать специфические и неспецифические ингибиторы роста бактерий, иммуноглобулины класса А и G.
Неповрежденный уротелий обладает значительной антиколонизационной и фагоцитарной активностью. Гормонзависимая десквамация базальных и парабазальных клеток эпителия в проксимальной уретре, шейке мочевого пузыря у женщин репродуктивного возраста также является защитным механизмом [3]. Степень эксфолиации клеток уретры, адгезировавших микрофлору, у девочек препубертатного периода и уженщин в постменопаузе снижается [4].
Важно, что в большинстве случаев цистит является вторичным, то есть осложняет течение имеющихся заболеваний мочевого пузыря, уретры, почек, половых органов, органов малого таза и др. и характеризующихся вялым рецидивирующим течением, устойчивым к этиотропной терапии. Известно, что при хронических заболеваниях возникает транзиторная дисфункция иммунной системы [4,5,6].
В ранее проведенных нами исследованиях установлено, что у женщин, страдающих хроническим циститом, отклонения в показателях уровня иммуноглобулинов от среднестатистической нормы в сторону повышения или понижения выявлены в 32,1-33,3% [7]. При этом патология желудочно- кишечного тракта имела место у 42% пациенток, заболевания органов женской половой сферы - в 67 % .
Таким образом, тактика лечения рецидивирующей инфекции нижних мочевых путей является многоплановой, требует участия в лечении женщины не только уролога, но и гинеколога, терапевта, гастроэнтеролога. Кроме того, тактика лечения во многом определяется частотой и степенью тяжести обострений, наличием психо-эмоциональных проблем у пациентки, иммунным статусом. Клиническая оценка эффективности комплексного подхода к лечению и профилактике хронических заболеваний мочевого пузыря является перспективным и актуальным направлением исследований.
Цель исследования – оценка эффективности иммуномодулирующей терапии препаратом «тилорон» обострений хронического цистита у женщин.
Задачей исследования было определение эффективности иммуномодулирующего лечения в составе комплексной терапии у пациенток, страдающих хроническим циститом, и сравнение её со стандартной терапией и плацебо путем оценки течения восстановительного периода (наличие рецидивов), динамики показателей иммунограммы и показателей степени выраженности воспалительного процесса в мочевом пузыре на основании клинических и лабораторных данных.
Объектом исследования были 60 женщин в возрасте от 20 до 80 лет (средний возраст 44,1). Длительность заболевания циститом составила в среднем 4,9 года (от 6 месяцев до 40 лет). Группы сравнения пациенток включали по 30 человек. Критерии включения - женщины, с установленным диагнозом хронического цистита в стадии обострения и давностью заболевания не менее 6 месяцев. Включение в исследование было добровольным, с обеспечением прав и защиты пациента. На начальном этапе проведено ознакомление пациенток с целью и условиями исследования. Все подписывали информационное согласие на участие в исследовании.
Больных разделили на 2 группы. Оценка однородности групп проводилась с использованием критерия Манна – Уитни. Группы были сопоставимы по критериям: средний возраст, длительность воспалительного процесса.
В первую группу (Л) вошло 30 женщин, которым в комплексном лечении рецидивирующего цистита был назначен «тилорон» (таблетки, покрытые оболочкой, содержащие 0,125 г) по схеме - в первые двое суток по 1 таблетке, затем по 1 таблетке через день – на курс 1,25 г, или 10 таблеток), а далее препарат назначали по 1 таблетке 1 раз в неделю в течение 10 недель. На курс профилактического лечения потребовалось 1,25 г препарата - 10 таблеток. Во вторую группу (П) вошло также 30 женщин, получавших в комплексном лечении цистита вместо иммуномодулятора плацебо. Общий срок лечения и наблюдения пациенток обеих групп составил 180 дней.
В процессе наблюдения и лечения каждая пациентка имела 5 визитов к врачу. Всем выполнен сбор анамнестических данных, жалоб, проведено физикальное обследование, стандартное клиническое лабораторное исследование, включая анализ мочи по Нечипоренко, посев мочи на флору с определением чувствительности к антибиотикам, исследование на ИППП, микроскопию мазков, окрашенных по Граму из отделяемого влагалища и уретры. Всем определяли уровень иммуноглобулинов IgG, IgM, IgA, Т, В- лимфоцитов, спонтанную активность фагоцитов, иммунорегуляторный индекс.
При необходимости пациенткам выполняли цистоскопию в начале лечения для уточнения причины затяжного хронического процесса. Из подозрительных зон выполняли щипковые биопсии. Дополнительные диагностические исследования - УЗИ верхних мочевых путей, органов малого таза, рентгенологическое исследование мочевой системы выполняли при наличии патологии верхних мочевых путей в анамнезе.
Обе группы пациенток получали этиотропную и патогенетическую терапию: лечение антибактериальным препаратом фторхинолонового ряда - ципрофлоксацином 500мг 2 раза в день в течение 10 дней, при необходимости назначали анальгетики, антидепрессанты, антигистаминные препараты, антихолинэргические средства, спазмолитики.
Субпопуляции иммунокомпетентных клеток определяли с помощью мембранной иммунофлуоресценции с использованием моноклональных антител (ООО «Сорбент» г.Москва). У пациенток исследуемых групп определяли НСТ-тест – тест восстановления нитросинего тетразолия (показатель фагоцитарной активности нейтрофилов). Определение иммуноглобулинов А, М, G осуществляли методом радиальной иммунодиффузии в агаре по Манчини.
Критерии эффективности лечения оценивались на основании динамики жалоб пациенток, динамики объективных клинических признаков и лабораторных данных.
Статистическую обработку полученных данных проводили с помощью пакета Microsoft Excel и программы Statistica 6.0. Различия считали достоверными при уровне значимости р<0,05.
Результаты: Средний возраст женщин, страдающих рецидивирующим циститом, составил 44,1 года, что, несомненно, согласуется с данными литературы о патогенезе развития мочевой инфекции, определяющейся недостатком эстрогенов, а также снижением иммунитета с возрастом. 86,6% пациенток были трудоспособного возраста (до 55 лет), все обращали внимание на проблему социальной неустроенности в связи с болезнью.
Анализ сопутствующей патологии пациенток обеих групп позволил выявить заболевания желудочно-кишечного тракта у 26,6% (n-16), заболевания женских половых органов – у 33,3% (n-20), мочевой системы у 18,3% (n-11) пациенток. При этом у 48,3% (n-29) женщин выявлена 3 степень чистоты влагалища, а у 11,6% (n-7) - 4 степень. Только у 15% (n-9) женщин не зафиксировано сопутствующей патологии.
Анализ лабораторных данных: в 81,6% случаев (n-49) в моче определялось 7 и более лейкоцитов в поле зрения. У 11 женщин на фоне нормального общего анализа мочи были выявлены превышения нормальных значений в анализе мочи по Нечипоренко и наличие в бактериологическом посеве мочи флоры в концентрации более 103 КОЕ /мл.
В начале исследования при посеве флора в моче была выделена в 54 случаях из 60 в диагностическом титре ≥103 КОЕ /мл. Чаще всего высевались E. coli – 23 случая (42,6%), St. saprophytiсus – 6 случаев (11,1%) и St. epidermidis – 6 случаев (11,1%). В процессе лечения высеваемость бактерий из мочи снижалась в обеих группах. На момент окончания базовой терапии иммуномодулятором (25-ый день наблюдения) в группе Л флора была выделена в 20,7% (6/29), в группе П в 48% (12/25). На 100-ый день наблюдения флора выделена в 13,8% (4/29) и 32% (8/25) случаев соответственно. На 180-ый день наблюдения в каждой группе флора выделена в 3 случаях.
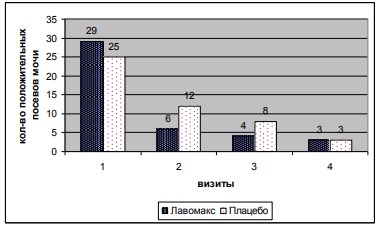
Рис. 1 - Элиминация бактерий из мочи . 1 - 0 визит; 2 - 25 день; 3 - 100 день; 4 -180 день Ряд 1 –соответствует группе Л, ряд 2- группе П
В результате эрадикация микроорганизмов у больных после окончания профилактического курса приема иммуномодулятора (100-ый день наблюдения) была интенсивнее и составила 86,2% (n-25), по сравнению с пациентами, не получавшими препарат – 68% (n-17). Причем после лечения в группе плацебо в двух случаях была выявлена микст-инфекция.
Одинаковое количество случаев выделения микрофлоры на 180-ый день наблюдения свидетельствует о необходимости повторения профилактических курсов иммуномодулирующей терапии - 2 курса в год.
Клиническая оценка в процессе лечения показала, что достоверного различия в изменении симптоматики между группами обнаружить не удалось, динамика изменений имела сходный характер. Оценка пациентками влияния на компоненты качества жизни (психо-эмоциональный статус) в процессе лечения имела достоверные отличия (степень подверженности мыслям о болезни, изменение интенсивности жалоб в целом, способность мириться с наличием имеющейся клинической картины, быть социально адаптированной).
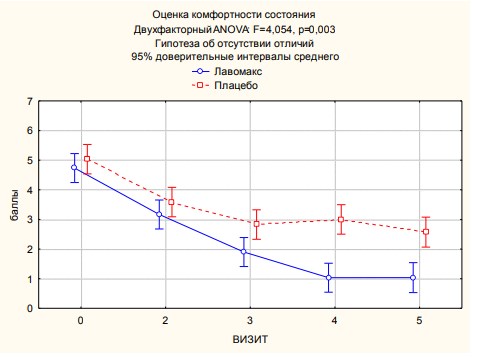
Рис.2 - Динамика оценки качества жизни пациентками в группах сравнения в процессе мониторинга
Параллельность событий в группах наблюдали до 3 визита (25 дней) (рис. 2). Увеличение интенсивности жалоб у пациенток группы П выявлено к 100 и 180 дням в отличие от пациенток гр. Л, которые получали профилактический курс терапии иммуномодулятором до 10 недель.
Наряду с клинической оценкой изучалось влияние препарата на иммунореактивность. Особенное положение фагоцитоза и комплемента в процессах неспецифической защиты и иммунологической реактивности организма подчеркивал Р. В. Петров (1986)[8]. Ключевым моментом функционирования адаптивного иммунитета является представление антигена антиген-презентирующими клетками, в роли которых в абсолютном большинстве случаев выступают дендритные клетки (DC). Дендритные клетки - это высокоспециализированная субпопуляция клеток, основной функцией которых является поглощение, переработка антигена в иммуногенную форму и его презентация в составе главного комплекса гистосовместимости в комбинации с ко- стимулирующими молекулами. В норме для адекватного иммунного ответа необходимо контактное и дистанционное взаимодействие дендритной клетки и Т- хелпера, которое осуществляется группой молекул на мембране клетки. В результате происходит активация Т-хелперов 1 и 2 типов, и соответственно клеточного и гуморального звеньев иммунитета [9]. Известно, что главными эффекторами воспаления являются фагоциты. Нейтрофилы при остром экссудативно- деструктивном течении принимают помощь гуморальных факторов - комплемента и антител, которые усиливают фагоцитарные реакции. Макрофаги же служат эффекторами хронического воспаления с преобладанием пролиферативно-склерозирующего компонента. Причем инфекционный агент способен персистировать внутри макрофага [9]. При выраженном воспалительном процессе количество Т-клеток в организме может уменьшаться.
Состояние врожденного иммунитета мы оценивали по реактивности нейтрофилов в тесте с нитросиним тетразолием (НСТ-тест). Как известно, нейтрофил играет центральную роль в организации экссудативно- деструктивного воспаления, являющегося универсальным механизмом освобождения организма от внеклеточных патогенов. Как эффекторная клетка нейтрофил располагает широким спектром протеаз и может генерировать ряд активных форм кислорода (АФК) с высокой биоцидной активностью. НСТ-тест в спонтанном и стимулированном вариантах дает возможность оценить как базисную продукцию АФК, коррелирующую с выраженностью воспалительного процесса, так и резерв биоцидности по индексу активации нейтрофилов (ИАН), рассчитанному как отношение показателя стимулированного теста к показателю спонтанного [5,8].
Выявлен достаточный исходный уровень биоцидности нейтрофилов в обеих группах. Однако при включении в схему лечения иммуномодулятора, изученный по анализу НСТ-теста стимулированный показатель фагоцитарного резерва (HCT-тест-СТ) в группе Л увеличился до 68% по сравнению с 60% в группе сравнения П, где динамики в показателях до и после лечения не отмечено (рис. 3а). После лечения иммуномодулятором ИАН увеличился с 4,07 до 4,8 (рис.3б.) в то время как в контрольной группе он снизился с 4,73 до 3,93, что можно объяснить угнетением функции активности нейтрофилов в процессе традиционной антибактериальной терапии. В свою очередь функциональная недостаточность фагоцитарного звена лежит в основе хронизации воспалительного процесса.
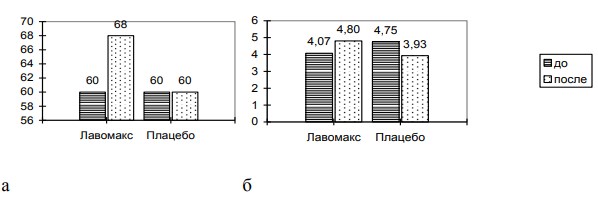
Рис. 3 - Показатели фагоцитарного резерва нейтрофилов и индекса активации фагоцитоза до и после лечения а) НСТ – стимулированный б) НСТ-тест-СТ/ НСТ-тест-СП
Изучение воздействия иммуномодулятора на Т-клеточное звено иммунитета показало отсутствие существенного влияния иммуномодулирующего препарата на содержание в крови общего количества Т-лимфоцитов (Т3+клетки), однако субпопуляционный анализ продемонстрировал возрастание иммунорегуляторного индекса Tx/Ts (Т4+/ Т8+) с 2,11 до 2,35, в то время как в контрольной группе П этот показатель не изменился (рис.4)
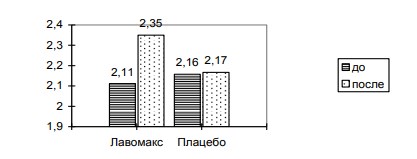
Рис. 4 - Показатели иммунорегуляторного индекса Tx/Ts до и после лечения.
Учитывая «хелперцентрический» характер функционирования иммунной системы, определено, что назначение иммуномодулирующего препарата у больных с рецидивирующей инфекцией нижних мочевых путей благоприятно влияет на иммунореактивность. Статистический анализ выявил достоверные отличия в группах во влиянии на показатели CD4 (Т4+) и HCTстимулированный. Также выявлена достоверная положительная динамика по ИАН в группе Л.
Эффекторы гуморального ответа – антитела и Т-лимфоциты воспринимают разную информацию об антигенах, потому выполняют разные функции в противоинфекционном иммунитете. Антитела иммобилизуют/нейтрализуют свободные антигены, не ассоциированные с молекулами главного комплекса гистосовместимости. Считают, что антитела добиваются элиминирующего эффекта в содружестве с фагоцитами и комплементом [10]. Известно, что В–лимфоциты - основа обеспечения гуморального иммунитета. Из них образуются плазмоциты, которые вырабатывают защитный белок иммуноглобулин.
Статистически достоверных изменений в состоянии гуморального иммунитета, который мы оценивали по содержанию в крови трех основных классов иммуноглобулинов - M,G,A не получено.
Обсуждение результатов исследования: У 85% (n-51) больных с рецидивами воспалительных изменений мочевого пузыря имелась та или иная сопутствующая хроническая патология, что могло быть следствием снижения/отклонения от нормы иммунных показателей. Следовательно, назначение им иммуномодулятора было патогенетически обоснованным. Важно осознавать, что ведущим фактором оценки эффективности проведенной терапии является динамика клинической картины заболевания, лабораторные показатели - вторичны. Лабораторными методами невозможно оценить состояние иммунного статуса, поскольку в крови циркулирует лишь 1,5-3% от всех лимфоцитов, имеющихся в организме. Основная масса лимфоцитов сосредоточена в лимфоидных и других тканях. (Е.И. Змушко с соавт., 2001)[4]. В представленном исследовании частота «неудовлетворительного» ответа на терапию к 25 дню лечения достоверно была выше в группе П (5 из 30 по сравнению 14 из 30; p=0,01, точный тест Фишера). Частота «выраженного» эффекта соответственно была выше в группе Л (р<0,01, точный тест Фишера). К 180 дню наблюдения за пациентами выявлено сохраняющееся различие в частоте ответа на терапию по группам. В группе Л «выраженный» ответ регистрировался у 19 больных, в группе «Плацебо» у 2 (р<0,01, точный тест Фишера).
Клиника обострения цистита в период базового приема иммуномодулятора возникла у 20% (n-6) пациенток в группе Л, в группе П - у 36,6% (n-11). В период профилактического приема иммуномодулятора (в течение 10 недель) обострения зафиксированы лишь у 10% пациенток группы Л (n-3) и у 36,6% (n-11) группы П. (p<0,01, точный тест Фишера). Причем после прекращения приема иммуномодулятора к 180 дню количество рецидивов цистита возросло в обеих группах: в группе Л до 20% (n-6), в группе П до 30% (n-9) (рис.5). Это свидетельствует о необходимости проводить профилактические курсы патогенетического лечения 2 раза в год – весной и осенью, в период максимального риска обострений заболевания.
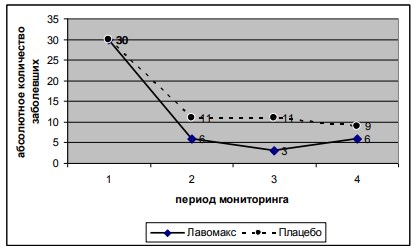
Рис.5 - Динамика обострений цистита в группах: (1)- исходное состояние, (2)- 25 день - после базового курса лечения , (3)-100 день - после курса профилактического патогенетического лечения группы Л, (4)- 180 день.
Заключение
Таким образом, включение иммуномодулятора в схему лечения рецидивирующей инфекции нижних мочевыводящих путей у женщин патогенетически обосновано, приводит к достоверному уменьшению частоты рецидивов заболевания после базового и профилактического курсов приема препарата. Рецидивы цистита выявлены у 10% пациентов основной и 36,6 % пациентов группы сравнения. Качество жизни и частота «выраженного» эффекта оказались выше у пациентов, получающих иммуномодулятор (р<0,01, точный тест Фишера). Иммуномодуляция должна быть обязательным компонентом лечения больных хроническим циститом с повышенным риском развития нового эпизода заболевания. Включение иммуномодулятора в состав комплексной терапии способствует возрастанию индекса активации фагоцитарного резерва нейтрофилов, позволяет с большей частотой добиться эрадикации инфекционного агента, приводит к достоверному уменьшению частоты обострений заболевания во время и после терапии, улучшает оценку компонентов качества жизни женщин, страдающих рецидивирующим циститом.
Литература
1. Шварцбурд, П.М. Хроническое воспаление повышает риск развития эпителиальных новообразований, индуцируя предраковое микроокружение: анализ механизмов дисрегуляции. Вопросы онкологии. 2006; Т. 52, № 2: 137- 144.
2. Переверзев А.С.Инфекции в урологии. Харьков, «Факт». 2006; 351.
3. Россихин В.В., Бухмин А.В. Цистит. Харьков. 2005; 124.
4. Змушко ЕИ, Белозеров ЕС, Минин ЮА, Клиническая иммунология «Питер» Санкт-Петербург. 2001; 574.
5. Ройт А. Основы иммунологии издательство. М. «Мир»: 1991; 327.
6. Богданов М.Б., Черненькая Т.В. Алгоритм и организация антибиотикотерапии. М: Издательский дом Видар. М: 2004;216.
7. Стрельцова О.С., Тарарова Е.А., Киселева Е.Б. Лавомакс в комплексном лечении хронического цистита. Урология.2008; 5:19-23.
8. Маянский А.Н. Механизм противоинфекционного иммунитета. Нижний Новгород. Полиграфический участок Ниж ГМА.1998;31.
9. Иммунология и аллергология: учебное пособие для студентов медицинских вузов/под ред. А.А. Воробьева, А.С. Быкова, А.В. Караулова.М.: Практическая медицина.2006;288.
10. Филиппович С.В., Московенко Н.В., Новиков С.Б., Генне Г.А. Цистит у женщин. Б. Безнощенко (ред). М: Медицинская книга, Н. Новгород: Изд-во НГМА, 2004; 44.
Статья опубликована в журнале "Вестник урологии". Номер №4/2014 стр. 35-47









Комментарии