Неймарк А.И. 1 , Тачалов М.А. 2 , Неймарк Б.А. 1 , Торбик Д.В. 1 , Арзамасцев Д.Д. 3
1 Кафедра урологии и нефрологии (зав. – проф. А.И. Неймарк) ГБОУ ВПО Алтайский государственный медицинский университет Росздрава (г. Барнаул)
2 Отделенческая клиническая больница на ст. Барнаул ОАО «РЖД». Урологическое отделение (г. Барнаул) 3 КГБУЗ «Краевая клиническая больница». Отделение рентген-операционных методов диагностики и лечения. (г. Барнаул) Эл. почта: neimark.b@mail.ru
Введение. Пик заболеваемости раком предстательной железы (РПЖ) и доброкачественной гиперплазии предстательной железы (ДГПЖ) приходится на возрастную категорию 70 – 75 лет и выше. Ожидаемая продолжительность жизни менее 10 лет и выраженная соматическая патология ограничивают использование традиционных хирургических методик. Улучшение качества жизни таких пациентов является актуальной задачей современной урологии.
В последние годы отмечается повышенный интерес врачей различных специальностей к такой отрасли медицины как интервенционная хирургия, которая позволяет проводить эндоваскулярные вмешательства с минимальной травматичностью, низким операционным риском и отсутствием необходимости в проведении анестезиологического пособия.
Впервые эндоваскулярная эмболизация в урологической практике нашла свое применение при купировании опасных для жизни кровотечений из мочевого пузыря и предстательной железы (ПЖ). Эмболизация артерий предстательной железы использовалась в течение многих лет для остановки кровотечения в связи с прогрессирующим РПЖ, а также для остановки кровотечения после операций на ПЖ [1].
Эмболизация артерий ПЖ при ДГПЖ применяется с 2004 года. Исследования отечественных и зарубежных авторов показали, что применение данного метода лечения ДГПЖ позволяет добиться уменьшения объема ПЖ более чем на 40% у 80 – 93% пациентов [2,3,4,5,6].
Основным источником кровоснабжения ПЖ является нижняя пузырная артерия — ветвь внутренней подвздошной артерии, от которой отходят от 2 и более артерий ПЖ. Современное оборудование для рентгенэндоваскулярных вмешательств позволяет проводить суперселективную катетеризацию и различные манипуляции, используя просвет мелких сосудов.
Возможности суперселективной катетеризации мелких артериальных сосудов обеспечивают не только эмболизацию, но и введение лекарственных препаратов непосредственно в ткань органа.
Химиоэмболизация (ХЭ) – это инновационный метод лечения злокачественных новообразований различной локализации, сочетающий в себе эмболизацию артерии, питающей опухоль, эмболизирующим материалом, в состав которого входит противоопухолевый препарат.
Эмболизация артериального сосуда, питающего пораженный злокачественной опухолью орган, приводит к некрозу опухоли и замедлению ее роста [7, 8, 9, 10].Суть методики заключается в резком замедлении регионарного кровотока в опухоли путем химиоэмболизации, что обеспечивает пролонгированный контакт опухоли с высокой концентрацией химиопрепарата. Это вызывает усиленную диффузию его в ткань, что позволяет добиться выраженного противоопухолевого эффекта без увеличения суммарной дозы препарата.
Цель исследования: оценка эффективности и безопасности суперселективной эмболизациии химиоэмболизации простатических артерий как самостоятельного метода лечения РПЖ и ДГПЖ.
Материалы и методы: эмболизацию артерий ПЖ проводили под местной анестезией трансфеморальным доступом по методике Сельдингера. Под рентгеновским контролем выполняла и суперселективную катетеризацию ветвей внутренней подвздошной артерии (ВПА) (Рис 1.). У пациентов с ДГПЖ производили эмболизацию сосудов, питающих ПЖ, путѐм применения микрокатетерной техники с введением микросфер EmboGold (Biosphere Medical, Франция) размером 100-300 мкм или 300-500 мкм до полной блокады кровотока (Рис. 2). У пациентов с РПЖ проводили суперселективную катетеризацию ВПА поочередно с обеих сторон с последующей химиоэмболизацией сосудов, питающих ПЖ, путем введения химиопрепарата и полимерных микросфер (Рис. 3.). Химиопрепаратом для проведения данной процедуры служил веромитомицин в дозировке 20 мг. В качестве источника транспортировки химиопрепарата применяли микросферы HepaSphere™ с размером микросфер 300-500 мкм – это новейший эмболизационный материал с высокими абсорбционными свойствами.
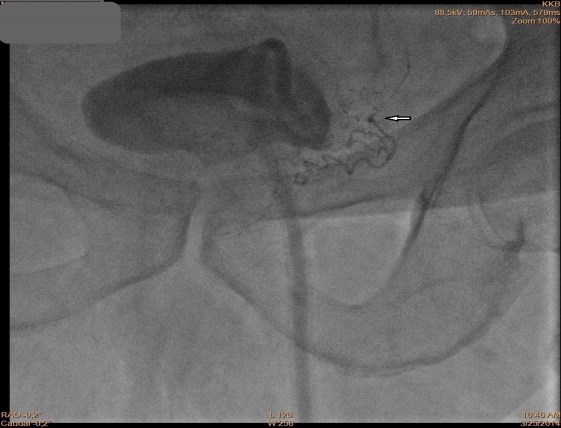
Рис.1. Ангиографический катетер подведен суперселективно к простатическим ветвям нижней мочепузырной артерии слева, стрелкой отмечен дистальный конец катетера
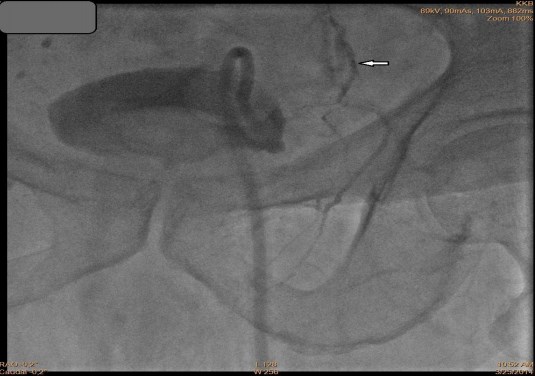
Рис.2. Выполненаэмболизация артерий простаты, кровоток блокирован, стрелкой отмечен дистальный конец катетера
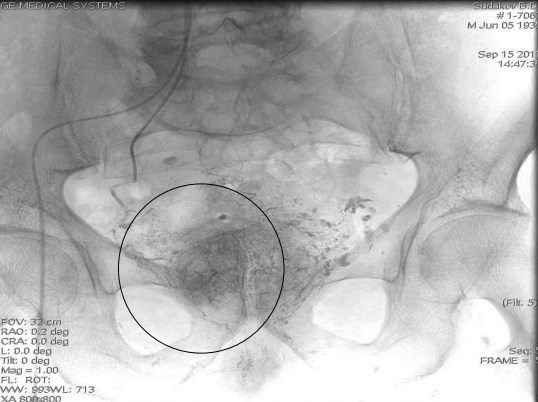
Рис.3. Выполнена супер селективная химиоэмболизация с двух сторон. Отмечено накопление химиоэмболизата в тканях ПЖ.
Лечение осуществляли на базе отделения рентгеноперационных методов диагностики и лечения Краевой клинической больницы. С 2004 по 2014 год проведена эмболизация артерий ПЖ у 59 пациентов с ДГПЖ, средний возраст, которых составил 68,2 ± 6,2 лет. Объем ПЖ варьировал от 35 до 296 см. куб.
В период с 2011 по 2014 годы, проведено лечение 36 пациентов с РПЖ методом рентгенэндоваскулярной химиоэмболизации. Все пациенты имели верифицированный РПЖ стадии T2а – 6 пациентов и стадии T2с – 30 пациентов. Средний возраст пациентов составил 72,3±2,06 года. Уровень простатспецифического антигена (ПСА) колебался от 0,8 до 17 нг\мл. Средний – 13,1±3,9 нг/мл. Объем ПЖ составил от 41 до 93 см. куб (средний объем 59±9,3). До проведения ХЭ 8 пациентов получали антиандрогенную терапию в монорежиме, 4 была выполнена хирургическая кастрация. 24 (66,6%) пациента имели симптомы нижних мочевых путей, в том числе у четверых цистостомические дренажи. Срок наблюдения составил от 3 до 36 месяцев. Все пациенты с ДГПЖ и РПЖ имели сопутствующую патологию, не позволяющую проводить радикальные методы лечения.
Результаты лечения оценивали по динамике уровня ПСА в сыворотке крови, данным трансректального ультразвукового исследования ПЖ, при котором определяли степень редукции объема ПЖ, ее эхоструктуру и васкуляризацию, анкетирование по международной системе суммарной оценки симптомов при заболеваниях простаты (IPSS), данным урофлоуметрии. Контрольными точками для оценки эффективности лечения стали: 3, 6, 9, 12, 18 и 24 месяца. 16 (44,4%) пациентам с РПЖ выполнена контрольная трансректальная мультифокальная биопсия ПЖ.
Противопоказаниями для проведения рентгенэндоваскулярных вмешательств являлись:
- Непереносимость рентгенконтрастных веществ;
- Наличие острых инфекционно-воспалительных заболеваний простаты;
- Декомпенсированная патология внутренних органов (сердечнососудистой системы, паренхиматозных органов);
- Декомпенсированная патология эндокринной системы;
- Нарушения сердечного ритма независимо от причины;
- Тяжелая форма бронхиальной астмы;
- Состояние после перенесенного инфаркта миокарда или острого нарушения мозгового кровообращения в срок до 6 месяцев;
- Наличие флотирующих тромбов в бассейне вен нижних конечностей;
- Анемия тяжелой и средней степени;
- Окклюзионно-стенотические поражения подвздошных сосудов;
- Аномалии анатомического строения подвздошных сосудов, не позволяющие выполнить операцию.
Данные подвергались статистической обработке посредством программы STATISTICA 10.0 и пакета прикладных программ, встроенного в программную среду MicrosoftExel 2010.
Результаты: в послеоперационном периоде у 63% больных наблюдали явления так называемого постэмболизационного синдрома, проявлявшегося умеренными болями в области промежности, по ходу уретры при мочеиспускании, в небольшойчасте случаев субфебрилитет имел место не более суток. 47% больных однако не испытывали какого-либо дискомфорта в послеоперационном периоде.
Для предупреждения и уменьшения проявлений болевого синдрома перед вмешательством и после операции в течение 7 дней больным назначали нестероидные противовоспалительные препараты (НПВП) в стандартных дозировках.
Каких-либо серьезных осложнений отмечено не было, за исключением одного случая, когда в послеоперационном периоде наблюдали ишемию головки полового члена, купированную консервативной терапией.
Таблица 1. Результаты лечения пациентов с ДГПЖ
| Показатели\сроки | Через 3 мес. | Через 6 мес. | Через 12 мес. | Через 24 мес. |
| Объем остаточной мочи(мл) | 158,2±0,0281 | 143,0±0,00231 | 25,3±0,0020- | 26,3±0,00203 |
| Баллы по шкале IPSS | 6,2±0,0511 | 4,0+0,014' | 3,6+0,011- | 3,9+0,0113 |
| ПСА (общи й/ с вобод н ы й) (нг/мл) | 1,3±/0,03± 0,00361 | 1,08±1 /0,0271 ± 0,00151 | 1,06±2 /0,022± 0,00152 | 1,09±3 /0,027 ± 0,00173 |
| Qmax (мл/сек) | 14,7±0,00431 | 15,9±0,00271 | 16,1+0,00142 | 16,4+0,00143 |
| Объем предстательной железы (см ) | 83,4±8,31 | 54,29 ±5,371 | 52,07+5,372 | 53,07+5,383 |
| Объем узла (см3) | 52,9±5,171 | 33,26±6,671 | 32,16±5,432 | 33,18±4,833 |
Примечание: 1 результат достоверный по сравнению с данными до лечения – (р>0,01), 2 результат достоверный по сравнению с данными через 3 месяца после лечения (р0,01)
Через 3 месяца ( табл.1) достоверно уменьшилось количество симптомов по шкале IPSS, увеличилась Q макс. Эта тенденция сохранилась и в течение годового мониторинга, при наблюдении за пациентами в течение 24 месяцев после эмболизации достигнутый эффект был стабилен. Объем предстательной железы и узлового образования в среднем уменьшился на 53 и 47% соответственно, максимальный эффект – уменьшение объема железы на 82%.
Положительный эффект от проведения суперселективной рентгенэндоваскулярной химиоэмболизации опухолевой простаты был достигнут у 30 (83,3%) пациентов.Объективный ответ получен по результатам снижения уровня ПСА, уменьшения объема ПЖ по данным ТРУЗИ и улучшения качества мочеиспускания. Снижение уровня ПСА отмечено уже через 1 месяц после проведения химиоэмболизации. Средний уровень ПСА через 1 месяц составил 9,2±0,8 нг\мл.в сравнении с дооперационным значением – 13,1±3,9. Максимальное снижение уровня ПСА отмечено к 6 месяцам после проведения химиоэмболизации. Медиана ПСА через 6 месяцев составила – 3,4±0,02нг\мл. При дальнейшем наблюдении отмечено достоверное снижение уровня ПСА до 60 % от первоначального уровня (p< 0,05).
Достоверное уменьшение объема ПЖ имело место через 3 месяца после химиоэмболизации (p< 0,05) и составило 49,1% от первоначального (29,6±4,8 см.куб). Среднее значение объема ПЖ через 1 месяц – 39,8±8,6 см.куб. (до химиоэмболизацции 59±9,3 см.куб).На протяжении всего периода наблюдения значимого увеличения объема ПЖ не наблюдали. (Рис. 4.).
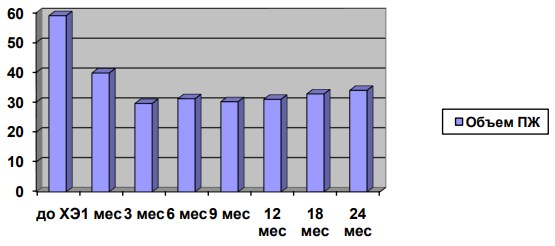
Рис.4. Динамика объема ПЖ.
Через 6 месяцев после ХЭ определены характерные эхографические признаки: нечеткие, неровные контуры ПЖ, усиление неоднородности эхоструктуры за счет участков неравномерного повышения эхогенности. У всех пациентов, с положительным эффектом от ХЭ не выявляли участки с гиперваскуляризацией ПЖ.
После проведения химиоэмболизациипроизошло улучшение качества мочеиспускания, что подтверждено данными урофлоуметрии и оценкой симптомов нижних мочевых путей по шкале IPSS (Таб. 2).
Таблица 2. Динамика максимальной скорости мочеиспускания и баллов суммарной оценки симптомов после ХЭ рака.
| Показатели\ сроки | До лечения | 3 месяца | 6 месяцев | 12 месяцев | 24 месяца |
| Qmax (мл\сек) | 9,6±2,2 | 14,6±0,8 | 15,8±1,2 | 15,2±0,6 | 14,8±0,4 |
| Р | 0,031 | 0,024 | 0,028 | 0,030 | |
| IPSS (баллы) | 12,8±1,6 | 8,6±0,4 | 5,8±0,9 | 6,2±0,4 | 6,4±0,5 |
| Р | 0,041 | 0,018 | 0,022 | 0,024 |
У всех пациентов, имеющих обструктивную симптоматику, отмечено улучшение мочеиспускания. Максимальное улучшение показателей Qmax и баллов IPSS наблюдали через 6 месяцев после ХЭ.
Через 12 месяцев выполнена контрольная биопсия 16 пациентам. По результатам морфологического исследования в 12 случаях наблюдался фиброз и дистрофия эпителия без признаков атипии, в 2-х – лечебный патоморфоз (Рис.5,6). В материалахбиопсий двух больных сохранялась картина мелкоацинарнойаденокарциномы без клинической прогрессии заболевания.
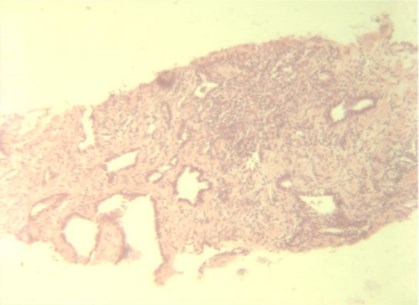
Рисунок 5. Биопсия ПЖ: аденокарцинома сумма Глисона – 4 балла.
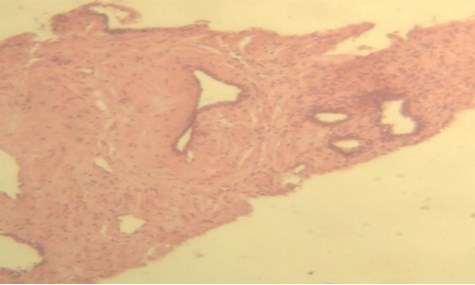
Рисунок 6. Биопсия ПЖ через 12 месяцев после химиоэмболизации: фиброзная ткань, в которой встречаются единичные простатические мелкие железы и их группы с атрофией эпителия без атипии, очаговые лимфоидные инфильтраты
Обсуждение. Эмболизация и химиоэмболизация при таких заболеваниях как ДГПЖ и РПЖ являются довольно новым и эффективным подходом клечениюя, расширяющим возможности медицинской помощи группе пациентов, которым ранее отказывали в проведении радикального лечения. Наш опыт рентгенэндоваскулярных вмешательств показал их эффективность и безопасность у селективных пациентов.
Возникновение методики химиоэмболизации было бы невозможно без использования всей совокупности научных и клинических исследований, проводившихся учѐными на протяжении последнего времени в области других методик. По сути химиоэмболизация в ее современном виде возникла на основе опыта внутрисосудистых исследований, интервенционной радиологии, системной химиотерапии и эмболотерапии.
Привлекательность методики ХЭ обусловливается еѐ малой травматичностью, а также низкой частотой осложнений. Однако для получения максимального эффекта от химиоэмболизации необходимо учитывать такие показатели как тип опухоли, ее происхождение, локализацию, чувствительность пораженной ткани к химиопрепаратам, а также тип и количество эмболизирующего носителя препарата.
Исследования последних лет продемонстрировали хороший и стойкий эффект от проведения эмболизации артерий ПЖ при ДГПЖ. Достижения интервенционной хирургии при ДГПЖ позволили разработать по-сути новую методику лечения РПЖ, связанную с суперселективной катетеризацией артерий ПЖ и введением в ткань ПЖ химиопрепарата совместно с эмболизирущим материалом, что позволяет непосредственно воздействовать на опухолевые клетки и значительно уменьшать кровоток в ПЖ. Для оценки онкологических результатов химиоэмболизации при РПЖ необходимо большее количество пациентов и более длительный период наблюдения.
Дальнейшее изучение методикэмболизации и химиоэмболизации при таких значимых заболеваниях как РПЖ и ДГПЖ позволит детально их отработать, точно определить показания и противопоказания к применению, с тем чтобы внедрить в практическую медицину.
Заключение. Методика эмболизации артерий ПЖ показала высокую эффективность и безопасность у селективных пациентов с ДГПЖ, не подлежащих хирургическому лечению.
Методика химиоэмболизации получаетвсе более широкоевсе более широкоеизучение при лечении опухолей различной локализации. Это объясняется ее эффективностью, т.к. химиоэмболизация сочетает в себе механизмы регионарной химиотерапии и эмболизации питающих опухоль сосудов, ведущей к ишемии и некрозу пораженной ткани.
Первый опыт химиоэмболизации при локализованном РПЖ показал эффективность и безопасность применения у пациентов, не подлежащих радикальному лечению.
Литература
1. Jeong CW, Park YH, Ku JH, Kwak C, Kim HH. Minimally invasive management of postoperative bleeding after radical prostatectomy: transarterial embolization. J Endourol. 2010 Sep;24(9):1529-33.
2. Prostatic arterial embolization to treat benign prostatic hyperplasia / J. М. Pisco, L. C. Pinheiro, Т. Bilhim [et al.] // J. Vasc. Interv. Radiol. — 2011. — Jan. — Vol. 22 (1). — Р. 11–9.
3. Эмболизация артерий предстательной железы в лечении больных аденомой предстательной железы с высоким хирургическим риском / Е. А. Яковец, А. И. Неймарк, А. А. Карпенко, Я. В. Яковец // Андрология и генитальная хирургия. — 2010. — № 1. — С. 38–43.
4. Carnevale FC, Motta Leal Filho JM, Antunes AA, Cerri LM, Baroni RH, Marcelino AZ, et al. Quality of life and symptoms relief support prostatic artery embolization for patients with acute urinary retention due to benign prostatic hyperplasia. J of Vascular and Interventional Radiology. 2012;23(3):S4.
5. Pisco J.M., Rio Tinto H, Campos Pinheiro L, Bilhim T, Duarte M, Fernandes L, Pereira J, Oliveira AG. Embolisation of prostatic arteries as treatment of moderate to severe lower urinary symptoms (LUTS) secondary to benign hyperplasia: results of shortand mid-term follow-up. EurRadiol. 2013 Sep;23(9):2573-4.
6. Gao YA, Huang Y, Zhang R, Yang YD, Zhang Q, Hou M, Wang Y. Benign prostatic hyperplasia: prostatic arterial embolization versus transurethral resection of the prostate--a prospective, randomized, and controlled clinical trial. Radiology. 2014;270(3):920-8.
7. Bruix J. Transarterial embolization versus symptomatic treatment in patients with advanced hepatocellular carcinoma: results of a randomized, controlled trial in a single institution / J. Bruix, J.M. Llovet, A. Castells // Hepatology. 1998. -Vol.27. N6. -P.578-579.
8. Di Stefano D.R. Preoperative percutaneous portal vein embolization: evaluation of adverse events in 188 patients / D.R. Di Stefano, T. de Baere, A. Denys // Radiology. 2005. Vol.234. P.625-630.
9. Hallisey M.J. Angiographic embolization for the control of massive postpartum and gynecologic hemorrhage / M.J. Hallisey, W. Miller, S.K. Sussman // Radiology. 1994. Vol.193. P.299-308.
10. Johansson M. Clinical outcome after endovascular coil embolization in elderly patients with subarachnoid hemorrhage / M. Johansson, O. Norback, G. Gal //Neuroradiology. 2004. Vol.46. P.385-391.
Статья опубликована в журнале "Вестник урологии". Номер №3/2015 стр. 62-68









Комментарии