Толкач Ю.В., Кучик М., Мерзебургер А., Зерт Ю., Херрманн Т., Имкамп Ф.
Медицинская Школа Ганновера, Клиника урологии и урологической онкологии, г. Ганновер, Германия
Введение. Рак предстательной железы является одним из самых распространенных онкологических заболеваний у мужского населения во всем мире. В силу внутренней, генетической, гетерогенности опухолей простаты зачастую сложно прогнозировать течение заболевания на основании только клинических, радиологических и стандартных патологических данных [1]. Поэтому попытка понять особенности опухоли на основании более глубокой характеризации ее клеток на молекулярно-биологическим уровне является абсолютно оправданной [2]. Одним из способов получить представление о свойствах карциномы простаты является оценка экспрессии различных генов, которые могут определять агрессивность опухоли (к примеру, склонность к быстрому росту, инвазии и метастазированию)[3].
Целью нашего исследования являлась оценка в ткани опухоли пациентов экспрессии нескольких десятков генов, роль которых для рака простаты уже была описана в предшествующих исследованиях, с целью выявления тех генов, которые могли бы служить прогностическими критериями инвазивного роста опухоли в предстательной железе, а также создание на их основе прогностической модели локального распространения опухоли в простате.
Материалы и методы
Характеристики пациентов
В исследование были включены 28 пациентов с гистологическиверифицированным раком предстательной железы с клинической стадией заболевания сТ1с-СT2bбез признаков метастатического поражения. У всех пациентов кроме одного (лапароскопическая радикальная простатэктомия) была выполнена открытая радикальная позадилонная простатэктомия в период с 2010 по 2011 годы. В 26 случаях была выполнена лимитированная или расширенная лимфаденэктомия. Более подробные характеристики пациентов приведены в Таблице 1.
Таблица 1. Клинические характеристики пациентов (включая генетическую субклассификацию опухолей)
|
Параметры |
Медиана |
[25%; 75%] |
Интервал |
|
||||||||
|
Возраст, лет |
66 |
[59,5; 69,5] |
49-75 |
|
||||||||
|
Общий ПСА до операции, нг/мл |
7,02 |
[5,57; 11,0] |
4,0-64,0 |
|
||||||||
|
|
Патоморфология |
|||||||||||
|
рТ |
рТ2а |
рТ2Ь |
рТ2с |
рТЗа |
рТЗЬ |
|||||||
|
2 |
2 |
15 |
5 |
4 |
||||||||
|
pT (локализованный / местнораспространенный РПЖ) |
Локализованный |
Местно-распространенный |
||||||||||
|
19 |
9 |
|||||||||||
|
pN |
pN0 |
pNl |
|
|
|
|||||||
|
26 |
2 |
|
|
|
||||||||
|
pR |
pRO |
pRI |
|
|
|
|||||||
|
21 |
7 |
|
|
|
||||||||
|
|
Gleason 3 |
Gleason 4 |
Gleason 5 |
|
|
|||||||
|
Primary Gleason |
23 |
5 |
0 |
|
|
|||||||
|
Secondary Gleason |
8 |
18 |
2 |
|
|
|||||||
|
|
6 (3+3) |
7(3+4) |
7(4+3) |
8 (4+4) |
9 (4+5) |
|||||||
|
Gleason Sum |
4 |
19 |
3 |
0 |
2 |
|||||||
|
|
Генетическая характеризация опухоли |
|||||||||||
|
TMPRSS2ERGфьюжн |
Есть |
Нет |
|
|
|
|||||||
| 5 | 23 | |||||||||||
| Повышенная экспрессия SPINK1 | Да | Нет | ||||||||||
| 4 | 24 | |||||||||||
Получение тканей из предстательной железы
Непосредственно после удаления предстательной железы производилось изъятие тканей без нарезки биопсийной иглой 16Gсистематически из разных зон с учетом радиологических и биопсийных данных. Из каждой зоны бралось два биоптата, один для гистологического контроля. Полученные образцы тканей замораживались в жидком азоте при температуре –800 С до последующей обработки в лаборатории. В дальнейшем анализе использовались образцы опухоли с максимальным показателем Глисона для соответствующего пациента.
Набор исследуемых генов
В соответствии с данными литературы[3-7] были отобраны 42 гена: ABCC4, AMACR, ASAH1, AURKA, BMI1, BUB1, BUB3, CBX3, CCNB1, CDC6, CDCA5, CDK4, CDKN2A, ELOVL7, ERG, ETV1, EZH2, FGFR2, GBX2, GOLM1, HOXC6, KLK3, MCM6, MKI67, MSH2, MTA1, MUC1, MYCBP2, MYO6, NRP1, PLK1, PTTG1, SMARCA4, SPINK1, SSTR1, TMPRSS2-ERGfusion, TOP2A, TPD52, UBE2I, UHRF1BP1, XIAP, XPO6. В качестве эндогенного контроля экспрессии и для нормализации были использованы два гена ALAS1и HPRT1.
Описание процедуры определения экспрессии генов
Экстракция РНК из образцов ткани осуществлялась согласно стандартному протоколу с использованием TRIZol® Reagent (Life Technologies, Carsbad, USA). Конверсия РНК в кДНК осуществлялась при помощи набора для обратной транскрипции (Applied Biosystems, Foster City, USA). Для оценки экспрессии генов использовалась технология TaqMan (LifeTechnologies) и количественная ПЦР. Коммерчески доступные праймеры были использованы для соответствующих генов. Абсолютные значения СТ были использованы для расчета относительной экспрессии мРНК генов.
Обработка данных и статистическая обработка
Данные экспрессии генов обрабатывались при помощи программного обеспечения DataAssist Software v. 3.01 (Life Technologies) с учетом поправок на тестирование множественных гипотез с использованием FDRБенджаминиХохберга. Повышенная или пониженная экспрессия считались значимыми при минимум двукратной разнице в относительной экспрессии в сравнении с контролем. Статистическая обработка и построение прогностической модели на основе линейного дискриминационного анализа осуществлялось при помощи STATISTICA 8.0 (StatSoft, Tulsa, USA).
Результаты
По данным патоморфологического исследования после радикальной операции опухоль была локализованной у 19 пациентов (pT2a-2c)и местно-распространенной (pT3a-3b)у 9 пациентов. Среди пациентов у 5 был обнаружен фьюжн генов TMPRSS2 и ERG, среди них 2 пациента с местнораспространенным раком предстательной железы и 3 пациента с локализованным процессом по данным финальной патологии. У четырех пациентов опухоли были SPINK1-позитивными (из них два с фьюжном TMPRSS2:ERG и 1 пациент с местно-распространенным процессом). Дополнительные характеристики приведены в Таблице 1.
В ходе анализа была обнаружена связь 6 генов с локальной стадией опухолевого процесса (Рисунок 1), при этом экспрессия лишь одного гена (GOLM1) была повышена при местно-распространенных опухолях.
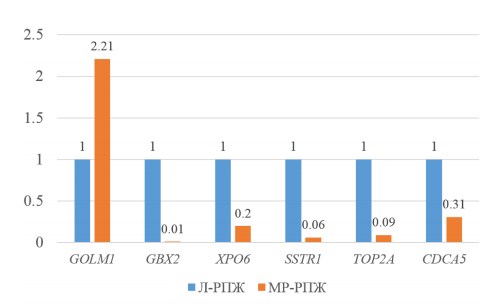
Рис. 1. Относительная экспрессия генов GOLM1, GBX2, XPO6, SSTR1, TOP2Aи CDCA5 в опухолевых тканях пациентов с локализованным (Л-РПЖ) и местно-распространенным (МР-РПЖ) раком предстательной железы. Для всех 6 показателей p<0,05. В качестве контроля выбрана группа пациентов с локализованным раком (экспрессия генов принята за 1).
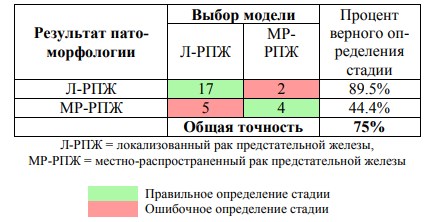
На основании полученных данных о экспрессии генов была создана модель на основе линейного дискриминантного анализа для прогнозирования локальной стадии заболевания на основе данных об экспрессии указанных шести генов. Общая точность модели в отношении предсказания стадии рТ рака предстательной железы на основании только экспрессии генов составила 75% (Таблица 2).
Таблица 2 Классификация пациентов (n=28) с раком предстательной железы по критерию рТ: сравнение результатов патоморфологического исследования и прогноза на основании использованной модели оценки экспрессии шести генов (GOLM1, GBX2, XPO6, SSTR1, TOP2A, CDCA5)
Обсуждение результатов.
Многочисленные исследования в области генетики рака предстательной железы позволили выявить изменения в различных генах в опухолевых клетках, задействованных в процессах опухолевого роста, инвазии и метастазирования [3-7]. Однако, большая часть этих исследований может быть отнесена к разряду исследований, генерирующих гипотезы. Соответствующая валидизация позволяет в этой ситуации подтвердить или опровергнуть полученные данные.
В нашем исследовании мы ограничились оценкой прогностической роли 42 генов с выявленным ранее значением для рака предстательной железы в отношении неблагоприятных находок при финальном патоморфологическом исследовании простаты после радикальной простатэктомии, а именно локальной стадии (распространенности) процесса в предстательной железе, а также выход его за пределы простаты (критерий рТ). Недостатком исследования является отсутствие контроля более надежных конечных показателей (выживаемость), однако, данные ранее опубликованных исследований показывают, что локальная стадия процесса может являться суррогатом для выживаемости[8].
Среди 42 генов мы выявили лишь 6, экспрессия которых обладала прогностическим значением для предсказания локальной стадии опухоли. Это говорит о том, что большая часть этих генов, несмотря на показанное ранее прогностическое значение в отношении рака предстательной железы [3-7], может быть переоценена. Их дополнительное исследование на клиническом и патологическом материале с длительный сроком наблюдения после операции было бы оправданным для оценки их роли в отношении прогнозирования выживаемости пациентов.
Как показывает анализ точности полученной на основании дискриминантного анализа модели, модель с высокой точностью позволяет классифицировать случаи локализованного рака предстательной железы, тогда как точность в отношении определения местно-распространенного рака предстательной железы оставляет желать лучших результатов. Тем не менее, при такой производительности модели ее можно было бы использовать следующим образом: все случаи, которые были классифицированы, как местно-распространенный рак предстательной железы, должны получать активное лечение независимо от прочих обстоятельств. В отношении случаев, классифицированных как локализованный рак предстательной железы, можно сделать акцент на активное наблюдение при условии, что клинические параметры позволяют включить пациентов в программу активного наблюдения.
Логичной область для применения полученных данных является оценка инвазивных свойств опухоли на основании биопсийного материала[9].
Данное исследование являлось пилотным и преследовало цель отбора генов для последующего использования на большей по размеру исследовательской когорте, поэтому мы не проводили мультипараметрический анализ с включением клинических и радиологических параметров (это было невозможным в связи с небольшим количеством исследованных пациентов). Поэтому на данный момент сложно утверждать, сохранят ли свою значимость параметры генетической экспрессии указанных выше шести генов или нет. Следующим закономерным этапом настоящего исследования является валидизация полученных данных.
Заключение. Результаты нашего исследования показывают, что на основании данных экспрессии ряда генов возможно прогнозирование локального распространения опухоли в предстательной железе. После соответствующей независимой валидизации можно будет принять решение о внедрении данного типа анализа в клиническую практику.
Литература
1. Eifler, JB. Anupdated prostate cancer staging nomogram (Partin tables) based on cases from 2006 to 2011 / J.B. Eifler, Z. Feng,B.M. Lin, M.T. Partin, et al. //BJU Int. – 2013, Vol.111. – P. 22-29.
2. Fraser, M. Genomic, pathological, and clinical heterogeneity as drivers of personalized medicine in prostate cancer / M. Fraser, A. Berlin, R.G. Bristow, T. van der Kwast //Urol Oncol. – 2015, Vol. 33. – P. 85-94
3. Tomlins, SA. Integrative molecular concept modeling of prostate cancer progression / S.A. Tomlins, R. Mehra, D.R. Rhodes et al. // Nat Genet. – 2007, Vol. 39. – P. 41-51.
4.Barbieri CE. The mutational landscape of prostate cancer / C.E. Barbieri, C.H. Bangma, A. Bjartell, J.W. Catto // Eur Urol. – 2013, Vol. 64. – P. 567-576.
5. Bismar TA. Defining aggressive prostate cancer using a 12-gene model / T.A. Bismar, F. Demichelis, A. Riva et al. //Neoplasia. – 2006, Vol. 8. – P. 59-68.
6. Glinsky GV. Gene expression profiling predicts clinical outcome of prostate cancer / G.V. Glinsky, A.B. Glinskii, A.J. Stephenson, R.M. Hoffman, et al. //J Clin Invest. – 2004, Vol.113. –P. 913-923.
7. Kosari F. Identification of prognostic biomarkers for prostate cancer / F. Kosari, J.M.A. Munz, C.D. Savci-Heijink et al. //Clin Cancer Res. – 2008, Vol.14. – P. 1734-1743.
8. May F. The ability of the American Joint Committee on Cancer Staging system to predict progression-free survival after radical prostatectomy / F. May, R. Hartung, J. Breul //BJU Int. – 2001, Vol. 88. – P. 702-707.
9. Van der Kwast TH. Prognostic prostate tissue biomarkers of potential clinical use / T.H. Van der Kwast //Virchows Arch. –2014, Vol.464. – P. 293-300.
Статья опубликована в журнале "Вестник урологии". Номер №3/2015 стр. 34-42









Комментарии