Ибишев Х.С., Черный А.А., Коган М.И.
Кафедра урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
Введение
Проблема дефицита тестостерона (ДТ) и методов его коррекции у мужчин вызывает интерес различных специалистов: урологов, андрологов, эндокринологов, кардиологов и занимает одно из ведущих мест в современной литературе [1, 2, 3, 4, 5, 6, 7].
Основной причиной ДТ является тестикулярная недостаточность, связанная со сниженной концентрацией тестосте-рона (Тс) в крови и обусловленная уменьшением интенсивности синтеза этого гормона клетками Лейдига или снижением общего количества данных клеток в тестикулах.
Морфологическая картина яичек, как и гормональная функция, у мужчин при различных патологических воздействиях на тестикулы претерпевает выраженные изменения. Снижаются объем репродуктивного эпителия и число клеток Лейдига [3] (Рис 1).
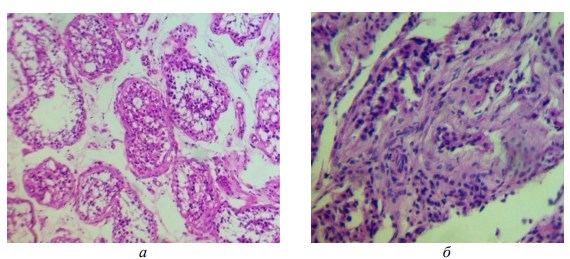
Рис. 1. Морфологическая картина тестикул: а – в норме. б – при дефиците Тс
Многочисленные исследования доказали, что при сниженной концентрации Тс на фоне хронических заболеваний со стороны сердечнососудистой, эндокринной и других систем происходит усугубление соответствующей симптоматики [6, 7].
Кроме того, доказано более тяжелое течение заболевания у пациентов с ДТ, а их лечение менее эффективно, чем у пациентов с нормальным уровнем тестостерона [1, 8, 9].
В настоящее время определена связь между течением некоторых урологических состояний и сниженной плазменной концентрацией тестостерона у мужчин [1, 5, 8, 9]. По мнению ряда исследователей, дефицит тестостерона крови негативно влияет на функцию мочевой и репродуктивной систем [1, 3, 5, 9], увеличивая процент рецидива многих урологических заболеваний. Некоторыми исследованиями продемонстрирована взаимосвязь между степенью тяжести урологической патологии и дефицитом тестостерона у мужчин [1, 2, 5, 8].
В разные годы было установлено, что снижение уровня Тс наступает у 17-60% пациентов с длительным течением хронических воспалительных заболеваний предстательной железы за счет нарушения метаболизма андрогенов, что нашло отображение в литературе [10].
Цель работы: провести ретроспективный анализ симптомов и клинического течения хронического бактериального простатита (ХБП) на фоне ДТ.
Материалы и методы
Исследование включало результаты обследования 124 пациентов с ХБП, средний возраст которых составил 31,58±0,55 лет (20-45 лет). Средняя продолжительность заболевания – 8,07±0,89 лет. Обследование включало: анамнез и клинические данные, которые оценивались с использованием Международной шкалы симптомов ХП NIH-CPSI (National Institute of Health – Chronic Prostatitis Symptom Index), Международной шкалы IPSS (International prostate symptom score), международного индекса эректильной функции (МИЭФ-5), данные пальцевого ректального исследования предстательной железы, пробу СтеймиМирса, исследование общего тестостерона крови, урофлоуметрию, трансректальную сонографию простаты, расширенное микробиологическое исследование секрета предстательной железы. РЕЗУЛЬТАТЫ У 37% мужчин с ХБП тестостерон крови был ниже нормативных показателей. В зависимости от уровня общего тестостерона пациенты были разделены на три группы: I группа – 46 пациентов, у которых уровень общего тестостерона был ниже нормативного показателя (8 нмоль/л), II группа – 27 пациентов, у которых тестостерон соответствовал диапазону серой зоны (8-12 нмоль/л), III группа – 51 пациент с нормативным уровнем тестостерона (>12 нмоль/л).
Несмотря на широкое распространение ДТ, его диагностика представляет определенные трудности, так как клинические проявления заболевания неспецифичны и часто бывают расценены пациентами и врачами как закономерные признаки другого заболевания. В связи с тем, что на уровень Тс в крови влияют различные факторы, для оценки клинических признаков ХБП на фоне ДТ рекомендуется проведение различных видов анкетирования. При оценке результатов анкетирования у 100% пациентов выявлен болевой синдром, сексуальные нарушения отмечены у 81,4%, расстройства мочеиспускания выявлены у 43,5% пациентов.
При оценке боли по шкале NIH – CPSI более выраженные ее проявления отмечены в I группе в сравнении со II и III группами (рис.2). Так, боль в промежности и надлонной области регистрировали с одинаковой частотой во всех группах, тогда как боль в яичках, боль при эякуляции и мочеиспускании достоверно чаще выявляли в I группе (р<0,05).
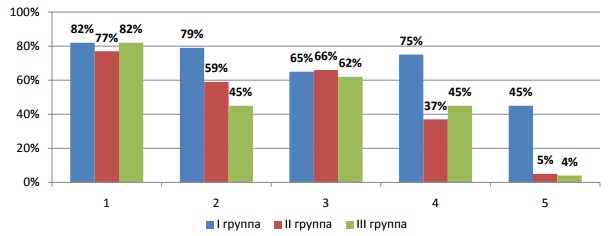
Рис. 2. Локализация боли (n=124): 1 – боль в промежности, 2 – боль в яичках, 3 – боль в надлонной области, 4 – боль при эякуляции, 5 – боль при мочеиспускании
Интенсивность болевого синдрома значительно влияла на качество жизни пациентов. В группе с уровнем Тс ниже нормативных показателей отмечена более высокая степень интенсивности болевого синдрома (Рис.3).
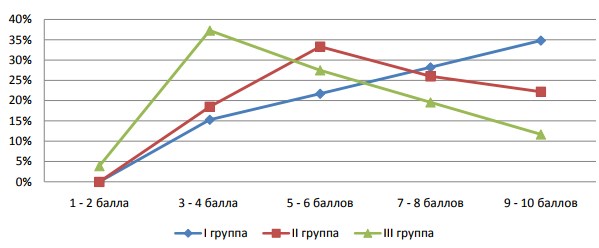
Рис. 3. Интенсивность болевого синдрома
Сексуальные нарушения отмечены у 81,4% пациентов, среди которых доминировали: преждевременная эякуляция (ПЭ) – у 73,4% пациентов, снижение либидо – у 53,3%, эректильная дисфункция (ЭД) – у 45,9%, реже отмечали стертость оргазма и отсутствие удовлетворенности от полового акта – у 41,9% и 39,5% пациентов соответственно. У подавляющего большинства пациентов встречается сочетание различных нарушений сексуальных функций.
В большинстве случаев ПЭ была регистрирована в первой группе – 44,3%, тогда как во второй и третьей группах – 16,1% и 12,9% соответственно. При оценке либидо в I группе снижение имело место у всех пациентов, во II группе – у 55,5% пациентов, в III – у 9,8% мужчин.
Анализ групп в зависимости от степени тяжести ЭД (легкая, средняя, тяжелая) продемонстрировал, что степень тяжести ЭД существенно различалась в зависимости от уровня общего Тс крови. Кроме того, средняя и тяжелая степень ЭД превалировала в группе с уровнем общего Тс ниже 8 нмоль/л, а в группе с нормальным уровнем общего Тс тяжелая степень ЭД не выявлена ни у одного пациента, а легкая и средняя степень имела небольшой удельный вес (Рис.4.).
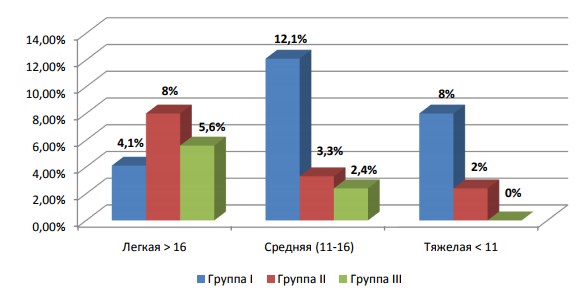
Рис.4. Степень тяжести эректильной дисфункции
Стертость оргазма выделяли в первой группе (23,4%), во второй (10,5%) и в третьей группе (8,0%).
Отсутствие удовлетворенности было выявлено практически с одинаковой частотой во всех группах.
Таким образом, высокий процент сексуальных нарушений был зарегистрирован в группе с уровнем общего Тс крови ниже нормативных показателей.
Известно, что существует связь между расстройствами мочеиспускания и тестикулярной недостаточностью у мужчин. При анализе опросников IPSS была установлена достоверная связь между расстройствами мочеиспускания и ДТ (p<0,05). Симптомы со стороны нижних мочевых путей выявлены у 43,5% пациентов (Рис. 5).
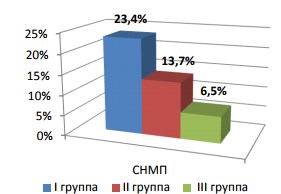
Рис. 5. Распределение больных с симптомами нижних мочевых путей
Симптомы нижних мочевых путей (СНМП) с большой частотой (23,4%) были выявлены среди пациентов с низким уровнем тестостерона. Имеются достоверные различия средних значений суммарного балла IPSS в трех группах. Так, в группе с низким уровнем Тс данный показатель достоверно выше (20,5±0,75 балла) в сравнении с группами с уровнем Тс, соответствующего серой зоне, и нормотестостерононемией (17,1±0,85 балла и 13,2± 0,85 балла соответственно (р<0,05)).
При анализе полученных данных обнаружена тесная связь между симптомами нижних мочевых путей и дефицитом тестостерона.
Обсуждения
В результате проведенного исследования выявлено, что у подавляющего большинства пациентов с хроническим бактериальным простатитом на фоне дефицита общего тестостерона клиническая картина, помимо болевого синдрома, представлена различными проявлениями сексуальных нарушений, а также симптомами нижних мочевых путей. При сравнительном анализе трех групп больных выраженность клинических симптомов наивысшей оказалась у пациентов со сниженным уровнем тестостерона. Ведущим клиническим симптомом, независимо от уровня тестостерона являлась боль, с преимущественной локализацией в промежности и в надлонной области. Однако интенсивность болевого синдрома превалировала в группе с низким уровнем плазменного тестостерона. Распространенность ЭД, как и другие сексуальные нарушения, может быть обусловлена не только низким уровнем Тс, но и связана с сосудистыми причинами, неврологическими, психологическими факторами, которые часто сопровождают ХБП. Наиболее яркие проявления сексуальных нарушений отмечены у пациентов с уровнем тестостерона ниже 8 нмоль/л.
Результаты исследования и их сопоставимость с данными литературы позволяют нам рекомендовать в комплексной терапии ХБП, сочетающегося с ДТ, лекарственные препараты, увеличивающие уровень общего Тс крови. Данная терапия может не только положительно влиять на ДТ, но также имеет потенциальные возможности купирования симптомов ХБП и снижения процента рецидива заболевания.
Выводы
Таким образом, при анализе клинических проявлений ХБП на фоне ДТ отмечены более выраженные нарушения у пациентов с уровнем общего Тс ниже 8 нмоль/л.
Поддержание физиологического уровня Тс является основным условием для лечения пациентов с ХБП на фоне ДТ.
Дефицит биодоступного Тс должен быть восполнен у мужчин, имеющих характерную симптоматику, независимо от фонового заболевания.
Литература
1. Аль-Шукри С.Х., Глазнева С.Ю., Корнеев И.А. Диагностика возрастного андрогенного дефицита у мужчин с расстройствами мочеиспускания // Сборник научных трудов VII российского конгресса «Мужское здоровье». – Ростов-на-Дону, 2011. – С. 243.
2. Гамидов С.И., Иремашвили В.В. Метаболический синдром в урологии. – М.: Практ. Медицина, 2010. – 42 с.
3. Глыбочко П.В., Чалый М.Е., Усачева О.А. Андрогенный статус мужчин после оперативного лечения варикоцеле // Материалы первого национального форума «Репродуктивное здоровье как фактор демографической стабилизации». – Ростов-на-Дону, 2012. – С. 155.
4. Мазо Е.Б., Степенский А.Б., Гамидов С.И. и соавт. Фармакотерапия хронических простатитов // РМЖ. – 2001. – Т.9, №23. – С. 12.
5. Шустер П.И. Эффективность и безопасность андрогенной терапии гипогонадизма у пациентов с радикально устраненным уролитиазом // Саратовский научно-медицинский журнал. – 2009. – Т.5, № 3. – С. 327-332.
6. Jones R.D., Nettleship J.E., Kapoor D. et al. Testosterone and atherosclerosis in aging men: purported association and clinical implications // Am J Cardiovascm Drugs. – 2005; №5: P. 41-54.
7. Malkin C.J., Pugh P.J., West J.N. et al. Testosterone therapy in men with moderate severity heart failure: doubleblind randomized placebo-controlled trial // Eur Heart J. – 2006. – №27. – P. 57-64.
8. Дедов И.И., Калиниченко С.Ю. Возрастной андрогенный дефицит у мужчин. – М.: Практ. Медицина, 2006. – 240 с.
9. Коган М.И., Ибишев Х.С., Ферзаули А.Х. Хронический бактериальный простатит и биохимический андрогенный дефицит // Материалы пленума правления российского общества урологов. – Кисловодск, 2011. – С. 326.
10. Курбатов Д.Г., Кузнецкий Ю.Я., Петричко М.И. Взаимосвязь синдрома хронической тазовой боли и андрогенодефицита // Тезисы научных трудов Всероссийского конгресса по андрологии. – Сочи, 2007. – С. 21.
Статья опубликована в журнале "Вестник урологии". Номер №1/2013 - стр. 39-46









Комментарии