В. В. Землянский1, О. Б. Жуков2, Т. А. Курманов1, Ж. Д. Жумагазин1, А. М. Чиналиев1
1ТОО «Национальный научный онкологический центр»; Республика Казахстан, 010000 Нур-Султан, ул. ханов Керея и Жанибека, 3;
2ФГАОУ ВО «Российский университет дружбы народов»; Россия, 117198 Москва, ул. Миклухо-Маклая, 6
Контакты: Виктор Викторович Землянский victor_zem@mail.ru
Введение
Статистические данные о заболеваемости раком почки свидетельствуют о том, что ежегодно число пациентов во всем мире растет, и Казахстан не является исключением. Если 5 лет назад доля рака почки в структуре онкологической патологии составляла 3,6 %, то в 2019 г. она достигла 4,1 %. В Республике Казахстан у впервые выявленных больных раком почки в 34,0 % случаев диагностируется I стадия, в 26,7 % – II стадия. Такое частое выявление локальных новообразований небольших размеров (Т1–2) привело к тому, что на данный момент именно частичная резекция почки, а не нефрэктомия стала наиболее широко выполняемым и даже рекомендуемым хирургическим вмешательством при опухолях почки [1–7].
Доступность и высокая эффективность современных малоинвазивных методов диагностики, таких как ультразвуковое исследование с доплерографией сосудов, мультиспиральная компьютерная томография (КТ) с возможностью трехмерного моделирования патологического процесса, магнитно-резонансная томография (МРТ), обусловливают выявление опухолей почек на более ранних стадиях [4, 7–11].
В целом в научной литературе органосохраняющая открытая частичная резекция почки рассматривается как приоритетный метод лечения опухолей I–II стадий, а в отдельных источниках – как стандарт органосохраняющего оперативного лечения опухолей почки размером <4 см. Лапароскопическая резекция при этом считается альтернативой [4].
Одно из многоцентровых исследований с участием 1799 пациентов продемонстрировало, что средний объем кровопотери при открытой и лапароскопической резекции почки сопоставим – 376 (10–3300) и 300 (25–6000) мл соответственно. Ввиду этого как при открытых, так и при лапароскопических резекциях почки основную проблему представляет интраоперационный контроль кровотечения [10]. В ряде случаев при лапароскопической резекции прямая компрессия паренхимы не позволяет достичь адекватного гемостаза, и это осложняет осуществление полного гемостаза в зоне резекции. С учетом высокого интраоперационного риска увеличения объема кровопотери разработка и внедрение в клиническую практику наиболее эффективного и безопасного способа интраоперационного (временного или окончательного) гемостаза при частичной резекции почки на сегодняшний день не теряют актуальности [12–14]. Одним из таких способов может быть эмболизация питающих опухоль артерий.
Цель исследования – определить эффективность использования суперселективной эмболизации питающих опухоль почки артерий для уменьшения объема интраоперационной кровопотери при лапароскопическом удалении новообразования.
Материалы и методы
В центре урологии, трансплантации почек и нефрологии Национального научного онкологического центра (г. Нур-Султан, Казахстан) в 2015–2019 гг. лапароскопическая частичная резекция опухоли почки была выполнена у 45 пациентов, из них у 9 пациентов с опухолью почки в стадии T1 предварительно проведена суперселективная эмболизация питающих опухоль артерий. Возраст больных варьировал от 46 до 63 лет (в среднем 54 года).
Для объективной оценки показаний к частичной резекции почки в предоперационном периоде использовали нефрометрию с оценкой по Renal Nephrometry Score. Полученная оценка варьировала в диапазоне от 4 до 6 баллов. Эти значения свидетельствуют о низком и среднем уровне сложности проведения резекции почки.
В предоперационном периоде для оценки функции почек выполнены лабораторные исследования для измерения уровня креатинина, мочевины в сыворотке крови, а также динамическая нефросцинтиграфия.
В рамках предоперационного обследования проведена мультиспиральная КТ в ангиорежиме с трехмерным моделированием путей артериального кровоснабжения новообразования. По результатам этого исследования определяли тактику временного гемостаза при резекции почки.
Локализация образования в области полюса почки, а также наличие артерии, изолированно питающей опухоль, были основными анатомическими показаниями к суперселективной эмболизации питающей артерии перед резекцией почки.
В выборе материала для эмболизации мы учитывали объем кровотока, подлежащего редукции, и диаметр артерий, питающих опухоль. Как правило, были использованы эмболы из поливинилалкоголя. В ряде случаев для острой эмболизации дополнительно применяли металлические спирали с синтетическими волокнами.
Результаты и обсуждение
Диаметр удаленной опухоли варьировал от 2,0 до 5,0 см (в среднем 2,8 см), средний объем кровопотери составил 280 мл.
Медиана наблюдения составила 12 мес (от 6 до 24 мес). Осложнения, характерные для постэмболизационного периода (боль, лихорадка, артериальная гипертензия), а также потеря функции органа, по данным лабораторных и радиоизотопных исследований через 3, 6 и 12 мес, в нашей серии случаев не зарегистрированы.
В условиях отделения урологии, трансплантации почки и нефрологии Национального научного онкологического центра (г. Нур-Султан, Казахстан) при выполнении частичной резекции почки (как открытой, так и лапароскопической) временный интраоперационный гемостаз осуществляется с применением следующих методов: одновременного пережатия артерии и вены, наложения зажима на артерию. Помимо этих механических способов осуществления гемостаза в зоне резекции, при лапароскопическом и открытом иссечении новообразований почки мы применяем ряд физиологических методик в комбинации с гемостатическими средствами на основе фибриногена, тромбина и др. Выбор метода гемостаза зависит от особенностей кровоснабжения опухоли, ангиоархитектоники почки, опыта оперирующего хирурга.
По нашему мнению, предоперационная суперселективная эмболизация артерий, питающих опухоль почки, является альтернативным методом осуществления окончательного гемостаза при лапароскопической частичной резекции почки. Этот метод способствует снижению интраоперационного риска массивной кровопотери, что, в свою очередь, улучшает результаты лечения и сокращает длительность операции.
Для иллюстрации данного заключения приводим собственное клиническое наблюдение.
Клиническое наблюдение
Пациентка Н., 1963 года рождения. При КТ выявлена опухоль правой почки размерами 38 × 40 мм (рис. 1). Клинический диагноз: рак правой почки T1аN0M0, I стадия. Сопутствующий диагноз: сахарный диабет II типа.
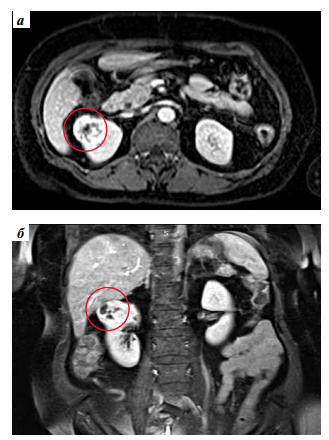
Рис. 1. Компьютерная томография брюшной полости в горизонтальной (а) и фронтальной (б) плоскостях. Признаки новообразования правой почки
Fig. 1. Computed tomography of the abdominal cavity in the horizontal (а) and frontal (б) planes. Signs of a tumor in the right kidney
За 2 мес до запланированной лапароскопической частичной резекции новообразования правой почки пациентка госпитализирована для суперселективной эмболизации. Суперселективная эмболизация сосудов опухоли верхнего полюса правой почки проведена 08.08.2019. В условиях рентгенооперационной через трансфеморальный доступ катетер селективно установили в просвет почечной артерии, выполнили контрастирование. Визуализированы артерии, питающие опухоль. Далее катетер переместили в просвет питающей артерии. Для эмболизации использовали микросферы диаметром 500–700 мкм и микрочастицы из поливинилалкоголя диаметром 350– 500 мкм. На контрольной ангиограмме видно основное артериальное русло почки, поступления контрастного препарата в артериальное русло опухоли не происходит (рис. 2).
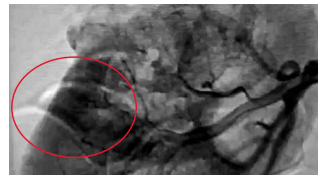
Рис. 2. Ангиография. Суперселективная эмболизация сосудов, питающих опухоль правой почки
Fig. 2. Angiography. Superselective embolization of the vessels feeding the
tumor in the right kidney
Спустя 2 мес после суперселективной эмболизации выполнена лапароскопическая частичная резекция правой почки. По общепринятой методике была выделена почка и основные элементы почечной ножки (рис. 3). Резекция проведена без перекрытия магистрального кровотока, при этом активного кровотечения в зоне резекции не наблюдалось. Линия демаркации, по которой и осуществляли резекцию, визуализировалась нечетко. С целью окончательной остановки кровотечения рану почки ушили непрерывным двухрядным швом нитью «Викрил», нити фиксированы клипсами Absolock с прокладкой валика Surgicel, дополнительно зона резекции укрыта материалом «Тахокомб». Опухоль отправили на гистологическое исследование. Брюшную полость дренировали. Объем кровопотери составил 50 мл.
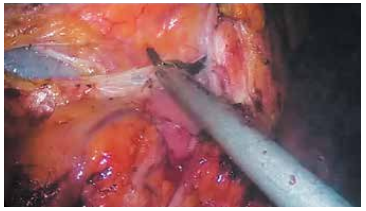
Рис. 3. Лапароскопическое выделение почки
Fig. 3. Laparoscopic isolation of the kidney
Гистологическое исследование удаленного образования: макропрепарат диаметром 3,5 см (рис. 4). Светлоклеточная карцинома 8310/3, G1 по S.A. Fuhrman. В крае резекции признаков опухолевого роста не обнаружено.
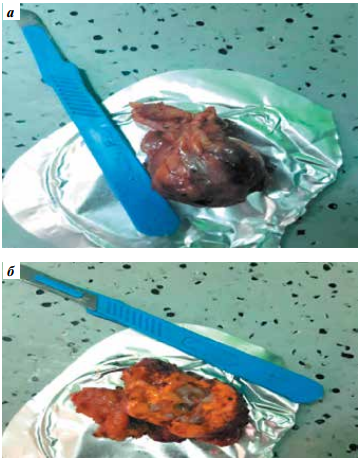
Рис. 4. Макропрепарат удаленной опухоли почки
Fig. 4. Gross specimen of the removed kidney tumor
Через 3 мес после оперативного вмешательства выполнена контрольная мультиспиральная КТ. Правая почка размерами 5,2 × 4,7 × 12,5 см. Накопление и выделение паренхимой контрастного препарата без особенностей. В результате резекции объем почечной паренхимы уменьшился на 9 %.
По результатам контрольных биохимических исследований, уровень креатинина (1,02 мг/л) и азота мочевины (6,5 ммоль/л) в пределах нормы.
Заключение
Суперселективная эмболизация артерий, питающих опухоль, перед выполнением частичной резекции почки с низкой и средней оценкой при нефрометрии позволяет отказаться от интраоперационного пережатия сосудов, т. е. предотвратить ишемию здоровой паренхимы почки. Этот метод создает условия для выполнения резекции почки в тех случаях, когда вследствие особенностей ангиоархитектоники мобилизация почечной артерии, а тем более сегментарных сосудов технически сложна или невозможна. Использование селективной эмболизации снижает объем интраоперационной кровопотери, что улучшает общее течение послеоперационного периода, способствует расширению показаний к органосохраняющим резекциям, в том числе лапароскопическим. Методика позволяет сократить сроки послеоперационного пребывания пациента в стационаре и сроки реабилитации.
Литература
- Haber G.P., Gill I.S. Laparoscopic partial nephrectomy: contemporary technique and outcomes. Eur Urol 2006;49(4):660–5. DOI: 10.1016/j.eururo.2006.02.001.
- Wille A.H., Tüllmann M., Roigas J. et al. Laparoscopic partial nephrectomy in renal cell cancer – results and reproducibility by different surgeons in a high volume laparoscopic center. Eur Urol 2006;49(2):337–42. DOI: 10.1016/j.eururo.2005.11.016.
- Nguyen M.M., Gill I.S., Ellison L.M. The evolving presentation of renal carcinoma in the United States: trends from the Surveillance, Epidemiology, and End Results program. J Urol 2006;176(6 Pt 1):2397–400. DOI: 10.1016/j.juro.2006.07.144.
- Chow W.H., Devesa S.S., Warren J.L., Freumeni J.F. Jr. Rising incidence of renal cell carcer in the United States. JAMA 1999;281(17):1628–31. DOI: 10.1001/jama.281.17.1628.
- Аляев Ю.Г., Шпоть Е.В. Рак почки. Прошлое, настоящее и будущее. Фарматека 2010;18–19:14–9. [Alyaev Yu.G., Shpot E.V. Renal cell carcinoma. Past, present and future. Farmateka = Pharmateca 2010; 18–19:14–9. (In Russ.)].
- Raz O., Mendlovic S., Shilo Y. et al. Positive surgical margins with renal cell carcinoma have a limited influence on long-term oncological outcomes of nephron sparing surgery. Urology 2010;75(2):277–80. DOI: 10.1016/j.urology.2009.06.110.
- Renal cell carcinoma. EUA Guidelines. Available at: https://uroweb.org/ guideline/renal-cell-carcinoma.
- Marszalek M., Meixl H., Polajnar M. et al. Laparoscopic and open partial nephrectomy: a matched-pair comparison of 200 patients. Eur Urol 2009;55(5):1171–8. DOI: 10.1016/j.eururo.2009.01.042.
- Peycelon M., Hupertan V., Comperat E. et al. Long-term outcomes after nephron sparing surgery for renal cell carcinoma larger than 4 cm. J Urol 2009;181(1):35–41. DOI: 10.1016/j.juro.2008.09.025.
- Gill I.S., Kavoussi L.R., Lane B.R. et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors. J Urol 2007;178(1):41–6. DOI: 10.1016/j.juro.2007.03.038.
- Delakas D., Karyotis I., Daskalopoulos G. et al. Nephronsparing surgery for localized renal cell carcinoma with a normal contralateral kidney: a European three-center experience. Urology 2002;60(6):998–1002. DOI: 10.1016/s0090-4295(02)01993-3.
- Van Dijk J.H., Pes P.L. Haemostasis in laparoscopic partial nephrectomy: current status. Minim Invasive Ther Allied Technol 2007;16(1):31–44. DOI: 10.1080/13645700601181372.
- Hassouna H.A., Manikandan R. Hemostasis in laparoscopic renal surgery. Indian J Urol 2012;28(1):3–8. DOI: 10.4103/0970-1591.94939.
- Viprakasit D.P., Derweesh I., Wong C. et al. Selective renal parenchymal clamping in robot-assisted laparoscopic partial nephrectomy: a multi-institutional experience. J Endourol 2011;25(9):1487–91. DOI: 10.1089/end.2010.0667.









Комментарии