К. Кайремо, Т. Йоэнсуу
Онкологическая клиника Дократес; Хельсинки, Финляндия
Введение
Большинство пациентов, у которых диагностируют локализованный рак простаты, могут быть пролечены полностью без каких-либо серьёзных побочных эффектов, в особенности если применяется брахитерапия в высокой дозе [1]. Однако первоначально метастатический рак простаты подлежит лечению и контролю в течение всей оставшейся жизни мужчины. При отсутствии лечения агрессивная форма рака простаты обычно диссеминирует в кости и лимфатические узлы [2, 3, 4]. Традиционные методы лечения метастатического рака простаты основаны на непрерывной гормональной терапии. В последние годы гормональная терапия все чаще усиливается химиотерапией доцетакселем ещё до того, как развивается резистентность к гормонотерапии в соответствии с результатами исследований CHARTEED и STAMPEDE [2, 3]. Наш собственный опыт также поддерживает локальную лучевую терапию, несмотря на метастазы и олигометастазы, с использованием методики объемномодулированной лучевой терапии (VMAT) радикальными дозами [1 ,4, 5]. В отдельных случаях брахитерапия с высокой мощностью дозы (HDR-брахитерапия) может быть использована в качестве поддерживающего лечения при раке простаты. Если рак широко распространён в костях, тогда данная практика должна завершаться лечением с помощью Радия-223 [4, 6, 7, 8].
Несмотря на то, что ответ может быть полным при первичном лечении, различные поддерживающие медикаменты рано или поздно утрачивают свою эффективность. Рак простаты может метастазировать в кости и лимфатические узлы, иногда в печень и лёгкие. Для наиболее точного определения распространения заболевания используют 68GaПСМА-11 или 18F-ПСМА-1007-ПЭТ-КТ. Если опухолевые клетки при ПЭТ-КТ сканировании оказываются ПСМА-положительными, то этот эффект может быть использован для лечения рака путём внутривенного ведения ПСМА-лигандов, маркированных радиоактивным нуклидом Лютеций-177 (177Лютеций-ПСМА), разрушающих ПСМА-положительные метастазы. Идея состоит в том, чтобы при распространённом опухолевом процессе донести источник радиации как можно ближе или даже непосредственно в раковую клетку. Лютеций-177 это β-эмиттер со средним диапазоном для бета-частиц приблизительно 1 мм. Радиофармацевтический агент быстро элиминируется из организма, эффективное время полужизни составляет примерно 2 дня (физическое время полужизни составляет примерно 7 дней). Лечение может быть ограничено путём захвата этого радиофармацевтического агента слюнными железами, что может вызывать сухость полости рта, но в соответствии с нашим опытом данные побочные эффекты лечения 177Lu-ПСМА встречаются редко.
Лечение с помощью 177Lu- ПСМА по-прежнему считается экспериментальным, хотя имеются хорошие результаты. Немецкое мультицентровое исследование сообщило, что из 115 пациентов после однократного цикла терапии 177Lu-ПСМА положительный ответ наблюдался в 40 % случаев [9] Наш метаанализ показал —двойной эффект в сравнении с методами третьей линии терапии при метастатическом раке простаты —50 % снижение уровня ПСА в 44 % против 22 % более чем у 650 пациентов, получавших 177Lu-ПСМА [10].
В этой статье мы сообщаем о двух пациентах с различным анамнезом, которые имели полный ответ на терапию 177Lu-ПСМА, доказанный методами визуализации.
Клинические случаи
Пациент 1. Первый пациент изначально имел ноктурию, поллакиурию и слабую струю мочи, что потребовало определённого клинического обследования. Первоначальный уровень ПСА составлял 216 нг/мл. В 2014 г. были взяты биоптаты простаты и отправлены на гистопатологическое исследование, которое показало во всех образцах аденокарциному с суммой по Глисону 9 (5+4), периневральной инвазией и экстракапсулярным ростом. Клинически пациент находился на четвертой стадии Т4, но по данным сцинтиграфии костей метастазов не выявлено. По поводу местно-распространённого рака простаты с двухсторонним гидронефрозом была начата общая андрогенная блокада лейпрорелином и бикалутамидом. Уровень креатинина составлял 150 мкмоль/л. Нефростомии были выполнены билатерально. После операции пациент также мог нормально мочиться два раза в день. Пиелостомы были заменены на JJ-стенты ретроградно в обеих мочеточниках. Спустя некоторое время стент правого мочеточника был заменен на новый. В последующем произведены двусторонние замены стентов. Общая андрогенная блокада продолжалась до марта 2017 г. Сцинтиграфия костей уже в феврале 2017 г. показала наличие метастазов. В начале марта костные метастазы были диагностированы при КТ, данных за наличие висцеральных метастазов не было. Уровень ПСА составлял 135 нг/мл. В конце марта бикалутамид был прекращён и начат абиратерон. Затем абиратерон вновь был прекращён и начато лечение 177Lu-ПСМА. Пациент отказался от какой-либо химиотерапии.
Ga-68-ПСМА-ПЭТ/КТ, выполненная в онкологической клинике Дократес в конце апреля 2017 г., показала активную и агрессивную злокачественную опухоль простаты в области левого семенного пузырька и обширное ПСМА-положительное поражение костей. По классификации Soloway составляло 3+/3 из-за чрезвычайно высокого захвата в нижнем грудном отделе позвоночника и в крестце, также отмечались признаки экспансии в костный мозг. Максимальные значения стандартизированного уровня накопления радиофармпрепарата ФДГ (SUVmax) были выше 27, в то время как значения более 3 рассматривались как патологические. Значение уровня ПСА в плазме крови составляло 375 нг/мл.
Терапия 177Lu-ПСМА, начатая в середине мая 2017 г., вызывала усталость, пациент отмечал отёчность ног и лодыжек, но хирургические компрессионные чулки препятствовали этому. Отмечалась тяжёлая депрессия и чувство тоски. При последующих четырёх циклах лечения мужчина отмечал тошноту и рвоту. На рисунке 1 представлены параметры крови во время четырёх первых циклов терапии 177LuПСМА. Они иллюстрируют, что эти методы лечения не были гематотоксичными. Не было каких-либо признаков токсического воздействия на печень и почки. На шестом цикле лечения тошнота отсутствовала, общее самочувствие было хорошим. Этому мужчине в настоящее время 70 лет.
Промежуточный контроль Ga-68-ПСМА-11-ПЭТ/ КТ был выполнен в онкологической клинике Дократес в конце октября 2017 г. Значение ПСА составляло 9,4 нг/мл. Рисунок 2 показывает Ga-68-ПСМА-11- ПЭТ/КТ исследования, выполненные в конце апреля и в конце октября 2017 г., то есть до терапии и через 4 недели после четырёх циклов терапии. В исходном исследовании на изображениях, полученных методом проекции максимальной интенсивности, а также путём слияния изображений таза можно увидеть обширное поражение костей. Нормальные органы (слюнные и слёзные железы, печень, селезёнку) трудно визуализировать с помощью метода проекции максимальной интенсивности. Кроме того, захват наблюдался в увеличенной простате и в области левого семенного пузырька. Промежуточный контроль ПЭТ изображений, полученных методом проекции максимальной интенсивности показал нормальные органы, такие как слюнные и слёзные железы, печень, селезёнку, почки и мочевой пузырь. Очень малая активность наблюдается в третьем грудном позвонке (Th 3). При промежуточном контроле слияния изображений таза (ПЭТ на КТ) не отмечается активности ни в увеличенной простате, ни в левом семенном пузырьке.
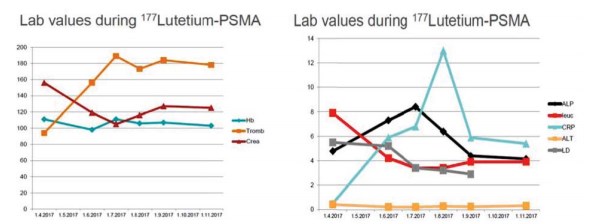
Рисунок 1. Значения уровня гемоглобина, тромбоцитов и креатинина в течение первых четырех циклов лечения 177Lu-ПСМА (слева). Значения уровней щелочной фосфатазы, лейкоцитов, С-реактивного белка, АЛТ и ЛДГ в течение первых четырёх циклов 177Lu-ПСМА (справа)
При контроле Ga-68-ПСМА-ПЭТ/КТ в середине января 2018 г. в онкологической клинике Дократес и через 6 недель послешестого цикла активная и агрессивная злокачественная опухоль простаты в области левого семенного пузырька полностью исчезла. Аналогично обширное ПСМА-позитивное поражение костей, по оригинальной классификации возможно 3+/3 отвечало на терапию во всех областях. Только одна область захвата РФП отмечалось слева в Th3 (рис. 2), но активность её уже могла считаться нормальной, потому что значения ФДГ (SUVmax) составляло только 3,8. Это расценивалось как впечатляющий ответ. Уровень ПСА снизился от 375 нг/мл до 4,2 нг/мл в течение периода наблюдения после терапии 177Lu-ПСМА1 (рис. 3).
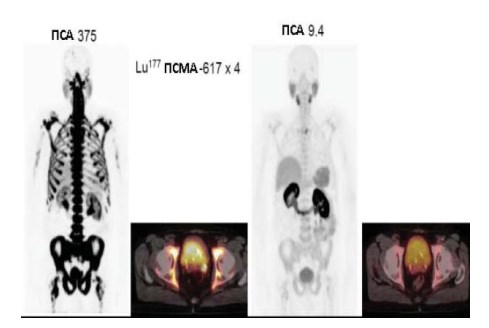
Рисунок 2. Два исследования Ga-68-ПСМА-ПЭТ/КТ, выполненные в конце апреля (слева) и в конце октября 2017 г. (справа) то есть до терапии и через 4 недели после четырех циклов лечения 177Lu-ПСМА. В исследовании, сделанном в апреле, можно увидеть обширное поражение костей на изображениях, полученных методом проекции максимальной интенсивности, а также на фьюжн-изображении (ПЭТ на КТ) (слева). Нормальные органы (слюнные и слёзные железы, печень, селезёнка) трудно визуализируются на изображениях, полученных методом проекции максимальной интенсивности (слева). Также отмечается активность в простате и в левом семенном пузырьке. В исследовании, сделанном в октябре, обширное поражение костей полностью исчезло, по данным изображений, полученных методом проекции максимальной интенсивности), а также поражения мягких тканей путём слияния изображении тазовой области (fusion) (ПЭТ на КТ) (справа). Слюнные и слёзные железы, печень, селезёнку можно увидеть на изображениях, полученных методом проекции максимальной интенсивности.
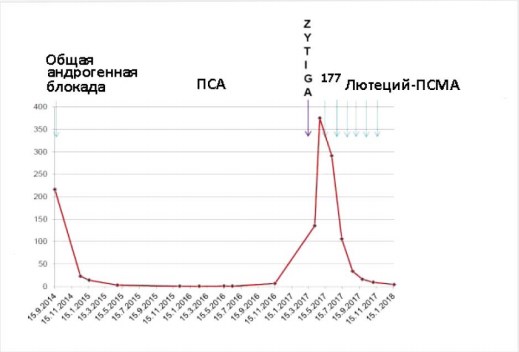
Рисунок 3. Кривая уровня ПСА (нг/мл) у пациента, который получил шесть циклов лечения 177Lu-ПСМА. Общая андрогенная блокада включала лейпрорелин и бикалутамид. Абиратерон (Zytiga®) был назначен после общей андрогенной блокады, но его приём был прекращён до лечения 177Lu-ПСМА. Уровни ПСА в плазме крови снизились от 375 нг/мл до 4,2 нг/мл.
В начале февраля 2018 г. была начата лучевая терапия простаты, тазовых лимфатических узлов и семенных пузырьков. Во время курса лучевой терапии оставшаяся часть опухолевых поражений в области Th3 будет облучена в дозе 3х9 Гр.
Пациент 2. Второй пациент имел гипертензию и сахарный диабет. Он был прооперирован по поводу язвы двенадцатиперстной кишки и камней в желчном пузыре, имел протез левого коленного сустава. Первоначально в течение 6 месяцев уровень ПСА повышался от 4,6 до 17 нг/мл. Диагноз был установлен на основании результатов повторной биопсии, выполненной в середине апреля 2001 г., когда была обнаружена аденокарцинома простаты в обеих долях с суммой по Глисону 6 (3+3). В середине мая 2001 г. начата общая андрогенная блокада лейпрорелином и бикалутамидом. В начале августа 2001 г. выполнена простатэктомия. Опухоль имела большой объём, инфильтрировала семенные пузырьки, составляя стадию pT3b, но не поражала местные региональные лимфатические узлы. Полный анамнез случая, включающий динамику уровня ПСА в плазме крови, показан схематически на рисунке 4.
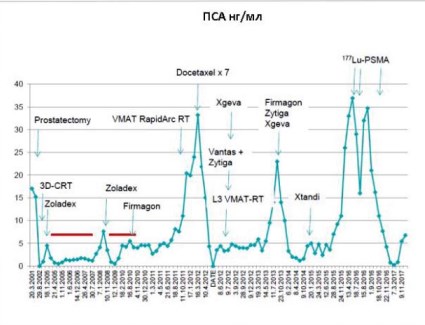
Рисунок 4. Кривая уровня ПСА (нг/мл) у пациента, получавшего три цикла лечения 177Lu-ПСМА по поводу его пятого рецидива.
В 2002 г. пациент получил курс лучевой терапии на область простаты в дозе до 70 Гр. Приём бикалутамида был начат в 2002 г. и прекращён в 2004 г. Касодекс — начат в марте 2002 г. и прекращён в октябре 2004 г. Гозерелин — начат в январе 2005 г. и приостановлен в марте 2007 г. Левая почка была уменьшена в размерах, в июле 2007 г. имел место временный гидронефроз. Приём бикалутамида вновь начат в январе 2008 г. вследствие повышенияПСА (до 4,1 нг/мл). Дегареликс вводили с сентября 2010 г. по ноябрь 2011 г. Одновременно в октябре 2011 г. позитивные подвздошные и паракавальные лимфатические узлы были облучены в дозе до 70/2 Гр. Однако в феврале 2012 г. уровень ПСА составлял 24 нг/мл, назначены 7 циклов доцетаксела с частичным ответом. В июне 2012 г. при МРТ обнаруженыкостныеметастазы, вследствие наличия боли проведена паллиативная радиотерапия в области L3 в дозе 24/3 Гр. В июле 2012 г. подкожно установлен имплантат Хистрелин Ацетате (Vantas). Также в июле 2012 г. назначен абиратерон, а в августе — деносумаб, но они были отменены в ноябре 2012 г. вследствие боли в мышцах и суставах. Кастрационный имплант был удалён и вновь начат абиратерон в декабре 2012 г. и приостановлен в марте 2013 г. С января 2013 г. по апрель 2014 г возобновлён приём деносумаба.
Дегареликс, который был начат в июле 2013 г., был заменён на лейпрорелин в январе 2015 г. вследствие локальной и системной реакции. Пациент также получал лучевую терапию вследствие положительных верхних забрюшинных и медиастинальных лимфатических узлов. В январе 2015 г. начат приём энзалутамида и прекращён в феврале вследствие эпилептического приступа. В июне 2015 г. с целью улучшения иммунного ответа начат приём дексаметазона и циклофосфамида, но он был прекращён вследствие диареи, отёчности и инфекции. Абиратерон был вновь назначен в декабре 2015 г. В апреле 2016 г. уровень ПСА составлял 33 нг/мл. В тот же день Ga-68-ПСМА-ПЭТ-КТ в онкологической клинике Дократес выявила активный захват в небольших лимфатических узлах с левой стороны в области запирательной ямки, в паракавальных и парааортальных лимфатических узлах и ретрокруральной области, в середине левого средостения, а также в надключичной области (рис. 5). Общий объём поражения оценивался в 20 см3 .
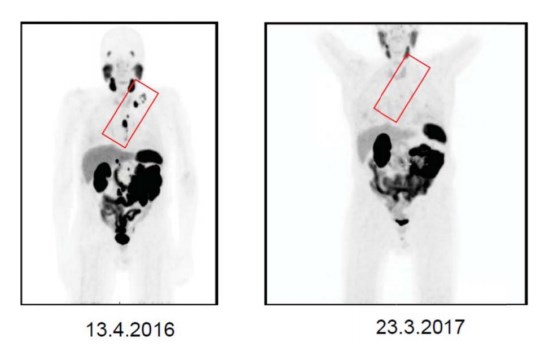
Рисунок 5. Два исследования Ga-68-ПСМА-ПЭТ/КТ были выполнены в апреле 2016 г. (слева) и в марте 2017 г. (справа,) то есть до терапии и через 5 месяцев после трёх циклов лечения 177Lu-ПСМА. В исследовании в апреле 2016 г. было выявлено обширное поражение лимфатических узлов с левой стороны (запирательных, забрюшинных, парааортальных, ретрокруральных, левых медиастинальных и надключичных) (красный треугольник) можно увидеть с помощью метода проекции максимальной интенсивности (левая панель). Нормальные органы, то есть слюнные и слёзные железы, печень, селезёнка, визуализировались на изображениях, полученных с помощью метода проекции максимальной интенсивности (обе панели). В марте 2017 г. в исследовании все патологические лимфатические узлы исчезли, включая левое средостение и надключичные области (красный треугольник) (правая панель).
Лечение 177Lu-ПСМА-617 проведено в июле, августе и октябре 2016 г. с 6-тинедельными интервалами. Надир значения ПСА 0,0 нг/мл был достигнут в марте 2017 г. Полный ответ наблюдался в марте 2017 г. на 68Ga-ПСМА-11 ПЭТ-КТ (рис. 5). Этот пациент до сих пор жив и наблюдается без какой-либо специфической терапии рака до января 2018 г. Однако он чувствует себя подавленным и сломал своё бедро, которое было прооперировано. В настоящее время мужчине 82 года.
Обсуждение
Представлены результаты лечения Lu-177-ПСМА двух пациентов, первый пациент имел обширные метастазы в костях и это был первый рецидив в течение 2 лет наблюдения, а второй пациент имел пятый рецидив в течение 15 лет наблюдения. Оба пациенты показали полную ответную реакцию, которая была подтверждена методами визуализации и значительным снижением уровня ПСА в плазме крови, то есть более, чем 95 % снижение без каких-либо серьёзных (степень дифференцировки — 3-4) побочных эффектов.
Лечение Lu-177-ПСМА рекомендовано при метастатическом раке простаты, особенно, когда заболевание является обширным, но фокусы до сих пор являются небольшими по размеру. Циклы лечения проводятся с интервалом 4-6 недель. Ответ на лечение оценивается с помощью лабораторных тестов, визуализации всего организма человека с использованием Lu-177-ПСМА-617 SPECT/КТ и Ga-68-ПСМА11-ПЭТ/КТ в качестве контроля. Методика SPECT/КТ также используется для расчёта дозы. Эти курсы лечения являются индивидуальными: интервал, число циклов и назначаемая активность могут варьироваться, как было показано у этих пациентов.
Это лечение назначается в виде внутривенной инфузии на амбулаторной основе и занимает приблизительно 30 минут. Мы мониторируем биологическое распределение Lu-177 с помощью многих методов визуализации, а также при помощи измерений показателя внешней дозы.
Выводы
Lu-177 даёт возможность дополнительной терапии, особенно для пожилых пациентов с раком простаты, у которых он прогрессирует, когда химиотерапия больше не является опцией для лечения вследствие плохой переносимости и возможных серьёзных побочных эффектов.
ЛИТЕРАТУРА
- Kiljunen T, Kangasmäki A, Aaltonen A, Kairemo K, Partanen K, Joensuu G, Alanko T, Vaalavirta L, Joensuu T. VMAT technique enables concomitant radiotherapy of prostate cancer and pelvic bone metastases. Acta Oncol. 2015;54(6):847-53. doi: 10.3109/0284186X.2014.962665
- Sweeney CJ, Chen YH, Carducci M, Liu G, Jarrard DF, Eisenberger M, Wong YN, Hahn N, Kohli M, Cooney MM, Dreicer R, Vogelzang NJ, et al. Chemohormonal therapy in metastatic hormone sensitive prostate cancer. N Engl J Med. 2015;373:737-746. doi: 10.1056/NEJMoa1503747
- James ND, Sydes MR, Clarke NW, Mason MD, Dearnaley DP, Spears MR, Ritchie AW, Parker CC, Russell JM, AƩ ard G, de Bono J, Cross W, Jones RJ, Thalmann G, Amos C, Matheson D, Millman R, Alzouebi M, Beesley S, Birtle AJ, Brock S, Cathomas R, ChakrabortiP, Chowdhury S, Cook A, EllioƩ T, Gale J, Gibbs S, Graham JD, Hetherington J, Hughes R, Laing R, McKinna F, McLaren DB, O’Sullivan JM, Parikh O, Peedell C, Protheroe A, Robinson AJ, Srihari N, Srinivasan R, Staff urth J, Sundar S, Tolan S, Tsang D, Wagstaff J, Parmar MK; STAMPEDE investigators. Addition of docetaxel, zoledronic acid, or both to fi rst-line long-term hormone therapy in prostate cancer (STAMPEDE): Survival results from an adaptive, multi- arm, multistage, plaƞ orm randomised controlled trial. Lancet. 2016;387(10024):1163-77. doi: 10.1016/S0140- 6736(15)01037-5
- Joensuu T, Joensuu G, Kairemo K, Kiljunen T, Riener M, Aaltonen A, Ala-Opas M, Kangasmäki A, Alanko T, Taipale L, Hervonen P, Bützow A, Virgolini I, Hemminki A. Multimodal Primary Treatment of Metastatic Prostate Cancer with Androgen Deprivation and Radiation. Anti- cancer Res. 2016;36(12):6439-6447. doi: 10.21873/anti- canres.11242
- Kairemo K, Rasulova N, Kiljunen T, Partanen K, Kangasmäki A, Joensuu T. PET/CT Dose Planning for Volumetric Modulated Arc Radiation Therapy (VMAT) - Comparison with Conventional Approach in Advanced Prostate Cancer Patients. Curr Radiopharm. 2015;8(1):2-8.
- Parker C, Nilsson S, Heinrich D, Helle SI, O’Sullivan JM, Fosså SD, Chodacki A, Wiechno P, Logue J, Seke M, Widmark A, Johannessen DC, Hoskin P, Bottomley D, James ND, Solberg A, Syndikus I, Kliment J, Wedel S, Boehmer S, Dall’Oglio M, Franzén L, Coleman R, Vogelzang NJ, O’Bryan-Tear CG, Staudacher K, Garcia-Vargas J, Shan M, Bruland ØS, Sartor O; ALSYMPCA Investigators. Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med. 2013;369(3):213-23. doi: 10.1056/ NEJMoa1213755
- Poeppel TD, Handkiewicz-Junak D, Andreeff M, Becherer A, Bockisch A, Fricke E, Geworski L, Heinzel A, Krause BJ, Krause T, Mitterhauser M, Sonnenschein W, Bodei L, Delgado-Bolton RC, Gabriel M. EANM guideline for radionuclide therapy with radium-223 of metastatic castration-resistant prostate cancer. Eur J Nucl Med Mol Imaging. 2017. doi: 10.1007/s00259-017-3900-4
- Kairemo K, Joensuu T. Radium-223-Dichloride in Castration Resistant Metastatic Prostate CancerPreliminary Results of the Response Evaluation Using F-18-Fluoride PET/CT. Diagnostics (Basel). 2015;5(4):413- 27. doi: 10.3390/diagnostics5040413.
- Rahbar K, Ahmadzadehfar H, Kratochwil C, Haberkorn U, Schäfers M, Essler M, Baum RP, Kulkarni HR, Schmidt M, Drzezga A, Bartenstein P, Pfestroff A, Luster M, Lützen U, Marx M, Prasad V, Brenner W, Heinzel A, Mottaghy FM, Ruf J, Meyer PT, Heuschkel M, Eveslage M, Bögemann M, Fendler WP, Krause BJ. German Multicenter Study Investigating 177Lu-PSMA-617 Radioligand Therapy in Advanced Prostate Cancer Patients. J Nucl Med. 2017;58(1):85-90. doi: 10.2967/jnumed.116.183194
- von Eyben FE, Roviello G, Kiljunen T, Uprimny C, Virgolini I, Kairemo K, Joensuu T. Third-line treatment and 177LuPSMA radioligand therapy of metastatic castrationresistant prostate cancer: a systematic review. Eur J Nucl Med Mol Imaging. 2018;45(3):496-508. doi: 10.1007/ s00259-017-3895-x
Статья опубликована в журнале "Вестник урологии" №1 2018, стр. 65-75









Комментарии