Чибичян М.Б.1 , Черногубова Е.А.2 , Коган М.И.1
1 Кафедра урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
2 Институт аридных зон Южного научного центра РАН, г.Ростов-на-Дону Адрес: 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014448 Эл.почта: michel_dept@mail.ru, echernogubova@rambler.ru, dept_kogan@mail.ru
ВВЕДЕНИЕ
В настоящее время «золотым стандартом» ранней диагностики, степени распространенности, определения стадии болезни и мониторинга терапии рака предстательной железы (РПЖ) является определение простатаспецифического антигена (ПСА) – представителя мультигенного семейства тканевых калликреинов [1, 2].
Однако ПСА является органоспецифичным, а не канцероспецифичным маркером, что обуславливает низкую прогностическую ценность ПСА при дифференциальной диагностике у пациентов с доброкачественной гиперплазией простаты и малыми, не симптомными формами рака простаты [3]. Разработан новый диагностический тест – PCA3 [4]. В перспективе определение хепсина – трансмембранной сериновой протеазы (transmembraneprotease, serine 1 – TMPRSS1), в сыворотке крови может быть использовано для диагностики рака простаты и как тканевой маркер для дифференциальной диагностики агрессивных и неагрессивных форм рака [5 ,6].
Однако, несмотря на интенсивные поиски, открытые и используемые в настоящее время онкомаркеры не обладают необходимой для клинической практики чувствительностью и специфичностью, что сохраняет актуальность проблемы и на сегодняшний день.
Перспективность анализа протеолитических процессов при раке предстательной железы и его рецидиве объясняется высокой биологической активностью протеиназ, их участием в защитных реакциях организма, процессах роста и деления клеток, ангиогенезе, деградации соединительнотканных структур при инвазии опухолевых клеток и метастазировании [7, 8].
Ранее, нами установлено, что при РПЖ в сыворотке крови и секрете простаты отмечается активация протеиназ калликреин-кининовой, ренин-ангиотензиновой систем крови, при ослаблении контроля за их активностью со стороны пула ингибиторов. Увеличение активности АПФ и калликреина в сыворотке крови и секрете простаты приводит к накоплению пептидных регуляторов митои ангиогенеза – ангиотензина II и брадикинина при раке предстательной железы [9, 10].
Решение проблемы мониторинга эффективности терапии РПЖ связано, по нашему мнению, с изучением протеолитических процессов.
МАТЕРИАЛЫ И МЕТОДЫ
Для идентификации биохимических маркеров развития рецидива рака предстательной железы после радикальной простатэктомии (РПЭ) была сформирована группа больных, у которых определялись показатели калликреинкининовой, ренин-ангиотензиновой и эластолитической систем в крови через 1, 6, 12 и 18 месяцев после операции. По результатам мониторинга пациенты, подвергнутые радикальной простатэктомии, были разделены на две группы: 1 группа – пациенты, у которых за период наблюдения не зафиксированы элевация ПСА в крови и клинические признаки болезни. 2 группа – пациенты, у которых отмечен биохимический рецидив (БР) болезни с развитием клинической симптоматики.
В I группе состояло 28 больных. У 18 пациентов в этой группе был локально-ограниченный рак, у 10 – рТ3. II группу составили 8 больных после РПЭ с развитием БР. Стадия рака простаты во II группе: у 7 пациентов – рT3, у одного – pT4. Средний возраст пациентов в группах – 61,44±1,39 года. Медиана ПСА до РПЭ – 8,05 нг/мл (LQ=5,01; UQ=12). Среднее значение объема простаты в группах составило 52±2,74 см3 . Медиана наблюдения – 18 месяцев. Контрольную группу составили 20 практически здоровых мужчин.
В сыворотке крови определяли следующие показатели протеолитических систем организма: активность калликреина (КФ 3.4.21.8) (К) и содержание прекалликреина (ПК) после отделения от других сериновых протеиназ с помощью ионообменной хроматографии на ДЭАЭ-сефадексе А-50 по скорости гидролиза N-бензоил-1-аргинин этилового эфира (БАЭЭ) [11], ингибиторную активность α1-протеиназного ингибитора (α1-ПИ) и α2-макроглобулина (α2-МГ) унифицированным энзиматическим методом [12], активность кининазы II (ангиотензинпревращающего фермента (АПФ), КФ 3.4.15.1) с использованием в качестве субстрата фурилакрилоилфенилаланилглицилглицина (ФАПГГ) [13], общую аргининэстеразную активность (ОАЭА) по отношению к БАЭЭ [14], активность эластазы и эластазоподобную активность по скорости гидролиза N-третбутоксикарбонил-аланин-р-нитрофенилового эфира (BOC-Ala-ONp) [15,16].
РЕЗУЛЬТАТЫ
Анализ состояния протеолитических систем крови показал, что у больных 2 группы через 1 месяц после РПЭ активность АПФ на 136,5% (p1<0,001) выше, а активность лейкоцитарной эластазы и ингибиторная активность α1протеиназного ингибитора на 29,0% (p1<0,05) и 41,2 % (p1<0,001) ниже, соответствующих показателей в 1 группе (рис. 1). Принципиально важно, что через месяц после РПЭ у больных 1 и 2 групп не отмечено отличий в уровне ПСА.
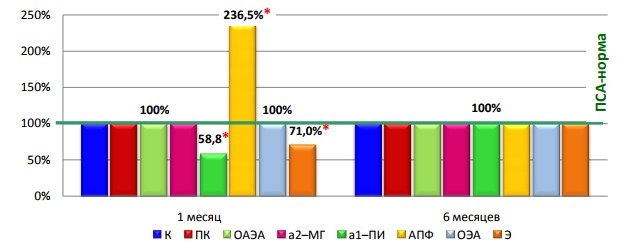
Рис. 1. Биохимические маркеры развития БР через 1 и 6 месяцев после РПЭ *-статистически достоверные различия между группами 1 и 2 (р1<0,05).
Через 6 месяцев после РПЭ не отмечается отличий в активности изучаемых протеаз и их ингибиторов, за исключением содержания ПСА, которое резко увеличивается у пациентов 2 группы (с 0,02 до 4,4 нг/мл).
Через 12 месяцев после РПЭ в сыворотке крови больных с БР активность АПФ на 291,7% (p1<0,001) выше, а активность ЛЭ – на 60,7% ниже, чем в первой группе (рис. 2).
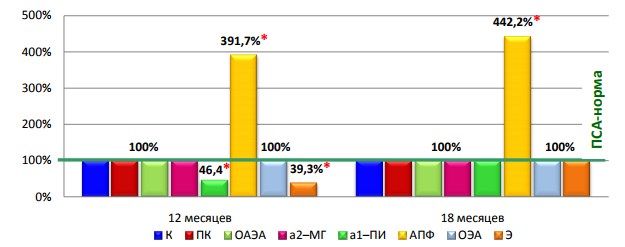
Рис. 2. Биохимические маркеры развития БР через 12 и 18 месяцев после РПЭ *-статистически достоверные различия между группами 1 и 2 (р1<0,05).
При развитии БР через 12 месяцев после РПЭ отмечается также снижение антипротеолитического потенциала крови за счет уменьшения ингибиторной активность α1-ПИ на 53,6% (p1<0,001) по сравнению с таковым у пациентов 1 группы на этом же этапе исследования.
Через 18 месяцев после РПЭ не выявлено отличий в изучаемых показателях, за исключением активности АПФ, которая при БР на 342,2% (p1<0,001) превышала соответствующие показатели в 1 группе (рис.2).
ОБСУЖДЕНИЕ
Анализируя особенности нарушения протеиназно-ингибиторного баланса в крови больных после РПЭ в разные сроки после операции необходимо отметить, что маркером развития биохимического рецидива является увеличение активности АПФ (рис. 3). Через 1 и 12 месяцев после операции развитие биохимического рецидива заболевания, кроме увеличения активности АПФ, сопровождается снижением активности лейкоцитарной эластазы и α1-протеиназного ингибитора, что свидетельствует о фазности нарушения протеиназноингибиторного баланса на разных этапах развития БР (рис. 4).
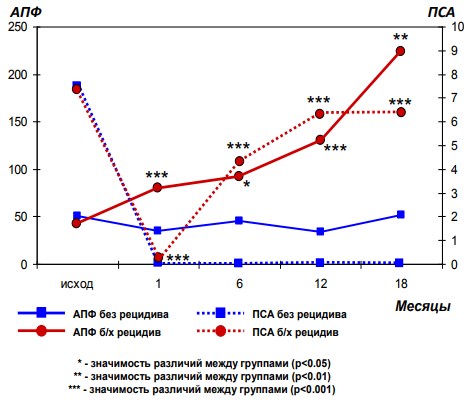
Рис. 3. Динамика активности АПФ и содержания ПСА в крови в разные сроки после РПЭ
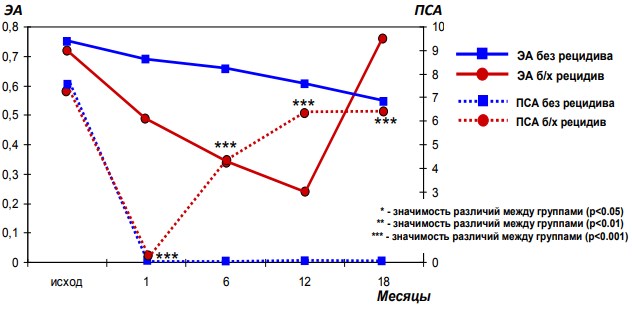
Рис. 4. Динамика активности лейкоцитарной эластазы и содержания ПСА в крови в разные сроки после РПЭ
Способность к метастазированию и инвазии – одно из фундаментальных свойств злокачественных опухолей. Ассоциированные с опухолью протеолитические ферменты участвуют в разрушении базальной мембраны и внеклеточного матрикса, в неоангиогенезе [17]. Особое внимание в последнее время привлечено к калликреинкининовой и ренин-ангиотензиновой системам крови – протеолитическим системам, участвующим в метаболизме пептидных регуляторов митои ангиогенеза – ангиотензина II и брадикинина. Основные функции ангиотензина II и брадикинина (воспаление, ангиогенез и миграция) также связаны с прогрессированием рака [17]. Впервые показано, . что ангиотензин II оказывает непосредственное воздействие на раковые клетки, способствуя росту опухоли, за счет влияния на адгезию, миграцию и подвижность клеток, ускоряя прогрессирование метастазирования [18].
В этой связи заслуживает особого внимания обнаруженное нами снижение активности лейкоцитарной эластазы при развитии рецидива РПЖ, что свидетельствует об истощении ее запасов (рис. 4). Субстратом эластазы кроме эластина являются коллагены III, VI и VIII генетических типов, интегрины, протеогликаны, гистоны, основной белок миелина, гемоглобин и множество белков плазмы крови, в том числе факторы гемокоагуляции, фибринолиза, калликреин-кининовой системы и комплемента [19]. Лейкоцитарная эластаза участвует также в активации матричных протеиназ (ММР-2), катепсина G, протеиназы-3, участвующих в клеточной инвазии и метастазировании [20].
ВЫВОДЫ
Увеличение активности АПФ на фоне снижения антипротеолитического потенциала крови у больных после РПЭ является метаболической основой развития биохимического рецидива и может явиться маркером его прогрессии. Увеличение активности АПФ и уменьшение активности ЭА являются предикторами развития БР уже через 1 месяц после РПЭ, когда элевация ПСА еще не наступила.
Таким образом, определение ключевых показателей ренин-ангиотензиновой, калликреин-кининовой систем крови, протеиназ лейкоцитов с целью мониторинга эффективности лечения и поиска предикторов развития рецидива РПЖ после РПЭ представляется перспективным.
ЛИТЕРАТУРА
1. Manji, M. Prostate-specific antigen (PSA): an overview / M. Manji / Annals of Saudi Medicine. – 2002. – V.22(1-2). – P.1-3.
2. Biomarkers for prostate cancer detection / D.J. Parekh, D.P. Ankerst, D. Troyer et al. // J. Urol. – 2007. – V.178(6). – P.2252-2259.
3. Соловов, В.А. Биология простатического специфического антигена и его роль в патогенезе рака простаты / В.А. Соловов // Вестник СамГУ. Естественно-научная серия. – 2005. – Т.5. – №39. – C.200-208.
4. Prostate Cancer Gene 3 (PCA3): development and integration of new nomograms biopsy / F.K. Chun, A. de la Taille, H. van Poppel et al. // J. European Urology – 2009. – 56(4)
5. Hepsin inhibits cell growth/invasion in prostate cancer cell / V. Srikantan, M. Valladares, J.S. Rhim et al. // Cancer Research. – 2002. – Vol.62. – P.6812-6816.
6. Detection of early prostate cancer using a hepsin-targeted imaging agent / K.A. Kelly, S.R. Setlur, R. Ross et al. // Cancer Res. – 2008. – Vol.68(7). – P.2286-2291.
7. Яровая, Г.А. Биорегулирующие функции и патогенетическая роль протеолиза / Г.А. Яровая // Лабораторная медицина – 2003. – №6. – С.48-54.
8. Functional imaging of tumor proteolysis / B.F. Sloane et al. // Annu. Rev. Pharmacol. Toxicol. – 2006. – Vol.46. – P.301-315.
9. Активность протеолитических ферментов и их ингибиторов в секрете простаты при доброкачественной гиперплазии и раке предстательной железы / М.И. Коган, Е.А. Черногубова, М.Б. Чибичян, Д.Г. Матишов // Онкоурология. – 2011. – №2. – С.46-51.
10. Angiotensin-Converting Enzyme and Kallikrein as a New Concept in the Study of Prostate Cancer / M. Kogan, M Chibichyan, A. Ilyash, E. Chernogubova // UROLOGY 80 (Supplement 3A). – 2012. – P.S81-S82.
11. Пасхина, Т.С. Упрощенный метод определения калликреиногена и калликреина в сыворотке (плазме) крови человека в норме и при некоторых патологических состояниях / Т.С. Пасхина, А.В. Кринская // Вопросы медицинской химии. – 1974. – Т.20. – №6. – С.660-663.
12. Нартикова, В.Ф. Унифицированный метод определения активности α1-антитрипсина и α2-макроглобулина в сыворотке (плазме) крови человека / В.Ф. Нартикова, Т.С. Пасхина // Вопросы медицинской химии. – 1979. – Т.25. – №4. – С.494-502.
13. Голиков, П.П. Экспресс-метод определения активности ангиотензинпревращающего фермента в сыворотке крови / П.П. Голиков, Н.Ю. Николаева / Клин. Лаб. Диагностика. – 1998. – №1. – С.11-13.
14. Пасхина, Т.С. Калликреин сыворотки крови человека. Активность фермента и хроматографический метод определения / Т.С. Пасхина, Г.А. Яровая // Биохимия. – 1970. – Т.35. – №5. – С1055-1058.
15. Доценко, В.Л. Выявление лейкоцитарной эластазы человека из комплекса с плазменным α1-протеиназным ингибитором по ее энзиматической активности с синтетическим субстратом / В.Л. Доценко, Е.А. Нешкова, Г.А. Яровая // Вопросы медицинской химии. – 1994.– Т.40. – №3. – С.25-31.
16. Активность протеиназ гранулоцитов и уровень кислотостабильных ингибиторов протеиназ в бронхиальном секрете детей с бронхопатиями различной этиологии / В.Л. Доценко, Е.А. Нешкова, Г.А. Яровая и др. // Вопросы медицинской химии. – 1980. – Т.3. – №26. – С.387-392.
17. George, A.J. The renin-angiotensin system and cancer: old dog, new tricks / A.J. George, W.G. Thomas, , R.D. Hannan // Nat Rev Cancer. – 2010. – Vol.10. – P.745–759.
18. Angiotensin II Facilitates Breast Cancer Cell Migration and Metastasis / S.M. Rodrigues-Ferreira, M.P. Abdelkarim, P. Dillenburg-Pilla et al. // PLoS ONE. – 2012. – Vol.7(4). – P.1-8.
19. Neutrophil Elastase Inhibition: A New Cancer Therapy / N. Sato, M. Yoshida, T. Satoshi et al. // Current Enzyme Inhibition. – 2008. – Vol.4(2). – P.82-85.
20. Activation of progelatinase A (MMP-2) by neutrophil elastase, cathepsin G, and proteinase-3: a role for inflammatory cells in tumor invasion and angiogenesis / P. Shamamian, J.D. Schwartz, B.J. Pocock et al. // J Cell Physiol. – 2001. – Vol.189(2). – P.197-206.
Статья опубликована в журнале "Вестник урологии". Номер №3/2013 стр. 12-18









Комментарии