О.И. Аполихин1 , А.В. Сивков1 , И.А. Шадеркин1 , А.В. Владзимирский2 , В.А. Шадеркина1 , Д.А. Войтко1 , М.Ю. Просянников1
1 НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» МЗ РФ; Москва, Россия
2 ГБУЗ «Научно-практический центр медицинской радиологии ДЗМ»; Москва, Россия
Автор для связи: Шадеркин Игорь Аркадьевич Тел.: +7 (903) 169-79-08; e-mail: info@uroweb.ru
Введение
Болезни мочеполовой системы занимают пятое место в структуре заболеваемости населения по основным классам, группам и отдельным нозологическим единицам. В их числе ведущую роль играют онкологические поражения органов мочеполовой системы [1-3]. Так, в Российской Федерации (РФ) прирост показателя первичной заболеваемости злокачественными новообразованиями предстательной железы составляет +127,4% [4-7]. Более того, за последние 10 лет в РФ на фоне значительного снижения стандартизованного показателя смертности (минус 11,3%) от всех злокачественных новообразований зафиксирован существенный рост показателя смертности от злокачественных опухолей предстательной железы (+31,8%) [8].
Рак предстательной железы по темпам прироста заболеваемости и смертности занимает первое место среди онкологических заболеваний (среди мужчин). Одной из причин высокой смертности является поздняя выявляемость: в онкоурологические отделения 22,8% больных госпитализируется в течение 7-12 месяцев от появления симптомов, а 52,1% — в более поздние сроки. Организация онкоурологической помощи нуждается, с одной стороны, в четкой системе этапного оказания помощи больным, а с другой ‒ в специальной системе мер, направленных на развитие и совершенствование скрининговых мероприятий [9]. В настоящее время скрининг представляет собой методику безопасной идентификации болезни или предшествующего ей состояния у условно здоровых людей [10, 11].
Полагаем, что именно популяционный скрининг онкоурологической патологии может потенциально обеспечить улучшение прогноза для ряда выявленных случаев, менее радикальное лечение, позволяющее добиться лучших исходов, особенно на ранней стадии заболевания, экономию ресурсов, эмоциональный комфорт для лиц с отрицательными результатами скринингового теста [2, 4, 12-14]. Ранее представлен положительный опыт применения телемедицинского скрининга ряда патологических состояний в эндокринологии, офтальмологии, неонатологии, ортопедии, онкологии [15]. Рассматривая проблему популяционного скрининга в урологии, мы эмпирически предположили, что разрабатываемая методика должна быть сфокусирована на проблеме злокачественных новообразований (раке) предстательной железы (РПЖ) и базироваться на применении телемедицинских технологий.
Цель исследования: теоретически обосновать модель организации популяционного скрининга в урологии на основе телемедицинских технологий.
Материал и методы
Исследование основано на принципах системного подхода. Применялись методы анализа, синтеза и информационного моделирования. Проведено построение графических информационных моделей, описывающих объект и его свойства в виде графического изображения определённого порядка объединения элементов объекта в единое целое. Для отображения информационной модели применены графы иерархических структур, дополненные схематичным изображением обратной связи. Для сравнительного изучения использовались материалы, подготовленные на принципах «доказательной медицины» и признанные Всемирной организацией здравоохранения (ВОЗ) в качестве методических рекомендаций [10, 11].
Результаты и обсуждение
Необходимость принципиально нового системного подхода к организации скрининга РПЖ с использованием телемедицины обусловлено, в том числе, следующими причинами:
- отсутствием единого стандарта выполнения анализа крови на простатический специфический антиген (ПСА),
- отсутствием единого стандарта выполнения биопсии простаты и неготовность патологоанатомической службы,
- малой осведомленностью населения о РПЖ,
- резким увеличением числа лиц с повышенным уровнем ПСА, которые будут рассматриваться как кандидаты на выполнение биопсии предстательной железы [4].
Указанные причины ведут к гипо- или гипердиагностике, резкому повышению количества инвазивных диагностических процедур, весомым неоправданным финансовым затратам, моральной и социальной напряженности значительных групп населения.
Ранее нами клинико-экономически обоснована методика селективного скрининга рака предстательной железы. Селективный подход на основе факторов риска РПЖ позволяет свести к минимуму необоснованные затраты и добиться оптимальных клинических результатов. Главным аргументом при принятии решении о целесообразность финансовых и иных затрат на внедрение популяционного скрининга РПЖ служит факт достоверного продления длительности жизни пациентов, благодаря раннему выявлению и своевременному лечению [6].
Концептуально полагаем, что в настоящее время для национальной программы популяционных скрининга РПЖ оптимальным инструментом является селективное этапное обследование целевой группы населения, проводимое на основе телемедицинских технологий (для интеграции, преемственности и оптимальной логистики).
Базируясь на международных методиках масштабных скрининговых исследований РПЖ (ERSPC, PLCO) [16, 17], собственном опыте посредством методов анализа и синтеза нами разработана формальная информационная (графическая) модель организации селективного популяционного скрининга рака предстательной железы с применением телемедицинских технологий (рис. 1).
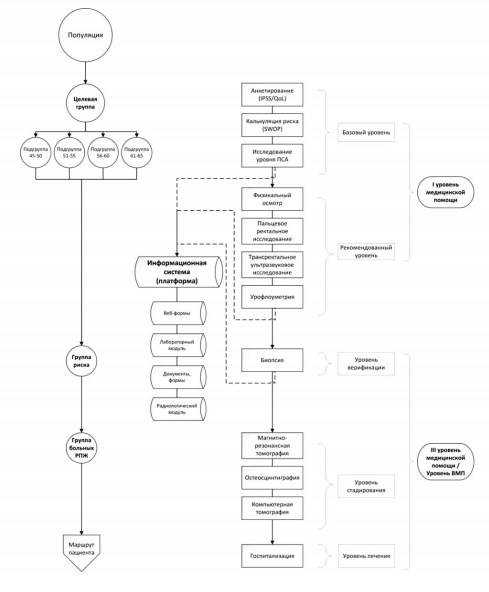
Рисунок 1. Формальная информационная (графическая) модель организации селективного популяционного скрининга рака предстательной железы с применением телемедицинских технологий
Согласно предложенной модели, скрининг осуществляется путем исследования целевой группы – мужчин старше 45 лет. Всю выборку разделяют на подгруппы (с «шагом» 5 лет), такой подход обусловлен возрастными колебаниями уровня ПСА ‒ ключевого показателя для определения риска РПЖ. Обследование выборки проводится на первичном уровне медицинской помощи, в том числе, с активным участием среднего медицинского персонала. Верифицирующие обследования сформированной группы риска и последующие стадирование и клиническую диагностику осуществляют на третичном уровне медицинской помощи или в условиях федерального центра высокотехнологичной медицинской помощи. Выбор учреждения для осуществления лечения делают, руководствуясь утвержденными порядками и маршрутами пациентов.
Ключевым интегрирующим компонентом модели выступает информационная система ‒ платформа агрегации и анализа данных, получаемых в процессе скрининговых обследований. Данная информационная система имеет клиент-серверную архитектуру, при этом используется «тонкий» клиент (веб-интерфейс для дистанционной работы с базами данных и инструментами анализа информации).
С функциональной точки зрения, информационная система включает в себя:
- веб-формы для анкетирования и калькуляции рисков,
- модуль ведения медицинской документации (накопление текстовых данных),
- модуль лабораторных исследований,
- модуль радиологических исследований.
Веб-формы позволяют осуществлять непосредственное или дистанционное анкетирование (опросники «IPSS», «QOL») и предварительный расчет рисков наличия РПЖ (калькулятор «SWOP») для «селекции» лиц, подлежащих дальнейшему обследованию. Благодаря наличию информационной системы такое анкетирование может осуществляться вне медицинских организаций, более того, самостоятельно, в условиях обычной жизни, посредством домашних компьютеров и смартфонов. Этим также реализуется вовлеченность индивидуума в заботу о собственном здоровье (то есть достигается один из базовых принципов пациент-центрированного здравоохранения).
Результаты анализов крови (точнее, ПСА) накапливаются и анализируются посредством лабораторного модуля (он может представлять собой и самостоятельную распределенную лабораторную информационную систему).
Исходя из возрастной подгруппы, результатов анкетирования и уровня ПСА возможно автоматическое формирование группы риска, подлежащей дальнейшему углубленному обследованию. Сочетание веб-анкет и калькулятора рисков с лабораторной информационной системой уже создает базовый минимальный инструмент для популяционного скрининга РПЖ, который может быть вариантом выбора в условиях ограниченных ресурсов.
Тем не менее, «оптимальной конфигурацией» следует считать выполнение рекомендованного уровня (физикального осмотра, пальцевого исследования, трансректального ультразвукового исследования (ТРУЗИ), урофлоуметрии) с накоплением соответствующих данных в модуле документов и радиологическом модуле предлагаемой информационной системы. Медицинские данные лиц из группы риска, полученные в процессе верификации и стадирования также накапливаются в указанных модулях.
Информационная система для селективного популяционного скрининга рака предстательной железы должна находится в ведении медицинских организаций федерального уровня. Это обеспечивает централизацию процессов управления массовыми обследованиями и анализа данных, а также мониторинг логистики групп риска и лиц с установленным диагнозом как на региональном, так и на федеральном уровнях.
Информационная система — инструмент выявления групп риска и обеспечения взаимодействия уровней медицинской помощи. В процессе выполнения базового или рекомендованного уровней обследований медицинские данные поступают в базу информационной системы. По мере накопления врачи-специалисты производят дистанционный анализ и отбор лиц в группу риска. Посредством коммуникационных инструментов системы отслеживаются результаты верификации для этих лиц и их дальнейшая логистика (в соответствии с установленными маршрутами). Таким образом, посредством информационной системы организация третичного уровня медицинской помощи или федеральный центр высокотехнологичной медицинской помощи могут дистанционно реализовывать принятие организационно-диагностических решений и управление потоками обследуемых лиц, а также контролировать соблюдение методологии и весь процесс селективного популяционного скрининга.
Важно отметить, что разработанная модель обладает значительной гибкостью с точки зрения физической реализации. В зависимости от уровня исходной информационно-коммуникационной инфраструктуры, бюджета, локальных особенностей и т.д. информационная система для селективного популяционного скрининга РПЖ может быть реализована на базе отдельного оригинального системотехнического решения или региональной медицинской информационной системы. В любом случае, в перспективе такой инструмент должен интегрироваться в Единую государственную информационную систему здравоохранения.
Для обоснования валидности методики селективного скрининга РПЖ использованы критерии, рекомендованные Всемирной организацией здравоохранения. Указанные критерии должны быть соблюдены перед проведением скрининга в отношении любого состояния, так как они имеют фундаментальное значение для обеспечения целостности процесса скрининга [10, 11] (табл. 1).
Таблица 1. Анализ соответствия разрабатываемой методики селективного скрининга критериям Всемирной организацией здравоохранения
| Категория | Эталонный критерий | Оригинальный критерий (авторская методика) |
| Состояние | Искомое состояние должно быть важной проблемой здоровья, анамнез которого, включая развитие от скрытого до выраженного заболевания, должен быть правильно понят. Необходимо, чтобы состояние имело узнаваемую скрытую или раннюю симптоматическую стадию. | Рак предстательной железы по темпам прироста заболеваемости и смертности занимает первое место среди онкологических заболеваний (среди мужчин). Одной из причин высокой смертности является поздняя выявляемость РПЖ. |
| Диагноз | Должен существовать подходящий диагностический тест, безопасный и приемлемый для охваченной популяции. Должна быть согласована политика, основанная на надежных результатах теста и национальных стандартах, определяющих, кого следует считать пациентами, а весь процесс должен быть непрерывным. | Этапное применение анкетирования, лабораторных, инструментальных (неинвазивных и инвазивных), патогистологических методов исследования с доказанной ранее диагностической ценностью обеспечивает массовость, доступность, качество и индивидуализацию скрининговых мероприятий. |
| Лечение | Для лиц, у которых выявлены заболевания или предболезненные состояния, должно существовать признанное и установленное лечение или вмешательство, а также должно быть доступно оборудование для лечения | Четко сформированный алгоритм, включающий верификацию диагноза у лиц из группы риска, выявление метастазирования, стадирование процесса, комплексного лечения. Разработан типовой маршрут пациента. |
| Стоимость | Стоимость выявления случаев заболевания (включая диагностику и лечение) должна быть экономически сбалансирована с возможными расходами на медико-санитарную помощь в целом. | Ранее доказаны (в сравнении) экономические преимущества селективного скрининга [3]. |
Как следует из таблицы, разрабатываемая методика селективного (этапного) скрининга с применением информационно-коммуникационных технологий отвечает базовым критериям Всемирной организацией здравоохранения.
Выводы
Онкологические поражения органов мочеполовой системы представляют собой серьезную медико-организационную, социальную и финансовую проблему современного здравоохранения. Высокий уровень неудовлетворительных результатов и смертности обусловлен низкой и поздней выявляемостью. Эпидемиологические показатели свидетельствуют о недостаточной эффективности существующих скрининговых программ. В условиях современного общества, информированности граждан и пациент-центрированного подхода в здравоохранении полагаем необходимым модернизировать существующие подходы и методы на основе телемедицинских технологий.
Теоретически обоснована и разработана формальная информационная (графическая) модель организации селективного популяционного скрининга рака предстательной железы с применением телемедицинских технологий.
В ее рамках скрининг осуществляется путем исследования целевой группы — мужчин старше 45 лет (всю выборку разделяют на подгруппы с «шагом» 5 лет). Обследование контингентов проводится на первичном уровне медицинской помощи. Верифицирующие обследования сформированной группы риска и последующие стадирование и клиническую диагностику осуществляют на третичном уровне медицинской помощи или в условиях федерального центра высокотехнологичной медицинской помощи. Ключевым интегрирующим компонентом модели выступает телемедицинская информационная система — платформа агрегации и анализа данных, получаемых в процессе скрининговых обследований.
Разработанная модель селективного (этапного) скрининга с применением телемедицинских технологий отвечает базовым критериям Всемирной организацией здравоохранения.
Дальнейшие исследования будут состоять в апробации и изучении эффективности модели.
Исследование не имело спонсорской поддержки. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Бутрина В.И. Организация лечебно-диагностической помощи больным с раком простаты в условиях лечебно-диагностического отделения урологии. Социальные аспекты здоровья населения. 2014; 1(35):3.
- Старцев В.Ю., Акиншевич И.Ю. Динамика статистических показателей медицинской помощи жителям Республики Крым при злокачественных опухолях органов мочеполовой системы. Вестник урологии. 2015;(4):3-15.
- Guƫ lla A, Bortolami A, Evangelista L. Prostate cancer as a chronic disease: cost-eff ecƟ veness and proper followup. Q J Nucl Med Mol Imaging. 2015;59(4):439-45.
- Аполихин О.И., Катибов М.И., Сивков А.В., Чернышев И.В., Рощин Д.А. с соавт. Индуцированные всеобщей диспансеризацией проблемы скрининга рака предстательной железы в Российской Федерации. Социальные аспекты здоровья населения. 2013;(6):1.
- Аполихин О.И., Сивков А.В., Катибов М.И., Чернышев И.В., Жернов А.А., Корякин А.В. Сравнительный анализ клинических и экономических результатов радикальной простатэктомии и брахитерапии. Экспериментальная и клиническая урология. 2011;(1):11-16.
- Аполихин О.И., Сивков А.В., Катибов М.И., Рощин Д.А., Шадеркин И.А., Корякин А.В. Скрининг рака предстательной железы: оценка с позиции клиникоэкономической эффективности. Экспериментальная и клиническая урология.2015;(2):20-24.
- Злокачественные новообразования в России в 2014 году (заболеваемость и смертность) [под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой] МНИОНИ им. П.А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России. М., 2016. С. 16.
- Каприн А.Д., Аполихин О.И., Сивков А.В., Москалева Н.Г., Солнцева Т.В., Комарова В.А. Анализ уронефрологической заболеваемости и смертности в Российской Федерации за 2003-2013 гг. Экспериментальная и клиническая урология. 2015;(2):4-12.
- Кротов К.Ю. Медико-организационное обоснование совершенствования оказания медицинской помощи больным с раком предстательной железы. Врачаспирант. 2015;6(73):125-133.
- Cochrane AL, Holland WW. ValidaƟ on of screening procedures. British Medical Bulletin. 1971;27(1):3-8.
- Holland WW, Stewart S, Masseria C. Основы политики. Скрининг в Европе. ВОЗ;2008.
- Енгалычев Ф.Ш., Миронов М.А., Галкина Н.Г., Галкин А.В., Дурденевский Н.Б., Сыскова М.А. Результаты целевой программы скрининга рака предстательной железы в Пензенской области. Онкоурология.2012;(1):62-65.
- Орлов А.Е., Егорова А.Г., Старинский В.В. Анализ онкоэпидемиологических тенденций в регионах Российской Федерации – основа успешной реализации территориальных программ профилактики рака. Самара: ООО «Издательство Ас Гард»; 2014.
- Чернов Н.А., Верещагин И.И., Галкин В.В., Исмаилов А.М., Сивков А.В. Первые результаты целевой программы диагностики рака предстательной железы в Калужской области. Экспериментальная и клиническая урология. 2010;(2):11−14.
- Владзимирский А.В. Телемедицина: Curatio Sine Tempora et Distantia.М; 2016.
- Brawley OW, Thompson IM Jr, Grönberg H. Evolving Recommendations on Prostate Cancer Screening. Am Soc Clin Oncol Educ Book. 2016;35:e80-7. doi: 10.14694/ EDBK_157413
- Randazzo M, Müller A, Carlsson S, Eberli D, Huber A et al. A positive family history as a risk factor for prostate cancer in a population-based study with organised prostate-specific antigen screening: results of the Swiss European Randomised Study of Screening for Prostate Cancer (ERSPC, Aarau). BJU Int. 2016;117(4):576-83. doi: 10.1111/bju.13310
Статья опубликована в журнале "Вестник урологии" №3 2017, стр. 5-12









Комментарии