Локшин К.Л.
Урологическое отделение Клинического госпиталя «Лапино», г.Москва НИИ уронефрологии и репродуктивного здоровья человека Первого Московского государственного медицинского университета им. И.М. Сеченова, г.Москва Адрес: 143081, Московская область, Одинцовский район, 1-е Успенское шоссе, Лапино, 111. Эл.почта: k_lokshin@hotmail.com
В марте 2013 года в официальном печатном органе Европейской Ассоциации Урологов, в журнале European Urology, были опубликованы новейшие клинические рекомендации по лечению и ведению больных с доброкачественной гиперплазией простаты. В этих клинических рекомендациях в отношении больных с гиперплазией простаты использовано определение: «больные с ненейрогенными симптомами нижних мочевых путей (СНМП) и с доброкачественной простатической обструкцией».
Мы представляем первый русскоязычный обзор данных клинических рекомендаций. Хотелось бы подчеркнуть,что обзор содержит в сжатом виде исключительно информацию, представленную в оригинальной статье журнала European Urology, без собственных дополнений или комментариев.
Экспертный совет подготовил данные клинические рекомендации, проведя анализ исследований, опубликованных в медицинских базах данных PubMed, Medline, Web of Science и Cochrane в период с 1966 г по 31 октября 2012 года.
Уже стандартно в рекомендациях была использована Оксфордская классификация уровня доказательности (таблица 1) и градации/степени рекомендаций (таблица 2).
| Уровень | Тип данных |
| 1a | Данные, полученные путем метаанализа рандомизированных исследований |
| 1b | Данные, полученные на основании хотя бы одного рандомизированного исследования |
| 2a | Данные, полученные на основании данных одного контролируемого нерандомизированного исследования |
| 2b | Данные, полученные на основании по крайнеймере одного хорошо с планированного квазиэкспериментального исследования |
| 3 | Данные, полученные в ходе описательных исследовании: исследования ̆ «случай-контроль», сравнительных исследовании, корреляционных ̆ исследований и описаний клинических случаев |
| 4 | Данные заключенийэкспертных комитетов и мнения признанных специалистов |
Таблица 1. Оксфордская классификация уровней доказательности
| Степень | Основание рекомендаций |
| A | Основаны на клинических исследованиях хорошего качества, включающих хотя бы одно рандомизированное исследование |
| B | Основаны на данных хорошо организованных клинических исследований не включающих рандомизированые клинические исследования |
| C | Сформулированы, несмотря на отсутствие качественных клинических исследований в данной области |
Таблица 2. Оксфордская классификация степени рекомендаций
Экспертный комитет планирует производить обновление данных рекомендаций каждые 2 года.
1. Клинические рекомендации по динамическому наблюдению
Динамическое наблюдение показано при незначительных (International Prostate Symptom Score – IPSS ≤7) или умеренных (IPSS 8-19) СНМП, не доставляющих пациенту ощутимого беспокойства.
Противопоказано при наличии осложненной ДГПЖ (абсолютных показаний к оперативному лечению, см. раздел рекомендаций, посвященный хирургическому лечению).
Динамическое наблюдение подразумевает периодические обследования больного, образование/информирование пациента и предоставление рекомендаций по образу жизни, включая:
- ограничение приема жидкостей (например, на ночь)
- cнижение потребления алкоголя и кофеин-содержащих напитков
- использование методик расслабления при мочеиспускании и двойного мочеиспускания
- «поддаивание» уретры во избежание подтекания мочи после мочеиспускания
- методики отвлечения внимания и тренировка мочевого пузыря (при ургентных симптомах)
- оценку и смену времени приема сопутствующих препаратов (например, диуретиков)
- обеспечение помощи при нарушениях координации, подвижности или психического состояния
- лечение запоров
2. Клинические рекомендации по медикаментозной терапии
2.1. Антагонисты альфа-1-адренорецепторов (альфа-1-адреноблокаторы) являются препаратами первой линии, показаны при умеренных и выраженных СНМП (1а, А).
В настоящее время в клинической практике используются 5 препаратов данной группы: альфузозин, доксазозин, силодозин, тамсулозин, теразозин.
Препараты имеют сходную эффективность и быстрое начало действия, способны улучшать как симптомы накопления, так и симптомы опорожнения.
При использовании альфа-1-адреноблокаторов имеет место снижение балла IPSS в среднем на 30-40%, повышение Qmax в среднем на 20-25%. Размер простаты не оказывает существенного влияния на эффективность.
Альфа-1-адреноблокаторы не уменьшают размер простаты и не снижают риск ОЗМ.
При постоянном приеме антагонистов альфа-1-адренорецепторов, снижение балла IPSS и повышение Qmax сохраняется на протяжении, как минимум, 4-х лет.
Отличия в переносимости препаратов данной группы обусловлены их фармакокинетикой и степенью селективности.
Наиболее часто регистрируемыми нежелательными явлениями являются: астения, головокружение и ортостатическая гипотензия. Наличие сердечнососудистых заболеваний, а также прием вазоактивных препаратов повышают риски развития нежелательных явлений (НЯ). Установлено, что риск гипотензии при приеме силодозина сравним с таковым у плацебо. При использовании тамсулозина описано развитие интраоперационного синдрома атоничной радужки.
В систематическом обзоре установлено, что альфа-1-адреноблокаторы не оказывают негативного влияния на либидо. Препараты способны несколько улучшать эректильную функцию, но иногда приводят к нарушениям эякуляции (уменьшение объема или исчезновение эякулята). Наиболее часто нарушения эякуляции регистрируются при приеме силодозина.
2.2. Ингибиторы 5-альфа-редуктазы показаны при умеренных и выраженных СНМП и при объеме простаты более 40 см куб., ПСА >1,4 нг/мл (1b, А).
В настоящее время в клинической практике используются 2 препарата данной группы: дутастерид и финастерид. Финастерид ингибирует 5-альфаредуктазу 2 типа, дутастерид – как 2ого, так и 1-ого типа.
Препараты имеют сходную клиническую эффективность, и для них характерно медленное развитие эффекта. После 2-4 лет лечения ингибитором 5-альфа-редуктазы имеет место снижение балла IPSS в среднем на 15-30%, снижение объема простаты в среднем на 18-28%, повышение Qmax в среднем на 1,5-2,0 мл/с. Установлено также, что чем больше исходный объем простаты, тем выше эффективность препаратов данной группы. У больных с V простаты >30 см3 эффективность дутастерида по уменьшению СНМП не уступает/превосходит таковую у тамсулозина.
В отличие от альфа-1-адреноблокаторов, ингибиторы 5-альфа-редуктазы способны снижать риск прогрессирования ДГПЖ за счет уменьшения риска острой задержки мочи (ОЗМ) и риска хирургического лечения (1b, А). На фоне приема ингибиторов 5-альфа-редуктазы риск развития ОЗМ снижается на 57-68%, риск оперативного лечения – на 34-64%.
Наиболее частые НЯ: снижение либидо, эректильная дифункция, редко – гинекомастия, эякуляторные нарушения.
2.3. Антагонисты мускариновых рецепторов (М-холиноблокаторы) показаны при умеренных и выраженных СНМП – преимущественно при симптомах накопления (1b, B).
В настоящее время в клинической практике используются 6 препаратов данной группы: дарифенацин, фезотеродин, оксибутинин, пропиверин, солифенацин, толтеродин и хлорид троспия. Препараты имеют сходную эффективность и переносимость. Однако, исследований по длительному их применению пока нет. Назначать М-холиноблокаторы надо с осторожностью, с регулярной оценкой IPSS и объема остаточной мочи.
Имеется небольшое количество исследований по изучению монотерапии антагонистами мускариновых рецепторову больных с простатической обструкцией и гиперактивностью мочевого пузыря (ГМП). В исследовании толтеродина и тамсулозина – в группе толтеродина было отмечено только снижение частоты ургентного недержания. Лучше эффект от терапии М-холиноблокаторамиу больных с маленькими простатами и при ПСА <1,3 нг/мл.
Наиболее часто регистрируемыми нежелательными явлениями являются: сухость во рту (<16%), запоры (<4%), затруднение мочеиспускания (<2%), назофарингит (<3%), головокружение (<5%). При отсутствии простатической обструкции, прием антагонистов мускариновых рецепторов сопряжен с частотой ОЗМ не отличающейся от таковой при приеме плацебо (0-1,3% и 0-1,4%, соответственно).
2.4. Ингибиторы фосфодиэстеразы 5 типа (ФДЭ-5) показаны при умеренных и выраженных СНМП (и накопления, и опорожнения) в сочетании или без ЭД (1b, А).
У больных с гиперплазией простаты в рандомизированных контролированных исследованиях изучались cилденафил, тадалафил и варденафил. Однако только тадалафил 5 мг зарегистрирован для лечения СНМП.
По данным мета-анализа терапия ингибитором ФДЭ-5 в сравнении с плацебо приводит к значимому снижению суммарного балла IPSS (-2,8 балла), без влияния на Qmax. При использовании тадалафила субъективное улучшение отмечается достаточно быстро – через 1 неделю с начала приема. Тадалафил 5 мг у больных ДГПЖ снижает балл IPSS на 22-37%.
В одном из последних исследований, не включенном в упомянутый метаанализ, при лечении тадалафилом имело место статистически значимое увеличение Qmax, по сравнению с плацебо (+2,4 мл/с). Тадалафил не оказывал значимого влияния на объем остаточной мочи.
Наиболее выраженный эффект от терапии ингибиторами ФДЭ-5 отмечается у более молодых пациентов с низким индексом массы тела и с тяжелыми СНМП.
Влияние ингибиторов ФДЭ-5 на прогрессирование заболевания и на объем простаты пока не изучено.
Наиболее частные НЯ: головные боли, боль в спине, головокружения, диспепсия. Препараты противопоказаны при приеме нитратов, активаторов калиевых каналов и альфа-1-адреноблокаторов; при перенесенном менее 3 мес. назад инфаркте миокарда или менее 6 мес. назад инсульте; при сердечной недостаточности более чем 2 стадии (по NYHA); при гипотензии и нестабильном артериальном давлении; при значительной печеночной или почечной недостаточности; при передней ишемической офтальмопатии в анамнезе.
2.5. Фитотерапия.
Наиболее широко используются экстракты Cucurbitapepo, Hypoxisrooperi, Pygeumafticanum, Secalecereale, Serenoarepens, Utricadioica.
Проблематичным представляется, что разные производители используют различные методы экстрагирования и в препаратах могут быть неодинаковые концентрации активных компонентов.
По данным мета-анализа при использовании экстракта Pygeumafticanum при сравнении с плацебо в 2 раза чаще имело место симптоматическое улучшение, (в исследованиях однако не применялся IPSS).
По данным мета-анализа при использовании экстракта Cecalecereale (пыльцы) положительный эффект отмечался в 2 раза чаще, чем при приеме плацебо.
По данным мета-анализа при использовании экстракта Serenoarepens последний не превосходил плацебо, финастерид или тамсулозин по действию на балл IPSS (сходная эффективность в исследованиях с финастеридом и тамсулозином может расцениваться, как эквивалентность лечебного эффекта).
В связи с гетерогенностью препаратов, несовершенством регуляторной базы и существенными методологическими недостатками опубликованных исследований и мета-анализов, экспертный совет не может дать сколь либо определенных рекомендаций по использованию растительных экстрактов для лечения СНМП у мужчин.
2.6. Аналог вазопрессина (десмопрессин) может быть использован для лечения ноктурии, обусловленной ночной полиурией (1b, А).
По данным мета-анализа при приеме десмопрессина в сравнении с плацебо имеет место статистически значимое снижение количества ночных мочеиспусканий и увеличение продолжительности сна без пробуждения.
Наиболее частые НЯ: головная боль, тошнота, диарея, боль в животе, головокружение, сухость во рту, гипонатиремия (5-7,6%), периферические отеки (2%), гипертензия (5%).
При назначении десмопрессина необходимо ограничение приема жидкостей за 1 час до и в течение 8 часов после приема, контроль уровня натрия в крови на 3, 7 сутки и затем регулярно.
2.7. Комбинированная терапия
2.7.1. Комбинированная терапия альфа-1-адреноблокатором и ингибитором 5-альфа-редуктазы показана при умеренных и выраженных СНМП, увеличенной простате, сниженной Qmax (другими словами, при высоком риске прогрессирования гиперплазии простаты) (1b, А).
Данная комбинированная терапия эффективней монотерапии каждым из препаратов в снижении балла IPSS и увеличении Qmax. Комбинированная терапия ингибитором 5-альфа-редуктазы и альфа-1-адреноблокатором в сравнении с монотерапией тамсулозином обеспечивает существенное снижение риска прогрессирования ДГПЖ (на 66%), ОЗМ (на 67,8%), необходимости хирургического лечения по поводу ДГПЖ (на 70,6%), симптоматического ухудшения (на 41,3%) (4 года наблюдения).
2.7.2. Комбинированная терапия альфа-1-адреноблокатором и М-холиноблокатором может быть назначена при умеренных и выраженных СНМП, когда монотерапия альфа-1-АБ или М-ХБ недостаточно эффективна в отношении симптомов накопления (2b, В).
Эта комбинация препаратов более эффективна, чем монотерапия альфа-1АБ или плацебо в уменьшении частоты мочеиспусканий и эпизодов ургентного недержания, ночной поллакиурии и суммарного балла IPSS.
У больных с СНМП и с гиперактивностью детрузора при сохранении СНМП на фоне терапии альфа-1-АБ добавление М-ХБ существенно снижает степень выраженности симптомов.
На фоне комбинированного лечения несколько чаще, чем при монотерапии, встречаются сухость во рту и нарушения эякуляции. Также при комбинированном лечении установлено клинически незначимое увеличение объема остаточной мочи, при этом риск ОЗМ остается низким.
Данный вид терапии должен с осторожностью назначаться при инфравезикальной обструкции – рекомендуется динамический контроль объема остаточной мочи.
3. Клинические рекомендации по хирургическому лечению
3.1. Трансуретральная резекция простаты (ТУРП) и трансуретральная инцизия простаты (ТУИП)
ТУРП – стандарт хирургического лечения умеренных/выраженных СНМП при объеме простаты 30-80 cм3 (1а, А).
Инцизия – стандарт хирургического лечения умеренных/выраженных СНМП при объеме простаты <30 cм3 и при отсутствии средней доли (1а, А).
По данным мета-анализа (20 рандомизированных исследований, до 5 лет наблюдения) эффективность ТУРП следующая: Qmax (+162%), IPSS (–70%), QoL (–69%), Vост. (–77%). Отдаленные результаты после ТУРП хорошие. Неудачи лечения чаще связаны с гиперактивностью, а не с инфравезикальной обструкцией.
По данным мета-анализа (включено 6 иссл.) частота повторных операций составляет 18,4% после инцизии и 7,2% после ТУРП.
До операции обязательно лечение мочевой инфекции.
Частота осложнений растет с увеличением объема простаты. Ближайшие осложнения после ТУРП: летальность – 0,1%, ТУР-синдром – 0,8%, необходимость гемотрансфузии – 2%, ОЗМ – 4,5%, тампонада – 4,9%, мочевая инфекция – 4,1%. Отдаленные осложнения после ТУРП: недержание мочи 2,2%, ОЗМ, инфекция, склероз шейки – 4,7%, стриктура уретры – 3,8%, ретроградная эякуляция – 65,4%, ЭД – 6,5%.
Осложнения после инцизии: ближайшие – ТУР-синдром – 0%, гемотрансфузия – 0%; отдаленные – стриктура уретры – 4,1%, ретроградная эякуляция – 18,2%.
3.2. Биполярная трансуретральная резекция простаты
Ближайшие и среднесрочные результаты биполярной трансуретральной резекции простаты аналогичны таковым при монополярной ТУРП (1а, А).
По сравнению с монополярной ТУРП, у биполярной ТУРП меньшая частота ранних осложнений: нет ТУР синдрома, ниже частота кровотечений, тампонад, меньше продолжительность катетеризации (1а, А).
3.3. Открытая аденомэктомия является стандартом хирургического лечения умеренных/выраженных СНМП при объеме простаты более 80 cм куб (1b, А). В то же время, она является самым инвазивным и морбидным методом хирургического лечения гиперплазии простаты (1b, А).
Только энуклеация гольмиевым лазером достигает сходной с открытой аденомэктомией результативности при меньшей частоте осложнений.
Эффективность открытой аденомэктомии следующая: Qmax (+375%), IPSS (–63-86%), QoL (–60-87%), Vост. (–8698%).
Ближайшие осложнения: летальность – 0,25%, необходимость гемотрансфузии – 7-14%.
Отдаленные осложнения: недержание мочи – 10%, склероз шейки или стриктура уретры – 6%.
3.4. Трансуретральная микроволновая терапия (ТУМТ) позволяет достигать улучшения СНМП, сходное с ТУРП при меньшей морбидности, но и при меньшем улучшении параметров мочеиспускания (1а, А). Продолжительность эффекта после ТУМТ короче, а частота повторных вмешательств выше по сравнению с ТУРП (1а, А).
Перед проведением ТУМТ обязательна уретроцистоскопия для исключения средней доли и точного определения протяженности простатического отдела уретры. Для выполнения ТУМТ не требуется анестезия – манипуляция показана больным с высоким анестезиологическим риском. Результат вмешательства хуже при маленьких простатах и при невыраженной симптоматике. Эффективность ТУМТ следующая: Qmax (+75%), IPSS (–65%).
По сравнению с ТУРП после микроволновой термотерапии больше продолжительность катетеризации, выше частота дизурии и ОЗМ.
При этом, ниже частота гематурии, тампонады, гемотрансфузии, ТУР-синдрома, стриктуры уретры, склероза шейки и эректильной дисфункции.
3.5. Трансуретральная игольная аблация простаты позволяет достигать улучшения СНМП сходного с ТУРП при меньшей морбидности, но и при меньшем улучшении параметров мочеиспускания (1а, А). Продолжительность эффекта игольной абляции по сравнению с ТУРП меньше, а частота повторных вмешательств выше (1а, А).
Для проведения процедуры требуется местная анестезия и седация больного. При Vпростаты >75 см3 и при большой средней доле результаты данного вмешательства неудовлетворительные.
Эффективность трансуретральной игольной абляции: Qmax (+70%), IPSS (–50%).
Частота повторных вмешательств составляет 19,1%, частота ОЗМ – 13-42% (1-3 день), в первые 4-6 недель имеет место высокая частота симптомов накопления.
По сравнению с ТУРП после игольной абляции ниже частота гематурии, инфекции, тампонады, гемотрансфузии, ТУР-синдрома, стриктуры уретры, недержания мочи, ЭД и нарушений эякуляции.
3.6. Гольмиевая лазерная энуклеация является стандартом хирургического лечения умеренных/выраженных СНМП при объеме простаты более 80 cм3 (1b, А).
По объективным и субъективным параметрам эффективности у больных с умеренными и выраженными СНМП гольмиевая лазерная энуклеация является альтернативой ТУРП (1а, А).
Данная операция имеет сходные с открытой аденомэктомией отдаленные результаты при существенно меньшей морбидности.
При сравнении с ТУРП: продолжительность гольмиевой энуклеации больше, степень улучшения симптоматики сходная или выше, а Qmax (через 1 год после операции) значительно выше.
Ближайшие осложнения гольмиевой энуклеации: летальность – 0,05%, гемотрансфузия – 1%, инфекция – 2,3%. Отдаленные осложнения: стриктура шейки – 0,8%, стриктура уретры – 3,2%, повторная операция – 2,8%.
Гольмиевая энуклеация безопасна при приеме антикоагулянтов.
По сравнению с ТУРП: при гольмиевой энуклеации короче время катетеризации, меньше кровопотеря и частота гемотрансфузии.
3.7. Выпаривание простаты зеленым (532 нм) лазером по объективным и субъективным параметрам эффективности у больных с умеренными и выраженными СНМП является альтернативой ТУРП (1а, А). Среднесрочные функциональные результаты выпаривания зеленым лазером сравнимы с таковыми после ТУРП (1b, A).
Интраоперационная безопасность выпаривания зеленым лазером выше, чем у ТУРП (1b, A); рассматриваемое вмешательство целесообразно у пациентов, получающих антикоагулянты и с высоким кардио-васкулярным риском (3, В).
Частота повторных вмешательств после выпаривания зеленым лазером 8,9-14,8%.
По сравнению с ТУРП: больше время операции; меньше продолжительность катетеризации, госпитализации; ниже частота гемотрансфузии, тампонады; сходная частота ОЗМ, инфекции, стриктуры уретры, шейки мочевого пузыря.
3.8. Выпаривание простаты диодным лазером. После операций с использованием диодного лазера в краткосрочной перспективе имеет место объективное и субъективное улучшение мочеиспускания (3, С).
С использованием диодного лазера может производиться контактная или бесконтактная вапоризация, а также энуклеация гиперплазии простаты.
В настоящее время нет рандомизированных исследований по сравнению с ТУРП и открытой аденомэктомией.
В одном рандомизированном исследовании получены сходные результаты энуклеации диодной энуклеации и биполярной ТУРП.
При операциях с использованием диодного лазера нет интраоперационных кровотечений.
По сравнению с выпариванием зеленым лазером: чаще дизурия из-за отхождения струпа, выше частота повторных вмешательств по поводу сужения шейки и обструкции струпом (33% vs 4%), выше частота стрессового недержания мочи (9,1% vs 0%). Выпаривание простаты диодным лазером может быть рекомендовано в качестве стандартного лечения гиперплазии простаты.
3.9. Хирургическое лечение с использованием тулиевого лазера. Вапорезекция тулиевым лазером может быть альтернативой ТУРП при простате малых и средних размеров (1b, A).
В краткосрочной и среднесрочной перспективе после выпаривания тулиевым лазером имеет место объективное и субъективное улучшение мочеиспускания (3, С).
Тулиевый лазер представляется безопасным с точки зрения интраоперационных осложнений и возможностей гемостаза (3, С).
С использованием тулиевого лазера может производиться вапоризация, вапорезекция, вапоэнуклеация и энуклеация аденомы простаты.
К настоящему времени проведено мало рандомизированных исследований по сравнению операций с использованием тулиевого лазера с ТУРП и нет исследований по сравнению с открытой аденомэктомией.
Максимальный период наблюдения после операций – 18 мес.
Результаты тулиевой энуклеации (по параметрам IPSS, Qmax, V ост.) сравнимы с таковыми после гольмиевой энуклеации. При тулиевой энуклеации отмечена сходная с гольмиевой энуклеацией продолжительность операции, при меньшей кровопотере.
Частота стриктур уретры после тулиевой вапорезекции – 1,6-1,9%, сужения шейки – 1,8%, повторных вмешательств (6-12 мес.) – 0-7,1%.
3.10. Простатические стенты являются альтернативой катетеризации у пациентов с противопоказаниями к оперативному лечению (3, С).
При использовании стента UroLume: снижение IPSS – на 10-12,4 баллов, повышение Qmax – на 4,2-13,1 мл/с.
При установке стента MemoCath: снижение IPSS – на 11-19 баллов, повышение Qmax – на 3-11 мл/с
Применение простатических стентов сопряжено с высоким риском миграции, инкрустации и усиления СНМП.
3.11. Новые хирургические методики.
3.11.1. Интрапростатическое введение этанола – при умеренных/выраженных СНМП – экспериментальная методика, может использоваться только в клинических исследованиях (3, С).
Позволяет достигать снижения суммарного балла IPSS на 6,7-16,5 баллов, повышения Qmax – на 3,2-11 мл/с.
Высокая частота повторных вмешательств – 41% в течение 1 года наблюдения.
Для проведения вмешательства требуется местная анестезия с седацией, региональная или общая анестезия.
Осложнения: боли в промежности, симптомы накопления (до 40%), гематурия (до 40%), инфекция и ОЗМ.
3.11.2 Интрапростатическое введение ботулинического токсина при умеренных/выраженных СНМП – экспериментальная методика, может использоваться только в клинических исследованиях (3, С). Приводит к уменьшению объема простаты. Продолжительность эффекта от 3 до 30 мес
В самом большом рандомизированном исследовании по IPSS, QoL и Qmax отличий от плацебо нет.
Хорошо переносится.
Необходимы дополнительные исследования.
Выбор метода лечения
Ниже представлены предлагаемые экспертами Европейской Ассоциации Урологов алгоритмы консервативного медикаментозного (схема 1) и оперативного лечения (схема 2) больных с СНМП.
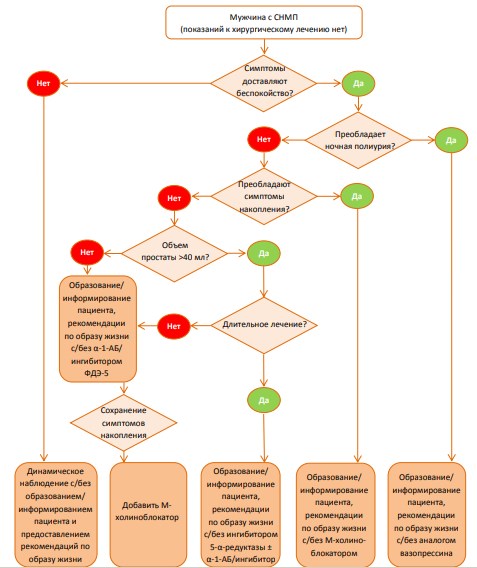
Схема 1. Алгоритм выбора консервативного/медикаментозного метода лечения у больного с СНМП
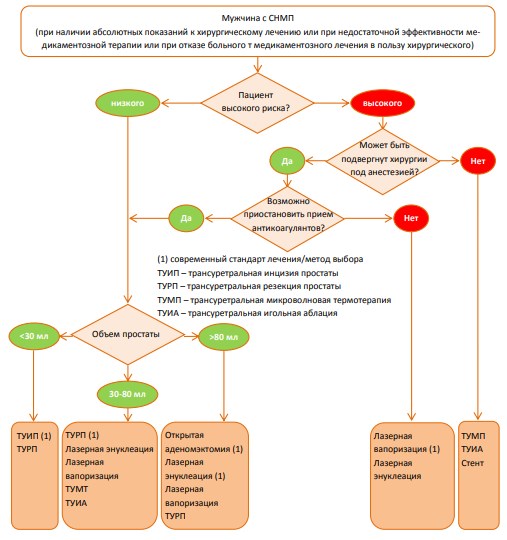
Схема 2. Алгоритм выбора оперативного метода лечения у больного с СНМП
Оперативное лечение абсолютно показано больным c:
- рецидивирующей инфекцией мочевых путей,
- повторившейся после удаления катетера или с рецидивирующей острой задержкой мочи,
- парадоксальной ишурией,
- устойчивой к терапии макрогематурией,
- двусторонним уретерогидронефрозом c почечной недостаточностью (или без нее),
- камнями мочевого пузыря,
- дивертикулом мочевого пузыря больших размеров, обусловленными инфравезикальной обструкцией, гиперплазией простаты.
Статья опубликована в журнале "Вестник урологии". Номер №3/2014 стр. 50-62











Комментарии