О.Н. Васильев1 , М.И. Коган1 , В.А. Перепечай2
1 ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России; Ростов-на-Дону, Россия
2Ростовская клиническая больница ФГБУЗ «Южный окружной медицинский Центр Федерального медико-биологического агентства России»; Ростов-на-Дону, Россия
Автор для связи: Васильев Олег Николаевич Тел./факс:+7 (863) 250-40-79;e-mail:vasilyev_on@mail.ru
Введение
Рак мочевого пузыря (РМП) включает в себя широкий спектр опухолей, которые можно, на основании статистики США, разделить на три основные категории: поверхностные (70%), мышечно-инвазивные (25%) и метастатические (5-10%). Опухолевые презентации отличаются по клиническому поведению, и они должны быть приняты во внимание при определении прогноза и подбора первичной терапии. Пятилетняя выживаемость при мышечно-инвазивном раке мочевого пузыря (МИРМП) составляет 30-50%[1]. Варианты лечения инвазивного РМП: хирургия, радикальная радиация и химиорадиотерапия. Радикальная лучевая терапия или химиолучевое с хирургическим лечением спасения показывают те же показатели выживаемости, что и немедленное хирургическое вмешательство, и позволяют части пациентов сохранить их мочевой пузырь [2]. Комбинированная химиотерапия вместе с лучевой терапией также могут быть использованы у пациентов, которые отказываются от хирургического вмешательства или, с медицинской точки зрения, непригодны к хирургии[3]. Радикальная цистэктомия (РЦЭ) остается золотым стандартом лечения МИРМП более 4-х десятилетий. В условиях приемлемых низкой смертности и частоты осложнений, РЦЭ с континентной уродеривацией остается методом выбора для лечения рака мочевого пузыря T2-4 во многих медицинских центрах [4,5-7]. Несколько большие исследования по результатам цистэктомии имеют подтверждение этих благоприятных результатов, но другие также показали, что качество жизни может быть скомпрометировано данным методом лечения [8-10]. Органосохраняющая терапия для МИРМП используется в течение более чем 20 лет с выживанием, сопоставимым с РЦЭ, с десятии пятнадцатилетней канцерспецифичной выживаемостью 59% и 57% соответственно [5-7,11-12]. Цистэктомия спасения (ЦС) выполняется у тех, у кого органосохраняющая терапия терпит неудачу. При этом отмечено большее количество осложнений при цистэктомии спасения у больных, перенесших до нее химиолучевую терапию [13].
В отсутствие рандомизированных клинических исследований III фазы, сравнивающих результаты радикальной цистэктомии и органосохраняющей терапии, трудно четко определить оптимальный вариант лечения. Однако современные исследования показывают впечатляющее пятилетнее отсутствие тазового рецидива в 80%-90% случаев и пятилетние общую и канцерспецифическую выживаемости 59%-60% и 55%65% соответственно для радикальной цистэктомии [8,9,10,16-18]. В то время как пятилетние показатели общей выживаемости для тримодальной органосохраняющей терапии составляют 48%-63%, а от 35% до 45% этих пациентов, в конечном итоге, требуют спасительной и паллиативной цистэктомии, что безусловно становится технически более сложной задачей с развитием осложнений до 58,5% в течение 90 дней после операции и значительно более высоким уровнем регионального метастазирования в сравнении с первичной РЦЭ (26% против 12%) и более короткой канцерспецифической выживаемостью (1256% против 80%). Кроме того, у тех, кто прошел органосохраняющую терапию и решил не проходить спасительную цистэктомию, выживаемость в течение 5 лет снижается до 36%[19-22].
Таким образом, лечение МИРМП остается дискуссионным с применением различных методов терапии. В связи с этим проведён анализ результатов радикального и паллиативного лечения у пациентов с РМП.
Материалы и методы
В исследование включены 349 пациентов, подвергнутых РЦЭ, из них сформированы три группы: РЦЭ первичная (n=206), РЦЭ спасения (n=119) и ЦЭ паллиативная (n=24).
Показаниями к РЦЭ считали наличие РМП в стадии сT2-T4aN0-хM0, либо наличие НМИРМП (cN0-хM0) высокой степени риска. Критериями высокого риска прогрессии при НМИРМП считали: cT1G3 – многофокусная и/или большая опухоль (>3 см); cT1G3 – рецидивная опухоль; cT1G3 + CIS; cT1G3 ± CIS в простатической уретре. Дополнительным показаниям к РЦЭ при НМИРМП считали cT1N0-хM0G2-3 + верифицированный РПЖ.
В работе руководствовались общепринятым разделением понятий первичной, спасительной и паллиативной ЦЭ: первичная РЦЭ – пациенты со стандартными вышеуказанными показаниями к РЦЭ при первично установленном диагнозе, неполучавшие по поводу РМП ранее никакого лечения; спасительная РЦЭ (или ЦЭ спасения) – пациенты, которые ранее получали лечение РМП, но ответ на консервативную терапию отсутствовал и/или возник рецидив с прогрессией, либо изначально выявлена непереходно-клеточная опухоль; паллиативная ЦЭ – нерезектабельные местнораспространенные (T4b), метастатические (M1) опухоли, имеющие тяжелые и/или жизнеугрожающие осложнения (мочепузырно-кожные, -кишечные, -влагалищные свищи), выраженный болевой синдром, неконтролируемые фармакологически и эндоскопически мочепузырные кровотечения, кишечная непроходимость как осложнение МРРМП и другие. Удаленные органокомплексы были обработаны в соответствии со стандартами патологических исследований макропрепаратов. Степень дифференцировки оценивали по классификации ВОЗ 1973 г. Патологическую стадию устанавливали в соответствии с системой TNM 2010 года. Наличие рака insitu (Tis) определяли, как наличие Tis в сочетании с другими патологическими категориями, либо в моноформе. Вся жировая клетчатка, удаленная при регионарной лимфаденэктомии (ЛАЭ), подлежала гистологическому исследованию. Положительный хирургический край расценивали как наличие опухолевых клеток в краях резекции удаленного органокомплекса.
Наблюдение больных после РЦЭ проводили в соответствии с существующими протоколами послеоперационного наблюдения: контрольное обследование 4 раза в течение первого года, раз в полгода в течение второго года, а затем ежегодно как минимум в течение 5 лет.
Причину смерти больных определяли по результатам наблюдения как смерть в результате прогрессии заболевания (наличие местного рецидива или отдаленных метастазов опухоли) или смерть от других причин, не связанных с РМП.
Статистический анализ проведен при помощи программы Statistica7.0. Различия в распределениях вариант наблюдения по нескольким градациям признаков оценивали по критерию Фишера и «Хи-квадрат», используя абсолютные значения частот в модуле непараметрической статистики. Кроме того, сравнение альтернативных показателей, представленных в виде процентов, проводили по критерию t Стьюдента с помощью дифференцировочного теста в модуле описательной статистики. Расчет показателей выживаемости по годам наблюдения выполняли по методике Kaplan-Meier с учетом последовательного выбывания из анализа больных, ушедших из-под наблюдения или прошедших лишь частичный срок наблюдения в рамках общего срока исследования. Во всех случаях сравнения результаты различий считали статистически достоверными при вероятности ошибки менее 5% (р<0,05).
Результаты
Общая, канцерспецифическая и безрецидивная выживаемости в трех группах представлены на графиках (рис. 1; рис. 2; рис. 3).
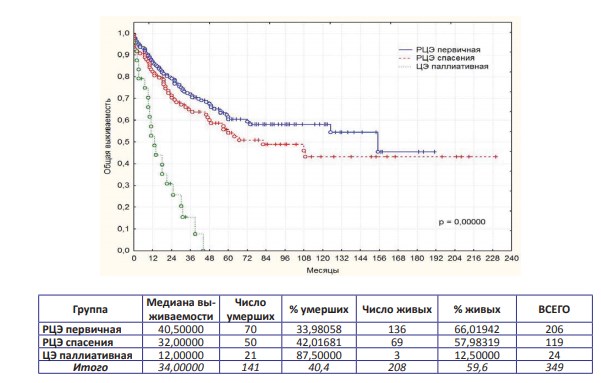
Рисунок 1. Общая выживаемость после РЦЭ первичной, РЦЭ спасения и ЦЭ паллиативной
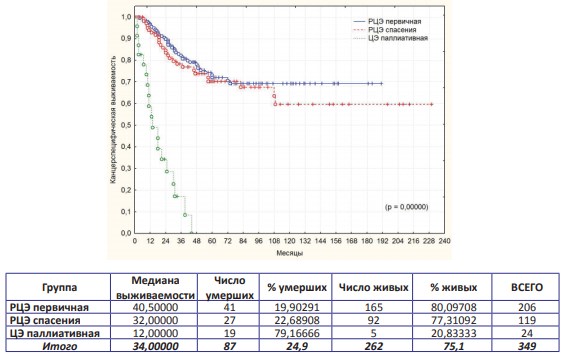
Рисунок 2. Канцерспецифическая выживаемость после РЦЭ первичной, РЦЭ спасения и ЦЭ паллиативной
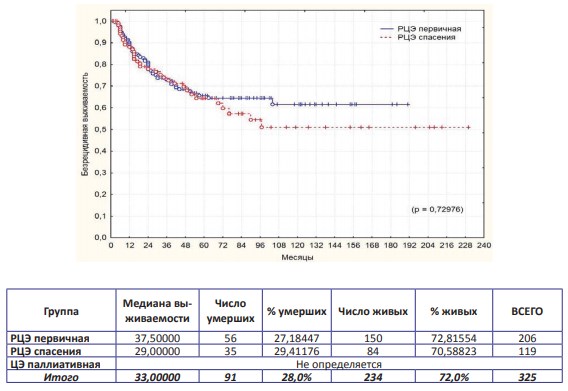
Рисунок 3. Безрецидивная выживаемость после РЦЭ первичной и РЦЭ спасения
По результатам выполненного анализа установлено, что достоверно худшие показатели всех видов выживаемости выявлены при паллиативной ЦЭ, что ассоциировано с продолженным ростом опухоли (p=0,00000). Если эту группу пациентов анализировать отдельно, а «в чистом виде» сравнивать онкологическую результативность первичной и спасительной РЦЭ, то оказывается, что статистически достоверная разница в показателях выживаемости в сравниваемых группах отсутствует! Трехлетняя, пятилетняя и актуриальная десятилетняя выживаемости в анализируемых группах представлены в таблице (табл. 1).
Таблица 1. Общая, канцерспецифическая и безрецидивная выживаемости после РЦЭ первичной, спасения и ЦЭ паллиативной
| Подгруппа (РЦЭ/ЦЭ) | Общая | Канцерспецифическая | Безрецидивная | Р | ||||||
| 3-лет няя | 5-лет няя | 10-лет няя | 3-лет няя | 5-лет няя | 10-лет няя | 3-летняя | 5-летняя | 10-летняя | ||
| Первичная | 71,80% | 60,40% | 58,20% | 82,10% | 72,00% | 69,20% | 73,00% | 65,70% | 61,60% | р=0,14657* р=0,40901** р=0,72976*** |
| Спасения | 64,90% | 54,20% | 43,20% | 78,20% | 70,20% | 59,60% | 73,90% | 64,40% | 51,00% | |
| Паллиа- тивная | 15,40% | 0,00% | 0,00% | 17,10% | 0,00% | 0,00% | Не подлежит оценке | р=0,00000* р=0,00000** | ||
Выживаемость: * – общая; ** – канцерспецифическая, *** – безрецидивная
Обсуждение
Цель любого метода лечения рака мочевого пузыря – дать пациенту высокий шанс долгосрочного выживания и оптимального качества жизни. Было показано, что РЦЭ увеличивает продолжительность жизни, связанной с ним заболеваемости и значимо влияет на качество жизни больных при впечатляющих результатах пятилетней общей и канцерспецифической выживаемости (5960% и 55-65% соответственно) [3-6,8,10,15,17-19]. В настоящем исследовании пятилетняя общая и канцерспецифическая выживаемости после первичной РЦЭ составили 60,4% и 72,0% соответственно, при этом безрецидивная долговременная выживаемость в течение 5 и 10 лет составила 65,7% и 61,6%, что указывает на необходимость выполнения первичной цистэктомии как первой линии лечения при четких показаниях.
Толчком для органосохраняющего лечения является обеспечение такого же шанса для лечения пациентов, что позволяет сохранить свой мочевой пузырь с поддержанием удовлетворительного качества жизни. Однако по данным различных исследований пятилетняя выживаемость после органосохраняющего лечения составляет от 22% до 45%. При этом пациент, которому предлагается органосохраняющее лечение, должен быть информирован о том, что приблизительно для одной трети пациентов не достигнут полного ответа, в целом, 20-40% пациентов подвергнутся цистэктомии спасения в какой-то момент из-за неполного ответа, местного рецидива или осложнений лечения [2-6,14-16]. Показания к ЦС могут возникать вплоть до 20 лет после проведения органосохраняющего лечения, что свидетельствует о целесообразности длительного тщательного мониторинга за больными РМП даже при наличии первоначально полного ответа от терапии [19,21]. По имеющимся литературным сведениям, хирургическое лечение в виде ЦС больных после органосохраняющего лечения, позволяет добиться удовлетворительных отдаленных результатов, сравнимых с радикальным оперативным вмешательством у пациентов, не получавших первичную терапию. Так пятилетняя канцерспецифическая выживаемость после ЦЭ составляет 48-56% [5,8,10,15,17-19,21-22]. Данное утверждение подтверждается и результатами данного исследования, где пятилетняя общая и канцерспецифическая выживаемости составили 54,2% и 70,2% соответственно. Кроме того, если сравнить долгосрочные результаты, то оказывается, что статистически достоверная разница в показателях выживаемости в группах первичной РЦЭ и ЦС отсутствует и составляет при десятилетнем наблюдении 69,2% и 59,6% (p=0,40901). Данные результаты убедительно свидетельствуют о возможности обеспечения путем РЦЭ долговременной высокой канцерспецифической выживаемости больных с РМП, и конкурируют с лучшими статистиками мира.
На практике это означает, что применяемый нами «максимально агрессивный» подход при прогрессии РМП (либо при отсутствии эффекта от проводимой консервативной терапии) на фоне органосохраняющего лечения с ранним выполнением спасительной РЦЭ оправдан в полной мере и обеспечивает онкологические результаты аналогичные таковым при первичной РЦЭ! Заблуждением является трактовка целесообразности РЦЭ только как крайней меры в клинически безысходной ситуации как вынужденного варианта лечения, как резервного метода оправданного только после использования всего известного альтернативного арсенала с негативным исходом, как запасной вариант «исправления» многочисленных предшествующих неудач в лечении РМП! Важно понимать, что продолжение органосохраняющего лечения на фоне отсутствия эффекта от проводимой терапии (при ранних рецидивах, рецидивах с прогрессией и пр.), запоздалое принятие решение о выполнении РЦЭ неминуемо ведут к развитию нерезектабельной и/ или метастатической фазы болезни, превращают РЦЭ в паллиативную и тем самым дискредитируют метод! Так, по данным ряда зарубежных исследований прогноз у пациентов данной категории очень плохой, со средним временем выживания три года и менее [3,12-13,15-16], что коррелирует с полученными данными, где трехлетняя общая и канцерспецифическая выживаемости составили 15,1% и 17,1% соответственно, до четырех лет после паллиативной цистэктомии не дожил не один пациент. Тем не менее, критически ошибочным является мнение об эффективности РЦЭ в запущенных ситуациях, в отчаянных попытках выполнить ЦЭ как «последний единственно возможный» вариант лечения! В такой ситуации ЦЭ возможна технически, но зачастую неэффективна и неоправдана с позиций радикализма. Однако пациенты, имеющие тяжелые и/или жизнеугрожающие осложнения (мочепузырно-кожные, -кишечные, -влагалищные свищи), выраженный болевой синдром, неконтролируемые фармакологически и эндоскопически мочепузырные кровотечения, кишечную непроходимость и другое должны быть подвергнуты паллиативной цистэктомии.
Выводы
Принципиально важно то, что при современном уровне развития уродеривации при наличии показаний РЦЭ должна рассматриваться не как терапия второй линии, а как первичный лечебный подход, как вариант выбора!
Строгое соблюдение долговременного мониторинга за пациентами с РМП должно способствовать своевременному решению вопроса о выполнении РЦЭ спасения. Цистэктомия спасения с уродеривацией технически выполнима и может быть рекомендована больным, не достигшимполного ответа после органосохраняющего лечения.
Высокие показатели долговременной выживаемости указывают на оправданность «максимально агрессивного» подхода при прогрессии РМП (либо при отсутствии эффекта от проводимой консервативной терапии) на фоне органосохраняющего лечения с раннимвыполнениемспасительной РЦЭ, обеспечивая онкологические результаты аналогичные таковым при первичной РЦЭ.
Исследование не имело спонсорской поддержки. Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Shipley WU, Kaufman DS, Tester WJ, Pilepich MV, Sandler HM, RadiaƟ on Therapy Oncology Group. Overview of bladder cancer trials in the RadiaƟ on Therapy Oncology Group. Cancer. 2003;97:2115–9. doi: 10.1002/ cncr.11282
2. James N, Hussain AS. Management of muscle invasive bladder cancer-BriƟ sh approaches to organ conservaƟ on. SeminRadiatOncol. 2005;15:19–27.
3. Yadav BS, Ghoshal S, Sharma SC. Outcome following radical cystectomy and bladder-preservaƟ on therapy in paƟ ents with invasive carcinoma of urinary bladder. Indian J Urol. 2008;24(1):48–53. doi: 10.4103/0970-1591.38603
4. Атдуев В.А., Строганов А.Б., Любарская Ю.А., Д.С. Ледяев, В.В. Шутов и др. Результаты создания артифициального мочевого пузыря после радикальной цистэктомии у больных раком мочевого пузыря. Саратовский научно-медицинский журнал. 2009;5(4):615-619.
5. Hautmann RE, Gschwend JE, de Petriconi RC, Kron M, Volkmer BG. Cystectomy for transiƟ onal cell carcinoma of the bladder: results of a surgery only series in the neobladder era. J Urol. 2006;176(2):486-92. doi: 10.1016/j. juro.2006.03.038
6. Novara G, De Marco V, Aragona M, Boscolo-Berto R, Cavalleri S et al. ComplicaƟ ons and mortality aŌ er radical cystectomy for bladder transiƟ onal cell cancer. J Urol. 2009;182(3):914-21. doi: 10.1016/j.juro.2009.05.032
7. Donat SM, Shabsigh A, Savage C, Cronin AM, Bochner BH et al. PotenƟ al impact of postoperaƟ ve early complicaƟ ons on the Ɵ ming of adjuvant chemotherapy in paƟ ents undergoing radical cystectomy: a high-volume terƟ ary cancer center experience. EurUrol. 2009;55(1):177-85. doi: 10.1016/j.eururo.2008.07.018
8. Перепечай В.А., Васильев О.Н., Спицын И.М., Коган М.И. Анализ достоверности факторов прогноза выживаемости после радикальной цистэктомии. Экспериментальная и клиническая урология. 2016;(1):7682.
9. Комяков Б.К., Гулиев Б.Г., Сергеев А.В., Фадеев В.А., Ульянов А.Ю. и др. Выживаемость больных раком мочевого пузыря после радикальной цистэктомии. Онкоурология. 2016;12(1):29-35. doi: 10.17650/17269776-2016-12-1-29-35
10. Stein JP, Lieskovsky G, Cote R, Groshen S, Feng AC et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. J ClinOncol. 2001;19(3):666-75. doi: 10.1200/JCO.2001.19.3.666
11. Gerharz EW, Mansson A, Hunt S, Skinner EC, Månsson W. Quality of life after cystectomy and urinary diversion: an evidence based analysis. J Urol. 2005;174(5):1729-36. doi: 10.1097/01.ju.0000176463.40530.05
12. Henningsohn L, Steven K, Kallestrup EB, Steineck G. Distressful symptoms and well-being aŌ er radical cystectomy and orthotopic bladder subsƟ tuƟ on compared with a matched control populaƟ on. J Urol. 2002;168(1):168-74.
13. Efstathiou JA, Spiegel DY, Shipley WU, Heney NM, Kaufman DS et al. Long-term outcomes of selecƟ ve bladder preservaƟ on by combined-modality therapy for invasive bladder cancer: the MGH experience. EurUrol. 2012;61(4):705-11. doi: 10.1016/j.eururo.2011.11.010
14. Rodel C, Weiss C, Sauer R. Organ preservaƟ on by combined modality treatment in bladder cancer: the European perspecƟ ve. SeminRadiatOncol. 2005;15(1):28-35.
15. Eswara JR, Efstathiou JA, Heney NM, Paly J, Kaufman DS et al. ComplicaƟ ons and Long-Term Results of Salvage Cystectomy AŌ er Failed Bladder Sparing Therapy for Muscle Invasive Bladder Cancer. J Urol. 2012;187(2):4638. doi: 10.1016/j.juro.2011.09.159
16. Madersbacher S, Hochreiter W, Burkhard F, Thalmann GN, Danuser H et al. Radical cystectomy for bladder cancer today—a homogeneous series without neoadjuvant therapy. J ClinOncol. 2003;21(4):690–6. doi: 10.1200/ JCO.2003.05.101
17. Ghoneim MA, Abdel-LaƟ f M, El-Mekresh M, Abol-Enein H, Mosbah A et al. Radical cystectomy for carcinoma of the bladder: 2,720 consecuƟ ve cases 5 years later. J Urol. 2008;180(1):121–7. doi: 10.1016/j.juro.2008.03.024
18. Shariat SF, Karakiewicz PI, PalapaƩ u GS, Lotan Y, Rogers CG et al. Outcomes of radical cystectomy for transiƟ onal cell carcinoma of the bladder: a contemporary series from the Bladder Cancer Research ConsorƟ um. J Urol. 2006;176(6Pt1):2414-22. doi: 10.1016/j. juro.2006.08.004
19. Yafi FA, Kassouf W. Radical cystectomy is the treatment of choice for invasive bladder cancer. Can UrolAssoc J. 2009;3(5): 409–412.
20. Zakaria AS, Santos F, Kassouf W, Tanguay S, Aprikian A. Salvage radical cystectomy aŌ er irradiaƟ on for muscle invasive bladder cancer in québec: a populaƟ on-based analysis of outcomes. The Journal of Urology. 2015;193(4):e699–e700. doi: 10.1016/j. juro.2015.02.2090
21. Матвеев В.Б., Волкова М.И., Фигурин К.М., Петерс М.В.. Спасительная цистэктомия у больных переходно-клеточным раком мочевого пузыря. Онкоурология. 2009;5(1):27-31. doi: 10.17650/1726-9776-2009-51-27-31
22. Абизгильдин А.Н., Фазлетдинов А.Д., Галимзянов В.З.. Спасительная цистэктомия в лечении рака мочевого пузыря с урологическими осложнениями. Онкоурология. 2009;5(3):16-18. doi: 10.17650/1726-9776-20095-3-16-18
23. Cooke PW, Dunn JA, LaƟ ef T, Bathers S, James ND, Wallace DM. Long-term risk of salvage cystectomy aŌ er radiotherapy for muscle-invasive bladder cancer. EurUrol. 2000;38(3,):279—86. doi: 20294.
Статья опубликована в журнале "Вестник урологии" №1 2017 стр. 12-19









Комментарии