А.А. Камалов, М.А. Хохлов, Н.И. Сорокин, Э.А. Галлямов, Д.А. Цигура
Московский государственный университет им. М. В. Ломоносова, Москва, Россия
Первично-множественные злокачественные новообразования (ПМЗНО или полинеоплазии) – одновременное или поочередное образование очагов злокачественного роста, которые развиваются самостоятельно и независимо друг от друга в пределах одного или нескольких органов. Общепринятые характеристики поли неоплазий:
- биологический потенциал может быть различным или одинаковым (злокачественные, доброкачественные или их комбинации);
- гистогенез может быть различным или одинаковым по тканевому происхождению;
- при морфологическом исследовании может отмечаться различное или одинаковое гистологическое строение;
- локализация может быть в одной системе (или парных органах), разных органах одной системы, либо в разных органах различных систем;
- возможность рецидива, местного распространения и/или метастаза исключена [1, 2].
Виды полинеоплазий:
- синхронные – выявленные одновременно (большинство авторов к синхронным относят новообразования, развившиеся одновременно или с интервалом не более 6 мес.). Они составляют 20–58,7%;
- метахронные – выявленные через временной интервал более 6 мес.
Понятия синхронного и метахронного рака являются условными [3–5].
Частота первичных злокачественных новообразований (ЗНО) в мире в зависимости от конкретной нозологии колеблется от 2,4 до 17% [6]. В среднем у 1 из 110 больных ЗНО развивается новая опухоль, независимая от первой.
У больных первично-множественным раком (ПМР) 2 опухоли диагностируются в 84–100% случаев, 3 опухоли – в 9,9–16%, 4 опухоли – в 1,62%, 5 опухолей – в 0,095% и 7 опухолей – в 0,095% [7, 8].
В исследовании M. Lv и соавт. среди про анализированных случаев ПМЗНО самыми частыми типами опухолей являлись аденокарциномы (49,3%), плоскоклеточный рак (26,1%), злокачественное поражение гемопоэтической и лимфоидной тканей (8,1%), переходно-клеточный рак (6,2%). Среди пациентов с ПМЗНО женщин было 39,1%, мужчин – 60,9%.
В группе синхронных опухолей наиболее часто встречались ЗНО пищеварительной (48,7%), урогенитальной (21,8%) и дыхательной (15,4%) систем [9].
A. Feller и соавт. продемонстрировали существенную вариацию риска развития второй опухоли в зависимости от типа пер вичной опухоли. Наибольшая вероятность второй опухоли наблюдалась при раке полости рта, глотки, гортани, пищевода, легкого и лимфоме Ходжкина [10].
R. Zheng и соавт. отметили, что чаще всего ПМЗНО связаны с колоректальным раком. Кроме этого, авторы сделали вывод, что пациенты с метахронным раком чаще имеют более благоприятный прогноз по сравнению с больными, у которых выявлены синхронные полинеоплазии [11]. Кроме колоректального рака, наиболее изучена среди ПМР маммогинекологическая группа ЗНО, при которых доказанным считается факт значимости наследственных онкологических синдромов. BRCA1/2-ассоциированные и dMMR- ассоциированные (синдром Линча) генетические мутации ведут к значительному увеличению частоты ПМР: рака молочной железы и женской половой системы. Активное изучение ПМР у обеих групп пациентов обусловлено высокой заболеваемостью.
В 2021 г. в России впервые было выявле но 580415 случаев ЗНО различных локали заций, у 58 217 пациентов зарегистрирова на первичная множественность опухолей, что составляет 10% [12, 13].
Из-за пандемии COVID-19 (прежде всего в 2020 г.) и ограничений, в том числе в сфере здравоохранения и, конечно, в онкологии, был отмечен некоторый спад онкологической заболеваемости. Это свя зано с меньшей обращаемостью здорового населения в медицинские учреждения для профилактических осмотров, а также с активным использованием диагностических служб на нужды пандемии (прежде всего лучевой диагностики и компьютерной томографии). Однако, если взглянуть на долю ПМР и заболеваемости за последние 6 лет, то налицо постоянный и неуклон ный рост: с 7,5% в 2016 г. до 10,03% в 2021 г.
К сожалению, онкоурологические заболевания в плане первичной множе ственности менее изучены. Кроме того в доступной литературе не так много инфор мации, представляющей статистику ПМР в онкоурологии.
В этом плане огромный интерес заслуживает работа В.И. Широкорада с соавт. (2023 г.), которые провели статистическую обработку 23299 пациентов онкоурологического профиля, наблюдавшихся в отделении с 1997 по 2021 гг. Так, из 23299 пациентов – у 1508 (6,47%) – ПМР. При этом с 2014 по 2021 гг. более 1/6 (15%) пациентов имели полинеоплазии. Из 1508 пациентов практически поровну, около 30% распределились между раком предстательной железы, почек и мочевого пузыря; осталь ные 10% пришлись на все остающиеся онкоурологические заболевания. Среди этих пациентов 28% составили женщины, а мужчины – 72%. 8,3% пациентов имели опухоли трех и более онкоурологических локализаций.
Таким образом, проблема полинеоплазий с каждым годом становится все более актуальной как в плане статистики, так и в отношении разработки подходов к диагностике и тактике лечения, особенно при синхронных ЗНО.
Рост числа пациентов с ПМР связан прежде всего с успехами онкологической службы. Появление целого спектра новых противоопухолевых препаратов, расширение показаний к хирургическим вмешательствам, широкое применение комбинированных и комплексных методов лечения, улучшение ранней диагностики – закономерно ведут во многих случаях к значительному росту радикально пролеченных больных и длительным ремиссиям. Соответственно, увеличивается число пациентов, перенесших онкологическое заболевание, которые имеют более высо кие риски возникновения нового ЗНО. И онкоурология не является исключением.
При синхронных полинеоплазиях требуется определиться с последовательностью лечения нозологий в зависимости от агрессивности течения и возможностей лечения. В лекарственной терапии метастатического и местно-распространенного ПМР возможно применение перекрестных схем лечения, которые будут воздейство вать на обе опухоли.

Рис. 1. Стоматологический шестигранник
(отвертка)
Однако, в нашем клиническом наблюдении, к сожалению, нерегулярное дис пансерное обследование или скрининг по месту жительства, а случайно проглочен ная стоматологическая отвертка во время имплантации зубов, явилась причиной обследования, в ходе которого выявлены первично-множественные злокачественные опухоли (ПМЗО) в виде синхронного рака почек и рака предстательной железы. Пациент К., 66 лет, в сентябре 2022 года, во время одного из сеансов протезиро вания зубов, ввиду нарушения целост ности страховочной нити, проглотил сто матологический шестигранник (отвертку) (рис. 1, рис. 2).

Рис. 2. Томограмма с инородным телом
в проекции правого фланка брюшной
полости
Несмотря на положительную динами ку «естественной дистальной миграции» инородного тела по желудочно-кишечного тракта, учитывая риски его стагнации в кишке с последующими возможными пролежнем и некрозом кишки, пациенту рекомендовано готовиться к оператив ному извлечению инструмента. В ходе обследования впервые в жизни сдана кровь на простатспецифический антиген (ПСА) и выявлено его повышение до 32 нг/мл. С этими данными пациент и обратился к нам в клинику.
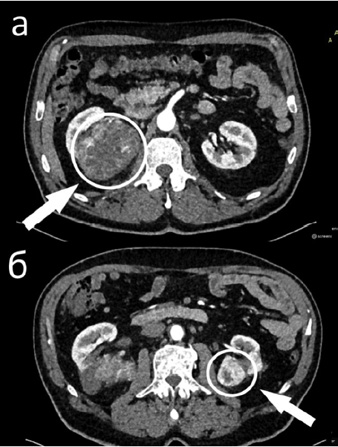
Рис. 3. МСКТ органов брюшной полости:
А – опухоль правой почки; Б – опухоль левой
почки
Учитывая подозрение на рак предстательной железы, в рамках дообследования выполнены магнитно-резонансная томография (МРТ) органов малого таза и мультиспиральная компъютерная томография органов брюшной полости и мочевой системы с контрастным усилением. Результатом этого стало выявление синхронного опухолевого поражения почек (рис. 3а, 3б), тромбоза глубоких вен таза слева (неопухолевой природы) (рис. 4), а также очагового поражения предстательной железы с вероятным экстракапсулярным распространением (рис 5а), поражением семенных пузырьков (рис. 5б) и тазовых лимфоузлов слева (рис. 5в).
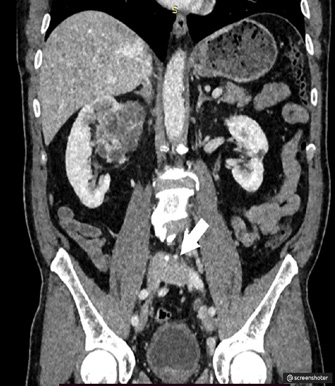
Рис. 4. МСКТ органов брюшной полости.
Тромбоз глубоких вен таза слева.
В ноябре 2022 г. выполнена пункционная биопсия предстательной железы, веримин, кровопотеря составила около 150 мл. Послеоперационный период протекал без особенностей, пациент был активизирован на 1 сутки после операции, на 2-е сутки удалены дренажи, выписан в удовлетворительном состоянии на 4-е сутки.
Гистологически опухоли были представ лены светлоклеточным ПКР: справа – G1 pT1bR0 Pn0 L0 V0, слева – G1 pT3aR0 Pn0 L0 V0.
Далее, через 6 месяцев, проведено контрольное обследование, которое не показало признаков рецидива опухолей почек, а также показало значительный регресс онкологического процесса в пред стательной железе (рис. 6).
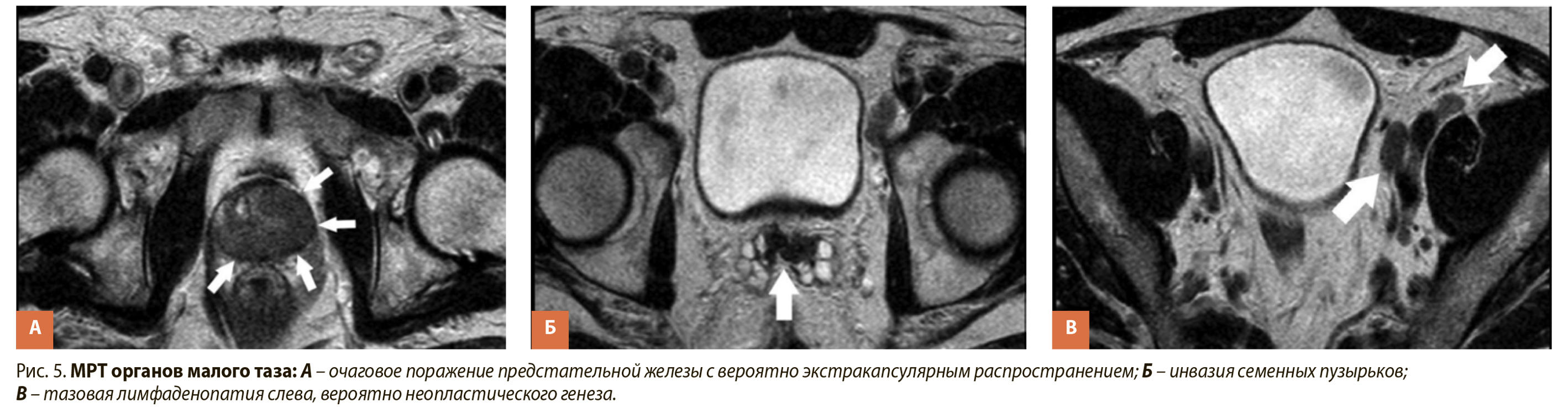
Рис. 5. МРТ органов малого таза: А – очаговое поражение предстательной железы с вероятно экстракапсулярным распространением; Б – инвазия семенных пузырьков;
В – тазовая лимфаденопатия слева, вероятно неопластического генеза.
30.06.2023 г., исходя из результатов нео адъювантной андрогенной депривационной терапии: снижение ПСА с 32 до 0,86 нг/мл, рестрикция зон (по данным МРТ) очаговых изменений в ПЖ, а самое значи мое – выраженная рестрикция наружных подвздошных лимфоузлов (с 60 мм до 21 мм), крайне негативный настрой пациента на проведение дистанционной лучевой терапии – выполнена радикальная лапа- роскопическая простатэктомия с тазовой лимфаденэктомией.
Морфологически – аденокарцинома ПЖ: pT3bpN1 (4/26) R0 Pn1 L1 V0.
В процессе послеоперационного наблюдения отмечалась следующая динамика ПСА, представленная в табл. 1.

12.2023 г. выполнена позитронно-эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ-КТ) с радиофармпрепаратом (РФП), способным выявить в организме простат-специфический мембранный антиген (ПСМА). По данным этого исследования зона ложа удаленной железы, регионарных лимфоузлов – без признаков патологической гиперфиксации РФП, область почек также без патологических изменений, костно-деструктивных изменений соответствующих вторичному поражению – не выявлено. Получены данные о наличии F18-ПСМА-1007 активной опухолевой ткани во внутригрудных и единичных правых надключичных лимфоузлах.
По решению консилиума с участием онкологов, проведенного после получения результатов ПЭТ-КТ начата терапия диферелином в дозировке 3,75 мг 1 раз в месяц, энзалутамидом в дозировке 160 мг 1 раз в сутки ежедневно. На фоне проводимой терапии отмечается снижение уровня ПСА в динамике – табл. 2.
Таким образом, исходя из данных послеоперационного наблюдения становится очевидно, что рост ПСА явился предиктором не местного рецидива, а появления вторичных очагов во внутригрудных и единичных правых надключичных лимфоузлах.
Таким образом, выполнение исходно лучевой терапии (ЛТ) по радикальной программе (а в последующем – в режиме адъювантной или спасительной ЛТ) не привело бы к радикальному излечению пациента, т.к. зона реализации вторичных очагов оказалась далека от облучаемого поля.
В заключение хотелось бы еще раз акцентировать внимание не на возможных вариантах лечения того или иного онкологического заболевания, а на том, что в данном конкретном наблюдении главной причиной выявления такого редкого сочетания синхронных урологических онкологических заболеваний явилась случайно (или совсем не случайно) проглоченная отвертка, а нерегулярное амбулаторно- диспансерное обследование пациента.
В заключение хотелось бы еще раз акцентировать внимание не на возможных вариантах лечения того или иного онко- логического заболевания, а на том, что в данном конкретном наблюдении главной причиной выявления такого редкого соче- тания синхронных урологических онколо- гических заболеваний явилась случайно (или совсем не случайно) проглоченная отвертка, а нерегулярное амбулаторно-диспансерное обследование пациента.
ЛИТЕРАТУРА
- Онкология. Национальное руководство. Под ред. В.И. Чиссова, М.И. Давыдова. М.: ГЭОТАР-Медиа, 2008. С. 537–539.
- A review of the definition for multiple primary cancers in the UnitedStates. Ed.: H.L. Howe. Workshop proceedings from December4–6, 2002, in Princeton, New Jersey. Springfield (IL): North American Association of Central Cancer Registries, May 2003. 40 p.
- Волченко Н.Н. Первично-множественный рак молочной железы. Российский онкологический журнал. 1999;(2):9–11.
- Соркин В.М., Ефетов В.М., Телькиева Г.Н. Частота выявления и критерии первично множественности ЗНО у больных раком молочной железы. Клиническая хирургия. 1998;(5):24–26.
- Crocetti E., Arniani S., BuiattiE. Synchronous and metachronousdiagnosis of multiple primary cancers. Tumori. 1998;84(1):9–13.
- Copur M.S., Manapuram S. Multiple primary tumors over a lifetime. Oncology (Williston Park). 2019;33(7):629384.
- Важенин А.В. Особенности иммунитета и гормональной секреции при первичной множественности ЗНО. Дис. ... канд. мед. наук. Томск, 1985.
- Сельчук В.Ю. Первично-множественные злокачественные опухоли (клиника, лечение и закономерности развития). Дис. ... д-ра мед. наук. М., 1994.
- Lv M., Zhang X., Shen Y. et al. Clinical analysis and prognosisof synchronous and metachronous multiple primary malignant tumors. Medicine (Baltimore). 2017;96(17):e6799.
- Feller A., Matthes K.L., Bordoni A. et al. NICER Working Group. The relative risk of second primary cancers in Switzerland: a population-based retrospective cohort study. BMC Cancer. 2020;20(1):51.
- Zheng R., Li H., Ye Y. et al. Clinic pathological features and prognostic analysis of 77 patients with multiple primary cancers. J BUON. 2020;25(4):2110–16.
- Состояние онкологической помощи населению России в 2021 году / Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России. 2022. 239 с.
- Злокачественные новообразования в России в 2020 году (заболеваемость и смертность) / Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021. 252 с.
- Широкорад В.И., Лупашко Д.Г., Доронин Л.В. К вопросу о месте первично-множественного рака в онкоурологии. Онкоурология. 2023;19(2):127–132.









Комментарии