Демешко П.Д., Красный С.А.
Государственное учреждение «Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова», Минск, Беларусь
Эл. почта: pdemeshko@icloud.com, sergeykrasny@tut.by
Введение. В настоящее время в Республике Беларусь наблюдается экспоненциальный рост заболеваемости раком предстательной железы (РПЖ) и данная нозология находится на первом месте по темпам прироста [1]. На фоне общего снижения смертности от злокачественных новообразований в республике рак простаты остается одной из немногих опухолей, при которых смертность растет.
Результаты лечения пациентов, страдающих РПЖ, определяются распространенностью опухолевого процесса на момент установки диагноза, а также наличием других факторов. Разработаны ряд классификаций, позволяющих разделять пациентов на группы с целью определения необходимого объема лечения и прогноза. В частности, выделение групп высокого и крайне высокого риска необходимо для идентификации популяции пациентов, страдающих «летальным» РПЖ, при котором существует необходимость применения наиболее активной лечебной тактики.
Одной из наиболее ранних и часто применяемых прогностических классификаций является стратификация, разработанная в 1998 году D’Amico A. et al. [2]. Авторы исследования показали, что выживаемость до биохимического прогрессирования у пациентов с высоким риском оказалась статистически значимо ниже при использовании внутритканевой брахитерапии (БТ) по сравнению с дистанционной лучевой терапией (ДЛТ) и радикальной простатэктомией. Другая распространенная стратификация используется в стандартах исследовательской группы National Comprehensive Cancer Network (NCCN) [3]. В отличие от предыдущей, NCCN отдельно выделяет группу крайне высокого риска, к которой относят пациентов с клинически определяемой инвазией опухоли в семенные пузырьки или прилежащие органы (cT3b-4), а также при наличии трех факторов высокого риска.
Относительная частота встречаемости пациентов, страдающих раком предстательной железы с неблагоприятным прогнозом (с высоким и крайне высоким риском) в разных популяциях варьирует в широких пределах. В частности, по данным Grossfeld G. D. et al. она составляет от 20 до 35% [4]. Согласно другим источникам, пациенты с высоким риском составляют 15-40% от всех вновь выявленных случаев РПЖ [5, 6].
В настоящее время существуют различные мнения относительно выбора оптимального метода лечения у пациентов с высоким риском прогрессирования, которое может включать радикальную простатэктомию (РПЭ), лучевую терапию (ЛТ), гормональную и химиотерапию, а также различные сочетания перечисленных методов специального лечения [7]. Однако в доступной литературе нет общепринятого консенсуса относительно предпочтительной тактики лечения, поскольку на сегодняшний день большие проспективные рандомизированные исследования по сравнению эффективности РПЭ и ЛТ не проводились. Целью настоящего исследования явилась оценка отдаленных результатов дистанционной ЛТ у пациентов с впервые выявленным РПЖ в зависимости от групп онкологического риска и различных прогностических факторов.
Материалы и методы. Материалом для исследования послужили данные о 178 пациентах, которым в период с 2005 по 2008 г.г. включительно в РНПЦ ОМР им. Н.Н. Александрова проведена ЛТ по радикальной программе по поводу аденокарциномы предстательной железы
Риск прогрессирования оценивался как низкий согласно критериям NCCN [3]: сТ1с-2а, сумма баллов Глисона ≤ 6 и ПСА < 10 нг/мл. К группе промежуточного риска были отнесены пациенты со следующими одним или двумя факторами: сТ2b-c или сумма баллов Глисона 7 или ПСА 10-20 нг/мл. Высоким риском считали случаи с клинической стадией сТ3а, суммой баллов Глисона 810 или ПСА > 20 нг/мл. Также к данной группе были отнесены пациенты с тремя факторами промежуточного прогноза. Крайне высокий риск характеризовался наличием инвазии семенных пузырьков или окружающих органов (сT3b4) или 3 факторов высокого риска.
В исследование не включались пациенты с клинически выявляемыми метастазами в регионарных лимфатических узлах по данным интраскопических методов исследования (компьютерной или магнитно-резонансной томографии). Кроме этого, всем пациентам для исключения метастатического поражения костных структур, лимфатических узлов забрюшинного пространства и/или органов брюшной полости выполнялась остеосцинтиграфия с 99m технецием и ультразвуковое исследование органов брюшной полости.
Всем пациентам облучение проводилось в условиях 3D планирования на линейном ускорителе электронов Clinac 2300/CD (Varian Medical Systems, США). Объем облучения включал предстательную железу и семенные пузырьки, а также зоны регионарных лимфоузлов. Разовая очаговая доза (РОД) составила 2 Гр, 5 фракций в неделю. Медиана суммарной очаговой дозы (СОД), подведенной на предстательную железу была равна 74 Гр, на регионарный лимфатический аппарат – 44 Гр. Управление процессом ЛТ по изображениям не применялось. Общая характеристика пациентов представлена в таблице 1.
Таблица 1 – Общая характеристика пациентов
| Показатель | Значение |
| Число пациентов | 178 |
| Медиана возраста (разброс значений), лет | 70,7 (53-82) |
| Степень местного распространения опухоли: сТ1-2 сТ3-4 |
93 (52,2%) 8 5 (47,8%) |
| Медиана ПСА (разброс значений), нг/мл | 26,0 (2,8-370,0) |
| Сумма Глисона: ≤ 6 ≥ 7 |
72 (40,4%) 106 (59,6%) |
| Наличие адъювантного лечения: Лечение не проводилось Лечение проводилось |
84 (47,2%) 94 (52,8%) |
| Группа риска: Низкий Промежуточный Высокий Крайне высокий |
30 (16,9%) 38 (21,3%) 64 (36,0%) 46 (25,8%) |
Адъювантное лечение в виде хирургической кастрации проведено 52,8% пациентам (группа неблагоприятного прогноза).
В качестве первичной конечной точки исследования выступала раковоспецифическая выживаемость (РСВ), в качестве события принимали факт смерти от причины, связанной с РПЖ. Наблюдение считалось завершенным, если пациент умер до даты завершения срока наблюдения. Наблюдение считалось цензурируемым, если к моменту завершения наблюдения пациент был жив, выбыл из-под наблюдения, умер от причин, не связанных с основным заболеванием или если получить достоверную информацию о дальнейшей судьбе не представлялось возможным. За начало наблюдения принималась дата установки диагноза, датой завершения исследования считали 1 августа 2014 года. Для оценки выживаемости использовался подход Каплан-Мейера. Рассчитывались точечные и интервальные оценки РСВ в различные контрольные сроки. Статистический анализ выполнен с использованием программы SPSS v.17.
Результаты. Медиана времени наблюдения при анализе РСВ в общей когорте пациентов составила 78,2 месяца (от 5,0 до 121,5 месяца). За указанный период времени от причин, связанных с РПЖ умерло 40 пациентов. Медиана выживаемости достигнута не была, 5-летняя и 10-летняя РСВ в общей когорте пациентов составила соответственно 81,3±0,028% и 67,4±0,039% (рисунок 1).
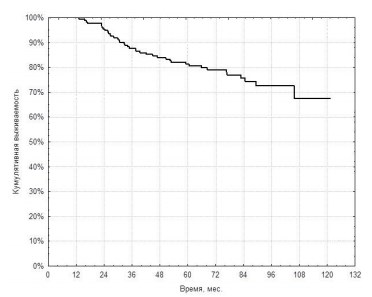
Рисунок 1 – РСВ в общей когорте пациентов
При анализе РСВ в зависимости от группы риска получены статистически значимые различия (рисунок 2, таблица 2).
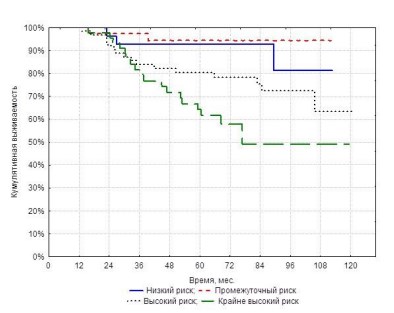
Рисунок 2 – РСВ в зависимости от групп риска (р = 0,001)
Таблица 2 – РСВ в зависимости от группы риска
| Группа риска | Медиана РСВ, мес. | РСВ, %±SE | ||
| 3-х летняя | 5-ти летняя | 9-ти летняя | ||
| Низкий | Не достигнута | 92,3±0,05 | 92,3±0,05 | 81,3±0,1 |
| Промежуточный | Не достигнута | 97,4±0,03 | 97,4±0,03 | 94,3±0,04 |
| Высокий | Не достигнута | 83,9±0,05 | 80,4±0,05 | 63,4±0,1 |
| Крайне высокий | 76,8 | 81,5±0,06 | 64,3±0,07 | 49,1±0,09 |
При проведении попарного сравнения статистически значимой разницы в показателе РСВ между группами низкого и промежуточного риска не получено (p log-rank = 0,5). В группах высокого и крайне высокого риска разница носила пограничный характер (p log-rank = 0,05). Разница в выживаемости между группами низкого и промежуточного риска и высокого и крайне высокого риска продемонстрировала статистическую значимость (p log-rank < 0,05).
Отдельно были проанализированы отдаленные результаты лечения (РСВ) в зависимости от суммы Глисона, уровня ПСА, клинической стадии, а также возраста пациентов (таблица 3).
Таблица 3 – Показатели РСВ в зависимости от различных прогностических факторов
| Показатель | Медиана РСВ, мес | РСВ, %±SE | ||
| 5-ти летняя | 9-ти летняя | р | ||
| Сумма Глисона: ≤ 6 7 ≥ 8 |
Не достигнута Не достигнута 49,4 |
87,5±0,03 66,1±0,09 54,5±0,1 |
|
< 0,001 |
Уровень ПСА, нг/мл: < 10,0 10,0-20, 0 > 20,0 |
Не достигнута Не достигнута Не достигнута |
88,7±0,03 93,0±0,03 67,5±0,06 |
59,1±0,2 87,2±0,05 58,2±0,07 |
0,003 |
| Клиническая стадия: сТ1с-2с cT3a cT3b-4 |
Не достигнута Не достигнута 76,8 |
90,9±0,03 78,4±0,06 63,7±0,07 |
81,9±0,06 62,9±0,1 48,1±0,09 |
0,001 |
| Возраст, лет: Моложе 70 70 и старше |
Не достигнута Не достигнута |
71,8±0,06 87,3±0,04 |
61,6±0,07 70,2±0,09 |
0,02 |
Как следует из представленных данных, все вышеуказанные факторы статистически значимо коррелировали с РСВ пациентов (рисунок 3).
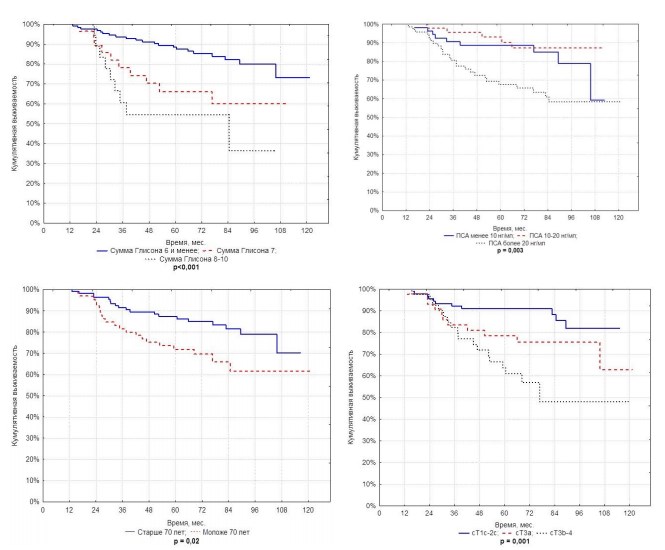
Рисунок 3 – РСВ в зависимости от суммы Глисона, уровня ПСА, клинической стадии и возраста
Обсуждение. На сегодняшний день существуют несколько классификаций, позволяющих разделять пациентов на группы низкого, промежуточного и высокого риска прогрессирования заболевания и смерти от РПЖ с целью определения прогноза и необходимого объема лечения [2, 3]. Наиболее часто применяемыми подходами к лечению данного заболевания у пациентов с низким и промежуточным онкологическим риском является радикальная простатэктомия, ЛТ и активное наблюдение. У пациентов с высоким онкологическим риском и/или местно-распространенным процессом наиболее часто используется ЛТ в сочетании с ГТ. В настоящем исследовании изучены отдаленные результаты ЛТ у пациентов с различным риском прогрессирования, который продемонстрировал статистически значимое влияние на выживаемость.
Следует отметить, что большинство подобных обсервационных исследований по изучению отдаленных результатов ЛТ у пациентов, страдающих РПЖ, в качестве конечной точки рассматривают факт развития биохимического рецидива заболевания [2, 8]. Однако, как показало исследование Pound C.R. et al. [9], медиана времени от развития биохимического рецидива после радикального лечения до смерти пациента составляет около 13 лет и не у всех пациентов с повышением уровня ПСА развивается клиническое прогрессирование заболевания. Касательно пациентов с благоприятным и промежуточным прогнозом это может означать, что существует достаточно высокая вероятность (принимая во внимание возраст и сопутствующую патологию) умереть от причины, не связанной с основным заболеванием. Поэтому смерть пациента, причиной которой является прогрессирование РПЖ – раково-специфическая выживаемость – является наиболее адекватной конечной точкой подобных исследований [10].
Согласно полученным нами данным, применение ЛТ у пациентов с благоприятным прогнозом (низким и промежуточным риском) продемонстрировало удовлетворительные отдаленные результаты: 9-летняя РСВ составила 81,3±0,1% и 94,3±0,04% соответственно. В связи с вышеуказанным, при удовлетворительных показателях выживаемости на первый план могут выступать функциональные результаты лечения, качество жизни пациентов, а также затраты на проведение самой терапии. В данном аспекте перспективным является применение брахитерапии высокой мощностью дозы в качестве монотерапии при низком риске или ее комбинации с дистанционной ЛТ у пациентов с промежуточным прогнозом. Использование данной техники позволяет провести точное подведение высокой дозы излучения к предстательной железе с минимальным воздействием на окружающие ткани, а также значительно сократить сроки лечения [11].
Раково-специфическая выживаемость пациентов с неблагоприятным прогнозом (высоким и крайне высоким риском прогрессирования) оказалась статистически значимо хуже относительно низкого и промежуточного риска и составила 63,4±0,1% и 49,1±0,09% соответственно. Возможной причиной относительно низких показателей являлось использование стандартных суммарных доз излучения (72-74 Гр), что в указанной подгруппе пациентов может быть недостаточно. Согласно ряду проведенных в настоящее время исследований, использование более высоких доз излучения (78-86 Гр) по сравнению со стандартными (66-74 Гр) приводит к значительному улучшению показателей безрецидивной выживаемости у пациентов с высоким риском прогрессирования. В частности, Heemsbergen W.D. et al [12] представили отдаленные результаты проспективного рандомизированного исследования по сравнению эффективности дистанционной ЛТ в стандартной (68 Гр) и эскалированной (78 Гр) СОД у пациентов с промежуточным и высоким онкологическим риском. Согласно полученным данным, в основной группе было отмечено статистически значимое повышение показателя 10-летней выживаемости без биохимического прогрессирования по сравнению со стандартной ЛТ, который составил 49% и 43% соответственно. Сходные результаты получены в исследовании Dearnaley D.P. et al. [13], согласно которому 10-летняя безрецидивная (ПСА) выживаемость составила 43% в контрольной группе и 55% в группе эскалированной ЛТ (относительный риск = 0, 69, p = 0,0003).
В изучаемой нами популяции пациентов проведение ЛТ в более молодом возрасте также было ассоциировано со статистически значимо худшими отдаленными результатами: 9-летние показатели РСВ у пациентов моложе и старше 70 лет составили соответственно 61,6±0,07% и 70,2±0,09% (р = 0,02). Согласно данным Zelefsky M.J. et al., возраст также являлся независимым прогностическим фактором при оценке долгосрочных результатов ЛТ у пациентов с промежуточным и высоким риском (уровень 7-летней смертности от РПЖ составил 19%) [14].
Заключение. Выбор метода лечения у пациентов, страдающих РПЖ, остается сложной клинической проблемой современной онкологии. Совершенствующиеся методики проведения ЛТ, включающие брахитерапию, ЛТ с модулированной интенсивностью (IMRT) и модуляцией интенсивности по объему (VMAT), ЛТ с управлением по изображениям (IGRT) позволяют провести безопасную эскалацию дозы и ее гипофракционирование. Указанный подход потенциально способен улучшить отдаленные результаты лечения пациентов, страдающих РПЖ в высоким риском прогрессирования, что, однако, требует подтверждения в проспективных исследованиях.
Литература
1. Океанов, А.Е. Статистика онкологических заболеваний в Республике Беларусь (2003-2012) / А.Е. Океанов, П.И. Моисеев, Л.Ф. Левин ; Под редакцией О.Г. Суконко. – Минск : РНПЦ ОМР им. Н.Н. Александрова, 2013. – 373 с.
2. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. / A.V.D’Amico R.Whittington, S.B. Malkowicz et al. // JAMA – 1998. – Vol. 280. – P. 969-974.
3. Prostate cancer, version 2.2014 / J.L. Mohler, P.W. Kantoff, A.J. Armstrong et al. // J. Natl. Compr. Canc. Netw. – 2014. – Vol. 12 (5). – P. 686-718.
4. Predicting recurrence after radical prostatectomy for patients with high risk prostate cancer / G.D. Grossfeld, D.M. Latini, D.P. Lubeck et al. // J Urol. – 2003. – Vol. 169. – P.157–163.
5. Secondary therapy, metastatic progression, and cancer-specific mortality in men with clinically high-risk prostate cancer treated with radical prostatectomy / O. Yossepowitch, S.E. Eggener, A.M. Serio et al. // Eur. Urol. – 2008. – Vol. 53. – P. 950–959.
6. Cooperberg, M.R. Time trends and local variation in primary treatment of localized prostate cancer / M.R. Cooperberg, J.M. Broering, P.R. Carroll // J Clin. Oncol. – 2010. – Vol. 28. – P.1117–1123.
7. Multimodal treatment for high-risk prostate cancer with high-dose intensitymodulated radiation therapy preceded or not by radical prostatectomy, concurrent intensified-dose docetaxel and long-term androgen deprivation therapy: results of a prospective phase II trial / A. Guttilla, R. Bortolus, G. Giannarini et al. // Radiation Oncology – 2014. – Vol. 9. – P. 24-34.
8. Comparative analysis of prostate-specific antigen free survival outcomes for patients with low, intermediate and high risk prostate cancer treatment by radical therapy. Results from the Prostate Cancer Results Study Group / P. Grimm, I. Billiet, D. Bostwick et al. // BJU Int. – 2012. – Vol. 109 (Suppl. 1). – P. 22-29.
9. Natural history of progression after PSA elevation following radical prostatectomy / C.R. Pound, A.W. Partin, M.A. Eisenberger et al. // J.A.M.A. – 1999. – Vol. 281 (17). – P. 1591–1597.
10. Comparative effectiveness of radical prostatectomy and radiotherapy in prostate cancer: observational study of mortality outcomes / P. Sooriakumaran, T. Nyberg, O. Akre et al. // B.M.J. – 2014. – Vol. 26. – P. 348.
11. High-dose-rate brachytherapy as monotherapy for prostate cancer: technique, rationale and perspective / Y. Yoshioka, O. Suzuki, Y. Otani et al.// J. Contemp. Brachytherapy. – 2014. – Vol. 6. – P. 91-98.
12. Long-term results of the Dutch randomized prostate cancer trial: Impact of dose-escalation on local, biochemical, clinical failure, and survival / W.D. Heemsbergena, A. Al-Mamganib, A. Slotc et al. // Lebesque Radiotherapy and Oncology. – 2014. – Vol. 110. – P. 104–109.
13. Escalated dose versus control-dose conformal radiotherapy for prostate cancer: long-term results from the MRC RT01 randomised controlled trial / D.P. Dearnaley, G. Jovic, I. Syndikus et al. // Lancet Oncol. – 2014. – Vol. 15. – P. 464–473.
14. Long-term results of conformal radiotherapy for prostate cancer: impact of dose escalation on biochemical tumor control and distant metastases-free survival outcomes / M.J. Zelefsky, Y. Yamada, Z. Fuks et al. // Int. J. Radiat. Oncol. Biol. Phys. – 2008. – Vol. 71. – P. 1028-1033.
Статья опубликована в журнале "Вестник урологии". Номер №3/2015 стр. 42-53









Комментарии