А.В. Маслюков, А.Ю. Цуканов, С.И. Мозговой, В.Н. Теленков, Е.В. Лубягина
ФГБОУ ВО «Омский государственный медицинский университет Министерства здравоохранения Российской Федерации», Омск, Россия
Введение
Бесплодие является глобальной проблемой и занимает одно из ведущих мест в ряду причин снижения рождаемости. Оно затрагивает около 15% супружеских пар, что составляет примерно 48,5 млн. пар во всем мире, при этом мужской фактор является причиной бесплодия в 50% случаев – это определяет высокую актуальность для изучения его развития и способов лечения [1-3].
Одной из частых причин нарушения сперматогенеза является варикоцеле (ВЦ) [4–6]. Доля первичного бесплодия с имеющимся ВЦ достигает 35%, а с вторичным бесплодием – 70–81% мужчин [7]. Несмотря на прогресс в изучении патофизиологических аспектов ВЦ, остаются трудности понимания связи заболевания с риском и частотой развития бесплодия [8]. Это определяет актуальность дальнейшего изучения и создания экспериментальных моделей данного заболевания на животных, с целью изучения механизма его возникновения, патофизиологию ассоциированных с ним состояний, а также решения вопросов профилактики и лечения.
Цель исследования: изучить функцию семенников при ВЦ в хроническом эксперименте на животных.
Материалы и методы
В хроническом эксперименте было задействовано 25 половозрелых кроликов-самцов породы Серый великан (Oryctolagus cuniculus) в возрасте от 4,5 до 5,5 месяцев, средней массой 3 кг, к вязке не допускались. Эксперимент проведен в соответствии с «Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей» (Страсбург, 1986).
На протяжении всего эксперимента препарат в форме порошка (в саше) вводили внутрижелудочно в дозе по L-карнитину 26,15 мг/сут с пересчетом на массу кролика [9, 10]. Все животные были рандомизированы на группы:
- Группа I (N) – интактные животные. Нормальная анатомия семенника и спермограмма (n=5).
- Группа II ГК 1 (группа контроля 1) – животные с моделью ВЦ без лекарственного воздействия, вывод через месяц после формирования ВЦ, (n=5).
- Группа III ОГ1 (основная группа 1) – животные с моделью ВЦ и лекарственным воздействием в течение 1го месяца с момента формирования ВЦ (n=5).
- Группа IV ГК2 (группа контроля 2) – животные с моделью ВЦ без лекарственного воздействия, вывод через 2 месяца после формирования ВЦ (n=5).
- Группа V ОГ2 (основная группа 2) – животные с моделью ВЦ и отсроченным лекарственным воздействием в течение 2-го месяца с момента формирования ВЦ (n=5).
Модель ВЦ создана путем формирования флебогипертензии в бассейне левой почечной и гонадной вен путем частичного (1/2–2/3) лигирования левой почечной вены с дополненным введением раствора прогестерона 2,5% (15 мг/кг) в/м в течение 7 суток, начиная с первых предоперационных суток. Модель формировалась к исходу 7-х суток с момента операции. Критерием создания модели ВЦ считали регистрацию при дуплексном ангиосканировании увеличения диаметра вен семенного канатика в 2 раза от исходного / сам факт их визуализации / регистрация рефлюксной волны крови длительностью более 1 сек. Последний провоцировали мануальной компрессией брюшной полости [10].
Семенную жидкость исследовали при помощи световой микроскопии с оценкой количества и качества сперматозоидов.
Изъятые семенники подвергали морфологическому исследованию с окрашиванием по Маллори и гематоксилином и эозином.
Животные выведены из эксперимента через 1 месяц (ОГ1 и ГК1), 2 месяца (ОГ2 и ГК2).
Статистический анализ проводили при помощи стандартного пакета Statistica 12.0 с применением непараметрических методов. Данные представлены в виде медианы.
Результаты
При ультразвуковом ангиосканировании у здоровых животных лишь у одного из группы К2 была зафиксирована семенная вена диметром 0,6 мм. У остальных – не визуализированы. Рефлюкса так же не было. Объем семенника в среднем составил 0,77 см3.
Спустя 14 суток от создания модели, у всех животных – визуализированы семенные вены (до 1,8 мм, без различий между группами) и регистрировали рефлюкс. Средний диаметр семенных вен (до 2,1 мм) был на 30-е сутки. На 60-е сутки – до 2 мм.
Отмечено прогрессирующее уменьшение объема левого семенника в течение 60 суток в среднем на 0,8 см3 (с 0,77 см3 до 0,69 см3) (p>0,05 между всеми группами).
При анализе спермограмм в ОГ1 и ОГ2 отмечена в разной степени положительная динамика (табл. 1).
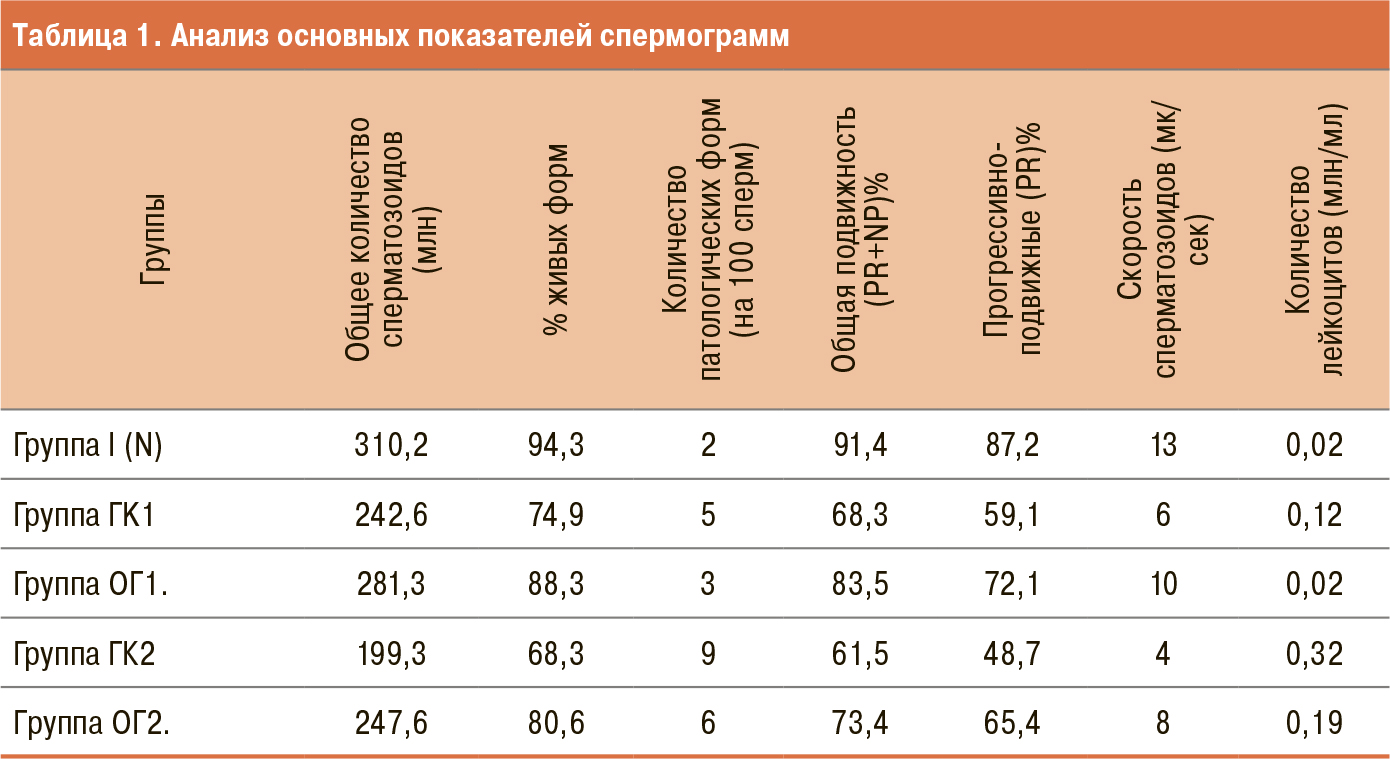
Сравнительный анализ спермограмм групп ГK1 и ОГ1, ГК2 и ОГ2 (животные с моделью ВЦ) продемонстрировал наличие различий от нормы по всем оцениваемым показателям.
В группе I (N) исходные характеристики общих показателей спермограммы были достоверно выше, чем в экспериментальных группах (p<0,05–0,01). Общее количество сперматозоидов – 310,2 млн (N) против 242,6 млн (К1), 281,3 млн (ОГ1), 199,3млн (К2) и 247,6 млн (ОГ2). В группе N из общ. количества 310,2 млн (94,3% живых форм, PR+NP – 91,4%, PR – 87,2% и скоростью сперматозоидов – 13 мк/сек).
Между группами ГK1 и ОГ1 отмечена статистически значимая разница в результатах спермограммы с преобладанием в лучшую сторону в группе ОГ1: общее количество сперматозоидов составило 281,3 млн, (88,3% живых форм, PR+NP – 83,5%, PR – 72,1% и скоростью сперматозоидов 10 мк/сек) (p<0,05).
Показатели спермограммы в группе ГК2 были значимо ниже, чем в группе ОГ2 с соотношением: общее колличество сперматозоидов – 199,3/247,6млн., (живые формы – 68,3/80,6%, PR+NP – 61,5/73,4%, PR – 48,7/65,4%, скорость сперматозоидов – 4/8 мк/сек) (p<0,01).
Таким образом, основных группах (получавшие препарат на основе L-карнитина), имели лучшие показатели сперматогенеза, в отличие от контрольных групп.
Для оценки морфологических изменений сперматогенного эпителия использовали бальную оценку биоптата яичка по Johnsen S.G. (1970 г.) в модификации (2014 г.) [11]. Выявлены следующие изменения:
- Группа I (N) – морфология представлена однородной картиной с сохранным сперматогенезом, 10 баллов.
- Группа ГK1 – морфология представлена неоднородной гистологической картиной с заметной и значительной редукцией сперматогенеза, 6-7 баллов.
- Группа ОГ1 – морфология представлена неооднородной картиной с незначительной редукцией сперматогенеза, 8-9 баллов;
- Группа ГК2 – неоднородной гистологической картиной с выраженной редукцией сперматогенеза, 5-7 баллов.
- Группа ОГ2 – неоднородная картина с заметной редукцией сперматогенеза, 7–8 баллов;
В целом взаимоотношения результатов морфологического раздела исследования выявила динамику, аналогичную изменениям в спермограммах.
Заключение
В проведенном эксперименте смоделированное ВЦ оказало негативный эффект на функцию семенника. Антиоксидант L-карнитин оказал положительное протективное действие на ткань гонады и, как следствие, на качество эякулята. Этот эффект оказался выше при более раннем введении препарата от момента формирования модели.
ЛИТЕРАТУРА/REFERENCES
- Лебедев Г.С., Голубев Н.А., Шадеркин И.А., Шадеркина В.А., Аполихин О.И., Сивков А.В., Комарова В.А. Мужское бесплодие в Российской Федерации: статистические данные за 2000–2018 годы. Экспериментальная и клиническая урология 2019; (4) 4-12.
- Андреева М.В., Хаят С.Ш., Шилейко Л.В., Черных В.Б., Штаут М.И., Остроумова Т.В., Сорокина Т.М., Курило Л.Ф. Количественный кариологический анализ незрелых половых из эякулята как часть протокола обследования мужчин с бесплодием в браке. Андрология и генитальная хирургия. 2017;18(1):62-69.
- Bozhedomov V.A., Sukhikh G.T., Lipatova N.A., Rokhlikov I.M., Alexeev R.A., Ushakova I.V. Male fertility and varicocoele: role of immune factors. Andrology. 2014;2(1):51-58.
- Su JS, Farber NJ, Vij SC. Pathophysiology and treatment options of varicocele: an overview. Andrologia 2021;53:e13576.
- Roque M., Esteves S. C. Effect of varicocele repair on sperm DNA fragmentation : a review. Int Urol Nephrol. 2018;50(4):583–603. doi: 10.1007/s11255-018-1839-4.
- Baichorov E. H., Panchenko R. I. Varicocele as a factor of violation of spermatogenesis and decrease in male fertility. Astrakhan Medical Journal. 2023;18(1):6–16. doi: 10.29039/1992-6499-2023-1-6-16.
- Цуканов А.Ю., Семикина С.П., Мустафаев Р.Ф. ВЦ как проявление синдрома дисплазии соединительной ткани. Урологический ведомости. 2019;9(2):11-16.
- Божедомов В.А. Шомаруфов А.Б., Божедомова Г.Е., Охоботов Д.А., Камалов Д.М., Камалов А.А. Варикоцеле и репродуктивная функция: эпидемиология и риск развития бесплодия (данные обследования 3908 мужчин). Урология. 2021;3:122-128.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ: учеб. пособие для системы послевуз. проф. образования врачей. Г. Москва Изд-во Медицина: Изд-во Шико 2005 г, 2-е изд., перераб. и доп. 826, [1] с.
- Патент РФ № 2612832, 13.03.2017 // Способ создания стойкого венозного полнокровия в малом тазу у лабораторных животных/ Патент России № 2612832. 2017. Бюл. №8// Цуканов Ю.Т., Цуканов А.Ю., Рудченко Н.В., Ахметов Д.С., Алябушев С.Ф., Васильева А.В.
- Abdel Raheem A., Garaffa G., Rushwan N. at al. Testicular histopathology as a predictor of a positive sperm retrieval in men with non–obstructive azoospermia. BJU Int. 2013;111(3):492–99.









Комментарии