Шварц П.Г.1 , Дутов В.В.2 , Кадыков А.С.1 , Шельдешев С.В.3 , Бершадский А.В.4
1 ФГБНУ «Научный центр неврологии», лаборатория нейроурологии и уродинамики, Москва
2 ГБУЗ МО Московский Областной Научно-исследовательский Клинический Институт им.Владимирского М.Ф., кафедра урологии, Москва
3 ГБУЗ Городская поликлиника №195 Департамента Здравоохранения г.Москвы, урологическое отделение, Москва
4 МАУЗ Центральная городская больница №3., Екатеринбург 125367, г.Москва, Волоколамское шоссе, д. 80, тел. (495)4902009 Эл.почта: uropavel@mail.ru, hammerwise@gmale.com, sheldeshevs@yandex.ru, natsia@gmail.com
Дисфункции тазовых органов, часто сопровождающие неврологические заболевания, имеют весьма разнообразные клинические проявления и их сочетания. Во многом, характер того или иного нарушения обусловлен патологическим процессом, происходящим в самой нервной системе (дегенерация, ишемия, демиелинизация, опухолевый рост). Течение болезни определяет динамику симптомов (острое или хроническое развитие), а общность эмбриологических закладок тазовых органов определяет все разнообразие сочетаний мочевой, половой и кишечной дисфункции, которое клиницист может выявить у одного неврологического больного [1]. Прогноз тазовых нарушений определяется течением основного заболевания (прогрессия или регресс симптома). Так, если нарушения мочеиспускания, наблюдающиеся после инсульта (ИИ), имеют тенденцию к регрессу симптоматики, то при дисциркуляторной энцефалопатии (ДЭ), болезни Паркинсона (БП) и др. нейродегенеративных заболеваниях прогноз неблагоприятен. При рассеянном склерозе (РС) чаще отмечается стабилизация мочевых и половых расстройств, за исключением первично и вторичнопрогредиентных форм заболевания. Современное уродинамическое, нейровизуализационное (магнитно-резонансная томография (МРТ), позитронноэмиссионная томография) и нейрофизиологическое (вызванные потенциалы) оборудование позволяет подробно изучить физиологические и патофизиологические механизмы формирования нарушения тазовых функций, диагностировать форму нарушения и объективно оценить результаты лечения. Доступность и разнообразие лекарственных средств, которые можно применить с целью коррекции этих нарушений позволяет индивидуализировать терапию при любом сочетании «тазовых» симптомов. В ряде случаев, использование монотерапии позволяет купировать несколько проявлений дисфункции тазовых органов (ингибиторы фосфодиэстеразы 5 типа (ФДЭ-5) применяют при эректильной дисфункции в сочетании с гиперактивным мочевым пузырем (ГАМП) у пациентов с РС; антихолинергические средства для купирования недержания мочи, сиалореи (слюнотечения) и спастического запора, возникших на фоне БП) [2, 3].
Центральные механизмы мочеиспускания и эрекции
Можно выделить несколько уровней регуляции работы тазовых органов: высший корковый, подкорковый, стволовой, мозжечковый, спинальный (нижнегрудной, симпатический) и пояснично-крестцовый (парасимпатический и соматический), ганглионарный (симпатический), периферический, внутриорганный ганглионарный (парасимпатический), нейромедиаторный, рецепторный, алостерический рецепторный (околорецепторный).
Корковые центры, регулирующие тазовые органы представлены в лобной, височной (островке Рейля) и затылочной областях (табл. 1).
Таблица 1. Центральные механизмы мочеиспускания/мочеобразования, эякуляции и эрекции [4]
| Зоны головного мозга | Регуляция мочеиспускания/ мочеобразования | Регуляция эрекции и эякуляции | |
| Лобная доля | Поясная извилина | Воспроизведение позыва на мочеиспускание | Половое влечение |
| Нижняя фронтальная извилина | Контроль накопления мочевого пузыря в период бодрствования | Корковый контроль эрекции | |
| Височная доля | Островок Рейля | Корковый моторный центр мочеиспускания | Контроль над детумесценцией |
| Затылочная доля | Зрительная кора | Контроль над мочеиспусканием в положении стоя | Визуальная стимуляция эрекции |
| Гипоталамус | Медиальная преоптическая область | Выработка гормонов и центральных нейромедиаторов мочеиспускания (окситоцин, дофамин) | Выработка гормонов и центральных нейромедиаторов эрекции (окситоцин, дофамин) |
| Паравентрикулярное ядро гипоталамуса | Выработка гормонов и центральных нейромедиаторов мочеиспускания (аргининвазопрессин, кортикотропин рилизинг фактор гормон, мелатонин) | Контроль над ночной эрекцией | |
| Мозжечок | Кора полушарий | Чувствительность мочевого пузыря (рецепторы растяжения) | Поддержание эрекции в различных позах |
| Червь, ножки | Контроль над позой при мочеиспускании (половой условный рефлекс) | ||
| Варолиев мост | Ядро Баррингтона, М-регион | Контроль над парасимпатическим центром мочеиспускания | Контроль над парасимпатическим спинальным центром эрекции |
| Ядро Баррингтона, L-регион | Контроль над симпатическим центром мочеиспускания | Контроль над симпатическим спинальным центром эякуляции | |
Роль нервных центров, расположенных в лобных долях, состоит в подавлении позывов на мочеиспускание, координации полового и мочевого поведения. Эти области имеют тесную связь с обонятельными, осязательными, слуховыми и зрительными центрами. Поражение этих зон при инсульте, объемном воздействии опухолей головного мозга и гематом может приводить к императивному мочеиспусканию, императивному недержанию мочи, усилению либидо (полового влечения), вследствие утраты подавляющих влияний этих зон.
Больные с указанной локализацией патологических процессов в головном мозге могут осуществлять мочеиспускание и дефекацию в необычных для себя местах, отмечается растормаживание половых инстинктов, с проявлениями половой агрессии. Зрительная кора у мужчин, во многом, определяет формирование полового стимула, в то время как у женщин не имеет такого значения. Нейромедиатором здесь служит ацетилхолин. Подкорковые и стволовые центры мочеиспускания, расположенные в зрительные буграх, гипоталамусе (медиальная преоптическая область, паравентрикулярное ядро гипоталамуса) и Варолиевом мосту (центр Баррингтона) обеспечивают бессознательные влияния на работу мочевого пузыря и уретры реализуя акт мочеиспускания. Преимущественно это тормозные центры. Основными нейромедиаторами на этом уровне являются окситоцин, кортикотропин рилизинг фактор гормон и дофамин (табл. 2).
Таблица 2. Нейромедиаторы мочеиспускания, мочеобразования, эрекции, детумесценции, эмиссии и эякуляции [5]
| Нейромедиатор | Рецептор | Влияние на мочеиспускание | Влияние на половую функцию |
|---|---|---|---|
| Ацетилхолин | М3 мускариновые | Активация детрузора² | Активация эрекции¹² |
| Н1 Никотиновые | Сокращение тазового дна, сокращение детрузора¹ | Активация эрекции² | |
| Адреналин, норадреналин | αадренорецепторы | α1сокращение сфинктера² α2А – расслабление сфинктера² | Активация эрекции² |
| βадренорецепторы | Расслабление детрузора² | Детумесценция, эякуляция² | |
| Кортикотропин | КТРФ рецепторы | Подавление сокращений детрузора (ядро Баррингтона) ¹ | Детумесценция, эякуляция¹ |
| Дофамин | D1 | Расслабление детрузора² | Активация эрекции¹ |
| D2 | Сокращение детрузора² | Детумесценция, эякуляция¹ | |
| Гамма аминомасляная кислота (ГАМК) | ГАМК рецепторы | Сокращение детрузора¹ | Детумесценция, эякуляция² |
| Глютамат | mGLUR1, mGLU R5 | Инициация мочеиспускания (ядро Онуфа) ¹ | ? |
| Гормон роста | Рецепторы гормона роста | Нейромедиатор ядра Баррингтона¹ | ? |
| Гистамин | H1, H4 | Сокращение детрузора H1² | Детумесценция, эякуляция¹ |
| Мелатонин | Мелатониновый рецептор | Регуляция ритмов мочеиспускания¹ | Активация ночной эрекции¹ |
| Серотонин | 5 НТ1а | Сокращение детрузора¹ | Детумесценция, эякуляция¹² |
| Субстанция Р | NK1-рецептор | Сокращение детрузора² | ? |
| Вазопрессин | V1, V2 | Уменьшение диуреза¹, сокращение детрузора² | ? |
| Вазоинтестинальный пептид, VIP | VIP-рецепторы | Расслабление детрузора² | Активация эрекции² |
| NOсинтаза | цГМФ | Расслабление детрузора² | Активация эрекции¹ |
| Кальцитонин | Активация эрекции² | ||
| Простагландин Е | ЕР, ТР | Сокращение детрузора² | Активация эрекции² |
| Эндотелиины 1 А, В, С | ЕТА | Сокращение детрузора² | Детумесценция, эякуляция² |
| АнгиотензинII | АТ1 | Сокращение детрузора² | Детумесценция, эякуляция² |
| Тахикинин | NK2 | Сокращение детрузора² | Детумесценция, эякуляция² |
| Брадикининовые | В2 | Сокращение детрузора² | Детумесценция, эякуляция² |
| Энкефалины | µκδ | Сокращение детрузора² | Детумесценция, эякуляция¹² |
| Пурины | Р2Х1, Р2Х3 | Сокращение детрузора¹² | Детумесценция, эякуляция² |
¹ центральное механизмы, ² периферические механизмы
В нижнегрудном отделе спинного мозга (Th12) расположены симпатические вставочные нейроны (ядра которых расположены вне спинного мозга), осуществляющие контроль над работой непроизвольной мускулатурой уретры и реализацией эмиссии спермы, эякуляцией и детумесценцией. Медиаторами здесь служат ацетилхолин (преганглионарные волокна) и норадреналин (постганглионарные волокна)
В поясничном отделе спинного мозга и конусе располагаются парасимпатический и соматический центры, осуществляющие контроль над сократительной активностью детрузора (мышцы мочевого пузыря), обеспечивающие реализацию эрекции (ядро тазового нерва, сакральный центр мочеиспускания) и регулирующие тонус мышц тазового дна (ядро срамного нерва Онуфа). Основным нейромедиатором сакрального центра мочеиспускания является ГАМК и ацетилхолин, ядра Онуфа-Онуфровича – глютамат, серотонин и норадреналин) (табл. 2).
Разнообразие нейромедиаторов, благодаря которым осуществляется передача нервных импульсов в центральных и периферических звеньях, позволяет избирательно влиять на нарушенные функции, используя лекарственные средства различных нейрофармакологических групп (антихолинергические и антихолинэстеразные средства, адреноблокаторы, холиномиметики, центральные миорелаксанты, ингибиторы ФДЭ 5 типа).
Распространенность нарушений мочеиспускания и половой функции при сосудистых заболеваниях головного мозга. Наиболее распространенной формой нарушения мочеиспускания при сосудистых заболеваниях головного мозга является синдром ГАМП. У 9 % больных дисциркуляторной энцефалопатией нарушение мочеиспускания отмечается на ранних стадиях заболевания. По мнению Sakakibara R., и соавт. (1999), еще до появления нейровизуализационных признаков заболевания (лейкоареоза) частота встречаемости нейрогенной детрузорной гиперактивности (НДГ) преобладает над двигательными и когнитивными нарушениями. Т.о., раннее выявление СНМП может облегчить выявление ДЭ на ранних стадиях заболевания [6].
По данным Суслина З.А., Варакин Ю.Я., (2007) инсульт является ведущей причиной инвалидизации населения. Ежегодно в мире диагностируется около 10 миллионов случаев инсульта, из которых на долю России приходится более 450 тысяч. Смертность от инсульта в России составляет 1,23 на 1000 населения, в течение года после перенес?нного инсульта умирает около 50 % больных [5].
Merrill D., Brikner et al., (2007) в исследовании POLYCLASS показали, что недержание мочи входит в пятерку признаков, определяющую риск смертности после инсульта [цит по 5]. Daviet J.C. et al, (2004) выявили частота встречаемости СНМП в различные периоды ИИ: первые сутки – 40 % больных, на 15-е – 32 %, 90-е 19 %.[цит по 5] Gelber D.A. еt al., (1993) определили, что уродинамические исследования у больных, перенесших ИИ, выявляют НДГ (37%), гипотонию детрузора (21%) и детрузорно-сфинктерную диссинергию (5%) [цит по 5]. На Рис.1 представлены основные механизмы формирования нейрогенных нарушений мочеиспускания и половой функции при СЗГМ.
Для развития эректильной дисфункции (ЭД), также как и для развития СЗГМ, необходимо сочетание различных предрасполагающих факторов, которые клиницист, как правило, выявляет у больного в их сочетании. К наиболее часто выявляемым факторам риска развития ЭД относят: артериальную гипертонию, гиперлипидемию, гиперхолестеринемию, гормональные нарушения, прием некоторых гипотензивных, гормональных, психотропных и других препаратов. Наиболее часто эти факторы ассоциированы с развитием метаболического синдрома (Х – синдрома). Распространенность ЭД у мужчин с метаболическим синдромом достаточно высокая: отмечается более чем у 50% пациентов.
Нередко, именно ЭД является поводом для первого обращения к врачу пациента с метаболическим синдромом [2]. Наличие у больного метаболического синдрома является значимым предиктором развития СЗГМ.
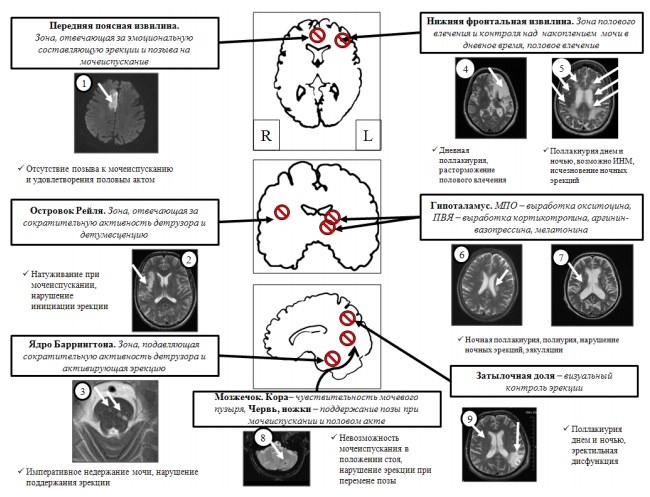
Рис.1. Механизмы нарушения мочеиспускания и эрекции при сосудистых заболеваниях головного мозга. 1, 2, 4, 9 – ишемический инсульт; 3, 6, 7, 8 – мультиинфарктная гипертоническая энцефалопатия; 5 – субкортикальная артериосклеротическая энцефалопатия [4].
Thompson I.M. et al. (2005), обследовав значительное количество больных с цереброваскулярными заболеваниями, оценивали время появления ЭД у больных с сердечно-сосудистыми заболеваниями, пришли к выводу о том, что это состояние предшествовало развитию инфарктов миокарда и инфарктов мозга значительно чаще, чем появлялось вследствие данных патологических состояний. Т.о., ЭД является одним из первых симптомов, которые может выявить невролог у больных с цереброваскулярными заболеваниями на ранних этапах диагностики [7].
Клиника нейрогенных нарушений мочеиспускания и половой функции при СЗГМ
В классической урологии принято разделение симптомов нижних мочевых путей (СНМП) на ирритативные и обструктивные, предложенное P. Abrams в 1997 г. Данное разделение имеет значение для описания таких заболеваний нижних мочевых путей как доброкачественная гиперплазия и рак простаты, простатита, цистита, и др. и в некоторых случаях служит основанием для проведения оперативных пособий [8, 9]. В тех случаях, когда речь идет о диагностике нейрогенных нарушений мочеиспускания, которые напрямую не связаны с патологическими изменениями нижних мочевых путей, симптомы нарушения мочеиспускания являются важными (неврологическими) признаками заболевания центральной, реже периферической, нервной системы! Для иллюстрации приведем ниже список СНМП, разделив их на обструктивные и ирритативные и выделив курсивом зону повреждения нервной системы.
«Ирритативные симптомы»:
- Учащение мочеиспусканий, поллакиурия (количество дневных мочеиспусканий более 8 раз/сут), левая лобная доля;
- Ноктурия (наличие ночных мочеиспусканий) при учащенном дневном мочеиспускании, множественное поражение головного мозга;
- Ноктурия (наличие ночных мочеиспусканий) при не учащенном дневном мочеиспускании, паравентрикулярное ядро гипоталамуса;
- Ночная полиурия, гипоталамус, дефицит секреции аргининвазопрессина;
- Наличие императивных позывов на мочеиспускание, лобная доля;
- Наличие эпизодов императивного недержания мочи, ядро Баррингтона;
- Наличие эпизодов недержания мочи при повышении брюшного давления (стрессовое недержание мочи), сторожевой центр Варолиевого моста;
- Недержание мочи, вызванное шумом падающей воды, реорганизация височной слуховой коры при поражении белого вещества лобных долей;
«Обструктивные симптомы»:
- Ощущение неполного опорожнения мочевого пузыря в конце мочеиспускания, правая лобная доля;
- Слабый напор струи мочи во время мочеиспускания, Островок Рейля;
- Неоднократное непроизвольное прерывание струи мочи во время мочеиспускания, вставочные интернейроны нижнегрудных сегментов спинного мозга;
- Необходимость натуживания для начала и/или продолжения мочеиспускания, Островок Рейля;
- Использование приема Креда (давление ладонью над лоном) для начала мочеиспускания, Островок Рейля;
- Затрудненное начало мочеиспускания при наличии императивного позыва, вставочные интернейроны нижнегрудных сегментов спинного мозга;
- Затрудненное начало мочеиспускания при отсутствии императивного позыва, мозжечок;
- Необходимость расслабления мышц промежности для начала мочеиспускания, мозжечок;
- Длительный период ожидания с момента возникновения позыва на мочеиспускание до его начала, ножки мозжечка, реже Островок Рейля;
- Отсутствие позыва к мочеиспусканию, правая лобная доля;
- Ослабление ощущения позыва на мочеиспускание, правая лобная доля;
- Ощущение позыва на мочеиспускание, как чувство давления или распирания в нижних отделах живота, правая лобная доля, чаще при поражение поясничных сегментов спинного мозга [1].
Приняв во внимание наличие у больного СНМП и помня о высокой частоте встречаемости нарушений мочеиспускания при хронических сосудистых заболеваниях головного мозга, врач невролог сможет диагностировать поражение головного мозга на ранних стадиях заболевания. Особенно это актуально у пациентов с так называемыми «немыми инфарктами». У больных с вертебральнобазиллярной недостаточностью (ВБН), часто предъявляемой жалобой является недержание мочи при физическом напряжении, так называемой «стрессовое недержание мочи» или «недержание мочи при напряжении у женщин» (38%), чаще встречается императивное недержание мочи (54%) вследствие поражения Lи M-регионов ядра Баррингтона.
У больных с мультиинфарктная гипертоническая энцефалопатия отмечается большее разнообразие симптомов по сравнению с пациентами, страдающими ВБН. Для данной формы хронического сосудистого заболевания головного мозга характерно учащение мочеиспускания более 8 раз в сутки (18%), в том числе с ноктурией (17%), наличие эпизодов императивного недержания мочи (12%) и уменьшения объема каждого мочеиспускания в среднем до 120-180 мл. Подобная симптоматика, по мнению Шварца П.Г., (2013), даже без проведения дополнительного комплексного уродинамического обследования, может свидетельствовать о наличии нейрогенной детрузорной гиперактивности. Анализ дневников мочеиспускания больных субкортикальная артериосклеротическая энцефалопатия показывает, что наиболее часто больные отмечают комплекс ирритативных симптомов (23%), а также изолированно учащенное мочеиспускание (23%), наличие императивных позывов (19%) и др. Ниже представлена классификация нарушений мочеиспускания при СЗГМ [5].
Классификация нарушений акта мочеиспускания при СЗГМ (ФГБНУ «НЦН»)[5]
Корковые нарушения мочеиспускания
Сенсорные (лобные) расстройства мочеиспускания
- ГАМП без детрузорной гиперактивности (гиперсенсорная форма);
- Гипосенсорная форма (синдром Фунакоши – Домашенко);
Моторные (теменные) сфинктерные расстройства мочеиспускания
- Псевдодиссинергия;
Моторные (инсулярные) детрузорные расстройства мочеиспускания
- Снижение сократительной активности детрузора (гипотония);
Мозжечковые расстройства мочеиспускания
- Позиционные расстройства мочеиспускания;
Подкорковые расстройства мочеиспускания
Моторные детрузорные расстройства мочеиспускания
- Нейрогенная детрузорная гиперактивность;
Дизритмия мочеиспускания
- Ноктурия;
Нарушение мочеобразования
- Ночная полиурия;
Стволовые расстройства мочеиспускания
Моторные детрузорные расстройства мочеиспускания (первичные)
- Нейрогенная детрузорная гиперактивность;
- Снижение сократительной активности детрузора (гипотония);
Моторные сфинктерные расстройства мочеиспускания (вторичные)
- Стрессовое недержание мочи
Поражение корковых центров (ИИ) и корково-подкорковых связей приводит к развитию психогенной ЭД (ДЭ). Пациенты с подобными расстройствами жалуются на снижение интенсивности эрекции и невозможность закончить половой акт, ввиду е? быстрого исчезновения. Возможность завершить половой акт появляется лишь при механической стимуляции (мастурбация активация спинальных центров эрекции). Нарушение либидо наиболее часто встречается поражении лобных долей (ИИ, ДЭ) и проявляется повышенным сексуальным влечением. Повышение либидо также может быть симптомом рассеянного склероза и опухолей лобных долей. В ряде случаев, этот симптом сочетается с ЭД или полной импотенцией. Находясь на лечении в стационаре, такие больные проявляют повышенную половую активность в отношении медперсонала и пациентов противоположного пола. Напротив, снижение либидо отмечается у больных с постинсультной депрессией. В пожилом возрасте или при наличии метаболического синдрома возможно снижение гормональной активности, связанное, в том числе с вторичным гипогонадизмом.
Нарушение ночных эрекций может служить симптомом повреждения подкорковых центров (мультиинфарктная гипертоническая энцефалопатия) в том числе расположенных паравентрикулярно (субкортикальная артериосклеротическая энцефалопатия). Этот симптом часто сочетается с изолированной ноктурией и является проявлением изменения суточных ритмов. Нарушение рефлекторной эрекции, проявляющееся в невозможности поддерживать эрекцию даже при мастурбации, наблюдается при спинальных поражениях, особенно поясничных и сакральных очагах (миелит, спинальный инсульт, травма) [10].
Расстройства эякуляции, как правило, связаны с дисфункцией симпатической составляющей регуляции половых органов. За реализацию эякуляции и детумесценции (опадения полового члена) отвечает височная доля, стимуляция D 1 подтипа дофаминовых рецепторов МПО И ПВЯ и соподчиненных интернейронов грудного отдела спинного мозга. Наиболее часто расстройства эякуляции сопровождаются сфинктерными нарушениями мочеиспускания (детрузорно-сфинктерная диссинергия). Преждевременная эякуляция является корковым симптомом (поражения передней центральной извилины), в то время как анэякуляция чаще встречается при заболеваниях спинного мозга (сирингомиелия, миелит, РС) и периферических нарушениях (диабетическая полинейропатия, последствия ятрогенных травм подчревного нерва). Наиболее полно перечень вопросов, которые необходимо задавать неврологическому больному для оценки его половой жизни, представлен в опроснике МИЭФ (Международный индекс эректильной функции) [3].
Параклинические методы оценки эрекции и эякуляции
Ведущую роль в диагностике уровня и характера повреждения нервной системы отводят нейрофизиологическим методам исследования. Одним из наиболее информативных методов исследования являются вызванные потенциалы (ВП). ВП представляет собой продукт сложной обработки афферентного импульса на уровне рецепторов, периферических нервов, специфических реле, неспецифических звеньев ретикулярной формации и лимбической системы и коркового звена. В форме ВП определ?нным образом отражаются влияния каждого из перечисленных уровней перцепторной системы. Метод ВП является главным способом выявления афферентных функциональных связей периферии с центральными нервными структурами. Для диагностики причин нейрогенных нарушений половой функции наиболее информативными являются соматосенсорные ВП со срамных нервов (правого и левого). Диагностические возможности соматосенсорных ВП в диагностике нейрогенной ЭД и его доступность в клинической практике позволяет включить этот метод в рутинное обследование неврологических больных. Другие нейрофизиологические методы: исследование бульбокавернозного рефлекса, электронейромиография полового члена позволяют оценить соматическую, по большей часть эфферентную, составляющую половой функции.
Лечение нейрогенных расстройств мочеиспускания и половых расстройств
Консервативное лечение нейрогенных нарушений мочеиспускания является основным видом медицинских мероприятий и чаще всего включает использование фармакологических средств (фармакотерапию), а также другие методы неоперативного лечения.
Основной группой лекарственных препаратов, применяемых для лечения ГАМП (его моторной и сенсорной форм), являются антихолинергические средства (АХС), в литературе нередко обозначаемые как холинолитические, холиноблокирующие и антимускариновые средства. Эти препараты с разной степенью органной специфичности и избирательности в отношении разных подтипов блокируют мускариновые (М) –холинорецепторы конкурируя с ацетилхолином.
В настоящее время перечень АХС при лечении ГАМП, включает троспиума хлорид, оксибутинина хлорид, толтеродина тартрат, дифенилтропина хлорид и солифенацина сукцинат, оказывающие блокирующее влияние на М 3 – холинорецепторы мочевого пузыря, за счет чего достигается уменьшение действия ацетилхолина на детрузор, что вызывает уменьшение его сократимости в условиях повышенного тонуса.
Помимо АХС при ГАМП применяют антагонисты ионов Са++ (нифедипин), агонист ГАМК (диазепам, баклосан), трициклические антидепрессанты (амитриптилин, имипрамин). Лечебный эффект последних связывают с умеренными антиадренергическими и антимускариновыми свойства, с блокирующим влиянием на Са++ и К+ каналы, а также ингибирующим влиянием на обратный захват моноаминов в нервных синапсах [5].
У больных с нарушением сократительной активности детрузора применяют ингибиторы ацетилхолинэстеразы, фермента, расщепляющего ацетилхолин на ацетил и холин, что приводит к накоплению нерасщепленного медиатора в синаптической щели и повышает степень взаимодействия последнего с мускариновыми постсинаптическими М3 рецепторами. К таким средствам относятся прозерин, пиридостигмина бромид, дистигмина бромид.
Клинический эффект, который развивается в первые сутки приема, проявляется в появлении позывов на мочеиспускание, облегчении начала мочеиспускания, уменьшении объема остаточной мочи. Применение этих средств в сочетании с α 1адреноблокаторами, позволяют купировать острую и хроническую нейрогенную задержку мочи в течение 1-2-х недель постоянного приема. В этот же период больным с мочевыми дренажами целесообразно осуществлять тренировку детрузора, пережимая катетер или цистостомический дренаж по 3-4 часа в дневное время суток. Пациенты с цистостомическим дренажем могут осуществлять попытки мочеиспускания при возникающем позыве на пережатом дренаже. Больные с уретральным катетером могут осуществить подобные попытки после удаления дренажа.
Побочно с восстановлением мочеиспускания, возможно купирование явлений атонического запора и восстановление половой чувствительности.
Больным, страдающим детрузорно-сфинктерной диссинергией и псевдодиссинергией, показан прием α 1-адреноблокаторов с различной степенью избирательности блокирующие постсинаптические адренорецепторы шейки мочевого пузыря, гладкомышечного сфинктера уретры и ядра Онуфа, конкурируя с норадреналином и вызывая их расслабление.
К средствам с таким механизмом действия относятся празозин, альфузозин, доксазозин, теразозин, тамсулозин и силодозин. Эффект от начатой терапии развивается через 3-4 дня, достигая своего максимума к концу 1-2 недель лечения и поддерживается при длительном приеме. Клинический эффект проявляется в облегчении начала мочеиспускания, уменьшении объема остаточной мочи. Побочные эффекты, в основном связаны, с ортостатическими реакциями (гипотензия). Прием альфа 1 адреноблокаторов в некоторых случаях позволяет уменьшить дозы антигипертензивной терапии, в тоже время препараты этой группы следует назначать с осторожностью у больных с недостаточностью мозгового кровообращения. Другим побочным эффектом является улучшение качества эрекции.
В комплексной терапии пациентов со спастичностью мышц тазового дна используют центральный миорелаксант баклофен, который применяют внутрь. Среди малоинвазивных методов, лечения НДГ и детрузорно-сфинктерной диссинергии применяют введение бутулинового токсина А в детрузор и область уретрального сфинктера. При неэффективности фармакотерапии у больных с НДГ используют физиотерапевтические процедуры, среди которых особое место занимает тибиальная и пудендальная нейромодуляции. На области проекции указанных нервов накожными электродами производят стимуляции с частотой 30 Гц, амплитудой импульса (вариабельна от 3 до 25 мА) и длительностью импульса 200 мсек. Процедуры повторяют с интервалом в 1 неделю до 15 процедур. К 3-5 процедуре появляется лечебный эффект сравнимый с действием антихолинергических средств.
Основным методом лечения половых расстройств является фармакотерапия. Изучение биохимических основ формирования эрекции позволило объяснить вероятный механизм действия группы препаратов, изначально предлагаемых в качестве сердечно-сосудистого средства – ингибиторов ФДЭ-5. Эти препараты не оказывают прямого расслабляющего действия на сосуды кавернозного тела, но усиливают сосудорасширяющий эффект высвобождаемого при сексуальной стимуляции оксида азота в отношении этой ткани. Первым препаратом, появившимся на рынке, стал силденофила цитрат, который в дозе 25-100 мг за час до полового акта обеспечивает поддержание эрекции до 6 часов. Сходным по длительности эффекта является препарат варденофила гидрохлорид тригидрат – доза 10-20 мг. По длительности действия эти два препарата уступают тадалафилу 20 мг в продолжительности действия (эффект до 36 часов при однократном приеме), однако, в случае пожилых пациентов с СЗГМ период действия силденофила предпочтителен [3, 11, 12].
Для лечения расстройств эрекции и эякуляции также используются агонист D2 рецепторов гипоталамуса (апоморфин), адреноблокаторы (йохимбин), ингибиторы обратного захвата серотонина (тразодон, симбалта), ингибиторы пролактина (бромкриптин), андрогены (тестостерон, андриол, сустанон, андрогель), интракавернозные инъекции (Кавержект, Альпростадил, Папаверин).
Одно из перспективных направлений в лекарственной терапии дисфункции тазовых органов является использование ингибиторов ФДЭ-5, механизм действия которых осуществляется через систему NO / цГМФ, и обеспечивает расслабление гладкой мускулатуры шейки мочевого пузыря [13].
Andersson K.E., Persson K. (1995) установили, что в мышечном слое стенки уретры человека вокруг кровеносных сосудов и в уротелии присутствует большое количество нервных волокон, содержащих NO-синтазу. Авторы предположили, что в нижних мочевых путях NO выполняет функции нейромодулятора, а NO-система является возможной целью прямого или опосредованного фармакологического воздействия при повышенной сократимости НМП. Как было установлено в исследовании in vivo, повреждения системы NO/цГМФ играют ключевую роль в развитии ГАМП [Цит. по 14].
Persson K., Igawa Y., Matiasson A., et al. (1992) в экспериментах на крысах продемонстрировали развитие гиперактивности мочевого пузыря в результате уменьшения продукции NO [цит. по 14]. Tinel H., Stelte-Ludwig B., et al. (2006) в опытах на мышах показали, что повреждения гена NO-синтазы и врожденный дефицит цГМФ-зависимой протеинкиназы приводят к в выраженным нарушениям мочеиспускания, гипертрофией стенки мочевого пузыря и возникновением ее спонтанных сокращений. [цит. по 14]. Схожие механизмы лежат в основе ЭД. Механизм расслабления и сокращения миоцитов кавернозной ткани является Са2+-зависимым, в то время как путь активации РоК является Са2+независимым. Rees R.W., Ziessen T., Ralph D.J., et al. (2002) выявили вещество РоА, небольшой G-белок и фермент Ро-киназу (РоК) в качестве возможных медиаторов α-адренергического и опосредованного эндотелином-1 сокращения гладких миоцитов [цит. по 14]. Chang S., Hypolite J.A., (2002) и Bing W., Chang S., Hypolite J.A., et al. (2003) независимо друг от друга в исследованиях invivo показали наличие дисфункции РоК в тканях мочевого пузыря при наличии инфравезикальной обструкции [цит. по 14]. Sairam K., Kulinskaya E., McNicholas T.A., et al. (2002) первыми нашли клиническое подтверждение этой теории, обследовав 112 мужчин с ЭД и СНМП. Было наглядно, продемонстрировано улучшение симптоматики после приема ингибитора ФДЭ-5 [15]. Mulhall J.P., Guhring P., Parker M., et al. (2006) показали улучшение симптоматики на 4,6 балла по шкале AUASS после 3-месячного курса силденафила. Это исследование положило начало дальнейшему изучению терапевтических эффектов ингибиторов ФДЭ-5 на СНМП. В результате 4-х крупных рандоминизарованных плацебо контролируемых исследованиях, была доказана эффективность ингибиторов ФДЭ-5 в отношении СНМП. [цит. по 14]. Christian G., Stief C.G., Porst H., et al. (2008) показали в своем исследовании, что ни один из препаратов из группы ингибиторов ФДЭ-5 не вызывает значимых изменений пиковой скорости мочеиспускания (Qmaх) и объема остаточной мочи. Gacci M., Del Populo G., Macchiarella A., et al.напротив, выявило у мужчин с нейрогенным нарушением функции НМП на фоне повреждения спинного мозга улучшение параметров мочеиспускания, при условии принятия ингибитора ФДЭ-5 за 1–3 часа до уродинамического исследования [16]. Наиболее перспективным представляется применение ингибиторов ФДЭ-5 при сочетании ЭД с СНМП [8, 9, 17, 18].
Таким образом, наличие взаимосвязи ЭД с СНМП у мужчин не оставляет сомнений. Принятые в настоящее время теории патогенеза данной взаимосвязи, особенно гипотеза о роли эндотелиальной дисфункции, на патофизиологическом уровне обосновывают применение пациентами с сочетанием ЭД и СНМП препаратов группы ингибиторов ФДЭ-5.
Литература
1. Шварц П.Г. Феноменология нейрогенных нарушений мочеиспускания. //Рус мед журн. – 2012. – № 18. – С. 912—916.
2. Попов С.В. Эректильная дисфункция при заболеваниях центральной нервной системы //Фарматека.2014. №19. С.74-75.
3. Пушкарь Д.Ю. Эректильная дисфункция: кардиологические аспекты. /Пушкарь Д.Ю., Верткин А.Л. — М.: МЕДпресс-информ, 2005. — 144 с.
4. Шварц П.Г. Патогенетические механизмы нарушений мочеиспускания и эрекции у пациентов с сосудистыми заболеваниями головного мозга и их фармакологическая коррекция. //РМЖ.2015. № 11.С. 639-646.
5. Шварц П.Г. Нейрогенные нарушения мочеиспускания у больных с острыми и хроническими сосудистыми заболеваниями головного мозга (клиника, диагностика и лечение). Дисс. … докт. мед. Наук. – М., 2013. – 285 с.
6. Sakakibara R. Urinary function in elderly people with and without leukoaraiosis: relation to cognitive and gait function. /Sakakibara R., Hattori T., Uchiyama T., et al. // J. Neurol. Neurosurg. Psychiatry— 1999. — Vol.67 — P. 658-660.
7. Thompson I.M. et al., Erectile dysfunction and subsequent cardiovascular disease. //JAMA. — Dec. 21. — 2005. — 294. —Р. 2996-3002.
8. Aytac I.A. Socioeconomic factors and incidence of erectile dysfunction: findings of the longitudinal Massachusetts Male Aging Study. /Aytac I.A., Araujo A.B., Johannes C.B., et al //SocSciMed. — 2000. — No.51. — Р. 771-778.
9. Billups K.L. Erectile dysfunction as an early indicator of systemic oxidative stress and endothelial cell dysfunction. /Billups K.L., Edina M.N., Kaiser D. et al. //J. Urol. — 2003; — №169. — Р. 323-327.
10. Шварц П.Г. Нейрогенная задержка мочи. / Шварц П.Г., Попов С.В. — М: —Пресс Бюро— 2011. –224 c.
11. Truss M.C. Phosphodiesterase 1 inhibition in the treatment of lower urinary tract dysfunction: from bench to bedside. / Truss M.C., Stief C.G., et al. //World J Urol—2001—19: — Р. 344–350.
12. Uckert S. Characterization and functional relevance of cyclic nucleotide phosphodiesterase isoenzymes of the human prostate./ Uckert S., Kuthe A., Jonas U. and Stief C.G. // J Urol— 2001 —166: — Р.2484–90.
13. Andersson K.E. LUTS treatment: future treatment options. //Neurourol Urodyn — 2007, vol. 26 — Р. 934–47.
14. Тажетдинов О.Х. Эффективность и безопасность ингибиторов фосфодиэстеразы 5-го типа у мужчин с эректильной дисфункцией и симптомами нижних мочевых путей. / Тажетдинов О.Х., Тхагапсоева Р.А., Павловичев А.А. //Фарматека. – 2011. №20. С. 22-29.
15. Sairam K. Sildenafil influences lower urinary tract symptoms. / Sairam K., Kulinskaya E., et al. //BJU Int—2002 —90: — Р. 836–9.
16. Guilleminault Ch. Clinical Neurophysiology of Sleep Disorders. — Elsevier Health Sciences. — 2005. — 363 p.
17. Giembycz M.A. Life after PDE4: overcoming adverse events with dualspecificity phosphodiesterase inhibitors. // CurrOpinPharmacol. — 2005— vol 5: — Р. 238–44.
18. Gillespie J.L. Phosphodiesterase-linked inhibition of nonmicturition activity in the isolated bladder. // BJU Int —2004 —93: — Р.1325–32.
Статья опубликована в журнале "Вестник урологии" №1 2016, стр. 52-71









Комментарии