Р.Н. Трушкин, П.Т. Сурков, А.Е. Лубенников, Н.В. Морозов, Т.К. Исаев
ГБУЗ «Городская клиническая больница № 52 Департамента здравоохранения г. Москвы»; Москва, Россия
Автор для связи: Лубенников Александр Евгеньевич
Тел.: +7 (499) 196-27-04; е-mail: lualev@yandex.ru
Введение
Перкутанная нефролитолапаксия (ПНЛ) в настоящее время широко используется для лечения пациентов с нефролитиазом. Однако, несмотря на совершенствования инструментария, накопления опыта, появление мини, ультрамини и микро перкутанных методик, самым грозным осложнением операции продолжает оставаться кровотечение [1]. Факторами риска развития кровотечения являются возраст, аномалии развития почек, размер конкремента, продолжительность операции, наличие инфекции мочевых путей [1, 2].
Частота геморрагических осложнений с момента широкого внедрения методики до настоящего времени значительно снизилась. Так, анализ публикаций за последние 27 лет показывает снижение необходимости в гемотрансфузии с 55% до 3.8% [1, 3-5]. В подавляющем большинстве случаев кровотечение купируется консервативно [6]. Рецидивирующее кровотечения после ПНЛ, как правило, обусловлено формированием артериовенозной фистулы или псевдоаневризмы [1-2, 6]. При отсутствии эффекта от консервативной терапии прибегают к селективной эмболизации ветвей почечной артерии. По данным различных авторов, необходимость в интервенционном лечении возникает не более чем у 1% пациента [1-2, 6]. Высокая эффективность эмболизации продемонстрирована в ряде публикаций [2, 7]. Однако проведение эмболизации у пациентов с ХПН чревато развитием контрастиндуцированной нефропатии. Неэффективность консервативных мероприятий, эмболизации, интенсивное кровотечение обусловливают необходимость в нефрэктомии, которая в настоящее время выполняется менее чем у 0.5% пациентов после ПНЛ [1, 6].
Клиническое наблюдение
Больная Т. 47 лет. 22.06.17 поступила в отделение урологии с жалобами на слабость, наличие нефростомических дренажей с обеих сторон.
Из анамнеза известно, что в декабре 2016 перенесла острый пиелонефрит. 05.05.17, 09.06.17 в г. Троицке по поводу острого обструктивного пиелонефрита на фоне конкрементов мочеточников выполнена чрескожная пункционная нефростомия слева и справа соответственно. Получала интенсивную терапию в условиях реанимационного отделения. В связи с нарастанием почечной недостаточности, для дальнейшего лечения переведена в отделение реанимации нефрологического профиля ГБУЗ ГКБ № 52 ДЗ г. Москвы. Проведены три сеанса гемодиализа. Также в анамнезе ОНМК в 2015 г. в бассейне правой СМА.
Мультиспиральная компьютерная томография (МСКТ) почек с контрастным усилением: правая почка размерами 52×57×98 мм, левая — 58×55×89 мм. Паренхима почек толщиной до 16 мм, справа местами истончена до 2-3 мм. Дистальные концы нефростомических дренажей в полости ЧЛС. Чашечки с обеих сторон расширены до 18 мм. В средней и нижней группах чашечек правой почки, а также в нижней группе чашечек левой почки расположены конкременты, диаметром от 6 до 15 мм. Лоханки почек расширены до 15 мм справа и до 18 мм слева. В верхних третях обоих мочеточников расположены конкременты, диаметром справа до 12 мм, слева не менее 15 мм, плотностью 480 HU. Накопление контрастного вещества паренхимой соответствует фазам контрастирования, выделение в почечные лоханки с обеих сторон не получено. Очагов деструкции паренхимы на момент исследования не определяется (рис. 1).
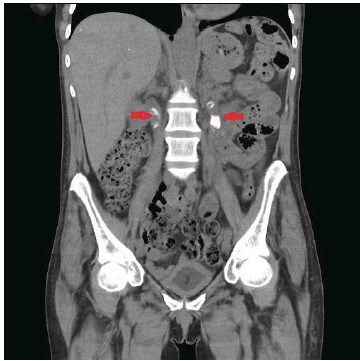
Рисунок 1. МСКТ почек, нативная фаза. В верхних третях мочеточников конкременты 480 HU (указаны стрелками)
В анализах крови: гемоглобин 76 г/л, эритроциты 2,9×1012/л, тромбоциты 301×109/л, лейкоциты 7.3×109/л, глюкоза 4,7 ммоль/л, мочевина 12,4 ммоль/л, креатинин 352 мкмоль/л, калий 4,9 ммоль/л, натрий 134 ммоль/л. Коагулограмма: МНО 1,24, АЧТВ 36 с, протромбиновое время 15.8 сек. В общем анализе мочи: лейкоциты 500 кл/мкл, рН нейтральная, плотность 1006, белок 1.13 г/л, реакция на кровь +++.
Учитывая то, что анемия носила хронический характер, в т.ч. нефрогенный, принимая во внимание наличие активного пиелонефрита, бесперспективность антибактериального лечения, в виду наличия инфицированных конкрементов, нефростомических дренажей, с целью создания условий для терапии пиелонефрита, а именно с целью удаления всех субстратов, на которых могут формироваться бактериальные биопленки, также в надежде на то, что почечная недостаточность не будет прогрессировать, больной выполнено оперативное лечение. 27.07.17 под эпидуральной анестезией проведены трансуретральная контактная, пневматическая уретеролитотрипсия в верхних третях с обеих сторон, стентирование мочеточников, перкутанная нефролитоэкстракция в положении на животе с обеих сторон, установка нефростомических дренажей с обеих сторон. Достигнуто состояние stone free (рис. 2). Учитывая данные МСКТ и интраоперационную картину (конкременты были очень рыхлыми, белого цвета, конкремент в правом мочеточнике в центре содержал детрит), можно с большой долей вероятности полагать, что камни у этой пациентки были инфицированными. Перкутанный доступ осуществлен с обеих сторон через нижние чашечки почек, бужирование проводилось телескопическими, металлическими бужами Алкена до 26 Сн. Время операции составило 130 мин.
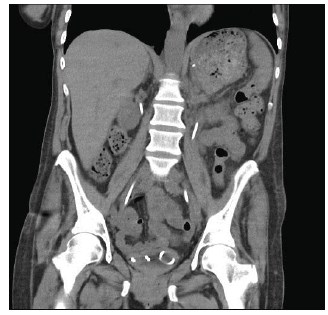
Рисунок 2. МСКТ почек, нативная фаза. В мочеточниках стенты, конкременты удалены в полном объеме
Через двое суток у больной развилось интенсивное кровотечение из левой почки, что привело к нарастанию гипоксемической гипоксии, в анализе крови гемоглобин 26 г/л. Пациентка переведена в отделение реанимации, где на фоне консервативной терапии, в том числе гемотрансфузий состояние стабилизировалось, кровотечение было остановлено. На 8 сутки кровотечение из левой почки рецидивировало. Было принято решение в экстренном порядке выполнить электрокоагуляцию стенок свищевого хода с помощью резектоскопа, используемого для трансуретральных вмешательств.
05.07.17 под эпидуральной анестезией в нефростомический дренаж слева 24Ch введена струна проводник с электроизоляционным покрытием (гидрофильная струнапроводник Cook). Под рентгенологическим контролем установлена в полости чашечно-лоханочной системы (ЧЛС). Дренаж удален. По свищевому ходу заведен нефроскоп 26Ch в полостную систему почки, удалены сгустки крови из свищевого хода и полостной системы почки при помощи эндоскопического захвата, суммарным объемом до 50 мл. Визуализирован источник кровотечения, находящийся на 12 и 7 часах у.ц. свищевого хода в паренхиме почки, а также выявлен источник кровотечения в области паранефральной клетчатки. Нефроскоп удален. В полостную систему почки, ориентируясь на струну проводник, под визуальным контролем заведен резектоскоп Karl Storz 26 Ch. Выполнена коагуляция в монополярном режиме 60W при помощи петлевого и шарикового электрода вышеописанных зон кровотечения (рис. 3).
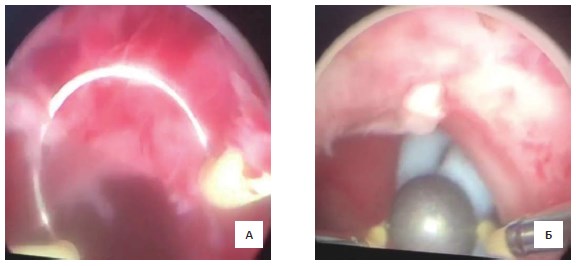
Рисунок 3. Этапы перкутанной электрокоагуляции стенок свищевого хода петлевым электродом (А) и шариковым электродом (Б)
Через двое суток у больной развилось интенсивное кровотечение из левой почки, что привело к нарастанию гипоксемической гипоксии, в анализе крови гемоглобин 26 г/л. Пациентка переведена в отделение реанимации, где на фоне консервативной терапии, в том числе гемотрансфузий состояние стабилизировалось, кровотечение было остановлено. На 8 сутки кровотечение из левой почки рецидивировало. Было принято решение в экстренном порядке выполнить электрокоагуляцию стенок свищевого хода с помощью резектоскопа, используемого для трансуретральных вмешательств.
05.07.17 под эпидуральной анестезией в нефростомический дренаж слева 24Ch введена струна проводник с электроизоляционным покрытием (гидрофильная струнапроводник Cook). Под рентгенологическим контролем установлена в полости чашечно-лоханочной системы (ЧЛС). Дренаж удален. По свищевому ходу заведен нефроскоп 26Ch в полостную систему почки, удалены сгустки крови из свищевого хода и полостной системы почки при помощи эндоскопического захвата, суммарным объемом до 50 мл. Визуализирован источник кровотечения, находящийся на 12 и 7 часах у.ц. свищевого хода в паренхиме почки, а также выявлен источник кровотечения в области паранефральной клетчатки. Нефроскоп удален. В полостную систему почки, ориентируясь на струну проводник, под визуальным контролем заведен резектоскоп Karl Storz 26 Ch. Выполнена коагуляция в монополярном режиме 60W при помощи петлевого и шарикового электрода вышеописанных зон кровотечения (рис. 3).
В качестве ирригационной жидкости использован 5% раствор глюкозы. Для профилактики ТУР-синдрома емкость с жидкостью находилась на высоте 70 см от точки операции. Кровотечение было полностью остановлено. Также выполнена антеградная замена мочеточникого стента слева. Операция завершена установкой нефростомического дренажа 24 Сн. Время операции составило 110 мин. Осложнений, электролитных нарушений не было. Кровотечение из левой почки не рецидивировало.
Пациентка выписана на амбулаторное лечение на 9 сутки после электрокоагуляции. Нефростомические дренажи удалены. При выписке состояние удовлетворительное, температура тела нормальная, наружные почечные свищи полностью закрыты, мочеиспускание самостоятельное, макрогематурии не было, диурез 1500-2000 мл Лабораторные данные при выписке: гемоглобин 70 г/л, эритроциты 2,5×1012/л, тромбоциты 413×109/л, лейкоциты 14.4×109/л, глюкоза 4,6 ммоль/л, мочевина 19.5 ммоль/л, креатинин 449 мкмоль/л, калий 4,7 ммоль/л, натрий 136 ммоль/л. В настоящее время пациентка получает нефропротективную терапию, эритропоэтин.
Обсуждение
Прототипом предложенной нами методики явилась работа Chiang PH и Su HH из Тайваня, которые впервые сообщили о возможности использования электроваопризации для создания перкутанного доступа к ЧЛС [8]. После стандартной пункции ЧЛС, установки струны проводника, авторы использовали биполярный резектоскоп 28Сн в режиме вапоризации 250-300W и Amplatz кожух. Доступ к ЧЛС осуществлялся путем выпаривания всех слоев тканей до необходимого диаметра, без предварительного бужирования хода. Исследователи пришли к заключению, что, по сравнению с баллонной дилатацией, вапоризация приводит к снижению геморрагических осложнений. Однако данная методика не нашла широкого применения и получила большое количество критических замечаний. Ряд авторов полагает, что вапоризация приводит к глубокому повреждению паренхимы почки, есть риск электролитных нарушений, электроповреждения мочеточника, заполнения ирригационной жидкостью плевральной полости, после проведения подобной процедуры остаются грубые рубцы, которые могут затруднить повторные ПНЛ, провоцировать более выраженную послеоперационную боль [9-10].
Мы считаем, что первым этапом при развитии геморрагических осложнений показано проведение консервативных мероприятий. В нашей клинике мы с успехом используем временное пережатие нефростомы с целью создания гемотампонады ЧЛС, которая впоследствии в подавляющем большинстве случаев самостоятельно разрешается. Гемотрансфузии проводим по строгим показаниям, которые определяются совместно с врачом-трансфузиологом. При некупируемом кровотечение прибегаем к суперселективной эмболизации ветвей почечной артерии. Однако выполнение интервенционного вмешательства предусматривает введение в артерию достаточно большого количества йодсодержащего контрастного вещества, что может спровоцировать контраст-индуцированную нефропатию, особенно у больных с уже имеющейся ХПН, как в нашем клиническом примере.
В связи с этим, представляется, что перкутанная электрокоагуляция стенок наружного почечного свища является второй линей гемостаза (после неэффективности консервативных мероприятий) у больных с ХПН. На данный момент помимо описанного клинического случая мы имеем подобный опыт лечения 3 пациентов, у всех больных достигнут эффективный гемостаз.
Заключение
При развитии кровотечения после ПНЛ, неэффективности консервативных мероприятий у пациентов с ХПН в качестве альтернативы эмболизации, нефрэктомии может быть предложена перкутанная электрокоагуляция стенок свищевого хода при помощи резектоскопа. Введение инструмента осуществляется под визуальным контролем, с ориентацией на предварительно антеградно установленную в ЧЛС струну проводник с электроизоляционным покрытием. Электрокоагуляция проводится по всей площади в режиме низкой мощности (60W) под постоянной ирригацией жидкости. Учитывая риск развития электролитных нарушений, предпочтительнее использовать биполярный электрод.
Учитывая небольшое число наблюдений, объективно судить об эффективности и безопасности предложенного метода гемостаза в настоящее время не представляется возможным.
Исследование не имело спонсорской поддержки. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Keoghane SR, Cett RJ, Rogers AE, Walmsley BH. Blood transfusion, embolisation and nephrectomy after percutaneous nephrolithotomy (PCNL). BJU Int. 2012;111(4):628-632. doi: 10.1111/j.1464410X.2012.11394.x
- Un S, Cakir V, Kara C, Turk H, Kose O et al. Risk factors for hemorrhage requiring embolization after percutaneous nephrolithotomy. Can Urol Assoc J. 2015;9(9-10):594-8. doi: 10.5489/cuaj.2803
- Jones DJ, Russell GL, Kellett MJ, Wickham JE. The changing practice of percutaneous stone surgery. Review of 1000 cases 1981–1988. Br J Urol. 1990;66:1-5. doi: 10.1111/j.1464-410X
- Stoller M, Wolf JS Jr., St Lezin MA. Estimated blood loss and transfusion rates associated with percutaneous nephrolithotomy. J Urol 1994;152:1977-81. doi: 10.1016/S0022-5347(17)32283-8
- de la Rosett e J, Assimos D, Desai M, Gutierrez J, Lingeman J et al. The Clinical Research Offi ce of the Endourological Society Percutaneous Nephrolithotomy Global Study: indica tions, complications, and outcomes in 5803 patients. J Endourol. 2011;25:11-7. doi: 10.1089/end.2010.0424
- Tayeb MM, Knoedler JJ, Krambeck AE, Paonessa JE, Mellon MJ et al. Vascular complications after percutaneous nephrolithotomy: 10 years of experience. Urology. 2015;85(4):777-81. doi: 10.1016/j.urology.2014.12.044
- Ierardi AM, Floridi C, Fontana F, Pinto A, Petrillo M et al. Transcatheter embolisation of iatrogenic renal vascular injuries. Radiol Med. 2014;119:261-8. doi: 10.1007/ s11547-013-0343-2
- Chiang PH, Su HH. Randomized and prospective trial comparing tract creation using plasma vaporization with balloon dilatation in percutaneous nephrolithotomy. BJU Int. 2013;112(1):89-93. doi: 10.1111/j.1464410X.2012.11507.x
- Philip J. Comment on Randomized and prospective trial comparing tract creation using plasma vaporization with balloon dilatation in percutaneous nephrolithotomy. BJU Int. 2013;112(1):3. doi: 10.1111/j.1464410X.2012.11520.x
- Maheshwari PN, Sharma G, Shah NB. Comment on Randomized and prospective trial comparing tract creation using plasma vaporization with balloon dilatation in percutaneous nephrolithotomy. BJU Int. 2013;112(7): 432. doi: 10.1111/bju.12408
Статья опубликована в журнале "Вестник урологии" №3 2017, стр. 95-100













Комментарии