Н.Э. Авадиева
МБУЗ «Городская поликлиника № 10 г. Ростова-на-Дону»; Ростов-на-Дону, Россия
Введение
Фертильность, является одной из важных и сложных биологических функций человека. По данным литературы 15% сексуально активных пар не достигают беременности в течение 1 года и обращаются за лечением бесплодия, 5% пар остаются бездетными, несмотря на попытки лечения. У половины бездетных пар бесплодие связано с «мужским фактором», проявляющимся отклонениями параметров эякулята [1 - 4].
Инфертильность обусловлена, как правило, влиянием различных факторов: врожденные аномалии мочеполовых органов; злокачественные опухоли; варикоцеле; эндокринные нарушения; генетические заболевания; инфекционновоспалительные заболевания репродуктивных органов; иммунологические факторы [1, 3 - 5]. Все вышеперечисленное может приводить к качественным и количественным нарушениям эякулята [6, 7].
Для выявления патоспермии используются различные методы диагностики, которые делят на обязательные и дополнительные методы обследования мужчин. К обязательным методам исследования инфертильности относят: спермиологическое (спермограмма, МАР-тест (mixed antiglobulinreaction, MAR-test), гормональные (исследование в сыворотке крови общего тестостерона, фолликулостимулирующего гормона, лютеинезирующего гормона), пролактина, тиреотропный гормона, ингибин В, витамин Д), микробиологические (бактериологическое исследование эякулята), методы ДНК-диагностики (полимеразная цепная реакция ‒ ПЦР), сонографические (ультразвуковое исследование органов мошонки с допплерографией вен лозовидного сплетения).
К дополнительным методам исследования эякулята относят: биохимическое исследование эякулята, тест на ДНК фрагментацию спермы, определение активных форм кислорода в сперме (Reactive Oxygen Species (ROS), тест на оплодотворяющую способность (HBA-тест, hualuronbinding assay), электронно-микроскопическое исследование сперматозоидов (ЭМИС), тест на зрелость сперматозоидов по соотношению гистон/протамин, функциональные тесты Шуварского, Курцрока-Миллера, данные о значении конденсации целостности ДНК ядра [7].
Для того чтобы получить более подробные данные биологических основ мужского бесплодия, разработан ряд функциональных тестов, направленных на оценку способности спермиев осуществлять оплодотворение. Данные о значении конденсации целостности ДНК ядра показывают ассоциацию между целостностью ДНК, организацией хроматина в сперматозоидах и фертильностью, повышая, при этом, вероятность появления ошибок в генетическом материале.
Одной из самых частых причин нарушений в ДНК сперматозоида является возникновение микроповреждений (фрагментаций). К наиболее распространённым методам диагностики ДНК фрагментации относятся:
- TUNEL (terminal deoxynucleotidyl transferase (TdT) mediated dUTP nick end labeling)
- выявляет разрывы в ДНК с помощью уридина на 3-OH конце; – SCSA (sperm cromatin structure assay) – выявляет ss и ds ДНК с помощью акридинового оранжевого и позволяет определить индекс фрагментации;
- COMET
- электрофорез фрагментов ДНК, полученных в нейтральных условиях (ds разрывы ДНК);
- SCD – выявляет степень фрагментации ДНК в образцах спермы в результате хроматической дисперсии.
При анализе эякулята мужчин группы контроля по сравнению с парами с привычным невынашиванием беременности были выявлены различные формы патоспермии: снижение количества прогрессивно-подвижных сперматозоидов почти у 30%, снижение количества морфологически нормальных сперматозоидов более чем у половины пациентов, повышение количества сперматозоидов с фрагментированной ДНК (17%), повышение сперматозоидов с нарушением упаковки ядерного хроматина (11,8% – 23,6%) [3].
Eisenberg ML в 2017 году провёл исследование качества спермы и невынашивания беременности в когорте пар, включённых в исследования до зачатия [8]. Из 347 пар, у которых во время исследования наступила беременность в 98 случаях (28%) произошла её потеря. Между парами, потерявшими и сохранившими беременность, не отмечено различий по объёму эякулята, концентрации, общему количеству, жизнеспособности и морфологии сперматозоидов. У мужчин в парах, потерявших беременность, качество спермы (по совокупности всех оцененных показателей) была хуже, чем у мужчин в парах, сохранивших беременность. Процентные доли по фрагментации ДНК также были сходными в группах невынашивания/сохранения беременности, но показатели более 30% были положительно связаны с потерей беременности.
Также в 2017 году проведено исследование фрагментации ДНК спермы в итальянских парах с привычным невынашиванием беременности [9]. Обследовано 112 мужчин из пар с привычным невынашиванием беременности. За исключением объёма эякулята, показатели спермограммы у фертильных и с привычным невынашиванием пар были сопоставимы и были лучше, чем у бесплодных. Средние показатели фрагментации ДНК показали положительную корреляцию с возрастом пациентов, с привычным невынашиванием беременности и количеством выкидышей. Результаты показывают корреляцию между увеличением фрагментации ДНК и нарушением репродуктивной функцией, как с точки зрения оплодотворения, так и невынашивания беременности.
Bareh GM, Jacoby EС et al в 2016 году исследовали корреляцию нормозооспермии и невынашивания беременности – средние показатели фрагментации ДНК спермиев у больных с нормозооспермией и невынашиванием беременности в 4 раза больше, чем в группе контроля (36,8% против 9,4%) [10].
Согласно исследованиям Agarwal A, Prabakaran S и Allamaneni SS высокие уровни фрагментации ДНК негативно влияют на некоторые показатели ВРТ: частоту оплодотворения, скорость деления эмбрионов, имплантацию, беременность, коэффициент рождаемости [11]. Авторы считают, что повреждения ДНК могут служить диагностическим маркёром негативного отцовского эффекта в отношении преимплантационного развития человека. Сперматозоиды со значительным уровнем повреждения ДНК могут блокировать развитие бластоцист и имплантации [12, 13].
Все вышеперечисленное несомненно определяет высокую актуальность проблемы фрагментации ДНК в развитии замершей беременности и обуславливает необходимость её глубокого изучения.
Цель исследования. Повышение эффективности диагностики пар с двумя и более замершими беременностями в анамнезе.
Материалы и методы
Обследованы 38 пациентов в возрасте от 22 до 38 лет с диагнозом бесплодие. В анамнезе у всех пар 2 и более замерших беременностей на сроках до 10 недель. Повторные беременности наступали в течение года, однако вновь приводили к замершим беременностям. Критерием исключения были: наличие у супруги выявленных изменений в гемостазе и гормональных показателях, как одних из значимых факторов невынашивания беременности.
Оценка оплодотворяющей способности эякулята проводилась в соответствии с критериями рекомендованными ВОЗ (2010) в клинико-диагностической лаборатории, спермограмма выполнялась с использованием строгих критериев Крюгера, MAР-тест. Морфологический анализ эякулята проводили на обработанных отмытых сперматозоидах, окрашенных по методу DiffQuick. ДНК фрагментацию спермы выполнялась с помощью методики TUNEL.
Результаты
При анализе эякулята, только у 18,4% пациентов, выявлена нормозооспермия. Кроме того, у 7,9% пациентов выявлены сочетания нескольких форм патоспермии – астенотератозооспермия (рис. 1).
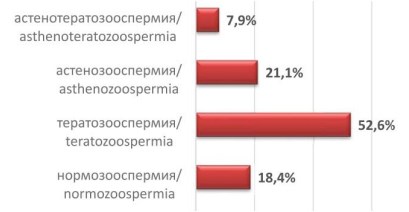
Рисунок 1. Частота встречаемости различных патологий эякулята в исследуемой группе
При исследовании эякулята на ДНК-фрагментацию, патология была выявлена у 30 (79%) пациентов (рис. 2). Кроме того, у 22 (73%) ДНК фрагментация составляла 15-20%, у 7 (23%) – 21-30%, у 1 (4%) более 30% (рис. 2).
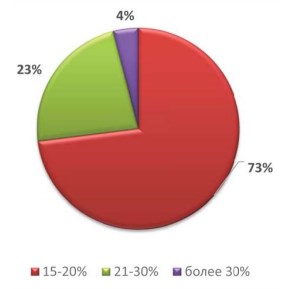
Рисунок 2. Частота встречаемости разных степеней повреждения ДНК сперматозоидов в исследуемой группе
Таким образом, при исследовании спермы мужчин, супруги, которых имели в анамнезе 2 и более замершие беременности, наиболее часто встречается тератозооспермия (52,63%). Однако данная патология не всегда является монопричиной. При использовании более углублённого обследования, в частности определение ДНК фрагментации спермы, оказывается, что лишь около 20% исследуемых не имеют данную патологию.
Обсуждение
Наличие разрывов в ДНК может служить индикатором апоптоза ‒ программируемой клеточной гибели. На основании Кохрановского обзора 2011 года от 30% до 80% мужчин субфертильны вследствие действия оксидативного стресса [14].
Существует масса факторов, приводящих к появлению разрывов в ДНК сперматозоидов: вредные привычки (табакокурение, алкоголь, наркотические вещества), электромагнитное излучение, влияние токсинов (хлоросодержащие соединения, пестициды и т. д.), травмы и перекруты яичек, воспалительные заболевания мочеполовой системы [7].
Номногими исследователями отмечается, что параметры фрагментации не имеют чёткой корреляции с параметрами спермограммы (в частности концентрацией, подвижностью, морфологие [10, 12, 13]. Ряд исследователей отмечают, что нет достоверной разницы в апоптотическом индексе между нормальными и аномальными сперматозоидами по критериям ВОЗ [7].
Выводы
Полученные результаты свидетельствуют о необходимости дальнейшего изучения вклада патоспермии, тератозооспермии в репродуктивные потери. Учитывая наличие ДНК фрагментации в развитии замерших беременностей, имеет смысл внести данное исследование в стандарт обследования мужчин, а также углубить поиск предикторов данного состояния.
Литература
- WHO Manual for the Standardized Investigation, Diagnosis and Management of the Infertile Ma le. Cambridge. Cambridge University Press; 2009.
- A Jungwirth (Ed.), T Diemer, GR Dohle et al. Guidelines on Male Infertility. European Association of Urology; 2015.
- Oumaima A, Tesnim A, Zohra H, Amira S, Ines Z, Sana C, Intissar G, Lobna E, Ali J, Meriem M. Investigation on the origin of sperm morphological defects: oxidative attacks, chromatin immaturity, and DNA fragmentation. Environ Sci Pollut Res Int. 2018;25(14):13775-13786. DOI: 10.1007/s11356- 018-1417-4
- Ибишев Х.С., Магомедов Г.А., Рябенченко Н.Н. Причастность папилломавирусной инфекции к нарушению мужской фертильности. Вопросы урологии и андрологии. 2018;6(3):22-27. DOI: 10.20953/2307-6631-2018-3-22-27
- Ибишев Х.С., Коган М.И., Магомедов Р.Г., Крайний П.А. Современный взгляд на патогенетические основы хронического рецидивирующего бактериального простатита. Эффективная фармакотерапия. 2017;42:6-10. eLIBRARY ID: 30798487
- Nieschlag E, Behre HM, Nieschlag S (Ed). Andrology: Male Reproductive Health and Disfunction. 3rd. 2010.
- Руководство по клинической андрологии. Под редакцией Виноградова И.В. 2018.
- Eisenberg ML, Sapra KJ, Kim SD, Chen Z, Buck Louis GM. Semen quality and pregnancy loss in a contemporary cohort of couples recruited before conception: data from the Longitudinal Investigation of Fertility and the Environment (LIFE) Study. Fertil Steril. 2017;108(4):613-619. DOI: 10.1016/j. fertnstert.2017.07.008.
- Carlini T, Paoli D, Pelloni M, Faja F, Dal Lago A, Lombardo F, Lenzi A, Gandini L. Sperm DNA fragmentation in Italian couples with recurrent pregnancy loss. Reprod Biomed Online. 2017;34(1):58-65. DOI: 10.1016/j.rbmo.2016.09.014.
- Bareh GM, Jacoby E, Binkley P, Chang TC, Schenken RS, Robinson RD. Sperm deoxyribonucleic acid fragmentation assessment in normozoospermic male partners of couples with unexplained recurrent pregnancy loss: a prospective study. Fertil Steril. 2016;105(2):329-36.e1. DOI: 10.1016/j. fertnstert.2015.10.033
- Agarwal A, Prabakaran S, Allamaneni SS. Relationship between oxidative stress, varicocele and infertility: a metaanalysis. Reprod Biomed Online. 2006;12(5):630-633. PMID: 16790111
- Tesarik J, Mendoza C. Eff ects of exogenous LH administration during ovarian stimulation of pituitary down-regulated young oocyte donors on oocyte yield and developmental competence. Hum Reprod. 2002;17(12):3129-3137. PMID: 12456612
- Benchaib M, Braun V, Lornage J, Hadj S, Salle B, Lejeune H, Guérin JF. Sperm DNA fragmentation decreases the pregnancy rate in an assisted reproductive technique. Hum Reprod. 2003;18(5):1023-1028. PMID: 12721180
- Showell MG, Mackenzie-Proctor R, Brown J, Yazdani A, Stankiewicz MT, Hart RJ. Antioxidants for male subfertility. Cochrane Database Syst Rev. 2014;(12):CD007411. DOI: 10.1002/14651858.CD007411.pub3
Статья опубликована в журнале "Вестник урологии" № 1 2019, стр. 7-11











Комментарии