М.Б. Чибичян1 , Е.А. Черногубова2 , А.В. Аветян1
1 ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ; Ростов-на-Дону, Россия
2 ФГБУН «Федеральный исследовательский центр Южный научный центр Российской академии наук»; Ростов-на-Дону, Россия
Введение
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является наиболее распространённой болезнью у мужчин пожилого возраста и причиной симптомов нижних мочевых путей (СНМП) вследствие обструкции выходного отверстия мочевого пузыря [1]. Симптомы варьируют от ургентного недержания до острой задержки мочи. Также известно, что значимые СНМП встречаются у 10-20% мужчин в возрасте 50-59 лет и увеличиваются до 1/3 мужчин в возрасте 70-79 лет. В Канаде СНМП (от выраженных до умеренных проявлений) обнаружили у 23% обследованных. В Германии приблизительно у 30% мужчин от 50 до 80 лет есть проявления этих симптомов. Параллельно увеличивается объем простаты в возрасте от 40 до 79 лет, причём наибольшее увеличение наблюдается на 6-м и 7-м десятилетиях жизни. ДГПЖ также связана с серьёзными осложнениями, включающими мочевую инфекцию, камни мочевого пузыря и почечную недостаточность. Гистологически ДГПЖ встречается приблизительно у 50% мужчин в возрасте 50 лет, и её распространённость увеличивается на 10% каждое последующее десятилетие жизни. ДГПЖ развивается в переходной зоне предстательной железы и в периуретральных железах. ДГПЖ представляет собой доброкачественный пролиферативный процесс и не считается предшественником рака простаты. При ДГПЖ увеличивается число клеток как в эпителиальном, так и в стромальном компонентах, но, как правило, больше в строме [2].
Патофизиология ДГПЖ плохо изучена, хотя известно, что в ней задействованы передача андрогенэргических сигналов, реактивность стромы железы и фактор воспаления. Во время развития гиперплазии простаты андрогены, повидимому, действуют главным образом через строму предстательной железы, вызывая пролиферацию и дифференцировку эпителия [3]. Геномные технологии привели к более глубокому пониманию рака человека, и более 15 лет назад исследователи использовали ДНК-микрочипы, чтобы начать исследовать ДГПЖ. Middleton L.W. et al. проводили генетические исследования, которые обнаружили новые сигнальные гены такие как BMP5 (костный морфогенетический белок, известен своей способностью индуцировать развитие костной и хрящевой ткани, а также, может играть определенную роль в некоторых видах опухолей) и CXCL13 (группа антиапоптозных генов Bcl2), экспрессия которых оказалась повышенной в ткани ДГПЖ, а точнее в строме, и уровень данной экспрессии коррелировал с симптомами ДГПЖ [4].
Наряду с вышеизложенным, нашими исследованиями было показано, что нарушение баланса между протеиназами и ингибиторами калликреин-кининовой и ренин-ангиотензиновой систем в секрете простаты при доброкачественных и злокачественных новообразованиях в предстательной железе является основой «биохимической индивидуальности» процессов онкотрансформации простаты [5, 6]. На основе этих исследований идентифицированы новые диагностические маркеры клинически агрессивных форм рака предстательной железы [7, 8].
Накапливаются данные, подтверждают теорию последовательного канцерогенеза в ткани предстательной железы. При утяжелении степени хронического воспаления и фиброза нарастает степень дисплазии в ткани простаты [9].
В связи этим, представляет интерес исследование активности ферментов и ингибиторов ренин-ангиотензиновой и калликреин-кининовой систем при ДГПЖ.
Материалы и методы
Клиническую группу составили 32 пациента с ДГПЖ (средний возраст – 66,7±8,53 лет, средний объем простаты – 68,67±16,9см3 (табл.1), средний уровень ПСА – 4,38±2,1нг/мл). 70% пациентов имели симптомы нижних мочевыводящих путей, которые длились от нескольких месяцев до 10 и более лет (рис.1). СНМП характеризовались следующими нарушениями мочеиспускания: ноктурия, учащённое мочеиспускание малыми порциями, затруднённое мочеиспускание, увеличение времени мочеиспускания, необходимость напрягать брюшную стенку, императивные позывы к мочеиспусканию. У более половины пациентов преобладала ирритативная симптоматика. IPSS варьировал от 12 до 22 баллов. Объём остаточной мочи колебался от 0 до 90 мл. Пациенты с СНМП находились на терапии препаратами группы α-адреноблокаторов и ингибиторов м-холинорецепторов.
Таблица 1. Распределение пациентов по объёму простаты
| Объём простаты | Пациенты, n | % |
| 21-40 | 5 | 15,6 |
| 41-60 | 9 | 28,3 |
| 61-80 | 11 | 34,3 |
| 81-100 | 7 | 21,8 |
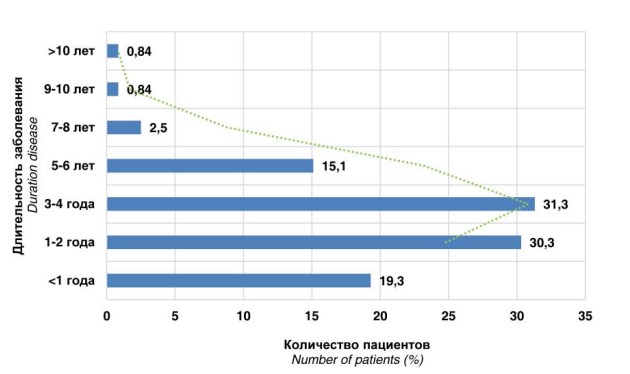
Рисунок 1. Длительность СНМП
Контрольную группу составили 20 практически здоровых мужчин сопоставимых по возрасту с пациентами клинической группы. Работы с биологическими материалами, полученными у пациентов, были проведены в соответствии с Национальным стандартом РФ «Надлежащая клиническая практика» (Good Clinical Practice; GCP) [10].
Определяли активность ангиотензинпревращающего фермента (АПФ), КФ 3.4.15.1) с использованием в качестве субстрата фурилакрилоилфенилаланил-глицилглицина [11], калликреиноподобную активность (КФ 3.4.21.8) и содержание прекалликреина после отделения от других сериновых протеиназ с помощью ионообменной хроматографии на ДЭАЭ-сефадексе А-50 по скорости гидролиза N-бензоил-1-аргинин этилового эфира (БАЭЭ) [12], общую аргинин-эстеразную активность по отношению к БАЭЭ, характеризующую активность трипсиноподобных протеиназ [13], ингибиторную активность ?1 -протеиназного ингибитора (?1 -ПИ) и ?2 -макроглобулина (?2 -МГ) унифицированным энзиматическим методом в секрете простаты (после его разведения в соотношении 1:9 физиологическим раствором [14, 15, 16].
Обработку полученных данных проводили общепринятыми методами медицинской статистики с использованием U-критерия Манна-Уитни с применением пакета прикладных программ Statistica*. Данные представлены в виде медианы и интерквартильного размаха – Me [LQ–UQ]. Статистически достоверными считали отличия на уровне р < 0,05 [17].
Результаты и обсуждение
Результаты исследования показали, что при ДГПЖ в секрете простаты отмечена резкая активация протеолиза, о чём свидетельствует увеличение калликреиноподобной (p<0,001) и общей аргинин-эстеразной (p<0,001) активности по сравнению с соответствующими показателями в контрольной группе (табл. 2).
Увеличение калликреиноподобной активности (p<0,001) на фоне снижения содержания прекалликреина в секрете простаты свидетельствует об интенсификации калликреинообразования, что приводит к накоплению ключевого эффекторного пептида калликреин-кининой системы – брадикинина.
Плейотропные функции брадикинина реализуются при взаимодействии с двумя брадикининовыми рецепторами – В1 и В2. Ранее нами показано, что у пациентов с ДГПЖ экспрессия В1 полностью отсутствует, а экспрессия В2 отмечается в строме как при ДГПЖ, так и при раке простаты [18]. Необходимо отметить, что В2 присутствует конституитивно во многих органах и тканях, тогда как экспрессия В1 индуцируется при стрессе, травмах и воспалении [19]. Таким образом, фактором, лимитирующим развитие гиперплазии простаты, является отсутствие брадикиновых рецепторов В 1 в ткани предстательной железы.
На первичных культурах нормальных стромальных клеток простаты человека показано, что брадикинин активирует рецепторы брадикинина B2, которые могут играть существенную роль в пролиферации посредством активации путей внеклеточных сигнальных киназ ERK-1/2 [20].
Таблица 2. Параметры протеолитических факторов в секрете предстательной железы при ДГПЖ, Me [LQ; UQ]
| Исследуемые показатели | Контроль (n=34) | ДГПЖ (n=36) | Р |
| Активность ангиотензинпревращающего фермента, мкМ/мин/л | 19,24 [13,79; 20,32] | 54,17 [50,30; 59,94] | <0,001 |
| Калликреинподобная активность, нмоль/мин/мл | 5,62 [4,88; 6,22] | 20,24 [15,18; 22,64] | <0,001 |
| Содержание прекалликреина, нмоль/мин/мл | 273,52 [264,00; 281,12] | 194,7 [177,7; 393,2] | <0,05 |
| Общая аргинин-эстеразная активность, Мед/мл | 18,96 [16,02; 24,12] | 45,62 [31,22; 57,37] | <0,001 |
| Ингибиторная активность α2 -макроглобулина, ИЕ/мл | 0,160 [0,102; 0,190] | 0,23 [0,172; 0,350] | <0,001 |
| Ингибиторная активность α1-протеиназного ингибитора, ИЕ/мл | 2,29 [1,52;3,08] | 12,22 [10,90; 14,94] | <0,001 |
Особого внимания заслуживает резкое увеличение при ДГПЖ активности АПФ (p<0,001), что приводит к накоплению ключевого эффекторного пептида ренин-ангиотензиновой системы – ангиотензина II (Анг II) в секрете простаты. Субстратом АПФ является не только ангиотензин I, но и брадикинин. Следствием активации АПФ в секрете простаты может быть некоторое снижение содержания брадикинина.
АПФ играет ключевую роль в регуляции артериального давления и ремоделировании сосудов, а также в репродуктивных функциях организма. Ангиотензинпревращаюший фермент конституитивно экспрессируется на поверхности эндотелиальных клеток, эпителиальных и нейроэпителиальных клеток и клеток иммунной системы (макрофаги, дендритные клетки) [21]. АПФ также представлен в растворимой форме в биологических жидкостях, среди которых семенная жидкость является самой богатой по содержанию АПФ - в 50 раз больше, чем в крови.[22]
В нормальной предстательной железе иммунореактивность Анг II локализована в базальном слое эпителия, а иммуноокрашивание рецептора Анг II первого типа (AT1R) обнаружено преимущественно на гладких мышцах стромы, а также на гладких мышцах простатических кровеносных сосудов. Предполагают, что Анг II может опосредовать паракринные функции в отношении роста клеток и тонуса гладких мышц в предстательной железе человека. При ДГПЖ иммунореактивность Анг II заметно увеличена в гиперпластических ацинусах по сравнению с ацинусами в нормальной простате, а иммунореактивность рецептора AT1R, напротив, значительно снижена. Подавление рецептора AT1R при ДГПЖ может быть связано с гиперстимуляцией рецептора повышенными локальными уровнями Анг II [23].
Активация ренин-ангиотензиновой системы при ДГПЖ, возможно, способствует патофизиологии этого расстройства путем усиления местного симпатического тонуса и роста клеток [24].
Эти данные подтверждают концепцию, что активация ренин-ангиотензиновой и калликреин-кининовой систем может быть вовлечена в патофизиологию ДГПЖ.
Интенсификация протеолиза в секрете простаты при ДГПЖ компенсируется увеличением его антипротеолитического потенциала. Так, ингибиторная активность α1 -протеиназного ингибитора (p<0,001 и α2 -макроглобулина (p<0,001) в секрете превышает аналогичные показатели в контрольной группе.
α1 -протеиназный ингибитор – белок острой фазы воспаления, является основным эндогенным регулятором эластазолитической активности и секретируется во время воспаления, снижая тем самым протеолитическую активность лейкоцитарной эластазы в месте воспаления. Резкое увеличение ингибиторной активности α1 - протеиназного ингибитора в секрете простаты при ДГПЖ свидетельствует о росте дегрануляционной активности лейкоцитов на фоне развития воспалительного процесса. Этот факт заслуживает особого внимания в связи с тем, что в настоящее время вопрос о провоцирующей роли хронического воспаления в пролиферативных заболеваниях простаты активно обсуждается.
О повышении уровня α1 -протеиназного ингибитора в сыворотке крови, как маркера воспаления, у онкологических больных хорошо известно. Роль α1 -протеиназного ингибитора в канцерогенезе и метастазировании признана, но недостаточно выяснена. Установлено, что статус экспрессии α1 -протеиназного ингибитора в опухолевых клетках может представлять собой прогностический биомаркер роста и прогрессирования опухоли [25]. Повышение уровня α1 -протеиназного ингибитора в плазме крови признано потенциальным диагностическим и прогностическим маркёром опухоли [26].
Отмечена корреляция между уровнем ПСА и α1 -протеиназным ингибитором в сыворотке крови у мужчин без и с раком простаты. У мужчин с ПСА> 2 нг/мл содержание α1 -протеиназного ингибитора было значительно выше, чем у мужчин с ПСА < 2 нг/мл [27] Обнаружено, что α1 - протеиназный ингибитор связывает ПСА в сыворотке крови. Комплекс ПСА-α1 -протеиназный ингибитор в сыворотке крови составляет 1,0-7,9% от общего ПСА (tPSA) при раке предстательной железы и 1,3 - 12,2% у пациентов с ДГПЖ [28].
α2 -Макроглобулин играет важную роль в регуляции процессов воспаления, так как ограничивает субстратную специфичность большинства протеолитических ферментов, превращая протеазы в пептидазы, которые гидролизуют низкомолекулярные пептиды, являющиеся медиаторами воспалительных процессов. Наряду с другими протеазами α2 -макроглобулин связывает и ПСА. Комплекс ПСА с α2 -макроглобулином не способен расщеплять белки, но сохраняет способность расщеплять небольшие пептидные субстраты. При распространённом раке предстательной железы в обращении может находиться достаточное количество комплекса ПСА с α2 -макроглобулином, чтобы влиять на общие уровни α2 -макроглобулина, уровни цитокинов, связанных с α2 -макроглобулином, и гидролизовать небольшие циркулирующие пептидные гормоны [29]. Изменения в уровнях цитокинов и протеолитическая деградация малых пептидных гормонов могут оказывать глубокое влияние на взаимодействие между хозяином и опухолью. Кроме того, α2 -макроглобулин является основным транспортером регуляторных цитокинов к клеткам, участвует в процессинге и презентации антигенов, в передаче сигнала к клетке и в запуске каскада внутриклеточных реакций, влияет на антителогенез [30].
До недавнего времени мы полагали, что обнаруженная в секрете простаты при ДГПЖ высокая ингибиторная активность α2 - макроглобулина, свидетельствует о повреждении гематопростатического барьера и развитии мембранопатии. Однако, α2 -макроглобулина экспрессируется в строме предстательной железы человека [31]. Учитывая уникальные свойства α2 - макроглобулина, его высокая экспрессия в предстательной железе, может играть важную роль в регуляции доброкачественного и злокачественного роста предстательной железы.
Заключение
При ДГПЖ отмечено резкое увеличение активности ангиотензинпревращающего фермента, калликреиноподобной и общей аргининэстеразной активности в секрете простаты, что приводит к накоплению ангиотензина II и брадикинина. Интенсификация протеолиза в секрете простаты при ДГПЖ компенсируется увеличением его антипротеолитического потенциала за счёт повышения ингибиторной активности α1 - протеиназного ингибитора и α2 -макроглобулина.
Нарушение активности ферментных систем участвующих в метаболизме ангиотензина II и брадикинина в простате играет важную роль в патогенезе ДГПЖ. Полученные данные расширяют представления о роли ренин-ангиотензиновой и калликреин-кининовой систем в патофизиологии ДГПЖ, отдельные показатели которых могут рассматриваться как новые терапевтические мишени при ДГПЖ.
ЛИТЕРАТУРА
- Chapple CR, Wein AJ, Abrams P, Dmochowski RR, Giuliano F, Kaplan SA, McVary KT, Roehrborn CG. Lower urinary tract symptoms revisited: a broader clinical perspective. Eur Urol. 2008;54(3):563-56. DOI: 10.1016/j.eururo.2008.03.109
- Gharaee-Kermani M, Kasina S, Moore BB, Thomas D, Mehra R, Macoska JA. CXC-type chemokines promote myofi broblast phenoconversion and prostatic fi brosis. PLoS One. 2012;7(11):e49278.23. DOI: 10.1371/journal.pone.0049278
- Vignozzi L, Gacci M, Cellai I, SantiR, Corona G, Morelli A, Rastrelli G, Comeglio P, Sebastanelli A, Maneschi E, Nesi G, De Nunzio C, Tubaro A, Mannucci E, Carini M, Maggi M. Fat boosts, while androgen receptor activation counteracts, BPH-associated prostate infl ammation. Prostate. 2013;73(8):789-800. DOI: 10.1002/pros.22623
- Middleton LW, Shen Z, Varma S, Pollack AS, Gong X, Zhu S, Zhu C, Foley JW, Vennam S, Sweeney RT, Tu K, Biscocho J, Eminaga O, Nolley R, Tibshirani R, Brooks JD, West RB, Pollack JR. Genomic analysis of benign prostatic hyperplasia implicates cellular re-landscaping in disease pathogenesis. JCI Insight. 2019;4(12):e129749. DOI: 10.1172/jci.insight.129749
- Коган М.И., Черногубова Е.А., Чибичян М.Б., Матишов Д.Г. Активность протеолитических ферментов и их ингибиторов в секрете простаты при доброкачественной гиперплазии и раке предстательной железы. Онкоурология. 2011;7(2):46-51. DOI: 10.17650/1726-9776-2011-7- 2-46-51
- Коган М.И., Черногубова Е.А., Чибичян М.Б., Мационис А.Э., Повилайтите П.Э., Матишов Д.Г. Роль калликреинкининовой и ренин-ангиотензиновой систем в патогенезе рака предстательной железы. Урология. 2015;3:50-54.
- Чибичян М.Б., Коган М.И., Черногубова Е.А., Павленко И.А., Матишов Д.Г. Роль рецепторов ангиотензина II второго типа в прогнозировании биохимического рецидива при терапии рака предстательной железы. Урология. 2016; 3:89-94.
- Коган М.И., Черногубова Е.А., Чибичян М.Б., Матишов Д.Г. Ангиотензинпревращающий фермент – новый прогностический маркер рецидива при терапии рака предстательной железы. Онкоурология. 2016;12(2):46-51. DOI: 10.17650/1726-9776-2016-12-4-87-93
- Горбунова Е.Н., Давыдова Д.А., Крупин В.Н. Хроническое воспаление и фиброз как факторы риска простатических интраэпителиальных неоплазий и рака предстательной железы. Соврем технол мед. 2011;(1):79-83.
- ГОСТ Р 52379-2005 Национальный стандарт РФ «Надлежащая клиническая практика» (Good Clinical Practice; GCP), (утверждён приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 г. N 232-ст). Доступно по: http://docs.cntd.ru/ document/1200041147 Ссылка активна на 25.06.2018.
- Яровая Г.А., Нешкова А.Е. Калликреин-кининовая система. Прошлое и настоящее. (к 90-летию открытия системы). Биоорганическая химия. 2015; 41(3): 275–291. DOI: 10.7868/S0132342315030112
- Пасхина Т.С., Кринская А.В. Упрощенный метод определения калликреиногена и калликреина в сыворотке (плазме) крови человека в норме и при некоторых патологических состояниях. Вопросы медицинской химии. 1974; 20(6): 660-663
- Пасхина, Т.С., Яровая Г.А. Калликреин сыворотки крови человека. Активность фермента и хроматографический метод определения. Биохимия. 1970;35(5):1055-1058.
- Нартикова В.Ф., Пасхина Т.С. Унифицированный метод определения активности α1 -антитрипсина и α2 - макроглобулина в сыворотке (плазме) крови человека. Вопросы медицинской химии. 1979; 25(4):494-502.
- Доценко В.Л., Нешкова Е.А., Яровая Г.А. Выявление лейкоцитарной эластазы человека из комплекса с плазменным α1 -протеиназным ингибитором по ее энзиматической активности с синтетическим субстратом. Вопросы медицинской химии. 1994;40(3):20-25.
- Парфенкова Г.А., Оглоблина О.Г., Домба Г.Ю. Клиническое значение определения активности эластазо- и химитрипсиноподобных протеиназ в плазме крови больных неспецифическим аортоартериитом и атеросклерозом. Кардиология. 1989;9:94-96.
- Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: МедиаСфера; 2002.
- Чибичян М.Б., Мационис А.Э., Повилайтите П.Э., Коган М.И. Роль рецепторного аппарата калликреин-кининовой системы в пролиферативных процессах предстательной железы. Онкоурология. 2013;(1):43-50.
- Leeb-Lundberg LM, Marceau F, Müller-Esterl W, Peƫ bone DJ, Zuraw BL. International union of pharmacology. XLV. Classifi cation of the kinin receptor family: from molecular mechanisms to pathophysiological consequences. Pharmacol Rev. 2005;57:27-77. DOI: 10.1124/pr.57.1.2
- Srinivasan D, Kosaka AH, Daniels DV, Ford AP, Bhattacharya A. Pharmacological and functional characterization of bradykinin B2 receptor in human prostate. Eur J Pharmacol. 2004;504(3):155-67. PMID: 15541417
- Bernstein KE, Ong FS, Blackwell WL, Shah KH, Giani JF, Gonzalez-Villalobos RA, Shen XZ, Fuchs S, Touyz RM. A modern understanding of the traditional and nontraditional biological functions of Angiotensin-converting enzyme. Pharmacol Rev. 2013:65: 1-46. DOI: 10.1124/pr.112.006809
- Kryukova OV, Tikhomirova VE, Golukhova EZ, Evdokimov VV, Kalantarov GF, Trakht IN, Schwartz DE, Dull RO, Gusakov AV, Uporov IV, Kost OA, Danilov SM. Tissue Specificity of Human Angiotensin I-Converting Enzyme. PLoS One. 2015;10(11):e0143455. DOI: 10.1371/journal. pone.0143455
- Dinh DT, Frauman AG, Somers GR, Ohishi M, Zhou J, Casley DJ, Johnston CI, Fabiani ME. Evidence for activation of the renin-angiotensin system in the human prostate: increased angiotensin II and reduced AT(1) receptor expression in benign prostatic hyperplasia. J Pathol. 2002;196(2):213-9. DOI: 10.1002/path.1021
- Fabiani ME, Sourial M, Thomas WG, Johnston CI, Johnston CI, Frauman AG. Angiotensin II enhances noradrenaline release from sympathetic nerves of the rat prostate via a novel angiotensin receptor: implications for the pathophysiology of benign prostatic hyperplasia. J Endocrinol. 2001;171(1):97-108. PMID: 11572794
- Kwon CH, Park HJ, Lee JR, Kim HK, Jeon TY, Jo HJ, Kim DH, Kim GH, Park DY. Serpin peptidase inhibitor clade a member 1 is a biomarker of poor prognosis in gastric cancer. Br J Cancer. 2014:111:1993–2002. DOI: 10.1038/bjc.2014.490
- Zhao W, Yang Z, Liu X, Tian Q, Lv Y, Liang Y, Li C, Gao X, Chen L. Identification of α1-antitrypsin as a potential prognostic biomarker for advanced nonsmall cell lung cancer treated with epidermal growth factor receptor tyrosine kinase inhibitors by proteomic analysis. J Int Med Res. 2013;41:573– 583. DOI: 10.1177/0300060513476582
- Kuvibidila S, Rayford W. Correlation between serum prostate-specifi c antigen and alpha-1-antitrypsin in men without and with prostate cancer. J Lab Clin Med. 2006;147(4):174- 81. PMCID 16581345
- Zhang WM, Finne P, Leinonen J, Stenman UH. Characterization and determination of the complex between prostatespecifi c antigen and α1-protease inhibitor in benign and malignant prostatic diseases. Scand J Clin Lab Invest Suppl. 2000;60(233):51-58. DOI: 10.1080/clb.60.233.51.58
- Kostova MB, Brennen WN, Lopez D, Anthony L, Wang H, Platz E, Denmeade SR. PSA-alpha-2-macroglobulin complex is enzymatically active in the serum of patients with advanced prostate cancer and can degrade circulating peptide hormones. Prostate. 2018;78(11):819-829. DOI: 10.1002/ pros.23539
- Зорин Н.А., Зорина В.Н., Зорина Р.М. Универсальный модулятор цитокинов α2 -макроглобулин. Иммунология. 2004; 25(5): 302-304.
- Geƫ ns PG. Serpin structure, mechanism, and function. Chem. Rev. 2002;102(12):4751–4804. DOI: 10.1021/cr010170
Статья опубликована в журнале "Вестник урологии" №2 2019, стр. 69-73









Комментарии