Х.С. Ибишев, Д.В. Крахоткин, А.А. Васильев, П.А. Крайний
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России; Ростов-на-Дону, Россия - Тел. +7 (928) 777-77-14; e-mail: Ibishev22@mail.ru
Введение
Рецидивирующие инфекции нижних мочевых путей (РИНМП) у женщин являются одной из наиболее актуальных и обсуждаемых проблем современной урологии, характеризующиеся полиэтиологичностью патогенетических факторов [1,2].
Частота регистрации РИНМП увеличивается с возрастом, зависит от пола, чаще отмечается у женщин (25-35%) в возрасте 20- 40 лет, чем у мужчин (0,7-0,8%) [3].
По данным ряда рандомизированных исследований, проведенных за последние годы, РИНМП у женщин имеет многогранный характер клинических проявлений: болевой синдром, симптомы нижних мочевых путей (СНМП), а также нейровегетативные и сексуальные нарушения, которые существенно ухудшают качество жизни данной категории пациенток [4, 5].
Широко обсуждаемым аспектом данной проблемы является изучение этиологической структуры инфекционного фактора. Наиболее частыми возбудителями, причастными к развитию РИНМП, являются грамотрицательные микроорганизмы, в частности, представители семейства энтеробактерий: E. coli, Proteus spp., K. pneumoniae, Enterobacter sp. и др. Особенно акцентируется роль уропатогенных штаммов E. coli, которые в превалирующем большинстве способствуют рецидивированию и хронизации инфекционновоспалительного процесса в нижних мочевых путях [4, 6, 7]. Дискутируется этиологическая роль коагулазоотрицательных стафилококков, в частности, Staphylococcus saprophyticus и др. [8].
В развитии РИНМП также могут участвовать дрожжеподобные грибы рода Candida, неферментирующие грамотрицательные бактерии (НГОБ), уреаплазмы, хламидии, неклостридиальные аэробные бактерии, герпесвирусная инфекция [9, 10, 11]. Дискутабельным и обсуждаемым вопросом на сегодняшний день является роль вирусной инфекции в генезе РИМП (11,12). До недавнего времени считалось, что вирусный цистит — редкое заболевание у пациентов с иммунодефицитным состоянием, однако в связи с широким использованием цитостатической и иммуносупрессивной терапии, длительного применения глюкокортикоидов, антибактериальных препаратов, нарушавших симбиотические взаимоотношения микроорганизмов в мочевых путях, наличие некоторых соматических заболеваний и др. привело к росту РИНМП вирусной этиологии [12]
В литературе практически не освещен вопрос о причастности папилломавирусной вирусной инфекции (ВПИ) к развитию рецидивирующего хронического цистита у женщин. С целью комплексного изучения инфекции мочевых путей у женщин, в том числе вирусной при хроническом рецидивирующем цистите у женщин, было проведено клиническое исследование.
Материалы и методы
В исследование включена 31 женщина (20– 45 лет). Критерии включения: рецидив симптомов инфекции нижних мочевых путей, (>2- х рецидивов год), отсутствие анатомических и функциональных нарушений мочевых путей, бактериальных патогенов при неоднократных культуральных исследованиях мочи, отсутствие ЗППП при полимеразной цепной реакции (ПЦР).
Обследование включало общеклиническое и культуральное исследования мочи, цистоскопию и морфологическое исследование биоптатов мочевого пузыря. В мазках уретры, моче и биоптатах мочевого пузыря определяли присутствие дезоксирибонуклеиновой кислоты (ДНК) хламидий, микоплазм, вируса простого герпеса (ВПГ) I и II типов, цитомегаловирусов, вируса ЭпштейнаБарр и вируса папилломы человека (ВПИ) с помощью ПЦР, УЗИ почек и мочевого пузыря. Исследование одобрено Локальным независимым этическим комитетом ФГБОУ ВО РостГМУ МЗ РФ.
Статистическая обработка полученных данных проводилась на персональном компьютере с использованием пакета прикладных программ MicrosoŌ Exel 2007 и STATISTICA (StatSoŌ 8.1). Из элементов описательной статистики вычислялись среднее арифметическое значение (М), стандартная ошибка среднего (m), число наблюдений (n) — для количественных признаков; доли и проценты пациентов с тем или иным показателем — для качественных признаков.
Статистическая значимость различий количественных признаков была оценена с использованием непараметрических (серийный критерий (S), критерии Mann-Whitney и Вилкоксона) и параметрических (t-критерий Стьюдента для зависимых и независимых групп) методов. При этом статистически значимыми считали отличия при p < 0,05.
Результаты
Доминирующим клиническими проявлениями были болевой синдром (100%), нейровегетативные нарушения (100%), императивные позывы к мочеиспусканию (90%) p>0,05. Поллакиурия регистрировалась реже, только в 16,1% случаев. При лабораторном исследовании во всех случаях выявлена лейкоцитурия и в 90% случаев — микрогематурия. Не выявлено диагностически значимой бактериурии известными уропатогенами. В средней порции мочи у всех обследованных пациенток путем ПЦР определена папилломавирусная инфекции в 100% случаев, а при исследовании мазков с уретры лишь в9,6 % случаев, доминированием 16 и 18 типов p < 0,05 ( рис. 1). Эндоскопическая картина у большинства пациенток характеризовалась экзофитными белесоватыми и/или сосудистыми изменениями слизистой мочевого пузыря, а у 54,8% случаев выявлены папилярные разрастания в шейки и треугольнике Льето, которые часто приходится дифференцировать с папиллярной уротелиальной карциномой (рис. 2).
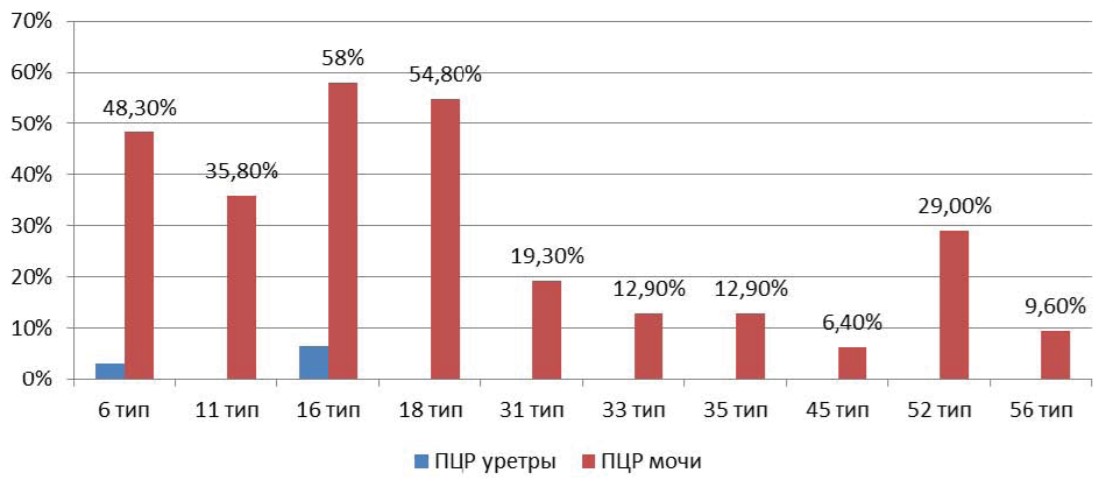
Рисунок 1. Этиологическая структура ВПЧ у пациенток при ПЦР уретры и мочи.
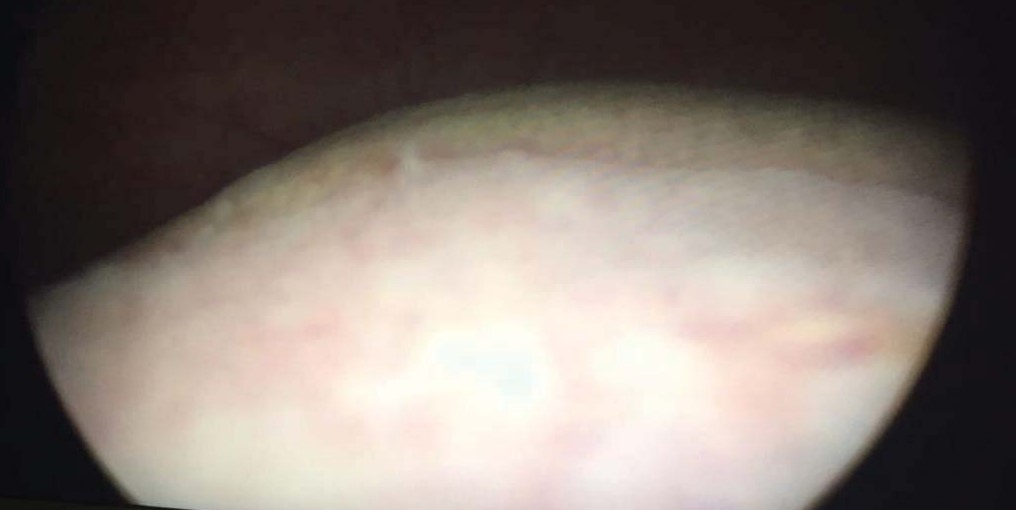
Рисунок 2. Экзофитные образования слизистой мочевого пузыря.
При гистоморфологическом исследовании биоптатов у всех обследованных пациенток отмечено наличие специфических характеристик ПВИ: папиллярной сквамозной гиперплазии с койлоцитозом и светлой цитоплазмой (рис. 3). У большинства обследованных выявлена морфологическая картина хронического воспаления, полнокровие, гиперплазия уротелия, очаговая плоскоклеточная метаплазия с пикнозом. Кроме того, у 22,5 % женщин, ПВИ была представлена в виде condyloma acuminatum мочевого пузыря (рис. 4). При анализе результатов ПЦР биопсийного материала данные корреспондировали с результатами ПЦР в средней порции мочи (рис. 5).
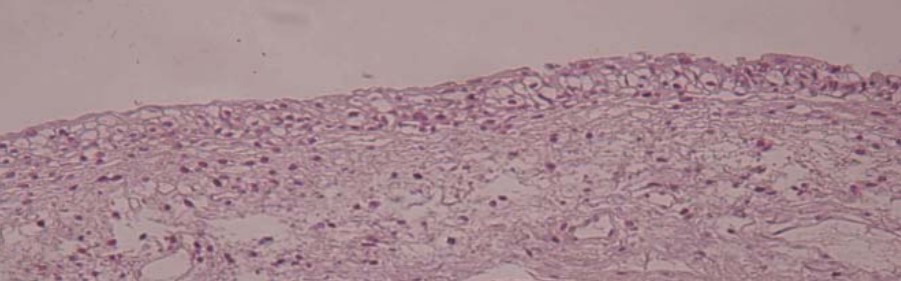
Рисунок 3. Микроскопическая картина ПВИ: папиллярная сквамозная гиперплазия с койлоцитозом, светлая цитоплазма со сморщенными ядрами.
Рисунок 4. Изменения слизистой мочевого пузыря при ПВИ ̶ кондилома.
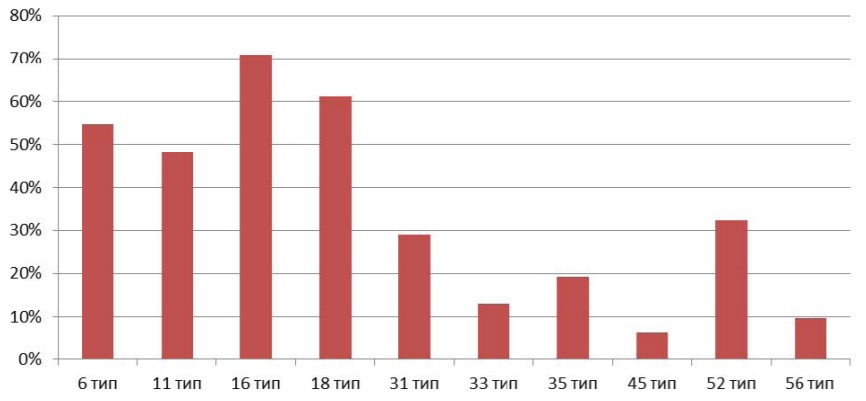
Рисунок 5. Этиологическая структура ВПЧ у пациенток при ПЦР биопсийного материала.
В биоптатах, как и в моче, доминировали ВПЧ 16 (71%), 18(61.1%), 6 (54,8%) и 11 (48,3%) типы вирусов, реже выявляли вирусы 31 (29,0%), 35 (19,3%) и 33 (12,9%), реже выделяли 45 (6,4%) и 56 (9,6%) тип ВПЧ. p < 0,05. Однако степень выявления и идентификации ПВИ была выше, чем при ПЦР мочи.
Обсуждение
При проведении комплексного обследования, включающего ПЦР-диагностику, цистоскопию с биопсией, морфологическое исследование биоптатов у женщин с рецидивирующим хроническим циститом, у которых при культуральном исследовании мочи не выявлены известные уропатогены, установлено наличие папилломавирусной инфекции в моче и биоптатах слизистой мочевого пузыря, с доминированием ВПЧ 16 и 18 типа. Используемые на сегодняшний день в клинической практике методы культуральной диагностики инфекции мочевых путей и репродуктивных органов имеют ограничения и недостатки, главным среди которых является невозможность оценить роль некультивируемых микроорганизмов, прежде всего вирусов, в инфекционно-воспалительном процессе.
В связи с этим результаты исследования показали, что у женщин с РИНМП этологическая структура представлена не только бактериальными микроорганизмами, но также вирусной инфекцией. Таким образом, полученные данные указывают на возможность участия ПВИ в развитии инфекционно-воспалительного процесса в мочевом пузыре. При этом были выявлены как высоко онкогенные (16,18,31,33,35,45, 52, 56), так и низко онкогенные типы ВПЧ (6,11). Присутствие онкогенных типов ПВИ повышает риск персистенции и хронизации вирусной инфекции, что является благоприятным условием для развития онкологического процесса в мочевом пузыре. Кроме того, степень выявления ВПЧ с помощью ПЦР в биопсийном материале была выше, чем в моче, это диктует необходимость создания комплексного диагностического подхода к данной проблеме или поиска специфических маркеров ПВИ МП. Наиболее часто регистрируемой клинической формой ПВИ была condyloma acuminatum, которая, по данным литературы, часто является предшественником инвертируемой папилломы или карциномы мочевого пузыря.
Таким образом, диагноз вирусного цистита ставится первоначально путем исключения наличия бактериальной культуры, но с клиникой РИНМ и верификацией вирусного патогена c использованием комплекса диагностических тестов, включающих ПЦР-диагностику мочи и биоптатов и морфологическое исследование. Сложность лечения РИМП требует поиска альтернативных методов профилактики и лечения при неэффективности антибактериальной терапии (13). Данное обстоятельство диктует использование иммуноактивных препаратов для решения этой сложной многогранной проблемы (14,15).
Выводы
Папилломавирусная инфекция может быть причастна к развитию рецидивирующего цистита. В этиологической структуре рецидивирующего вирусного цистита могут выступать как высоко онкогенные, так и низко онкогенные типы ВПЧ. Для лечения рецидивирующего цистита папилломавирусной этиологии должны использоваться иммуноактивные препараты с антивирусной активностью. Исследование не имело спонсорской поддержки. Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Синяков Л.А., Косова И.В. Профилактика рецидивов инфекции мочевыводящих путей. Урология. 2009;2:22-25.
2. Набока Ю.Л., Гудима И.А., Мирошничнко Е.А. Коган М. И., Ибишев Х. С., Васильева Л. И. Этиологическая структура и антибиотикочувствительность уропатогенов при хронической рецидивирующей инфекции нижних мочевых путей. Урология. 2011;6:12-16.
3. Синякова Л.А. Рецидивирующие инфекции нижних мочевых путей - междисциплинарная проблема. Медицинский совет. 2014;9:100-102
4. Ибишев Х.С. Некоторые аспекты лечения персистирующей инфекции нижних мочевыводящих путей у женщин. Урология. 2014;5:30-34.
5. Ciani O., Grassi D., Tarricone R. An economic perspecƟ ve on urinary tract infecƟ on: the «costs of resignaƟ on». Clin. Drug InvesƟ g. 2013;33(4):255-261. doi: 10.1007/ s40261-013-0069-x
6. Синякова Л.А., Косова И.В. Профилактика рецидивов инфекции мочевыводящих путей. Урология. 2009; 2:22–25.
7. Naber KG, Schaeff er AJ, Heyns CF, Matsumoto T, Shoskes DA, Bjerklund JTE. Urogenital InfecƟ ons. The Netherlands: European AssociaƟ on of Urology, 2010.
8. Guidelines on urological infecƟ on. EAU; 2015.
9. Набока Ю.Л., Васильева Л.И., Гудима И.А., Коган М.И., Ибишев Х.С., Мирошниченко Е.А. Микробный спектр мочи и биоптатов мочевого пузыря у женщинс хроническим рецидивирующим циститом. Эффективная фармакотерапия. 2013;26:32-35.
10. Набока Ю.Л., Коган М.И., Гудима И.А., Черницкая М.Л., Ибишев Х.С. и др. Роль неклостридиальных анаэробов в развитии инфекционно-воспалительных заболеваний органов мочевой и половой систем. Урология. 2013;6:118-211.
11. Гомберг М.А., Винаров А.З., Евдокимов В.В. Герпетическая инфекция в урологической практике. Эффективная фармакотерапия 2012;43:6-9.
12. Hansel DE, McKenney JK, Stephenson AJ, Chang SS. The Urinary Tract. A comprehansive Guide to paƟ ent Diagnosis and Management. New York: Springer Science+Business Media;2012/
13. Кульчевеня Е.В., Бреусов А.А. Целесообразность индивидуального подхода к иммунопрофилактике рецидивов инфекций урогенитального тракта. Урология. 2013;6:24-25.
14. Кульчавеня Е.В., Бреусов А.А. Эффективность уро-ваксома при рецидивирующих инфекционно-воспалительных заболеваниях мочеполовой системы. Урология. 2011;4:7-11.
15. Ибишев Х.С. Целесообразность интерферонотерапии при рецидивирующей инфекции нижних мочевых путей. Лечащий врач. 2013;12:30-34.









Комментарии