Грицкевич А.А., Ильин С.А., Тимина И.Е., Зотиков А.Е., Кармазановский Г.Г., Теплов А.А., Покровский А.В., Кубышкин В.А.
ФГБУ «Институт хирургии им. А.В. Вишневского» МЗ РФ, г. Москва Эл.почта: grekaa@mail.ru
Введение. Злокачественные новообразования почки (ЗНП) в 2013 году составили 3,9% всех злокачественных новообразований населения РФ, занимая 10 ранговое место в структуре онкологической заболеваемости обоих полов. Абсолютное число больных с впервые в жизни установленным диагнозом ЗНП в РФ в 2013 году составило 11442 человек. Прирост заболеваемости за 10 лет составил 41%, а ежегодный прирост 3,35 %. Стандартизированный показатель заболеваемости в 2013 году вырос до 9,39 на 100 000 человек. Прирост смертности за 10 лет вышел на уровень 8,39%. В 2013 году количество умерших от ЗНП составило 8459 случаев [1, 2].
Учитывая многочисленные данные о развитии почечной недостаточности после хирургического лечения, а также возрастающее количество пациентов с ранними стадиями почечно-клеточного рака (ПКР), важность органосохраняющего лечения нельзя недооценивать. Несмотря на отсутствие рандомизированных исследований, сравнивающих эффективность органосохраняющего лечения и радикальной нефрэктомии при ПКР, многочисленные ретроспективные данные указывают на сопоставимую эффективность обоих лечебных подходов при лучших показателях функции почек в случае органосохраняющего лечения. Поэтому органосохраняющийподход все чаще используется как при открытых, так и при малоинвазивных хирургических вмешательствах[3, 4, 5].
Анализируя результаты лечения более 1 миллиона пациентов в США, Goetal, (2004) установили, что значительное снижение функции почек ассоциируется с увеличением заболеваемости сердечно-сосудистыми болезнями и смертности от них, а также с повышением частоты госпитализаций по разным причинам.Поскольку большинство доноров почки на протяжении длительного времени после удаления органа чувствуют себя хорошо, считалось, что нефрэктомия у пациентов с ПКР опасности также не представляет. Современные взгляды это представление более не разделяют. Данные полученные Кoenigetal, (7) показывают, что у больных ПКР вероятность развития почечной недостаточности больше, чем у здоровых доноров, и что эти две популяции могут существенно отличаться. Кроме того, МcKiernanetal, (8) продемонстрировали развитие почечной недостаточности у трети больных ПКР еще до лечения. Несмотря на значительные успехи в заместительной терапии почечной недостаточности (ЗТПН) с использованием таких методов как диализ или трансплантация, ЗТПН остается значимой причиной появления других заболеваний и смертности от них. У пациентов, находящихся на длительном гемодиализе, смертность от сердечно-сосудистых болезней в 10-30 раз выше, чем в общей популяции. При анализе смертности от инфаркта миокарда общая выживаемость пациентов на диализе значительно меньше, чем у пациентов без почечной недостаточности или даже при наличии сопутствующих болезней. Согласно базе данных США по заболеваниям почек (USRDS) смертность у больных на диализе составляет 22% в первые два года и 15% во время последующих 3 лет. Roccoetal, (11) сообщили о потребности в госпитализации более 50% больных, находящихся на хроническом диализе. Около 20% больных погибли. При этом стоит отметить высокую стоимость диализа: в США выделяется около 70000$ в год на одного пациента. Трансплантация почки является жизненно важной для некоторых пациентов, но и она сопряжена с рисками. Согласно современным рекомендациям трансплантацию почки в случае ПКР можно проводить через 2 года безрецидивного периода. Это вынуждает пациентов ждать, получая диализ не менее двух лет. Кроме того, недостаточное количество аллогенных трансплантантов может привести к дальнейшим задержкам. И, наконец, даже с очевидными достижениями в трансплантации, от 20 до 33% трансплантатов функционируют не более 5 лет. Согласно результатам исследований 5-летняя выживаемость после трансплантации почки составляет только 75% [6-14].
Основной задачей проведенного исследования является анализ непосредственных и отдаленных результатов экстракорпоральной резекции почки (ЭКРП) с применением фармако-холодовой ишемии без пересечения мочеточника с ортотопической реплантацией почечных сосудов с целью оценки эффективности и безопасности использования данной методики у больных ПКР.
Цель исследования: разработка методики экстракорпоральной резекции почки в условиях фармако-холодовой ишемии без пересечения мочеточника с ортотопической реплантацией почечных сосудов при почечно-клеточном раке.
Материалы и методы
В урологическом отделении ФГБУ «Институт хирургии им. А.В. Вишневского» МЗ РФ разработана методика ЭКРП в условиях фармако-холодовой ишемии у больных ЗНП. В исследование 2012 – 2015 г.г. включено 37 больных с морфологически подтвержденным ПКР со стадией pT1a-Т3вN0M0-1G1-3 с интрапаренхиматозной и центральной локализацией опухоли при наличии сопутствующей патологии как контрлатеральной почки, так и почки на стороне опухолевого поражения. В это число входят 6 больных с ПКР единственной и единственно функционирующей почки. Оригинальная методика оперативного пособия заключалась в выполненииЭКРП с применением фармако-холодовой ишемии раствором кустодиола без пересечения мочеточника с последующей ортотопической аутотрансплантацией.
Средний возраст больных составил 55,32±13,1 года (21 73 года). Количество мужчин в исследовании составило 73% (n=27), женщин 27% (n=10). Соотношение мужчин и женщин – 2,7:1. Поражение правой почки выявлено у 18 (48,6%) больных, левой – у 19 (51,4%). Двусторонние опухоли почек наблюдались у 3 (8,1%) больных, (66,7% синхронные, 33,3% метахронные), единственной и единственно функционирующей почки у 6 (16,2%) пациентов. У одного пациента (2,7%) имел место ПКР единственной почки с интралюминальной инвазией (каваренальная форма).Первично-множественный рак имел место у 3 (8,1%) больных. Второй локализацией являлись: рак прямой кишки, рак пищевода и рак щитовидной железы.
Все опухоли интерпретировались в трехмерном измерении до оперативного пособия и по данным исследования операционного материала патоморфологом. Средние размеры опухолей до операции составили: 46,9+15,7 мм, 41,4±14 мм, 42±15,5 мм. Размерыобразований определяем по результатам КТ и МРТ органов брюшной полости и подтверждалиинтраоперационным УЗИ.
Определение стадии заболевания производили по системе ТNM: рТ1аТ3вN0M0-1G1-3. Стадия рТ1а выявлена у 20 (54,1%) больных, рТ1b — у12 (32,4%), рТ2 – у 2 (5,4%), рТ3 – у 3 (8,1%). По данным морфологического исследования ни у одного больного не были выявлены регионарные метастазы. Один больной с ПКР единственной почки и интралюминальной инвазией (каваренальная форма) имел отдаленные метастазы: мелкие гематогенные легочные местатазы в количестве 8. В таблице 1 представлена характеристика больных.
Таблица 1. Характеристика больных до операции
| Критерий | Группа больных, (n=37) |
| Возраст, лет | 55,32±13,1 |
| Мужчины, n (%) | 27 (73) |
| Женщины, n (%) | 10 (27) |
| Сторона поражения, n (%) правая левая |
18 (48,6) 19 (51,4) |
| Размеры опухоли, мм 1x 2x 3x |
46,9±15,7 41,4±14 42±15,5 |
| Двухсторонний ПКР, n (%) синхронный метахронный |
3 (8,1) 2 (66,7) 1 (33,3) |
| Рак единственной почки, n (%) | 6 (16,2) |
| Локализация опухоли, n (%) центральная периферическая |
21 (56,8) 16 (43,2) |
| Категория Т распространенности, n (%) Т1а Т1в Т2 Т3 |
20 (54,1) 12 (32,4) 2 (5,4) 3 (8,1) |
| Категория N распространенности, n (%) N0 |
37 (100) |
| Категория M распространенности, n (%) M0 M1 |
36 (97,3) 1 (2,7) |
| СКФ, мл/мин | 77,78±18,4 |
Опухоль локализовалась в верхнем полюсе у 11 (29,8%), в нижнем – у 10 (27%), в области почечного синуса – у 16 (43,2%), в нескольких сегментах почки – у 15 (40,5%) больных. У всех больных опухоль так или иначе затрагивала чашечно-лоханочную систему (ЧЛС). В таблице 2 представлены нефрометрические показатели опухолей почки больных.
Таблица 2. Нефрометрические показатели опухолей почки.
| Нефрометрический показатель | Количество | |
| Абс | % | |
| Размер опухоли <4 см >4 см |
8 29 |
21,6 78,4 |
| Локализация опухоли: Верхний сегмент Средний сегмент Нижний сегмент |
11 16 10 |
29,7 43,3 27 |
| Заинтересованность ЧЛС: Деформация Деформация и инвазия |
10 27 |
27,2 72,8 |
| Сумма баллов по шкале RENAL 4-6 7-9 10 и более |
- 6 31 |
- 16,2 83,8 |
Всем пациентам на предоперационном этапе проводилось МСКТ органов брюшной полости с болюсным контрастным усилением с целью адекватной оценки размера опухоли, структуры, локализации и распространенности онкологического процесса, исключения тромбоза почечной и нижней полой вены,вторичного поражения лимфатических узлов и других органов брюшной полости.
Все исследования проводились на мультидетекторных компьютерных томографах (64 и 256 срезов) PhilipsBrilliance 64 CT и iCTBrilliance (PhilipsMedicalSystems, Cleveland) с применением неионных контрастных веществ (Оптирей 350, Сканлюкс 370). Для запуска сканирования использовали программный пакет «bolustracking». Изображение оценивали во все фазы исследования в трех стандартных проекциях. В нативную фазу сканирования средний показатель плотности опухоли составил 33,6±10 ед.H. В артериальную фазу плотность составила 110,9±40,7 ед.H., в венозную фазу 84,8±20,2 ед.H и в отсроченную 62±14,1 ед.H. Цифровые значения денситометрической плотности светлоклеточного ПКР в артериальную фазу исследования были значительно выше (131,9±29,6 ед.H) , чем у папиллярного почечно-клеточного рака (59,6±17,2 ед.H).
На основании МСКТ была проводенанефрометрическая оценка почечных новообразований по шкале R.E.N.A.L., разработанной сотрудниками Онкологического центра Фокс Чейз при Медицинском университете Темпл (США) в 2009 году. Шкала R.E.N.A.L. подразумевала следующие характеристики: R – радиус (размер опухоли); E – экстраили интраренальный характер роста опухоли; N – близость опухоли к синусу почки или к чашечно-лоханочной системе; A – характеристика переднего (A) или заднего (P) расположения опухоли во фронтальной плоскости; L – расположение опухоли по отношению к полярным линиям.
Подавляющее большинство больных (n=31) относилось к группе с высоким нефрометрическим индексом R.E.N.A.L. (83,8%). Средний балл составил 10,32±0,94. Таким образом, эта группа представляет сложную категорию больных для выполнения резекции почки insitu. Подробная характеристика нефрометрического индекса R.E.N.A.L. представлена в таблице 3.
Таблица 3. Характеристика нефрометрического индекса R.E.N.A.L. у больных.
| Анатомические характеристики | Медиана | Диапазон |
| Сумма нефрометрического индекса | 10,32±0,94 | 4-12 |
| Критерий R | 2,0±0,67 | 1-3 |
| Критерий E | 2,78±0,42 | 1-3 |
| Критерий N | 2,84±0,37 | 1-3 |
| Критерий L | 2,7±0,62 | 1-3 |
Всем больным до операции выполняли ультразвуковое исследование на приборах Voluson 730Exp и LogiqE9 с применением стандартных методик (Врежим, цветовой, импульсно-волновой допплеграфии и спектрального анализа скоростей потока). В связи со сложной сосудистой анатомией и для уточнения вовлечения сегментарных артерий в опухолевый процесс проводили трехмерную реконструкцию изображений в В-режиме и в режиме энергетического допплера у 15 (40,5%) больных. Всем больным выполняли интраоперационное ультразвуковое исследование (ИОУЗИ) и динамическое наблюдение в послеоперационном периоде. Для получения более достоверных результатов исследование проводили по определенной методике и разработанному протоколу.
На дооперационном этапе в задачи УЗИ входило уточнение топографии и характеристик опухоли, описание взаимоотношения с ЧЛС и почечными сосудами, определение исходного внутрипочечного кровотока. Опухоли по данным УЗИ в 34 (91,9%) наблюдениях были представлены солидными образованиями повышенной эхогенности 17 (45,9%), гипоэхогенными8 (21,6%) или изоэхогенными9 (24,3%) образованиями. Структура опухолей в большинстве наблюдений 33 (89,2%) была неоднородная, за счет наличия анэхогенных жидкостных кистозных включений у 26 (78,7%) больных, гипоэхогенных зон у 5 (15,2%) и у 2 – кальцинатов (6,1%). Во всех наблюдениях в режиме цветного допплеровского картирования (ЦДК) выявляли перинодулярные сосуды, которые были представлены сегментарными и междолевыми артериями. По регистрации интранодулярного кровотока опухоли разделили на аваскулярные – 10 случаев (27%), гиповаскулярные – 14 (37,8%) и гиперваскулярные образования – 13 (35,2%). Кистозные опухолибыли выявлены у 3 (8,1%) больных и оценивались как тип 4 по шкале Bosniak.
В В-режиме и при построении трехмерной реконструкции определяли распространение опухоли на ЧЛС. Распространение опухоли на центральные структуры проявлялось в виде регистрации опухолевых масс в проекции синуса, нарушения типичного внутрипочечного сосудистого рисунка, деформации контуров ЧЛС. Подозрение на инвазию ЧЛС возникло у 27 (72,8%) больных.
Точность в выявлении инвазии в структуры ЧЛС по данным УЗИ в В-режиме составила 87,5%, а врежиме трехмерной реконструкции – в 91,7% наблюдений.
Спектральный анализ кровотока проводили на уровне междолевых артерий во всех сегментах почки с измерением пиковой систолической скорости, конечной диастолической скорости, индексов резистивности и пульсативности, а также времени акселерации.
В послеоперационном периоде проводили УЗИ на 1, 3 и 7 сутки. В первую очередь оценивали зону резекции, забрюшинное пространство, малый таз на предмет наличия свободной или отграниченной жидкости. В оперированной почке измеряли показатели кровотока во всех сегментах и сравнивали с контрлатеральной почкой (при ее наличии). В 1-е сутки послеоперационного периода в 14 случаях (37,8%) регистрировалась высокая резистивность в оперированной почке: индекс резистивности (РИ) составил 0,72±0,05. Во всех случаях нормализация гемодинамических показателей наблюдалась к 3-м суткам после операции. В таблице 4 приведены результаты инструментальных методов исследования.
Таблица 4. Данные инструментальных методов исследования
| Вид обследования | Группа больных, (n=37) |
| Контрастное усиление ткани опухоли на МСКТ, ед.H Нативная фаза Артериальная фаза Венозная фаза Отсроченная фаза |
33,6±10 110,9±40,7 84,8±20,2 62±14,1 |
| Спектральные характеристики внутрипочечного кровотока до операции ЛСК, м/с РИ |
0,31±0,09 0,67±0,07 |
| Спектральные характеристики внутрипочечного кровотока после операции ЛСК, м/с РИ |
0,27±0,09 0,72±0,05 |
При гистологическом исследовании у 29 (78,4%) пациентов диагностирован светлоклеточный рак. В 51,7% случаев (n=15) были высокодифференцированные формы ПКР (G1). На долю умеренно и низкодифференцированных форм (G2-3) приходилось 48,3% (n=14) случаев. Папиллярный ПКР наблюдали у 5 (13,5%) больных и был представлен во всех случаях умеренно и низкодифференцированными формами ПКР (G2-3). У одного пациента (2,7%) был хромофобный тип рака с эозиноклеточным вариантом. В двух случаях (5,4%) имел место уротелиальный рак G1 и G3. В случаях с уротелиальным раком на предоперационном обследовании по данным КТ и МРТ опухоль имела вид четко визуализируемых опухолевых узлов. В таблице 5 представлены морфологические типы опухолей.
Таблица 5. Гистолические типы опухолей
| Гистологические типы опухолей | n (%) |
| Почечно-клеточный рак: Светлоклеточный тип G1 G2 G3 Папиллярный тип G1 G2 G3 Хромофобный тип, эозиноклеточный вариант |
35 (94,6) 29 (78,4) 15 (51,8) 11 (37,9) 3 (10,3) 5 (13,5) - 3(60) 2 (40) 1 (2,7) |
| Уротелиальный рак: G1 G2 G3 |
2 (5,4) |
Таким образом, подавляющее большинство случаев представлено светлоклеточным ПКР. У двух больных уротелиальный рак был выявлен по результатам гистоисследования, как морфологическая находка.
Во всех случаях проводилась регионарная лимфаденэктомия. При выполнении резекции правой почки выполнялась аортокавальная лимфаденэктомия; при резекции левой почки – парааортальная лимфаденэктомия. Количество удаленных лимфоузлов варьировало от 1 до 19. Среднее количество удаленных лимфоузлов составило 5,73±4,13.
В 8 случаях (21,6%) проводилось восстановление целостности резецированных сегментарных артерий. Пересеченные во время резекционного этапа сегментарные артерии под оптическим увеличением восстанавливали путем формирования косого анастомоза «конец в конец» нитью из полипропилена 8/0.
Во всех случаях производили резекцию чашечно-лоханочной системы почки. Интраоперационное антеградное стентирование мочеточника было выполнено в 27 случаях (72,9%).
В 9 случаях (24,3%) выполняли ипсилатеральнуюадреналэктомию. Все случаи определялись онкологическими показаниями.
В 12 (32,4%) случаях потребовалось выполнение протезирования почечной артерии протезом из политетрафторэтилена. Причем, сторона резекции была одинакова, как слева, так и справа – по 6 случаев соответственно.
В 2 случаях была выполнена симультанная операция: резекция инфраренального отдела аорты с протезированием по поводу аневризмы аорты и экстирпация пищевода с одномоментной пластикой по поводу рака пищевода.
У 8 больных (21,6%) была аномалия развития почечных артерий. Количество артерий варьировало от 1 до 3. Среднее значение составило 1,29±0,62. Аномалия почечных вен наблюдалась у 3 больных (8,1%). Среднее значение составило 1,08±0,28.
Температурный режим почки exvivo варьировал от 9,1 до 11,7 С. Среднее значение температуры почки на протяжении всего экстракорпорального этапа составило 10,58±0,66C.
У одного больного с раком единственной правой почки имелся опухолевый тромб, распространяющийся в просвет нижней полой вены (кава-ренальная форма). Опухолевый тромб распространялся на 48 мм.антеградно от устья правой почечной вены и имел диаметр до 30 мм. Больному одномоментно была выполнена тромбэктомия с резекцией нижней полой вены и извлечение единственной правой почки из забрюшинного пространства с последующей резекцией почки, тромбэктомией из центральных сосудов почки с ортотопической реплантацией сосудов. Характеристика особенностей оперативного пособия представлена в таблице 6.
Таблица 6. Характеристика интраоперационных манипуляций
| Критерий | Группа больных, (n=37) |
| Количество удаленных лимфоузлов, n | 5,73±4,13 |
| Многофокусные опухоли, n (%) Среднее количество удаленных опухолевых узлов, n |
2 (5,4) 3 |
| Стентирование мочеточника, n (%) | 27 (72,9) |
| Размеры опухоли по данным ПГИ, мм 1x 2x 3x |
43,49±17, 28 38,08±14,75 35,49±12,89 |
| Резекция и микрососудистая пластика сегментарных артерий, n (%) | 8 (21,6) |
| Средняя температура холодой нефроплегии, С | 10,58±0,66 |
| Протезирование почечной артерии, n (%) | 12 (34,4) |
| Симультанная операция, n (%) | 2 (5,4) |
| Количество почечных артерий, ср. | 1,29±0,62 |
| Количество почечных вен, ср. | 1,08±0,28 |
| Единственная почка, n (%) | 6 (16,2) |
Класс предоперационного риска по классификации ASA оценен как I II у 29 (78,4%) больных, IIIIV – у 8 (21,6%).
Методика выполнения экстракорпоральной резекции почки в условиях фармако-холодовой ишемии без пересечения мочеточника с ортотопической реплантацией почечных сосудов при почечно-клеточном раке.
Доступ осуществляется путем выполнения лапаротомии. Применяется Jобразная лапаротомия по общепринятой в клинике методике. Осуществляется доступ в правое (левое) забрюшинное пространство по линии Тольди. Почка мобилизуется вместе с паранефрием в пределах фасции Героты. На рис. 1 представлена МСКТ-грамма резецируемой почки.
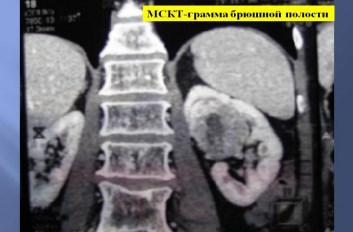
Рис. 1. МСКТ-грамма с опухолью правой почки центральной локализации
Проводится регионарная лимфаденэктомия. Справа удаляется аортокавальный лимфатический коллектор; слева – парааортальная группа лимфоузлов. Проводится мобилизация мочеточника на стороне поражения в верхней и средней трети; для хорошей визуализации, последний берется на провизорный резиновый турникет. Почка освобождается от всей паранефральной клетчатки. Клетчатка отправляется на морфологическое исследование. Если опухоль имела экстраренальный тип, то прилежающая к опухоли зона клетчатки маркируется дополнительно. Выполняется тщательная диссекция элементов почечной ножки. Клетчатка с лимфоузлами области ворот почки отправляется на морфологическое исследование. Почечные сосуды раздельно берутся на провизорные резиновые турникеты. Диссекция верхней трети мочеточника распространяется до лоханки для оптимальной визуализации всех элементов почечной ножки.
Интраоперационно проводится доплерографическое исследование почки, опухолевого узла с параметрической оценкой кровотока в паренхиме почки и опухоли. В случае с полностью интрапаренхиматозно-расположенной опухолью производится определение границ опухолевого узла, лоцируется максимально близкий и малотравматичный нефротомический доступ к опухоли. Регистрируются показатели кровотока по магистральным почечным сосудам, аорте и нижней полой вене.
Мобилизуется аорта в супра, -интра и инфраренальном отделе. Выделяется левая (правая) почечная артерия и почечная вена на всем протяжении. При выделении правой почечной артерии мобилизуется нижняя полая вена, берется на провизорный резиновый турникет дистальнее анатомического устья почечной артерии, формируется канал под нижней полой веной для проведения правой почечной артерии при реимплантация в аорту. Производится системная гепаринизация 5000-7500 МЕд. Почечная артерия на сосудистых зажимах пересекается у устья. Проксимальная культя перевязывается и прошивается. Почечная вена на сосудистых зажимах также пересекается у устья.
В почечную артерию через в/в катетер вводится 500-1000 мл.раствора Кустодиол с целью профилактики ишемии почки и осуществления фармакоплегии. Почка на мобилизованном мочеточнике извлекается из забрюшинного пространства и погружается в лоток с ледяной крошкой изотонического раствора exvivo. Сразу же налаживается система перфузии почки через просвет пересеченной почечной артерии (артерий) раствором Кустодиола для осуществления классической фармако-холодовой нефроплегии. На рис. 2 представлен этап перфузии почки раствором Кустодиол.
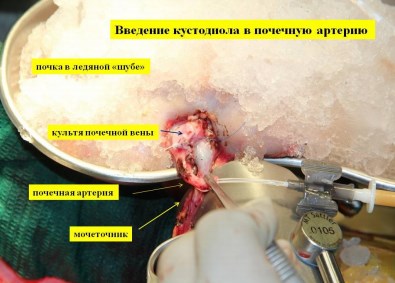
Рис. 2. Этап перфузии почки охлажденным раствором Кустодиол.
Физические параметры охлаждения почки.
- температура раствора 5-8 °С,
- скорость перфузии 1,5 мл/мин/г оценочной массы почки (в среднем 150 г у взрослого человека),
- давление перфузии, измеряемое в месте ввода канюли в просвет почечной артерии, 90-110 мм рт. ст. (емкость с раствором расположена на высоте 120-140 см над уровнем почки),
- время перфузии не менее 8-10 мин (чтобы обеспечить гомогенное распределение раствора во внеклеточном пространстве, включая промежуточную ткань и систему почечных канальцев),
- дополнительные мероприятия: до начала перфузии рекомендуется обеспечить усиленный диурез с помощью мочегонных средств и/или гидратацией,
- методические указания: контроль время перфузии и высоту расположения емкости с раствором над уровнем почки либо, если раствор подается с помощью насоса, время перфузии и давление на конце почечной канюли.
Охлажденная почка находится в препарате Кустодиол, охлажденном до 2-4 °С весь период резекции. Каждые 30 минут проводится определение температуры почки. При полном соблюдении правил охлаждения почки продолжительность защиты органа от ишемических повреждений достигает 24 48 часов.
После интраоперационной эхографии выполняется резекция опухоли острым путем. Опухолевый узел резецируется в пределах здоровых тканей. Отступ от края резекции составляет 2-3 мм. На рис. 3 представлена обширная пострезекционная рана почки.
Если при удалении опухоли было отмечено повреждение интрапаренхиматозных артерий и/или вен (диаметром 1-2 мм) они по возможности анастомозируются косым анастомозом «конец в конец» нитью из полипропилена 8/0 или ушиваются наглухо той же нитью. Герметичность швов контролируется дополнительнымивведением кустодиола в почечную артерию. На рис. 4 представлена пересеченная сегментарная артерия.
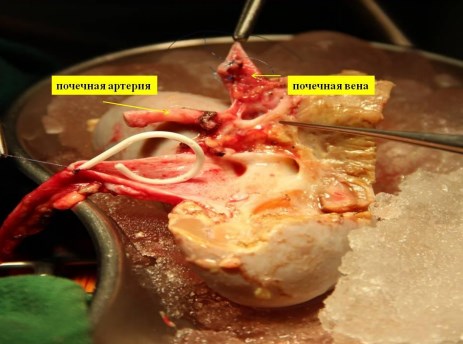
Рис. 3. Почка после удаления опухоли.
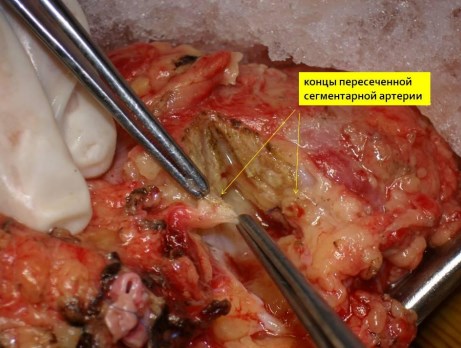
Рис. 4. Проксимальный и дистальный сегменты пересеченной сегментарной артерии.
На рис. 5 изображен этап формирования артериального анастомоза «конец в конец»
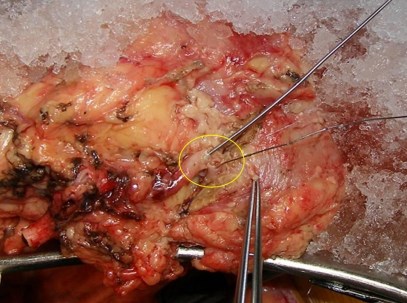
Рис 5. Этап формирования артериального анастомоза «конец в конец» полипропиленовойнитью 8/0.
На рис. 6 изображен окончательный вид микрососудистого анастомоза
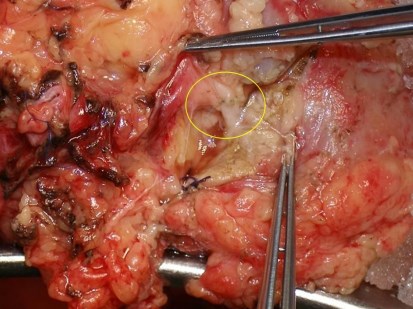
Рис 6. Конечный вид артериального микрососудистого анастомоза
После отправки макропрепарата на морфологическое исследование подоптическим увеличением проводится тщательная ревизия дна резекции. По показаниям (при обширном нарушении целостности ЧЛС) выполняется антеградное стентирование мочеточника. Используется стент внутреннего дренирования Ch.№ 6-8. Дефект в ЧЛС ликвидируется непрерывным викриловым(4/0) швом. Зияющие сосуды под увеличением тщательно прошиваются Z-образными викриловыминитями 4-5/0. Герметичность швов контролируется дополнительными введениями кустодиола в почечную артерию. Целостность паренхимы почки восстанавливается 2-3 этажными одиночными викриловыминитями 1-2/0. Если герметичность удовлетворительная, почка перемещается в забрюшюнное пространство
В почечную артерию вводится дополнительная доза Кустодиола (100-300 мл.) и приступают к реконструкции почечных сосудов и реваскуляризации почки. Почка ортотопически укладывается в забрюшюнное пространство. При реимплантации левой почечной артерии в инфраренальном отделе аорты по левой боковой стенке с помощью аортального «панча» выкраивается окно диаметром 5 мм, в которое имплантируется по типу «конец в бок» почечная артерия нитью из полипропилена 6-7/0 непрерывным обвивным швом. При реимплантации правой почечной артерии, во-первых, оценивается диастаз между культей почечной артерии и аортой. На рис. 7 представлен этап реконструкции почечных сосудов.
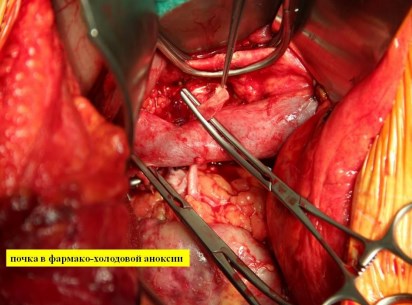
Рис. 7. Краевое отжатие аорты и проведение почечной артерии позади нижней полой вены.
Определяется необходимость протезирования почечной артерии. Если такой необходимости нет, то почечная артерия проводится в ранее сформированное окно под нижней полой веной к аорте. Далее в инфраренальномотделе аорты по правой боковой стенке с помощью аортального «панча» выкраивается окно диаметром 8-10 мм, в которое имплантируется по типу «конец в бок» почечная артерия нитью из полипропилена 6/0 непрерывным обвивным швом. Затем формируется анастомоз по типу «конец в конец» между проксимальной и дистальной культями почечной вены нитью из полипропилена 5/0 непрерывным обвивным швом (с применением методики «расширения анастомоза» для профилактики стенозирования анастомоза). Последний шов не дотягивается до пуска кровотока по вене. На рис. 8 представлен этап формирования аортоартериального анастомоза.
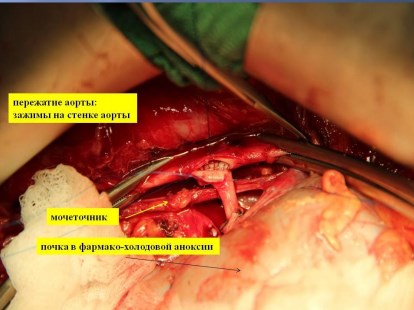
Рис. 8. Этап формирования аорто-артериального анастомоза.
На последних швах осуществляется пуск кровотока (200-300 мл.) для вымывания раствора Кустолиола из паренхимы почки. После окончания реваскуляризации проводится макроскопическая оценка почки и интраоперационный эхографический контроль показателей кровотока на уровне междолевых и дуговых артерий во всех сегментах почки, почечных артериях и венах. Нейтрализация остаточной дозы гепарина, как правило, не требуется. На рис. 9 представлен вид операционного поля после пуска кровотока.
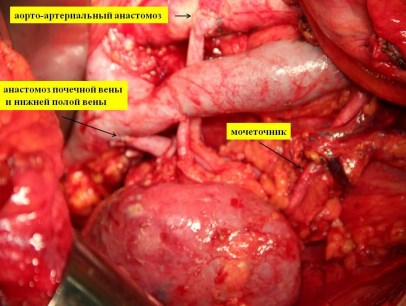
Рис. 9. Операционное поле после пуска кровотока.
Очень редко при благоприятных топографо-анатомических условиях основная почечная артерия реимлантируется в старое устье.
При дефиците длины почечной артерии выполняется протезирование. В качестве протеза во всех случаях использовали протез диаметром 8 мм из политетрафторэтилена производства «Gore-Tex». Первым этапом накладывается анастомоз exvivo между почечной артерией и протезом, и уже в ортотопической позиции почки между протезом и аортой. На рис. 10 представлен этап протезирования почечной артерии.
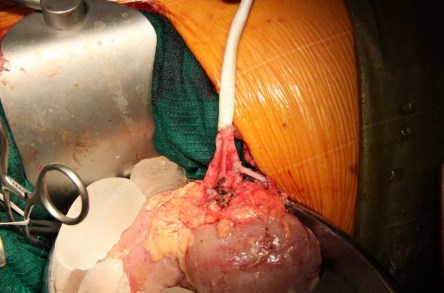
Рис. 10. Протезирование почечной артерии.
При наличии одной из почечных артерий, которая, кровоснабжаетполюс почки, она в подавляющем большинстве случаев имплантируется в основной ствол по типу «конец в бок» нитью из полипропилена 6-7/0 непрерывным обвивным швом.Крайне редко самостоятельно имплантируется в аорту.
В случае тромбоза почечной артерии проводится артериотомия с эвакуацией свертков крови, отмывание просвета артерии и дополнительнаягепаринизация. Артериотомный доступ ликвидируется непрерывным швом полипропилена 8/0. Дополнительно проводится эхографическая оценка показателей кровотока в системе почечной артерии.
Результаты
Продолжительность оперативного вмешательства варьировала от 280 до 730 минут. Средняя длительность операции составила 413,97±89,14 минут. Среднее время общей анестезии составило 485,95±98,8 минут. Тепловая ишемия определялась периодом от момента пересечения почечной артерии до момента погружения почки в ледяную крошку с одномоментным началом перфузии охлажденным раствором Кустодиола. Среднее время тепловой ишемии составило 8,39±4,75 минут. Продолжительность холодовой ишемии варьировала от 70 до 240 минут, в среднем 151,41±41,29 минута. Средний объем кровопотери равнялся 729,03±481,4 мл.при диапозоне от 200 до 2300 мл. Первые 5 операций были продолжительностью более 500 минут, что связано с освоением методики. Средняя продолжительность последующих 32 операций составила 388,8±58,2 минут, что сопоставимо с литературными данными при ЭКРП с аутотрансплантацией в подвздошную область [15].В таблице 7 представлены интраоперационные данные.
Таблица 7. Данные продолжительности операции, наркоза, ишемии.
| Критерий оперативного пособия | Медиана |
| Продолжительность операции, мин | 413,97±89,14 |
| Продолжительность наркоза, мин | 485,95±98,8 |
| Период тепловой ишемии, мин. | 8,39±4,75 |
| Период холодовой ишемии, мин. | 151,41±41,29 |
| Кровопотеря, мл. | 729,03±481,4 |
Интраоперационные осложнения отмечены у 3 (8,1%) больных. В двух случаях после пуска кровотока почка была признана нежизнеспособной. При нормально функционирующих магистральных сосудах в обоих случаях отсутствовал внутрипочечный кровоток. После безуспешных консервативных мероприятий по восстановлению внутрипочечного кровотока в обоих случаях было выполнено удаление почки по типу радикальной нефрэктомии.
Еще в одном случае после пуска кровотока развился тромбоз протезированной почечной артерии. После артериотомии и удаления сгустков вновь рецидивировал тромбоз. Однако на этом фоне имелся удовлетворительный внутрипочечный кровоток. Было принято решение не выполнять нефрэктомию. В послеоперационном периоде имело место гладкое течение. Однако через 3 месяца по данным КТ зафиксировано сморщивание почки с отсутствием функции. Такой исход был обусловлен артериальным тромбозом протеза.
Для оценки тяжести послеоперационных осложнений использована классификация Clavien-Dindo. При возникновении у пациента более одного осложнения, в анализ включалось осложнение имевшее наиболее высокую степень [16].
Послеоперационные осложнения выявлены у 18 (48,6%) больных. У 15 больных (40,5%) в послеоперационном периоде по данным УЗИ, МСКТ и МРТ определялись гематомы в зоне резекции. В 5 случаях потребовалось пункционное дренирование гематом под УЗИ контролем. Остальные 10 больных велись консервативно с эхографическим контролем. Мы связываем столь частое осложнение с повышенной технической сложностью операций (множественные зоны резекций, их глубина и объем), травмой почки при резекциях в условиях exvivo, интраоперационнойгепаринизацией. Гематомы во всех случаях разрешились благополучно без открытых повторных вмешательств.
В 1 (2,7%) случае проводилось длительное консервативное лечение атаки острого необтурационного пиелонефрита оперированной почки.
Был 1 (2,7%) случай эвентерации на 6-е сутки после операции.
При резекции единственной почки (2,7%) с одномоментной тромбэктомией и резекцией нижней полой вены наблюдалась острая почечная недостаточность. Было проведено 3 сеанса гемодиализа. Следует отметить отсутствие необходимости в гемодиализе в послеоперационном периоде у остальных 5 (13,5%) больных с единственной оперированной почкой. В этих случаях имел место транзиторное повышение уровня азотистых шлаков, не требующее проведения гемодиализа.
У 1 (2,7%) больного в 1-е сутки произошло внутрибрюшное кровотечение из зоны резекции почки. Была выполнена релапаротомия с дополнительным прошиванием зоны резекции почки. У этого же пациента на 8-е сутки появилась массивная макрогематурия. По данным МСКТ с внутривенным усилением обнаружена артерио-венозно-чашечно-лоханочная фистула, которая была ликвидирована эндоваскулярной установкой окклюдера в сегментарную почечную артерию.
У 1 (2,7%) больного послеоперационный период осложнился острым деструктивным панкреатитом.
Один (2,7%) летальный исход был обусловлен мезентериальным тромбозом, произошедшим на 4-е сутки послеоперационного периода, с развитием последующей полиорганной недостаточности.
В структуре осложнений I степени все случаи представлены наличием гематомы в зоне резекции, не требующие хирургического вмешательства. Структура осложнений указана в таблице 8.
Таблица 8. Распределение послеоперационых осложнений по группам в соответствии со степенью тяжести по Clavien-Dindo
| Степень тяжести осложнения по Clavien-Dindo | Частота | |
| Абс. | % | |
| I степень | 7 | 38,8 |
| II степень | 1 | 5,6 |
| IIIa степень IIIb степень |
4 4 |
22,2 22,2 |
| IVa степень IVb степень |
1 - |
5,6 - |
| V степень | 1 | 5,6 |
Не выявлено влияния на частоту послеоперационных кровотечений и гематом стороны поражения, размеров, локализации опухоли, категории Т, длительности холодовой ишемии. При сравнении с личным опытом резекций почек insitu в урологической клинике Института хирургии отмечается значительное увеличение этих осложнений при выполнении операцийexvivo (2,3% и 43% соответственно).
Пол, возраст, сторона поражения, локализация, размеры опухоли и категория Т влияния на риск снижения почечной функции в раннем и позднем послеоперационном периоде не оказывали. Наличие второй функционирующей почки значительно снижало риски транзиторного повышения уровня азотистых шлаков. Частота и вид осложнений зависели от нефрометрических показателей по шкале RENAL. Определялась связь с частотой гематом в области резекции и высоким индексомRENAL.
При плановом гистологическом исследовании по краю резекции опухолевые клетки не выявлены ни в одном случае. Сроки наблюдения составили от 3 до 41 месяца (21,4±7,3). Данных за рецидив опухоли и прогрессирование опухолевого процесса не выявлено ни у одного больного. СКФ до операции составляла 77,78±18,4 мл\мин, а после 63±26,06 мл\мин. При выписке ни один больной не находился в ренопривном состоянии.
Обсуждение
Первая успешная трансплантация почки была выполнена 23 декабря 1954 г. M.E. Murray. В 1990 г. хирург-пионер был награжден Нобелевской премией. Первыми пациентами были однояйцевые близнецы, что позволило избежать иммунологических проблем и обеспечило успех хирургического вмешательства. Выживаемость трансплантата составила 11 мес. В настоящее время 5-летняя выживаемость аллогенного трансплантата в Европе колеблется от 60 до 80%. В 1960-е годы велось активное накопление опытасо все возрастающим числом различных ЭКРП, которые, как правило, выполнялись при хронических доброкачественных заболеваниях (хроническая почечная недостаточность) и редко — при ПКР. В 1970 г. наблюдался пик частоты выполнения подобных комплексных оперативных вмешательств, и ПКР стал принятым показанием к хирургическому лечению подобного объема.1980-е годы характеризовались снижением доли операций ex vivo параллельно с увеличением возможностей гемодиализа. В 1990-е годы сообщалось лишь о нескольких случаях использования экстракорпоральных хирургических вмешательств. Несмотря на это, в течение последних лет отмечается заметное оживление интереса к операциям на почке ex vivo с последующей аутотрансплантацией. Это может быть обусловлено несколькими причинами. Первой и, возможно, наиболее важной из них является резкое сокращение активности доноров почек, а также отсутствие приоритета у больных ПКР в центрах трансплантологии. В связи с этим альтернативная стратегия, заключающаяся в нефрэктомии с последующей пересадкой донорской почки, ассоциирована с серьезными сложностями, связанными с необходимостью длительного наблюдения, проведения программного диализа и наличием листа ожидания трансплантации. Во-вторых, программный гемодиализ достоверно снижает качество жизни, приводит к развитию соответствующих осложнений и летальности, а также является дорогостоящей процедурой [17-20].
При критической оценке нашего собственного опыта, представленного 37 наблюдениями (с 2012 по 2015 г.), можно заключить, что ЭКРП с последующей аутотрансплантацией по поводу ПКР технически осуществима и селективно оправдана. Следует подчеркнуть необходимость тщательного отбора больных, у которых есть абсолютные показания к органосохраняющему лечению при опухолях, ограниченных почкой, соблюдения мультидисциплинарного подхода и выполнения подобных операций в крупных центрах, где есть соответствующие технические возможности и опыт сложных оперативных вмешательств. В одном случае даженами была выполнена одномоментная резекция единственной почки с тромбэктомией из нижней полой вены при ПКР с интралюминальной инвазией (рено-кавальная форма). По данным морфологического исследования местногостатусаоперация оказаласьрадикально выполненной. При соблюдении всех необходимых условий ЭКРП с последующей аутотрансплантацией вполне может стать одним из относительно безопасных вариантов лечения этой сложной группы пациентов. Вместе с тем, хирургическое лечение больных с ПКР в объеме ЭКРП является сложным и высокотехнологичным процессом. Ключевыми в терапии таких больных должны быть использование мультидисциплинарного подхода, а также индивидуализации алгоритмов лечения. Несмотря на актуальность представленной проблемы, анализ литературных данных свидетельствует о дефиците доказательной базы, в особенности рандомизированных исследований, посвященных хирургическому лечению при этой патологии. Основным критерием успешного лечения является возможность одновременного онкологического излечения и реализации ораносохранного лечения. Это в большей степени касается резекций единственной почки.
Заключение
Актуальность органосохранного лечения при ПКР определяется несколькими важными причинами. Первой, является низкий приоритет больных ПКР в центрах трансплантологии в связи с длительной сопутствующей иммуносупрессией. В связи с этим альтернативная стратегия, заключающаяся в нефрэктомии с последующей пересадкой донорской почки, ассоциирована с серьезными сложностями, связанными с необходимостью длительного наблюдения, проведения программного диализа и наличием листа ожидания трансплантации. Во-вторых, программный гемодиализ достоверно снижает качество жизни, приводит к развитию соответствующих осложнений и летальности, а также является дорогостоящей процедурой. При правильно соблюдаемых условиях разработанной нами методики ЭКРП становится относительно безопасным вариантом органосохранного лечения этой сложной группы больных. Она позволяет на длительное время отключать почку из магистрального кровотока, использовать максимально допустимое время холодовой ишемии для выполнения полноценной резекции с тщательным восстановлением сосудистых, собирательных структур почки. Несмотря на всю сложность операции, она обладает рядом несомненных достоинств: практически неограниченный запас времени для работы на почке, идеальная визуализация, максимальная защита почечной паренхимы в условиях холодовой консервации, возможность выполнения срочного морфологического исследования границ резекции почки. Данный метод позволяет выполнять радикальные резекции опухолей значительно превышающих размер 40 мм. В связи с этим при данной операции необходимо выполнение парааортальной лимфаденэктомии, которая производится в расширенном варианте за счет мобилизации супраи инфраренального отделов аорты и нижней полой вены до ворот печени. При данном варианте консервации почки возможно безопасно выполнять расширенные резекции почки вплоть до одномоментной резекции единственной почки с тромбэктомией из нижней полой вены, резекцией нижней полой вены. Разработанная авторами методика позволяет произвести возврат почки на прежнее место с ортотопической реплантаций почечных сосудов, исключает выполнение дополнительного доступа с последующей потерей времени для диссекции и аутотрансплантации почки в подвздошную область, и также исключает необходимость пересечения мочеточника с последующим наложением уретеро-уретероанастомоза или уретероцистоанастомоза.
Выводы
1. Методика экстракорпоральной резекции почки в условиях фармакохолодовой ишемии без пересечения мочеточника с ортотопической реплантацией почечных сосудов является эффективной и безопасной методикой органосохранного лечения ПКР.
2. Холодовая ишемия почки поддерживается контролируемой фармакоплегией, что позволяет выполнять резекционный этап с реконструкцией внутрипочечных сосудов и собирательной системы почки любой сложности и длительности с привлечением микрохирургической техники.
3. Данный подход позволяет выполнять резекции почки при внутрипаренхиматозной и центральной локализациях опухоли, вовлечении в опухолевый процесс артерий и вен почки, и при размерах опухоли более 40 мм.
4. Ортотопическая реплантация сосудов почки позволяет исключить дополнительный доступ к подвздошной области и сосудам таза, значительно сокращая длительность и уменьшая травматичность операции.
5. Отсутствие необходимости пересечения мочеточника позволяет исключить вмешательства на мочеточнике и мочевом пузыре, что уменьшает риски развития послеоперационных осложнений со стороны мочевой системы.
6. Соблюдение онкологических принципов при ЭКРП (радикальное удаление опухоли, морфологический контроль по границам резекции почки, как паренхимы, так и собирательной системы почки, выполнение адекватной расширенной парааортальной лимфаденэктомии, удаление паранефральной клетчатки) позволяет добиться хороших ближайших и отдаленных онкологических результатов (медиана наблюдения 21,4±7,3 мес).
Литература
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2013 году. М., 2015. С. 9-15.
2. Широкорад В.И., Махсон А.Н., Ядыкова О.А. Состояние онкоурологической помощи в Москве, онкоурология. 2013. №4. С.11.
3. Bratslavsky G, Boris RS. Emerging Strategies of Nephron Sparing Surgery in Patients with Localized and Recurrent Renal Cell Carcinoma. // Malign Tumours 2010. №1. P. 5-14.
4. Gill I. Laparoscopic radical nephrectomy for cancer. // OrolClinNorth Am. 2000. №27. P. 707-719.
5. Клиническая онкоурология. Под редакцией профессора Б.П. Матвеева. 2011. М.: ООО «Издательский дом «АБВ-пресс». С.76-77.
6. Go A. S, Chertow G. M, Fan D, McCulloch C. E, Hsu C. Y. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. // N Engl J Med. 2004. № 351. P. 1296.
7. Koenig P, Gill I.S, Kamoi K, Aron M, Haber G, Singh A.B, Weight CJ, Desai MM, Kaouk JH, Goldfarb DA, Poggio E.D. Kidney cancer and the risk for chronic kidney disease: matched-paired comparison with living donors. // The Journal of Urology. 2008. Vol. 179. P. 170.
8. McKiernan J, Simmons R, Katz J, Russo P. Natural history of chronic renal insufficiency after partial and radical nephrectomy. // Urology. 2002. Vol. 59. Р. 816.
9. System U. S. R. D.: Annual Data Report. National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK), National Institutes of Health (NIH), and US Department of Health and Human Services (DHHS). 2007
10. Foley R N, Parfrey P S, Sarnak M J. Clinical epidemiology of cardiovascular disease in chronic renal disease. // Am J Kidney Dis. 1998. Vol. 32. Р. 112.
11. Rocco M, Frankenfield DL, Hopson SK, McClellan WM: Relationship between clinical performance measures and outcomes among patients receiving longterm hemodialysis. // Ann Intern Med. 2006. Vol. 145. P. 512.
12. Neil N, Guest S, Wong L, Inglese G, Bhattacharyya S K, Gehr T. The financial implications for Medicare of greater use of peritoneal dialysis. // ClinTher. 2009. Vol. 31. P. 880.
13. Kasiske B L, Cangro C B, Hariharan S, Hricik D E, Kerman R H, Roth D. The evaluation of renal transplantation candidates: clinical practice guidelines. // Am J Transplant. 2001. № 3. Suppl 2.
14. Lin S J. The association between length of post-kidney transplant hospitalization and long-term graft and recipient survival. // Clin Transplant. 2006. № 20. Р. 245.
15. Джеральд Г.Д. Микич. Почечно-клеточный рак: экстракорпоральная резекция почки с последующей аутотрансплантацией при локализованной форме заболевания. // Онкоурология. 2007. №3. С. 16-20.
16. Clavien P, Sanabria J, Strasberg S. Proposed classification of complication of surgery with examples of utility in cholecystectomy. // Surgery. 1992. Vol. 111. P. 518 -526.
17. Bellinger MF, Koontz WW. Jr Smith MJ. Renal cell carcinoma: twenty years of experience. // Va Med. 1979. №106. Р.819—24.
18. Montie JE. «Bench surgery» for renal cell carcinoma: a proper niche. // Mayo Clin Proc. 1992. №67. Р. 701—2.
19. Petritsch PH, Gruber H, Colombo T. Indications and results of ex vivo surgery of the kidney. // Wien KlinWochenschr. 1995. Vol. 107. P. 731—5.
20. Stormont TJ, Bilhartz DL, Zincke H. Pitfalls of «bench surgery» and autotransplantation for renal cell carcinoma. // Mayo Clin Proc. 1992. №67. Р. 621—8.
Статья опубликована в журнале "Вестник урологии". Номер №3/2015 стр. 3-33









Комментарии