Гиперплазия предстательной железы (ГПЖ) – одно из наиболее частых заболеваний у пожилых мужчин старшей возрастной группы. Стратегия лечения больных ГПЖ на начальной стадии заключается в лекарственной терапии. Показаниями к оперативному лечению больных ГПЖ являются прогрессирование симптомов заболевания и, в частности, расстройств мочеиспускания, не поддающихся лекарственной коррекции, а также связанные с ним осложнения. Оперативные вмешательства остаются одним из краеугольных камней лечения больных ГПЖ.

А.М. Пшихачев
д.м.н., заместитель главного врача по медицинской части ФГУ «ЦКБ Гражданской авиации», и.о. заведующего и профессор кафедры урологии и общей хирургии медицинского института ФГБОУ ВО «МГТУ», Москва, Россия
С.А. Тургуналиев
врач-уролог клиники «MED-ART group», г. Фергана, Узбекистан
Учитывая широкую доступность и эффективность, монополярная трансуретральная резекция (ТУР) простаты в течение длительного времени считалась «золотым» стандартом оперативного лечения больных ГПЖ. Однако в последние годы появились новые методы, представляющие собой безопасную и эффективную альтернативу ТУР простаты. К таким видам минимально инвазивных операций относятся резекция, энуклеация, вапоризация и аблация с использованием различных методов воздействия на ткань простаты и обладающие рядом преимуществ по сравнению с монополярной ТУР простаты. В то же время, оперативное лечение больных ГПЖ требует индивидуального подхода к пациенту с учетом его возраста, сопутствующих заболеваний, клинических симптомов, объема предстательной железы и других факторов. Несмотря на обилие существующих трансуретральных методов лечения больных ГПЖ, в некоторых клинических ситуациях выполнение подобных вмешательств нежелательно, а порой и технически невозможно. Причинами, ограничивающими трансуретральные операции на предстательной железе при ее гиперплазии, являются большой объем простаты, крупные конкременты мочевого пузыря, стриктура уретры, ортопедические патологические состояния тазобедренного сустава, крупный дивертикул мочевого пузыря, требующий удаления, необходимость выполнения симультанного лечения по поводу сопутствующих хирургических заболеваний и другие состояния. Альтернативным методом лечения при таких ситуациях является открытая аденомэктомия. Однако в последнее время растет интерес к менее травматичным лапароскопическим и робот-ассистированным операциям у такой группы больных. Последние мета-анализы, сравнивающие эффективность и безопасность открытой, лапароскопической и робот-ассистированной аденомэктомии продемонстрировали ряд преимуществ робот-ассистированных операций по сравнению с другими видами вмешательств, в том числе снижение количества послеоперационных осложнений, объема кровопотери, длительности послеоперационного дренирования мочевого пузыря уретральным катетером, сроков госпитализации и др.
В своем сообщении коллегами продемонстрированы возможности робот-ассистированных технологий в лечении больных с большим объемом ГПЖ. Интерес данного клинического наблюдения заключался не только в больших размерах предстательной железы, но и в том, что в 2019 г. он перенес ТУР простаты в лечебном учреждении по месту жительства. Данные об объеме предстательной железы перед ТУР простаты не были предоставлены. В послеоперационном периоде пациент отметил кратковременное улучшение симптомов, связанных с ГПЖ, однако в последующем стал повторно отмечать прогрессирующее ухудшение качества мочеиспускания. Пациент возобновил прием препаратов из группы α-адреноблокаторов, однако, спустя 4 года после операции возникла острая задержка мочеиспускания, в связи с чем выполнена пункционная цистостомия. При обследовании по данным УЗИ и МРТ (рис. 1) объем предстательной железы был увеличен до 323 см3.
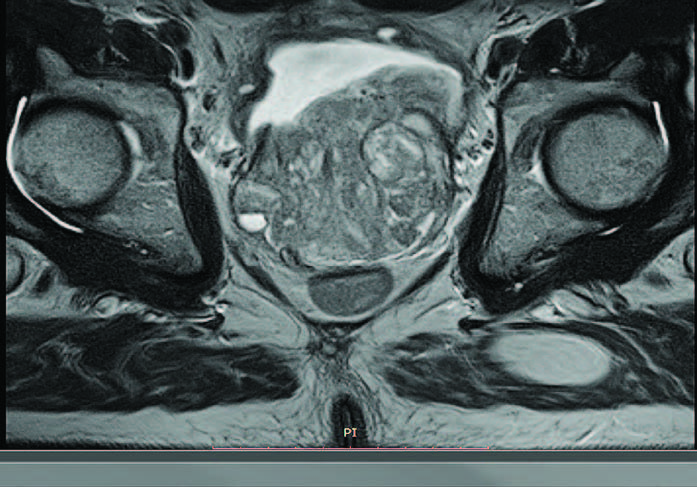
Рис. 1. МРТ простаты (аксиальный срез)
Простата имела причудливую форму с неровными контурами, что было связано не только с аденоматозными узлами, но и с перенесенной ранее ТУР простаты. При этом отмечалось, что левая доля простаты увеличена значительно больше, по сравнению с правой.
Кроме того в полости мочевого пузыря определялись 2 конкремента размерами до 2 см. Судить о характере рецидива ГПЖ (истинный или ложный) не представлялось возможным ввиду отсутствия информации перед первичной операцией и при дальнейшем прогрессировании заболевания. Можно было только предположить, что в связи с кратковременным положительным эффектом после операции и очень большими размерами простаты речь шла о ложном рецидиве ГПЖ. Уровень ПСА крови составлял 2,1 нг/мл. По данным пальцевого ректального исследования и МРТ патологические участки, подозрительные на злокачественный процесс, не обнаружены. При уретрографии данных за стриктуру уретры также не выявлено.
С целью избавления больного от цистостомического дренажа и восстановления самостоятельного мочеиспускания пациенту было показано оперативное лечение.
Учитывая большие размеры аденоматозных узлов, ТУР простаты не был рекомендованным методом лечения. Выполнение энуклеации гиперплазии простаты могло быть сопряжено с техническими сложностями, связанными с рецидивным характером ГПЖ и измененной ее анатомией. Учитывая данные обстоятельства, принято решение отказаться от трансуретрального вмешательства в пользу аденомэктомии. Также обсуждался выбор доступа. Открытая аденомэктомия признана высокотравматичной, а лапароcкопический доступ технически более сложным и сопряженным с высоким риском интраоперационных осложнений.
В связи с этим, пациенту выполнена робот-ассистированная аденомэктомия. Операция выполнена трасперитонеальным доступом. Положение пациента и расстановка троакаров соответствовало выполнению робот-ассистированной радикальной простатэктомии. Во время робот-ассистированной аденомэктомии наиболее часто используются три доступа к аденоматозным узлам: чреспузырный, позадилонный и через переднюю полуокружность шейки мочевого пузыря с последующим «выходом» на аденоматозный узел. Среди перечисленных доступов к аденоматозным узлам чреспузырный считается наиболее травматичным в связи с необходимостьюдополнительного разреза передней стенки мочевого пузыря и выполнения практически всей операции через мочевой пузырь. Однако данный доступ считается наиболее безопасным в плане травматизацииустьев мочеточников в связи с их визуализацией и «маркировкой» в самом начале операции. От позадилонного доступа также решено воздержаться в связи с «неправильной» формой предстательной железы и предполагаемыми сложностями работы в правильном слое в области шейки мочевого пузыря. Таким образом, принято решение осуществить первоначальный доступ к аденоматозной ткани предстательной железы по передней поверхности после рассечения передней полуокружности шейки мочевого пузыря. После рассечения брюшины по передней брюшной стенке визуализирован и пересечен цистостомический свищ. Последний герметично ушит ниткой Vicryl 2-0.
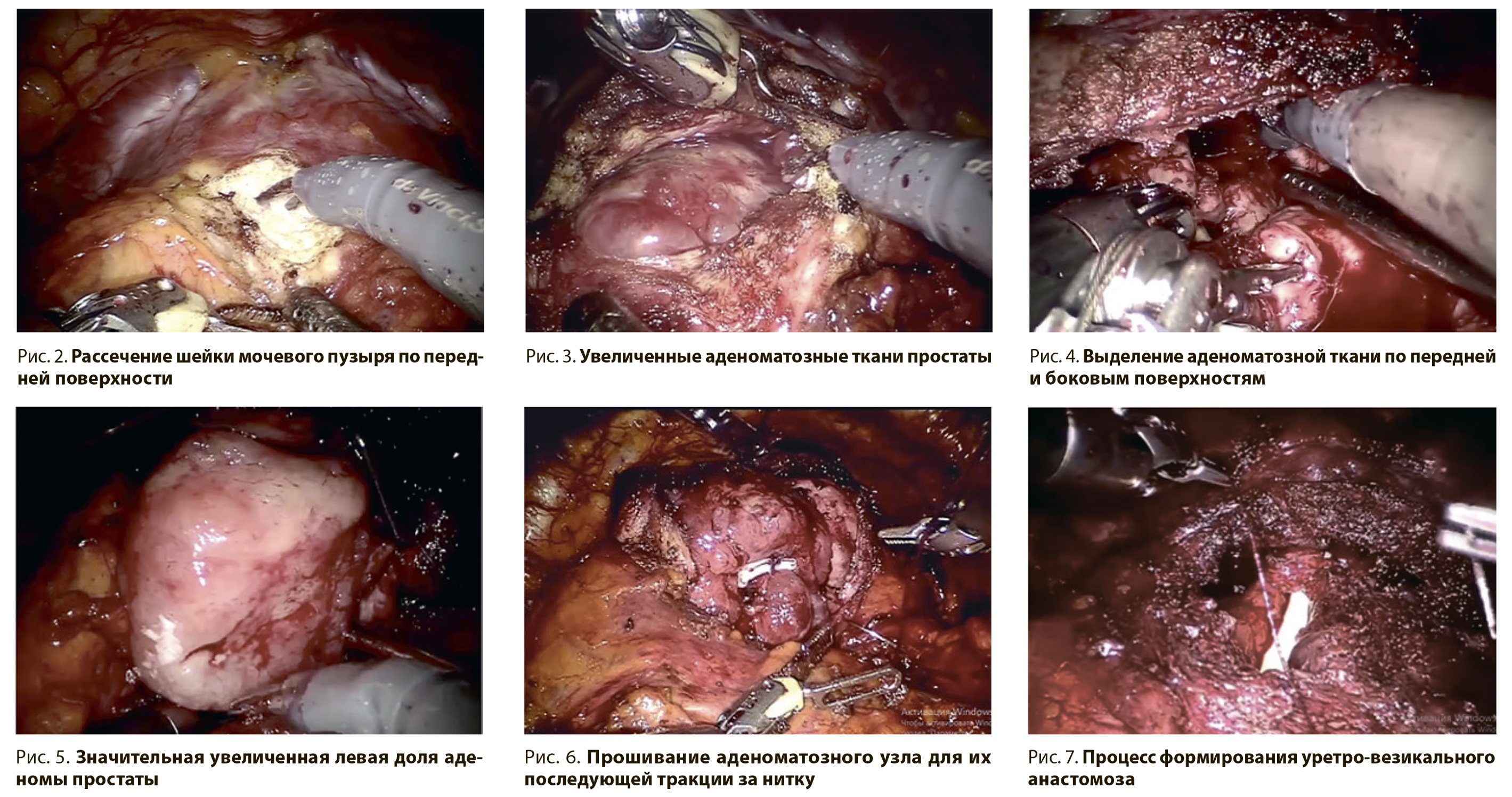
Шейка мочевого пузыря рассечена перпендикулярно от 11 до 13 ч. условного циферблата максимально близко к передней поверхности простаты (рис. 2).
Визуализирован ТУР-дефект и ассиметричные доли аденомы простаты, увеличенные преимущественно за счет средней и левой доли (рис. 3).
По передней поверхности простаты тупым и острым путем осуществлен «выход» на аденоматозную ткань. Далее продолжено выделение аденоматозных тканей по передней и боковым поверхностям по направлению к верхушке простаты (рис. 4).
Ориентируясь на уже сформированный слой по боковым поверхностям, с 11 и 13 ч. условного циферблата продолжено выделение аденоматозных узлов в области основания. Основным преимуществом данной методики, когда первоначальный доступ осуществляется через шейку мочевого пузыря, заключается в полном контроле удаления аденоматозных узлов неправильной формы, расположенных внутрипузырно. Еще одним преимуществом данного доступа по сравнению с позадилонным является визуальный контроль устьев мочеточников. Стоит отметить, что в данном клиническом наблюдении визуализировать устья мочеточников во время операции не представлялось возможным в связи с выраженным буллезным отеком слизистой мочевого пузыря из-задлительного нахождения цистостомического дренажа. Тем не менее, разделение тканей по уже сформированному слою максимально близко к аденоматозным узлам позволил предотвратить повреждение устьев мочеточников. В процессе выделения аденоматозных узлов в рану из мочевого пузыря вылущены значительно увеличенные средняя и левая доли, которые мешали адекватной визуализации операционного поля (рис. 5).
При таких ситуациях существует методика прошивания аденоматозных узлов ниткой с фиксированной клипсой на конце и последующая тракция узлов за нитку, что и было осуществлено в данном случае. Следует отметить, что у данного пациента в связи с очень большими размерами аденоматозного узла в левой доли простаты для осуществления тракции его пришлось последовательно прошивать трижды (рис. 6).
Во время дальнейшего вылущивания аденоматозных узлов по задне-латеральной поверхности использовалась минимальная коагуляция кровоточащих сосудов в области хирургической капсулы с целью профилактики термического повреждения сосудисто-нервных пучков и нарушения эрекции. Отсечение аденоматозных узлов от уретры производилось с максимальным сохранением длины уретры для предотвращения повреждения наружного сфинктера и недержания мочи в послеоперационном периоде. После полного удаления аденоматозных узлов из мочевого пузыря извлечены оба конкремента, последние уложены в контейнер вместе с аденоматозными узлами.
Далее подобно, как при робот-ассистированной простатэктомии с целью сокращения дистанции между шейкой мочевого пузыря и уретрой наложен шов Рокко. Также подобно робот-ассистированной простатэктомии создан циркулярный уретро-везикальный анастамоз (рис. 7), после чего дефект передней поверхности простаты герметично ушит.
Длительность операции составила 155 мин, а консольное время при этом составило 125 мин. Объем кровопотери менее 100 мл. Масса удаленных аденоматозных тканей составила 294 гр. (рис. 8).
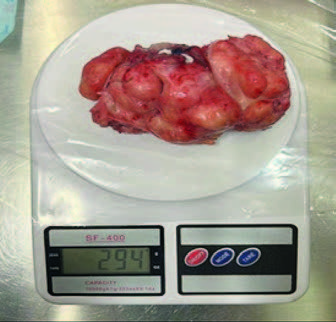
Рис. 8. Удаленная аденоматозная ткань
простаты
Послеоперационных осложнений не отмечено. Уретральный катетер удален на 5 сутки после операции, самостоятельное мочеиспускание восстановилось в полном объеме, признаков стрессового недержания мочи не отмечено.
Таким образом, робот-ассистированная аденомэктомия является безопасным и эффективным методом оперативного лечения больных ГПЖ с большим объемом простаты, а также пациентов с сопутсвующими заболеваниями, ограничивающими выполнение трансуретральной операции или требующей симультанного вмешательства.









Комментарии