Киприянов Е.А., Ивахно К.Ю., Важенин И.А., Галямова Ю.В., Важенин А.В., Карнаух П.А.
ГБУЗ «Челябинский окружной клинический онкологический диспансер», ЮУНЦ РАМН 454087, г.Челябинск, ул.Блюхера 42, тел. (904)9708607
Эл.почта: kiprijanov@list.ru
Введение. Заболеваемость раком предстательной железы в Российской Федерации в 2012,2013гг. составила 29,35 на 100 тыс. населения. Среди злокачественных новообразований мужского населения рак предстательной железы в 2009г составил 10,7%. На протяжении последних лет отмечается рост удельного веса больных с I-II стадией опухолевого процесса – с 32,7% в 1999г. до 44,8% в 2009г [1,3,5,7,8]. Почечно-клеточный рак (ПКР) в общей структуре заболеваемости злокачественными новообразованиями населе¬ния России занимает десятое место (3,7%). В России в 2012 году почечно-клеточный рак впервые диагностирован у 19102 пациентов. Смертность от данной патологии составляет около 18,3% (8500 больных). Важно отметить, что в последнее десятилетие доля локализованных опухолей увеличилась до 55,8%, что сказалось на онкологических результатах лечения [1].
Строгий отбор пациентов с обязательным учетом риска рецидива позволяет достичь хороших результатов [1,2,7].
Стандартный курс лучевой терапии пациентов с раком предстательной железы с использованием линейных ускорителей длится до 7 недель в режиме традиционного фракционирования до суммарной очаговой дозы 72Гр. Использование техники гипофракционированной стереотаксической лучевой терапии позволяет сократить время лечения до пяти сеансов при подведении суммарной дозы 35Гр [2,4,9].
Несмотря на то, что ПКР относится к радиорезистентным опухолям, в настоящее время расширяются возможности органосохранного лечения у пациентов с локализованными стадиями, с высоким риском хирургического лечения или соматическими противопоказаниями к операции. Эволюция лучевых методов лечения способствовала внедрению в клиническую практику стереотаксической гипофракционной радиотерапии (SRT), которая получает более широкое распространение в мире [1,4,11,13].
В настоящее время пролечено 1100 пациентов с раком простаты в 8 центрах, за период 2003-2011 гг. Средняя доза 35-37.5Гр за 4-5 фракций. У 5% пациентов имели лучевые реакции 2 степени со стороны мочевого пузыря или прямой кишки. Поздние повреждения мочевого пузыря 2 степени в 4% случаев при СОД=35Гр и 9% с СОД=37.5Гр Поздние повреждения прямой кишки 2% с 35Гр и 5% с 37.5Гр. 75% пациентов сохранили потенцию. Отдаленные результаты лечения показали , что пятилетняя выживаемость 97% в группе низкого риска, 90.7% средний риск, 74.1% высокий риск. Общая 5-ти летняя выживаемость составила 93% Выживаемость в зависимости от индекса Глисон 6-95%, 7-83%, 8-78%. Выживаемость в зависимости от риска прогрессирования: 95%-с низким риском, 84% средний, 81% высоким риском.
Очевидны преимущества SRT: неинвазивность, безболезненность, высокая точность, максимальная доза в опухоли, минимизация дозы на здоровые ткани, кратковременность лечения, минимальные лучевые реакции и осложнения, возможность амбулаторного лечения [8,9,11].
В лечении опухолей применяется система InTempo™ — это технология слежения за движениями в режиме реального времени, которая используется для компенсации нециклического движения опухоли. Система InTempo специально разработана с учетом моделей движения. Локализация цели определяется путем получения рентгеновского изображения, позволяющего визуализировать внутренние маркеры [9,11].
В настоящее время роботизрованная радиотерапия также используется для лечения опухолей мозга, I стадии рака легких, опухолей позвоночника, локализованного рака предстательной железы, солитарных метастазов.
Цель: оценить эффективность роботизированной радиотерапии (SRT) в лечении пациентов с онкоурологической патологий.
Материалы и методы. С 2011 года в ГБУЗ «Челябинский окружной клинический онкологический диспансер» используется методика роботизированной радиотерапии (система «КиберНож») В настоящее время пролечено более 800 пациентов, в том числе 77 пациентов с локализованным раком предстательной железы, два пациента с почечноклеточным раком, причем у одного пациента с двухстронним поражением почек.
Показаниями к проведению лечения пациентов с раком предстательной железы явились: стадия Т1-2N0М0. Противопоказаниями были: уровень PSA более 20нг/мл, объѐм предстательной железы более 100см3 (наличие цистостомы), местнораспространенный и генерализованный рак предстательной железы, сопутствующая патология в стадии декомпенсации.
Показаниями к лечению пациентов с почечно-клеточным раком: возраст ≥18 лет; гистологически верифицированная опухоль размерами до 5,0 см в диаметре; отказ от оперативного лечения. Противопоказания: опухоль более 5,0 см в диаметре; нарушение функции почек; генерализация процесса; также сопутствующая патология в стадии декомпенсации; беременность.
В мае 2012 года на базе ЧОКОД были проведены клинические испытания рентгенконтрастных меток для использования в системе KyberKnife в РФ. Рентгенконтрастные метки имплантируются органа перед началом лечения.
Пациентам с опухолью предстательной железы имплантация меток проволась трансректально, под ультразвуковым контролем, в количестве трех штук. Расстояние между метками должно быть не менее 20 мм, а также угол минимум 15о между соседними имплантатами. В опухоль почки имплантируются до четырех меток.
Пациенту назначалась антибактериальная, противовоспалительная терапия на срок 7-10 дней, после чего проводится нативное МСКТ сканирование органов малого таза (для более точной визуализации предстательной железы также используется МРТ с контрастным усилением). Таким образом создавалась 3D модель, оконтуривались критические органы.
Роботизированная радиотерапия проводилась на аппарате (KiberKnife), в режиме гипофракционирования, с мощностью облучения 6Мэв.
При лечении рака предстательной железы разовая очаговая доза 7Гр, до суммарной очаговой дозы 35Гр.
В исследование включено 77 пациентов с диагнозом рак предстательной железы, проанализированы 35 случаев. Средний возраст пациентов составил 66,4±3,4 года. Диагноз злокачественного новообразования предстательной железы у всех пациентов морфологически верифицирован. Большинство опухолей представлены умереннодифференцированной формой аденокарциномы предстательной железы. У всех пациентов установлена вторая стадия (Т2N0М0) заболевания.
Первый опыт применения роботизированной радиотерапии с пациентов с почечно-клеточным раком.
Пациент Т, 58 лет, диагноз: Первично-множественный синхронный рак: 1) Рак нижней половины удвоенной правой почки рТ1вN0М0, после хирургического лечение – геминефрэктомия справа 2010г. Иммунотерапия 2011г. Рецидив в 2012г. 2) Рак левой почки сТ1вN0М0, после радиочастотной абляции опухоли левой почки , резекции левой почки в 2010г. Иммунотерапия 2011 г. Рецидив в 2012г.
Из анамнеза: в январе 2010 года по данным МСКТ выявлен синхронный рак обеих почек: удвоение правой почки, в нижней половине удвоенной правой почки образование 57х62х60мм накапливающее контраст, в нижнем полюсе левой почки аналогичное образование 48х50х49мм, накапливающее контраст.
Январь 2010 – операция: лапаротомия, геминефрэктомия справа, биопсия левой почки. Гистология – гипернефроидный рак, светлоклеточный вариант. Март 2010 года – операция: люмботомия слева. Радиочастотная абляция опухоли левой почки. Резекция левой почки. Гистология – почечно-клеточный рак, светлоклеточный вариант. МСКТ Июль 2010 года: нельзя исключить объѐмное образование правой почки в среднем сегменте 36х18х36 мм, связанный с ЧЛС. Постоперационное изменение почек. С июля 2010 года получал иммунотерапию (интерферон-α 3 млн.МЕ через день). МСКТ ноябрь 2010г: признаки постоперационных изменений обеих почек. Данных за рецидив нет. ПЭТ-КТ август 2011 года: признаки метаболически неактивных объѐмных образований среднего сегмента правой почки 25 мм в диаметре; нижнего сегмента левой почки размером 22х13мм в области рубцово-фиброзных изменений. Биопсия не выполнена в связи с техническими трудностями (постоперационные изменения). ПЭТ-КТ Май 2012: отрицательная динамика в сравнении с 08.2011 – рост образований справа до 32 мм, слева до 29 мм. В мае 20102 года выполнена биопсия образований почек. Гистология – почечно-клеточный рак, светлоклеточный вариант.
В Июне 2012года установка рентгеноконтрастных маркеров (4 шт.) в образование левой почки. Проведен курс SRT на левую почку: 3 фракции с РОД=15Гр СОД=45Гр; V опухоли 12см3 (рис. 1).
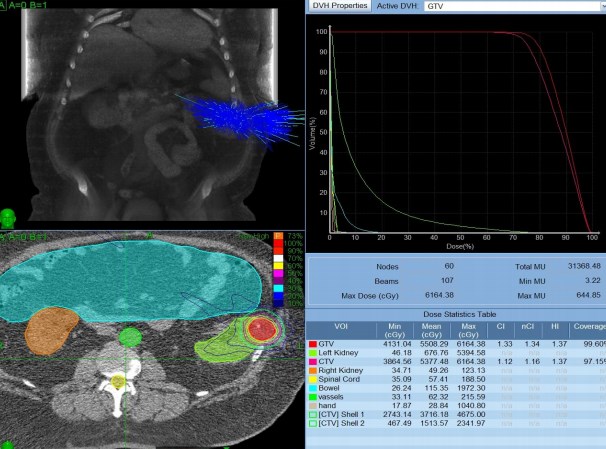
Рис. 1.
В Сентябре 2012 года установка рентгеноконтрастных маркеров (4 шт.) в правую почку проведен курс SRT на правую почку: 3 фракции РОД=10Гр; СОД=30Гр. V опухоли 80см3 . (рис.2).
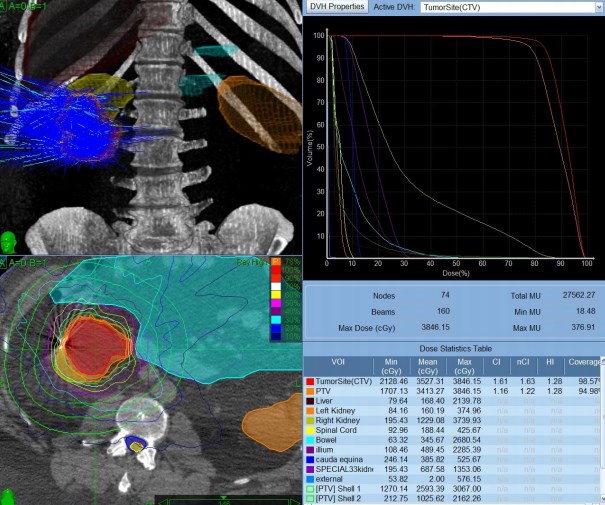
Рис.2
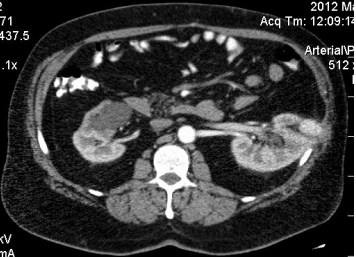
Рис.3. МСКТ до лечения
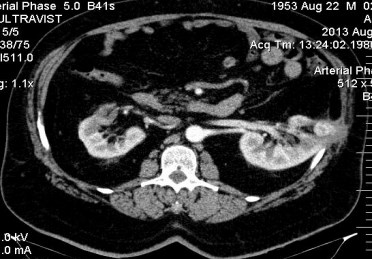
Рис. 4. МСКТ через 14 месяцев.
Пациентка С, 61г. Диагноз: первично-множественный метахронный рак:
1) Рак левой почки рТ1вN0М0, после хирургического лечения – нефрэктомии слева в 2006г.
2) Рак правой почки Т1аN0М0, после хирургического лечения резекции единственной правой почки в 2011г, иммунотерапия 2011г, рецидив в 2013г.
Из анамнеза: январь 2006 г. Операция – нефрэктомия слева. Гистология – почечно-клеточный рак левой почки, светлоклеточный вариант. В послеоперационном периоде получала иммунотерапию (интерферон альфа 2а 3 млн. МЕ через день). МРТ контроль март 2011 года – образование единственной правой почки на границе среднего и нижнего сегментов до 20 мм. Апрель 2011 года операция: люмботомия. Резекция единственной правой почки. Гистология: почечно-клеточный рак, светлоклеточный вариант. Диаметр узла 2 см. В послеоперационном периоде получала иммунотерапию (интерферон-α 3 млн.МЕ через день). МРТ контроль апрель 2013 года – признаки рецидива опухоли единственной правой почки нижний сегмент 33мм. Накапливает контраст в раннюю артериальную фазу. Биопсия не выполнена по техническим причинам.
Сентябрь 2013г. Биопсия опухоли правой почки. Гистология – почечноклеточная карцинома, светлоклеточный вариант 2 балла по Фурману.
В ноябре 2013г. Установка рентгенконтрастных маркеров (4 шт.) проведен курс SRT: 3 фракции РОД=11Гр, СОД=33Гр. V опухоли 25см3 (рис 5).
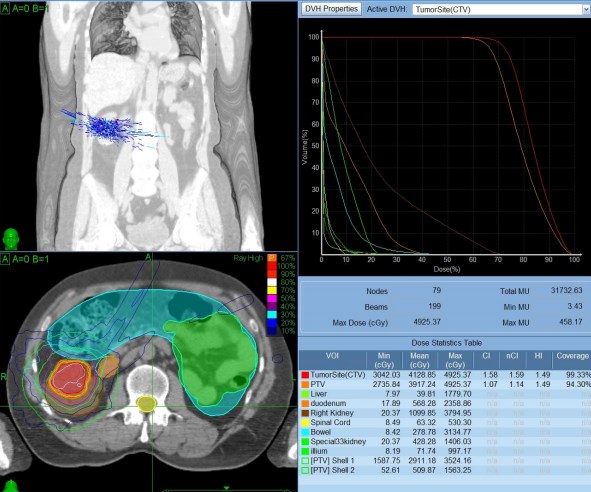
Рис.5.
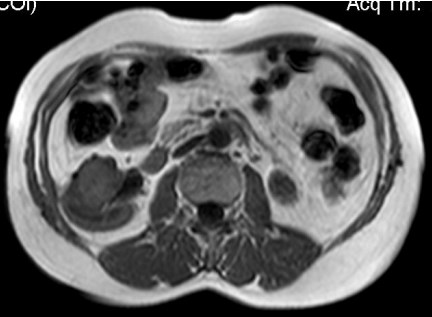
Рис.6. МРТ до лечения
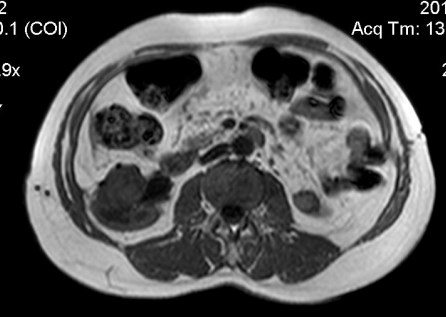
Рис.7. МРТ через 6 месяцев
Результаты. Результаты лечения пациентов с раком предстательной железы. В процессе лечения не было зафиксировано превышения толерантных доз на критические органы. После проведенного лечения у 16,6% пациентов раком предстательной железы диагностирован лучевой цистит 1степени, у 5,5% пациентов ректит 1степени.
Ближайшие результаты лечения оценивались каждые три месяца после лучевой терапии по следующим показателям: динамике уровня общего простатспецифического антигена, объему предстательной железы, количеству остаточной мочи, оценке качества мочеиспускания по международной шкале IPSS.
До проведенного лечения значения общего ПСА было: 0-4 нг/мл – 12% пациентов, 4-10 нг/мл – 44% пациентов, 10-20 нг/мл – 44%человек. Через три месяца после окончания лечения уровень общего ПСА не превышал 4нг/мл в 70% случаев, и лишь в у одного пациента превысил значение 10 нг/мл. Через шесть месяцев уровень ПСА менее 4 нг/мл зафиксирован у 92% больных. Через девять и двенадцать месяцев, а также при дальнейшем наблюдении уровень общего ПСА у всех пациентов не превышал 4 нг/мл. Объем предстательной железы до лечения: менее 20 см3 у 5,5% пациентов, 20-40 см3 – 55,5%, до 60 см3 – 38,8%. Через три месяца после окончания лечения объем простаты у большинства пациентов варьировался в диапазоне 20-40см3 (70,5)%. Через шесть месяцев у подавляющего количества пациентов объем простаты не превышал 40см3 , лишь в 15,3% объем простаты более 40см3 . Через девять месяцев показатели объема предстательной железы были сопоставимы с результатами предыдущих исследований. Через двенадцать месяцев объем предстательной железы в 50% случае менее 20см3 и в 50% не более 40см3 .
Динамика уменьшения объема предстательной железы (т.е. первичного очага) отразилась и на качестве жизни. До лечения, в исследуемой группе, объем остаточной мочи менее 20 мл у 61,1% пациентов, 20-50 мл у 22,2% пациентов, до 100мл в 16,6% случаев.
Через три месяца количество пациентов у которых объем остаточной мочи не превышал 20 мл 70,5%, объем остаточной мочи 50-100мл диагностирован лишь в 11,7% случаев. Через девять месяцев клиничски-незначимым объем остаточной мочи 72,7%, такая же тенденция сохранилась и через девять после проведенного контрольного обследования пациентов.
До проведенного лечения количество балов по шкале IPSS в первой группе 0-7 баллов – 16,6% пациентов, 8-19 баллов 83,4% человек.
Через три месяца после проведенного лечения количество пациентов с выраженной симптоматикой сотавило 11,7%. В последующем, через шесть, девять месяцев количество пациентов с выраженной симптоматикой уменьшилось до 11,7 и 7,1% соответственно. Пациентов со слабой симптоматикой, через девять месяцев было 58,3%. Через год после лечения в 44,5% случаев имела место слобовыраженная симптоматика, умеренная симптоматика у 53,5% пациентов.
Оценка отдаленных результатов лечения производилась путем расчета безрецидивной, онкоспецифической, общей выживаемости.
Анализ результатов в группе больных раком предстательной железы с проведенным лечения показал, что безрецидивная (ПСА-рецидив) трехлетняя выживаемость составила88,8% Общая выживаемость: через 36 месяцев 100%, онкоспецифическая выживаемость, также 100% (р<0.05).
Результаты лечения больных с почечно-клеточным раком.
Первый пациент: при контрольном исследовании на МСКТ через 11 месяцев после окончания SRT в правой почке нет контрастного усиления ни в одной фазе, кистозная дегенерация, опухоль достоверно не определяется. Слева опухоль уменьшилась в размерах (с 29мм до 21мм), контраст копит по периферии только в артериальную фазу, фиброзно-рубцовые изменения. Функция почек сохранена. Второй пациент: контроль МРТ через 6 мес. опухоль уменьшилась в размерах (с 33 мм до 29 мм), но сохраняется контрастирование в артериальную фазу. Функция единственной почки сохранена.
Выводы: Роботизированная радиотерапия является эффективным, безопасным, неинвазивным, методом лечения больных раком предстательной железы. Ближайшие результаты лечения отразились на быстрой регрессии первичного очага, что положительно сказалось на уродинамике. При оценке онкоспецифической выживаемости роботизированная радиотерапия является эффективным лечения методом лечения больных с локализованным раком предстательной железы.
Первый опыт применения у пациентов с почено-клеточным раком показывает, что стереотаксическая радиотерапия расширяет возможности лечения, особенно, в тех случаях, когда невыполнимо хирургическое лечение. Результатом лечение явилось уменьшение размеров опухоли или полная еѐ резорбция без ухудшения функции почки.
Литература
1. Злокачественные новообразования в России в 2009 году (заболеваемость и смертность). Под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. – М.: ФГУ «МНИОИ им. П.А. Герцена Росмедтехнологий», 2011. – 260 с.
2. Карнаух П.А. Тенденции эпидемиологии рака предстательной железы в Челябин-ской области / А.В. Важенин, П.А. Карнаух // Онкоурология. 2008. № 3. С. 67-68.
3. Карнаух П.А. Эпидемиология рака предстательной железы в Челябинской области / А.В. Важенин, П.А. Карнаух // Паллиативная медицина и реабилитация. 2008. № 2. С. 26-28.
4. Карнаух П.А. Способ оценки эффективности лечения рака предстательной железы / А.В. Важенин, П.А. Карнаух // Сибирский онкологический журнал. 2008. № 3. С. 21-24.
5. Карнаух П.А. Повышение эффективности лечения больных раком предстательной железы / Е.А. Киприянов, А.В. Важенин, П.А. Карнаух // Сибирский онкологиче-ский журнал. 2009. № 1. С. 45-47.
6. Соколова О.В. Методология лабораторного определения простатспецифического антигена для ранней диагностики и скрининга рака предстательной железы в рамках региональной программы «Урологическое здоровье мужчины» / Соколова О.В., Орлова Е.Э., Леонов О.В., Копыльцов Е.И., Манько О.И., Дедова И.В., Сальник С.П.// Омский научный вестник. Ресурсы Земли. Человек. 2013. № 2 (124), приложение. С. 82-87.
7. Состояние онкологической помощи населению России в 2009 году. Под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. – М.: ФГУ «МНИОИ им. П.А. Герцена Росмедтехнологий», 2011. – 196 с.
8. Katz AJ, Kang J «Stereotactic body radiotherapy as treatment for organ confined lowand intermediate-risk prostate carcinoma, a 7-year study.» Front Oncol. 2014 Sep
9. Katz AJ, Kang J «Quality of Life and Toxicity after SBRT for OrganConfined Prostate Cancer, a 7-Year Study.» Front Oncol. 2014 Oct
10. Pontoriero A, Iatì G, Mondello S «High-Dose Robotic Stereotactic Body Radiotherapy in the Treatment of Patients With Prostate Cancer» Technol Cancer Res Treat. 2015 Jan 13
11. Rothman J. et al. Pathologic concordance of sporadic synchronous bilateral renal masses. Urology 2008;72(1):138-42
12. Sanfilippo NJ, Cooper BT «Hypofractionated radiation therapy for prostate cancer: biologic and technical considerations.» Am J Clin Exp Urol. 2014 Dec 25;2(4):286-93. eCollection 2014.
13. Simmons M.N. et al. Management of bilateral synchronous kidney tumors: functional and oncological outcomes. J. Urol. 2010; 184(3):865-72.
Статья опубликована в журнале "Вестник урологии". Номер №4/2015 стр. 29-51









Комментарии